Similar presentations:
Молекулярная биология
1.
Молекулярная биологияне очень большой практикум
2021
2.
Примеры ситуаций, требующих применениямолекулярно-биологических методов в работе с
белками:
Ограниченная доступность
материала для выделения
необходимого белка
Низкое содержание белка в
исходном материале
Сложность получения чистого
препарата нативного белка
(проблемы с очисткой,
нестабильность белка),
проблемы с детекцией белка
Необходимость внесения иных
изменений в аминокислотную
последовательность
исследуемого белка
Экспрессия рекомбинантного белка в
культуре клеток, использование
«сильных» транскрипционных
промотеров
Все что угодно! Создание слитого
белка (fusion protein), добавление к
белку олигопептидных меток (tags),
облегчающих очистку и детекцию
белка, блокирование или добавление
сайтов посттрансляционных
модификаций, стабилизация
структуры белка (e.g., блокирование
сайтов протеолиза), точечные
замены, делеции, изменение
сигнальных последовательностей…..
3.
Что нужно для экспрессиирекомбинантного белка?
1. Последовательность
ДНК, кодирующая нужный
нам белок
2. Экспрессионный вектор
pET14b
3. Клетка - хозяин
4. Система культивирования
4.
Итак, Вам нужен рекомбинантный белок, или с чегоначать выбор экспрессионной системы
Каково происхождение интересующего Вас белка (бактериальный,
человеческий, или происходит из какого-либо другой организма)?
Свойства белка: большой или маленький? Много ли в нем
дисульфидных
связей?
Посттрансляционные
модификации:
гликозилирован (а также фосфорилирован, ацилирован и т.п.) ли он
в природе? Доменная структура?
Каковы его функции: это бесхитростный структурный вирусный
белок или же нежный компонент мультиферментного комплекса?
Внутриклеточная локализация белка в природе? Быть может, белок
секретируемый? Или же он мембраносвязанный? Есть ли у него
кофакторы?
Полиморфизм?
Для чего Вам нужен белок (Антиген? Активный фермент? Материал
для рентгеноструктурного анализа? Вакцина или фармпрепарат?) и
в каком количестве?
Ресурсы, находящиеся в Вашем распоряжении? Сроки?
5.
Последовательность действий:от гена к белку
Получение кодирующей
последовательности
гена белка
Клонирование в
экспрессионный вектор
Трансфекция
Получение
экспрессионной
конструкции
Трансформация
Масштабирование
экспрессии и очистка
рекомбинантного белка
Анализ экспрессии
рекомбинантного белка
Отбор трансформантов
(трасфектантов) на
селективных средах
6.
Центральная догма7.
Первые сложностиПросто кусок линейной ДНК с кодирующей
последовательностью в клетке не сохранится!
Просто кусок линейной ДНК с кодирующей
последовательностью не сможет использоваться
для экспрессии белка!
Необходимо создать для
подходящее окружение.
кодирующей
ДНК
8.
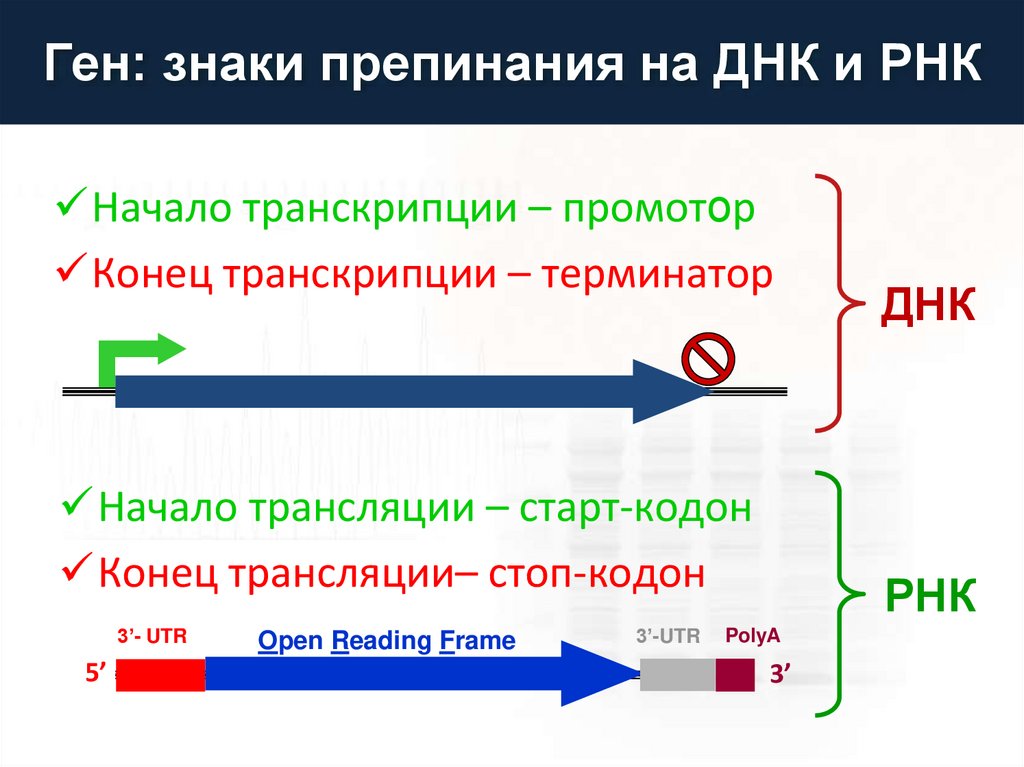
Ген: знаки препинания на ДНК и РНКНачало транскрипции – промотор
Конец транскрипции – терминатор
Начало трансляции – старт-кодон
Конец трансляции– стоп-кодон
3’- UTR
5’
Open Reading Frame
3’-UTR
ДНК
РНК
PolyA
3’
9.
Плазмидынехромосомные репликоны, как правило,
представляющие собой кольцевые молекулы ДНК
Размер:
от <2 т.п.н. (kilobase pairs, kbp) до нескольких
сотен т.п.н.)
Число копий: от одной до нескольких сотен на клетку
Спектр хозяев: прокариоты, дрожжи, грибы. Плазмиды на
основе вирусных геномов могут существовать
в клетках млекопитающих. Спектр хозяев
определяется структурой ori-области
10.
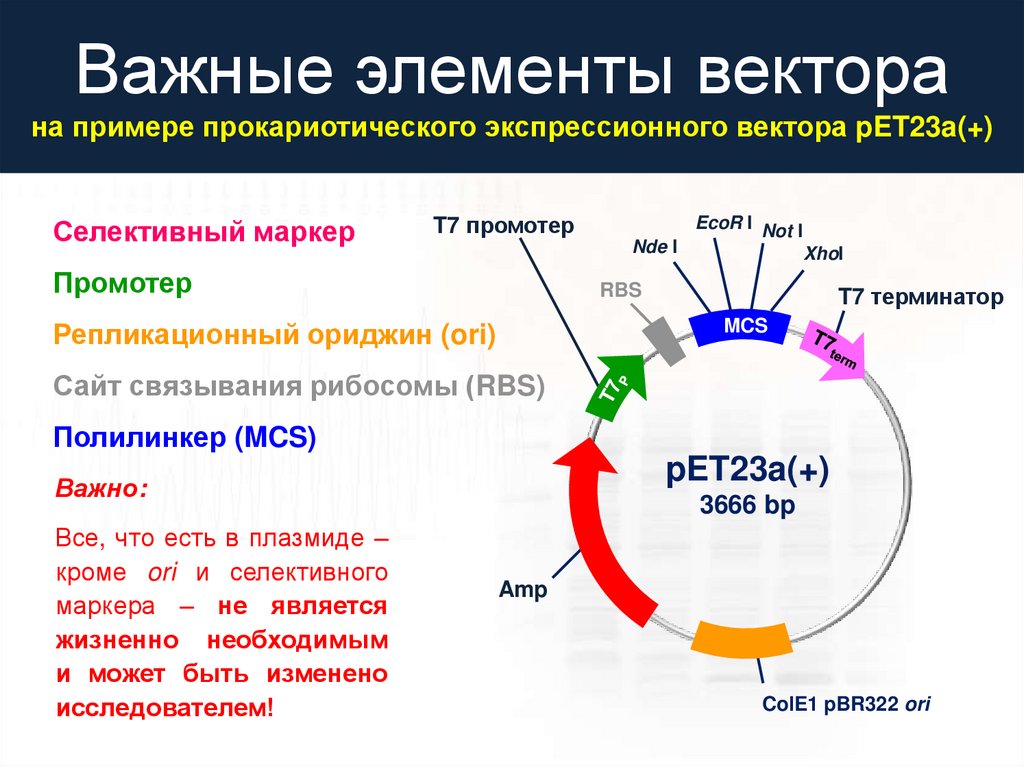
Важные элементы векторана примере прокариотического экспрессионного вектора pET23a(+)
Селективный маркер
T7 промотер
Nde I
Промотер
EcoR I Not I
XhoI
RBS
Репликационный ориджин (ori)
T7 терминатор
MCS
Сайт связывания рибосомы (RBS)
Полилинкер (MCS)
pET23a(+)
Важно:
Все, что есть в плазмиде –
кроме ori и селективного
маркера – не является
жизненно необходимым
и может быть изменено
исследователем!
3666 bp
Amp
ColE1 pBR322 ori
11.
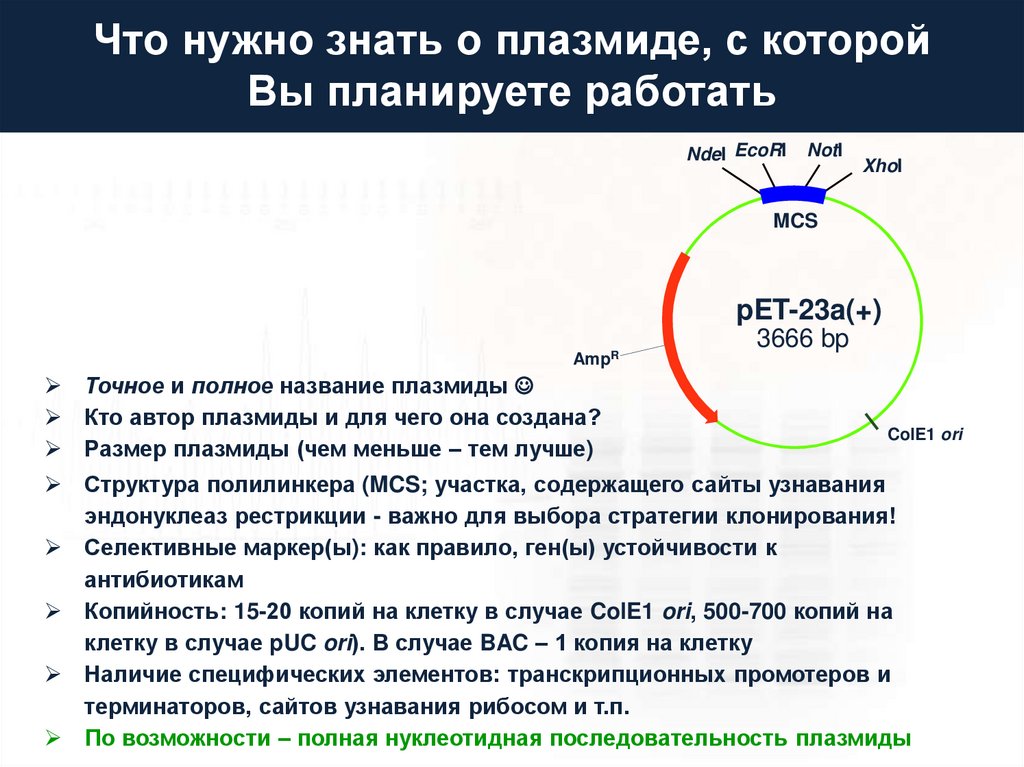
Что нужно знать о плазмиде, с которойВы планируете работать
NdeI EcoRI
NotI
XhoI
MCS
pET-23a(+)
AmpR
Точное и полное название плазмиды
Кто автор плазмиды и для чего она создана?
Размер плазмиды (чем меньше – тем лучше)
3666 bp
ColE1 ori
Структура полилинкера (MCS; участка, содержащего сайты узнавания
эндонуклеаз рестрикции - важно для выбора стратегии клонирования!
Селективные маркер(ы): как правило, ген(ы) устойчивости к
антибиотикам
Копийность: 15-20 копий на клетку в случае ColE1 ori, 500-700 копий на
клетку в случае pUC ori). В случае BAC – 1 копия на клетку
Наличие специфических элементов: транскрипционных промотеров и
терминаторов, сайтов узнавания рибосом и т.п.
По возможности – полная нуклеотидная последовательность плазмиды
12.
Экспрессионные системы:из чего выбирать
Бесклеточные
Лизат ретикулоцитов кролика (RRL)
Экстракт зародышей пшеницы (WGE)
Прокариотические E.coli, B.subtilis и др.
Дрожжи и прочие грибы
Растения
Эукариотические
Клетки насекомых
Клетки млекопитающих
Трансгенные организмы
13.
Прокариотыпроще некуда (на первый взгляд)
Проверенные временем, легкие в освоении, сравнительно
недорогие экспрессионные системы, обеспечивающие во
многих случаях высокий уровень продукции рекомбинантных
белков в быстрорастущих клетках бактерий
Ограничения:
Неэффективный фолдинг (особенно больших белков),
проблемы с формированием S-S связей и, как
следствие, высокая вероятность формирования
белковых телец включения
Отсутствие
большинства
посттрансляционных
модификаций
(в первую очередь N- и Огликозилирования)
14.
Просьба различать:Репликация
≠
Транскрипция
≠
Трансляция
пара оснований ≠ триплет ≠ аминокислота ≠ kDa
промотер ≠ oператор
промотер ≠ инициирующий кодон
терминирующий кодон ≠ терминатор транскрипции
аденин ≠ аланин
цитозин ≠ цистеин
рестрикция ≠ лигирование ≠ трансформация
вектор ≠ вставка
агар ≠ агароза
миллилитр ≠ микролитр
15.
Наши инструментыЭндонуклеазы
рестрикции
Лигазы
Штаммы E.coli
Экзонуклеазы
ПЦР
ДНК-полимеразы
16.
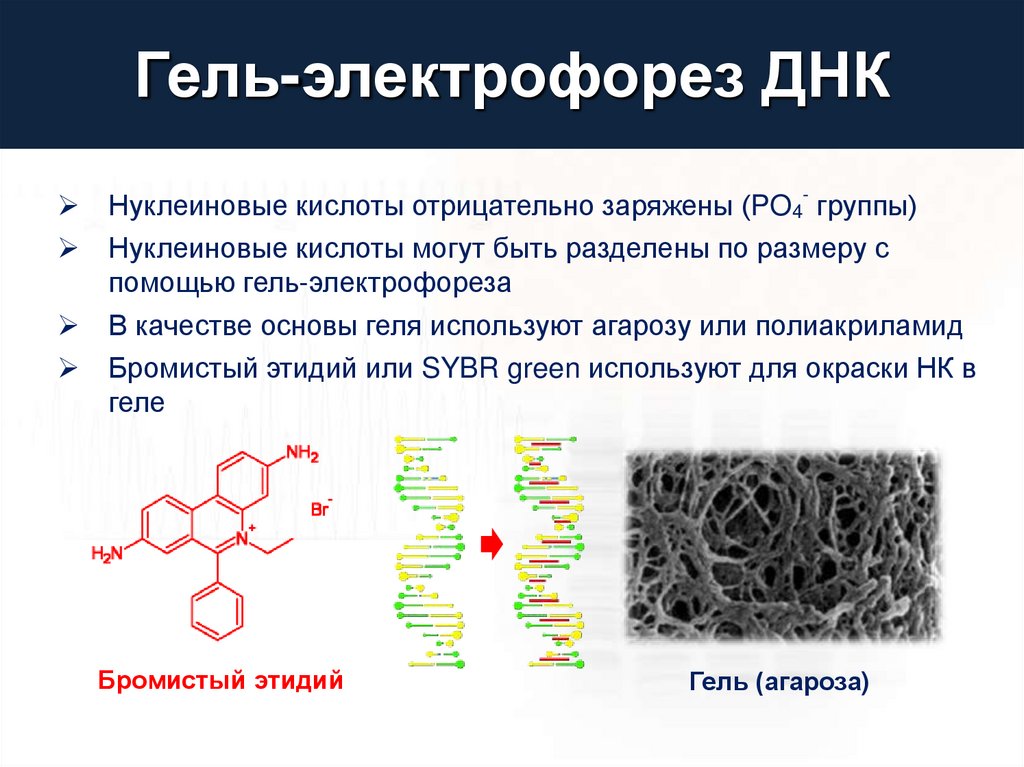
Гель-электрофорез ДНКНуклеиновые кислоты отрицательно заряжены (PO4- группы)
Нуклеиновые кислоты могут быть разделены по размеру с
помощью гель-электрофореза
В качестве основы геля используют агарозу или полиакриламид
Бромистый этидий или SYBR green используют для окраски НК в
геле
Бромистый этидий
Гель (агароза)
17.
Гель-электрофорез ДНКбуфер
Гель
катод ( - )
источник
тока
анод ( + )
буфер
18.
Формы плазмидной ДНКSC
OC
L
supercoil
open coil
linear
( - )
OC (?)
SC
( + )
19.
Эндонуклеазы рестрикции 2 типапримеры
Фермент
Организм-источник
Сайт узнавания
20.
Система модификации-рестрикциина примере EcoRI
Рестрикция
EcoRI эндонуклеаза
«разрезает» ДНК
Модификация
EcoRI метилаза
добавляет метильные группы
21.
Тупые или ЛипкиеPестриктаза HpaI
«Тупые концы»
Рестриктаза EcoRI
«Липкие концы»
22.
Липкие концы:5´- и 3´-выступающие
BamHI
создает 5´-выступающие концы:
5´-GGATCC-3´
3´-CCTAGG-5´
5´-G
5´-GATCC-3´
3´CCTAG-5´
G-5´
5´-
-5´
Pst I
создает 3´-выступающие концы: -3´
5´CTGCAG-3´
3´-GACGTC-5´
5´CTGCAG-3´
G-3´
3´-G
3´ACGTC-5´
-3´
3´-
23.
Разные рестриктазы –одинаковые «липкие концы»
Pестриктаза BamHI
Лигаза
Рестриктаза Bgl II
24.
Эндонуклеазы рестрикции 2 типа:Как
правило, узнают 4-, 6- или 8-нуклеотидные палиндромные
последовательности
Могут образовывать 5´-, 3´- выступающие или тупые концы ДНК в
месте разреза
Разные
ферменты
могут
распознавать
одну
и
ту
же
последовательность, однако:
Изошизомеры: распознают одинаковые последовательности и
разрезают их в одном и том же месте (например, DraI и AhaIII
узнают и разрезают палиндром -T T T A A A- с образованием тупых
концов)
Гетерошизомеры: распознают одинаковые последовательности,
однако разрезают их по-разному: (например, ферменты ApaI и
Bsp120I узнают палиндром -G G G C C C-, при этом ApaI разрезает
-G G G C C C- , а Bsp120I делает это иначе: -G G G C C C-)
Изокаудомеры:
рестриктазы,
узнающие
разные
последовательности,
но
при
разрезании
образующие
одинаковые (комплементарные) липкие концы (например,
рассмотренные выше BamHI и Bgl II)
25.
О чем важно помнить, работая сэндонуклеазами рестрикции
Реакционный буфер
Концентрация в реакционной смеси
!!! Star Activity
Mg++ vs. EDTA
t° хранения, t° инкубации
!!! dam- и dcm- метилирование
26.
Dam- и Dcm-метилирование в E.coliDam-метилтрансфераза: узнает последовательность GATC и
модифицирует аденин в N6-метиладенин (m6A)
Dcm-метилтрансфераза: узнает последовательности CCAGG
и ССTGG и модифицирует цитозин в C5-метилцитозин (m5C)
В некоторых случаях dam- или dcm-метилирование может
блокировать
узнавание
сайта
рестрикции
В то же время:
соответствующей
эндонуклеазой рестрикции, например:
Эндонуклеаза BclI, сайт узнавания TGATCA
Dam-метилирование
блокирует сайт
узнавания
Рестриктаза
XbaI, всегда
сайт узнавания
TCTAGA
CH3
Эндонуклеаза BamHI, сайт узнавания GGATCC
5'...TCTAGATC...3'
5'...TCTAGATC...3'
dam+
Нечувствительна
к
dam-метилированию
3'...AGATCTAG...5'
3'...AGATCTAG...5'
XbaI
XbaI
5'...T
CTAGATC...3‘
3'...AGATCTA
G...5'
CH3
27.
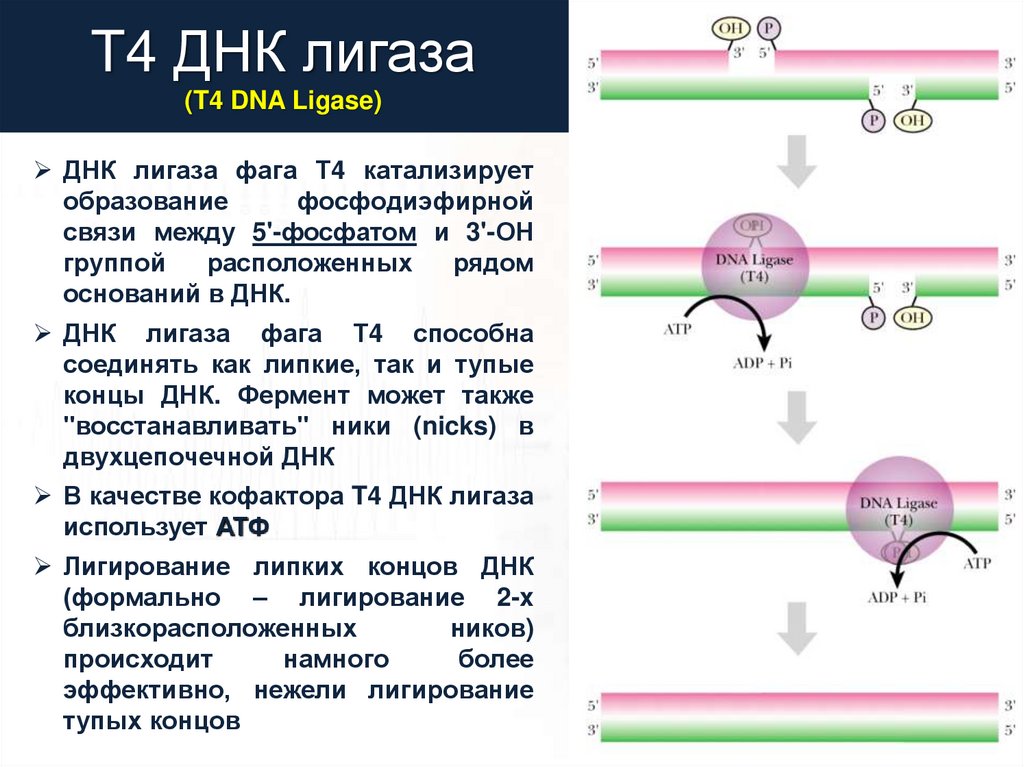
T4 ДНК лигаза(T4 DNA Ligase)
ДНК лигаза фага Т4 катализирует
образование
фосфодиэфирной
связи между 5'-фосфатом и 3'-ОН
группой
расположенных
рядом
оснований в ДНК.
ДНК лигаза фага Т4 способна
соединять как липкие, так и тупые
концы ДНК. Фермент может также
"восстанавливать" ники (nicks) в
двухцепочечной ДНК
В качестве кофактора T4 ДНК лигаза
использует АТФ
Лигирование липких концов ДНК
(формально – лигирование 2-x
близкорасположенных
ников)
происходит
намного
более
эффективно, нежели лигирование
тупых концов
28.
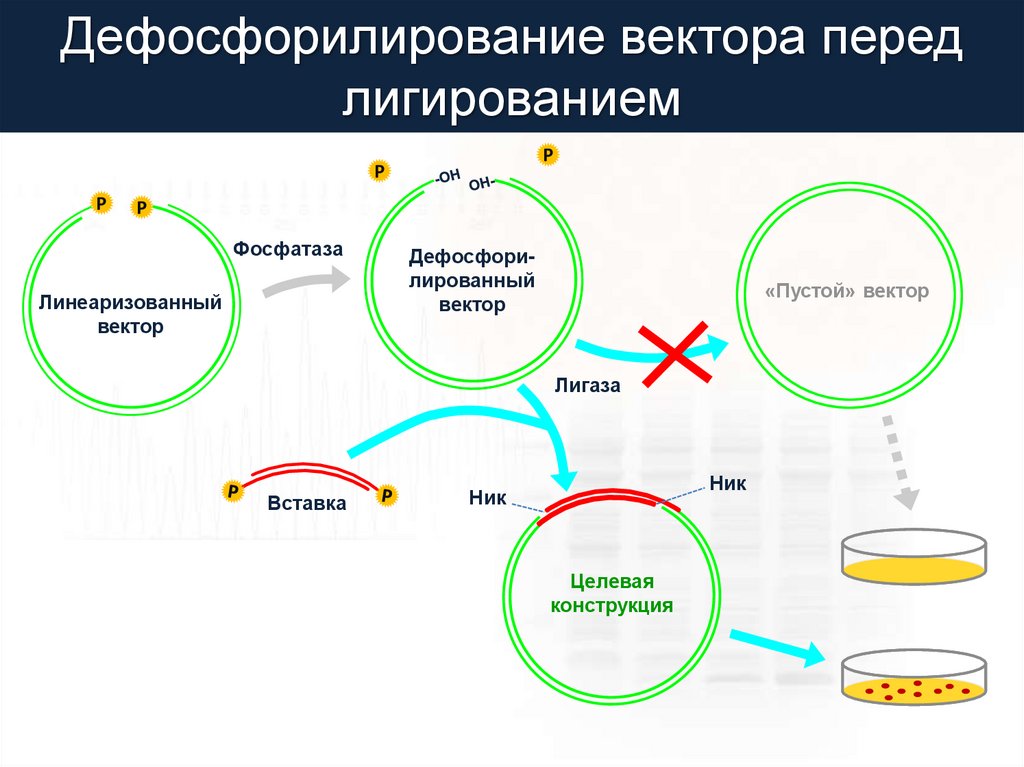
Дефосфорилирование вектора передлигированием
P
P
P
P
Фосфатаза
Линеаризованный
вектор
Дефосфорилированный
вектор
«Пустой» вектор
Лигаза
Вставка
Ник
Ник
Целевая
конструкция
29.
5′→3′ - и 3′→5′экзонуклеазные активности
3′→5′ exo
5′→3′ exo
30.
Как можно и как нельзяработать с ферментами
Контаминация
Потеря активности
31.
Трансформация: компетентныеклетки
Компетентные клетки – клетки, способные
проходить трансформацию, т.е. поглощать ДНК
Большинство клеток не являются компетентными
(только 1-2%)
+
Ампициллин
β-лактамаза
32.
Методы трансформации E.coli+42ºС
=
Тепловой шок
Простой и воспроизводимый
метод
Не требует сложного
оборудования
Сравнительно невысокая
эффективность
трансформации
(высокоэффективные
протоколы сложны и
трудоёмки)
Электропорация
Высокая эффективность
трансформации
Быстрая процедура
приготовления компетентных
клеток
Требует специального
оборудования
В присутствии даже
небольшого количества солей
эффективность процесс резко
снижается
33.
Штаммы Е.coli и их генотипыJM110
rpsL thr leu thi lacY galK galT ara tonA tsx dam dcm glnV44 Δ(lac-proAB)
e14- [F' traD36 proAB+ lacIq lacZΔM15] hsdR17(rK-mK+)
JM109
endA1 glnV44 thi-1 relA1 gyrA96 recA1 mcrB+ Δ(lac-proAB)
e14- [F' traD36 proAB+ lacIq lacZΔM15] hsdR17(rK-mK+)
BL21
E. coli B F- dcm ompT hsdS(rB- mB-) gal [malB+]K-12(λS)
Ampr
Устойчивость к ампициллину. Ген bla (периплазматический фермент
ß-лактамаза, расщепляющий ß-лактамное кольцо ампициллина).
EndA
Мутация в гене эндонуклеазы I. Показано, что мутация повышает
выход и улучшает качество препаратов плазмид.
LacY
Мутация в гене галактозид пермеазы. Неспособность использовать
лактозу.
OmpT
Мутация протеазы OmpT. Уменьшение деградации экспрессируемых
белков.
34.
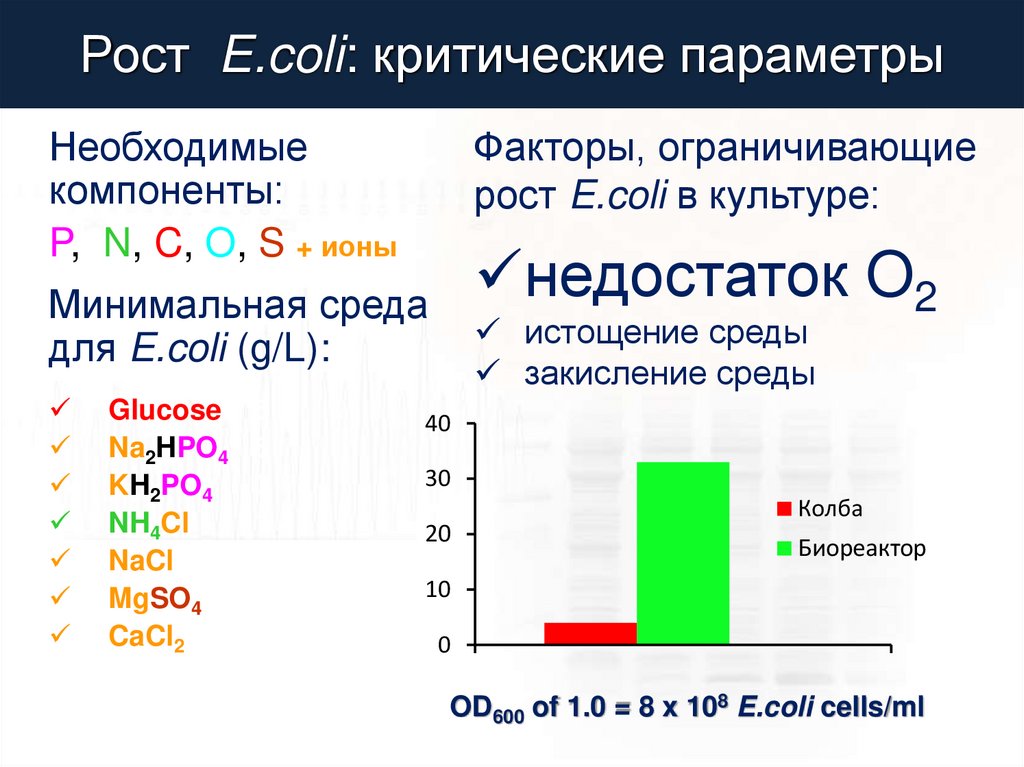
Рост E.coli: критические параметрыНеобходимые
компоненты:
P, N, C, O, S + ионы
Факторы, ограничивающие
рост E.coli в культуре:
недостаток O2
Минимальная среда
для E.coli (g/L):
Glucose
Na2HPO4
KH2PO4
NH4Cl
NaCl
MgSO4
CaCl2
5
6
3
1
0.5
0.12
0.01
истощение среды
закисление среды
40
30
20
Колба
Биореактор
10
0
OD600 of 1.0 = 8 x 108 E.coli cells/ml
35.
ПЦРАмплифицируемый участок ДНК
Исходная ДНК
Термостабильная
ДНК-полимераза
Тепловая
денатурация
Отжиг
праймеров
Элонгация
Тепловая
денатурация
36.
Условия проведения ПЦРОсновные компоненты реакционной
смеси для проведения ПЦР:
ДНК-матрица
Реакционный буфер + соли Mg++ (иногда
добавляются отдельно)
Праймеры (обычно 2)
Смесь dNTPs (ATP, GTP, CTP и TTP)
Термостабильная ДНК-полимераза
Вода
Минеральное масло (при использовании
старых моделей ДНК-амплификаторов)
+
ДНК–амплификатор
37.
Условия проведения ПЦРТемпературный режим (трехстадийный цикл)
1. Плавление ДНК-матрицы
+95°C, 20-60 сек
2. Отжиг праймеров
+50-60°C, 30-60 сек
3. Синтез ДНК
+68-72°C, 1-2 мин / 1Kb ПЦРпродукта (в зависимости от
используемой полимеразы)
12-35
циклов
Цикл 1
t°,
Плавление
матрицы
(денатурация)
Цикл 2
Синтез
ДНК
Отжиг
праймеров
Время (мин.)
Плавление
матрицы
(денатурация)
38.
ПЦР –экспоненциальный процесс
Циклы Количество копий ПЦР-продукта
1
2
2
4
4
16
10
1,024
15
32,768
20
1,048,576
25
33,554,432
30
1,073,741,824
39.
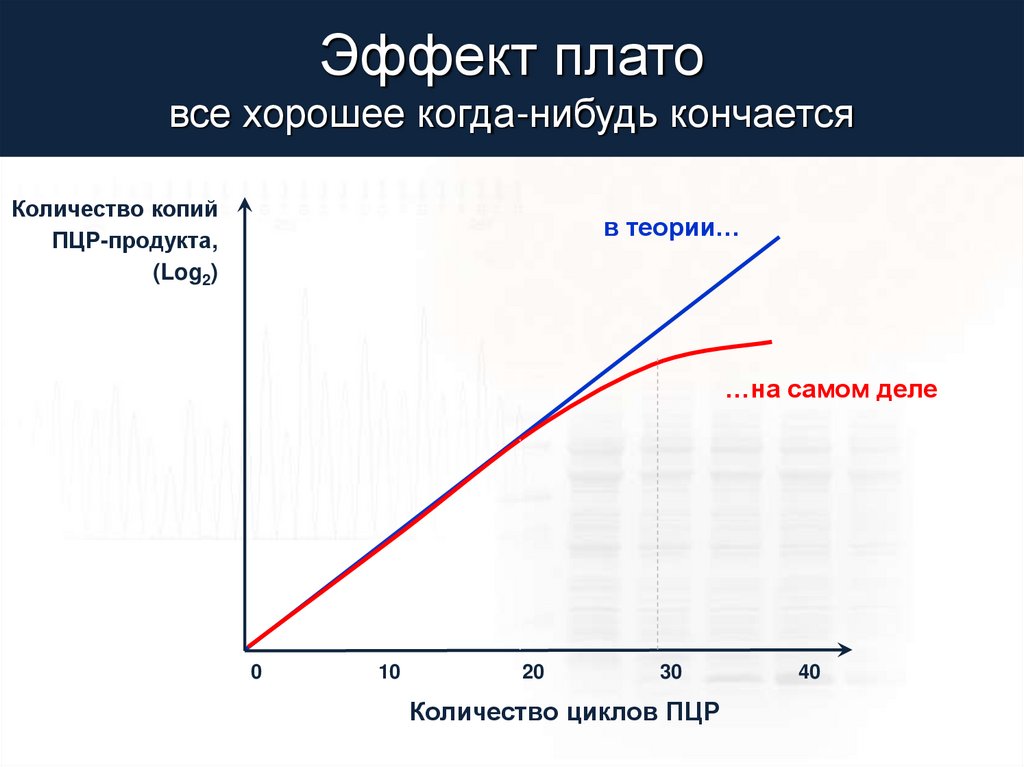
Эффект платовсе хорошее когда-нибудь кончается
Количество копий
ПЦР-продукта,
(Log2)
в теории…
…на самом деле
0
10
20
30
Количество циклов ПЦР
40
40.
ПраймерыОлигонуклеотиды длиной в среднем 15-60
оснований
Каждый праймер комплементарен лишь
одному участку матрицы (в идеале)
В идеале оба праймера должны иметь
сходные температуры плавления
GC-состав:
желательно
избегать
крайностей (50%GC - оптимум)
3´-конец праймера: желательно G или С,
но не более 3-х подряд!
Избегать
комплементарности
между
праймерами
(возможно
образование
димеров),
избегать
протяженных
участков
комплементарности
внутри
каждого из праймеров (образование
«шпилек»)
Концентрация праймеров в реакционной
смеси: 100-500nM
Димеры праймеров
«Шпильки»
41.
Другие компоненты ПЦРdNTPs
50-300 mkM каждого dNTP
Mg++
0.5-5mM (обычно 2.5mM)
Высокие концентрации Mg++ стабилизируют ДНК-дуплекс,
следствием чего может являться появление неспецифичных
продуктов ПЦР
Бетаин (1.0-1.7M), DMSO (2-10%):
дестабилизируют водородные связи в GC-парах, используются
при проведении ПЦР на GC-богатых матрицах
BSA (10-100mkg/ml): стабилизирует ДНК-полимеразу
Глицерин (1-10%): повышает стабильность ДНКполимеразы, облегчает амплификацию GC-богатых матриц
42.
Основные характеристики термостабильныхДНК-полимераз на примере Taq и Pfu
Taq-pol
Pfu-pol
Источник
Thermus aquaticus
Pyrococcus
furiosus
3'→5' экзонуклеазная
активность
Нет
Есть
Частота ошибок
2 x 10-5
1.5 x 10-6
Скорость синтеза
(нуклеотидов / сек)
60-150
25
Время полужизни при +95
0.75–1.6 h
C
Концы ПЦР-фрагментов
6.0 h
3′-A выступающие Тупые
43.
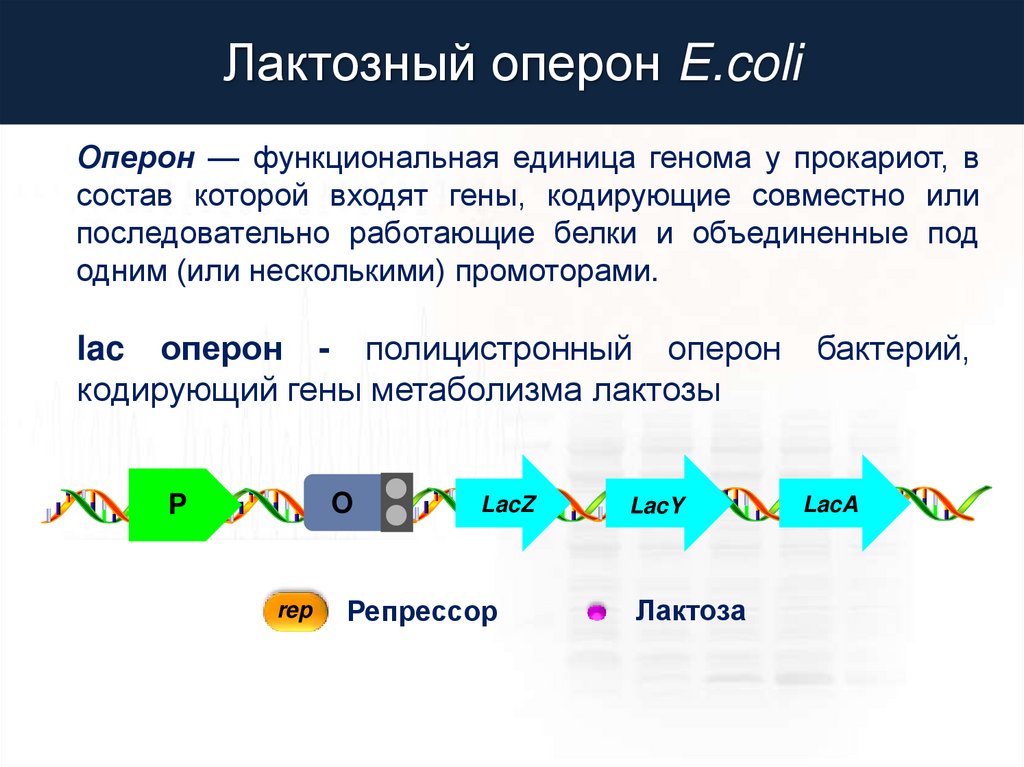
Лактозный оперон E.coliОперон — функциональная единица генома у прокариот, в
состав которой входят гены, кодирующие совместно или
последовательно работающие белки и объединенные под
одним (или несколькими) промоторами.
lac оперон - полицистронный оперон
кодирующий гены метаболизма лактозы
O
P
rep
LacZ
Репрессор
LacY
Лактоза
бактерий,
LacA
44.
Как регулируется работа lac-оперона- лактоза
RNA pol
O
P
LacZ
LacY
LacA
rep
+ лактоза
RNA pol
O
P
LacZ
LacY
LacA
rep
мРНК
45.
Экспрессия рекомбинантных белковИндуци́бельная (управляемая)
экспрессия:
При обычных условиях (по умолчанию)
экспрессия не происходит
При индукции уровень экспрессии
резко возрастает
Зачем это нужно?
46.
Чем хороша индуцибельная системаэкспрессии?
Низкий уровень
продукции белка
клетками E.coli
Индукция
экспрессии
OD600 0.4-0.8
Низкая плотность
культуры E.coli
47.
pET системамРНК
Lac оператор
Лактоза
Экспрессионная
конструкция
rep
DE3
мРНК
Lac I
хромосома E.сoli
48.
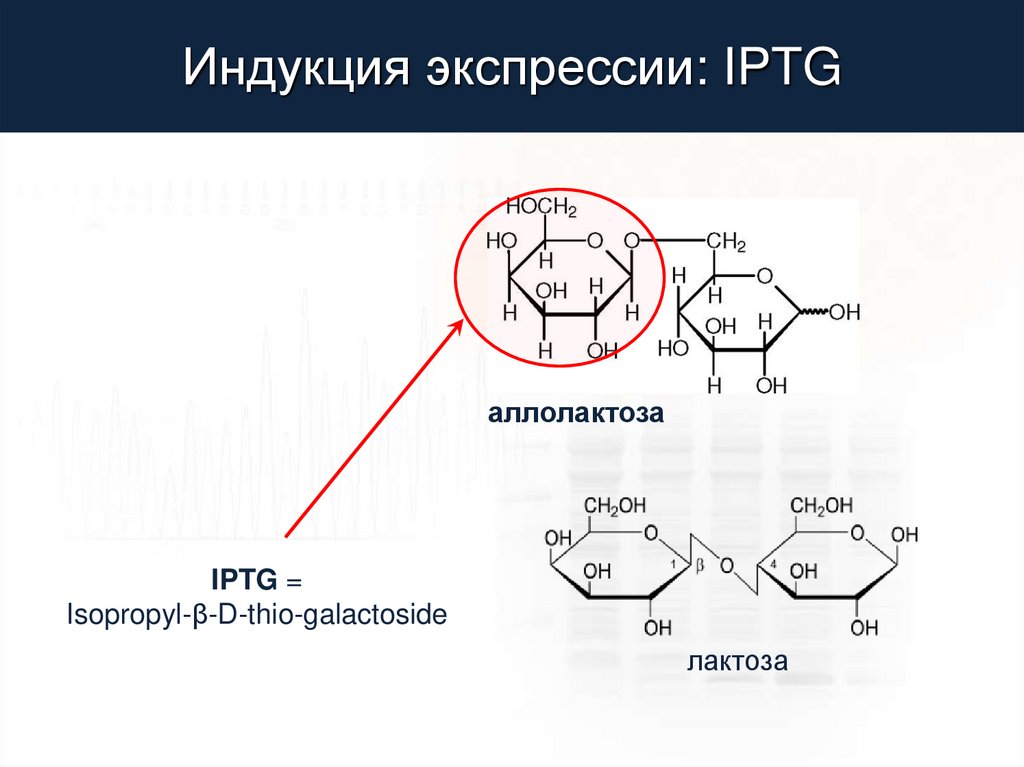
Индукция экспрессии: IPTGаллолактоза
IPTG =
Isopropyl-β-D-thio-galactoside
лактоза
49.
Как подавить «базальную» экспрессию?pLysS штаммы E.coli,
экспрессирующие лизоцим
T7 / lac промотер вместо T7
rep
GOI
Лизоцим
Amp
50.
Тельца включения E.coliБлаго или зло?
Во многих случаях экспрессированный в E.coli рекомбинантный белок
формирует нерастворимые агрегаты – тельца включения (inclusion
bodies)
Проблемы: белок находится в неактивном, денатурированном состоянии,
и получение активного белка требует дополнительных стадий (отмывка
телец включения, их солюбилизация и ренатурация белка). Это сложно;
иногда – практически невозможно
Однако:
Высокий уровень экспрессии
Защищенность от протеаз
Возможность одностадийной очистки
(степень чистоты может быть разной…)
1.
2.
3.
4.
Тотальный белок E.coli (без индукции)
Тотальный белок E.coli, после индукции экспрессии
Растворимая фракция из индуцированных E.coli
Фракция телец включения из индуцированных E.coli
M 1
2
3
4
51.
Тельца включения E.coli: причиныформирования и способы борьбы с ними
высокий уровень
экспрессии белка,
отсутствие условий для
правильного фолдинга
белка
Уменьшение концентрации индуктора
Снижение tº культивирования
Коэкспрессия с шаперонами
Использвание штаммов E.coli,
способствующих правильному
формированию дисульфидных
связей
52.
53.
CRISPR-Cas9и геномное редактирование
53
54.
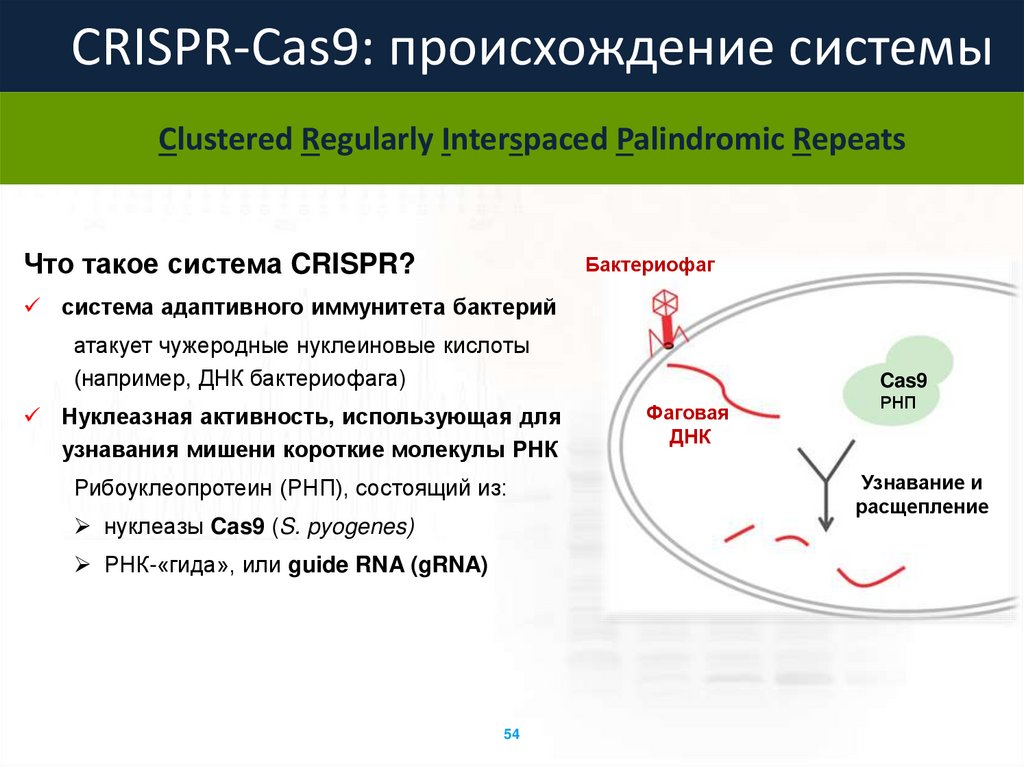
CRISPR-Cas9: происхождение системыClustered Regularly Interspaced Palindromic Repeats
Что такое система CRISPR?
Бактериофаг
система адаптивного иммунитета бактерий
атакует чужеродные нуклеиновые кислоты
(например, ДНК бактериофага)
Нуклеазная активность, использующая для
узнавания мишени короткие молекулы РНК
Рибоуклеопротеин (РНП), состоящий из:
нуклеазы Cas9 (S. pyogenes)
РНК-«гида», или guide RNA (gRNA)
54
Cas9
Фаговая
ДНК
РНП
Узнавание и
расщепление
55.
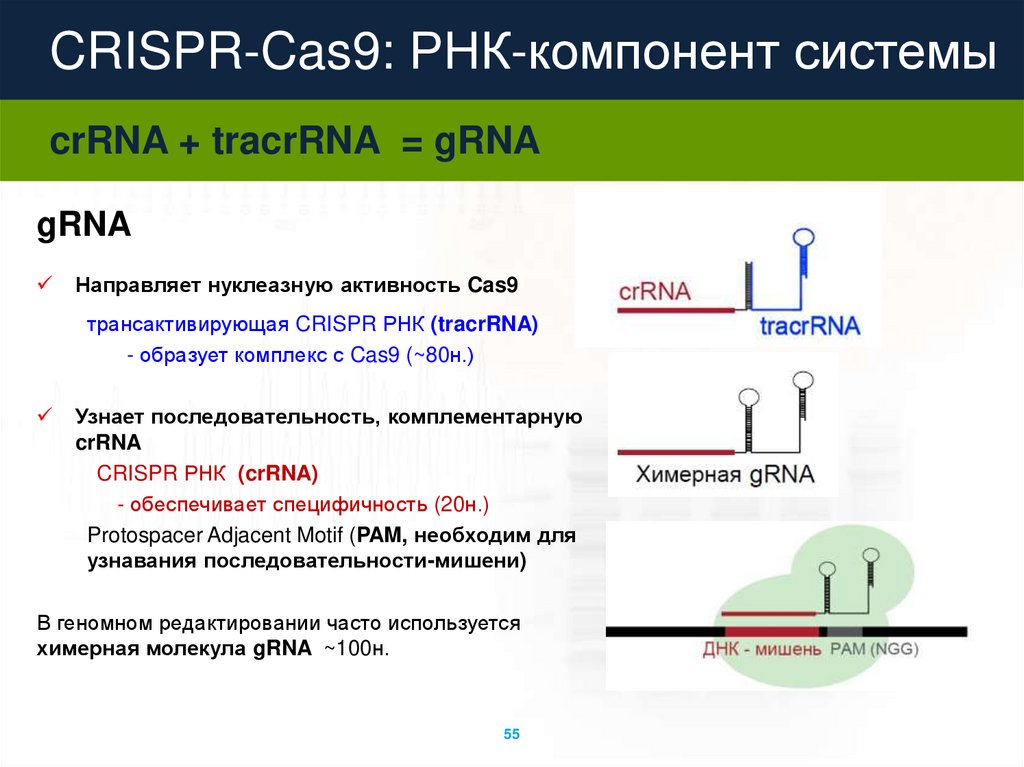
CRISPR-Cas9: РНК-компонент системыcrRNA + tracrRNA = gRNA
gRNA
Направляет нуклеазную активность Cas9
трансактивирующая CRISPR РНК (tracrRNA)
- образует комплекс с Cas9 (~80н.)
Узнает последовательность, комплементарную
crRNA
CRISPR РНК (crRNA)
- обеспечивает специфичность (20н.)
Protospacer Adjacent Motif (PAM, необходим для
узнавания последовательности-мишени)
В геномном редактировании часто используется
химерная молекула gRNA ~100н.
55
56.
CRISPR-Cas9: нуклеазаStreptococcus pyogenes Cas9 (SpCas9)
Сравнительно большой (> 1000 aa) белок Cas9
Содержит два независимых каталитических
эндонуклеазных домена – RuvC и HNH
Образует комплекс с tracrRNA (~80н.)
SpCas9 PAM:
5′-NGG-3′
56
57.
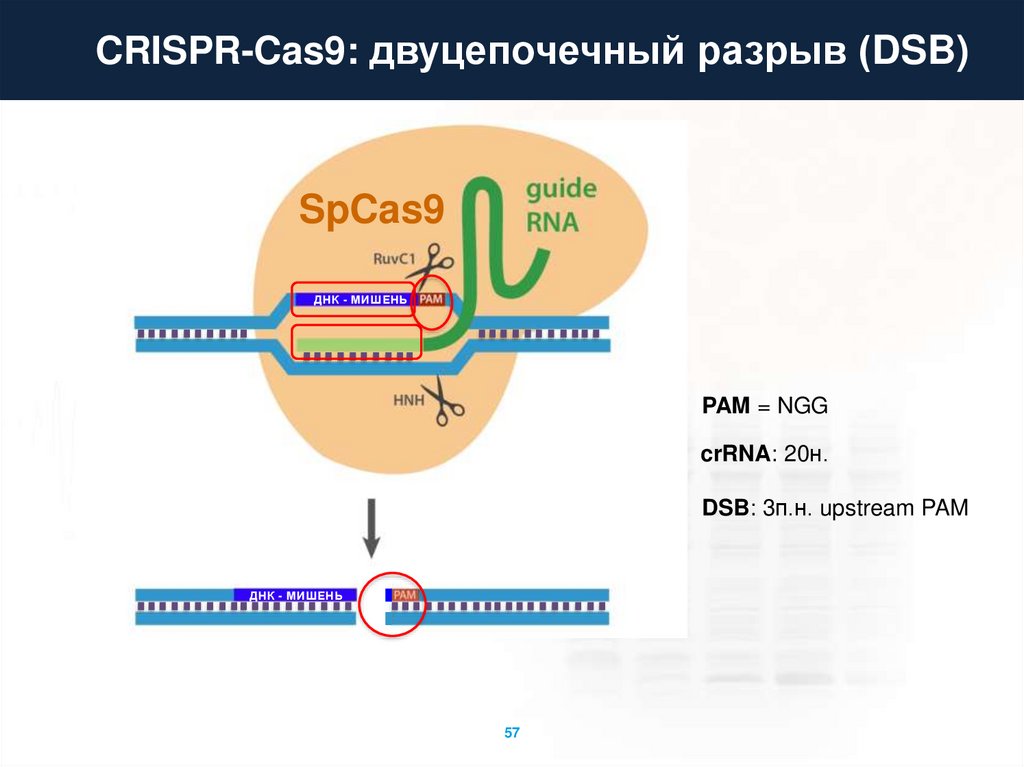
CRISPR-Cas9: двуцепочечный разрыв (DSB)SpCas9
ДНК - МИШЕНЬ
PAM = NGG
crRNA: 20н.
DSB: 3п.н. upstream PAM
ДНК - МИШЕНЬ
57
58.
Off-Target20 пар оснований vs. геном
gRNA-Cas9 комплекс может узнавать и расщеплять последовательности ДНК,
неполностью комплементарные gRNA (до 4-5 мисмэтчей)
Seed region (8 bp)
PAM
CRISPR - мишень
Вероятность
расщепления
альтернативного
сайта комплексом
gNRA-Cas9
Альтернативные
потенциальные
сайты-мишени
в геноме
Некомплементарные (относительно CRISPR-мишени ) пары оснований
58
59.
Двуцепочечные разрывы:два способа репарации
• вставки / делеции (indels)
• необходима ДНК-донор
ДНК-донор
точное соединение концов
делеция
вставка
Точная репарация
59
60.
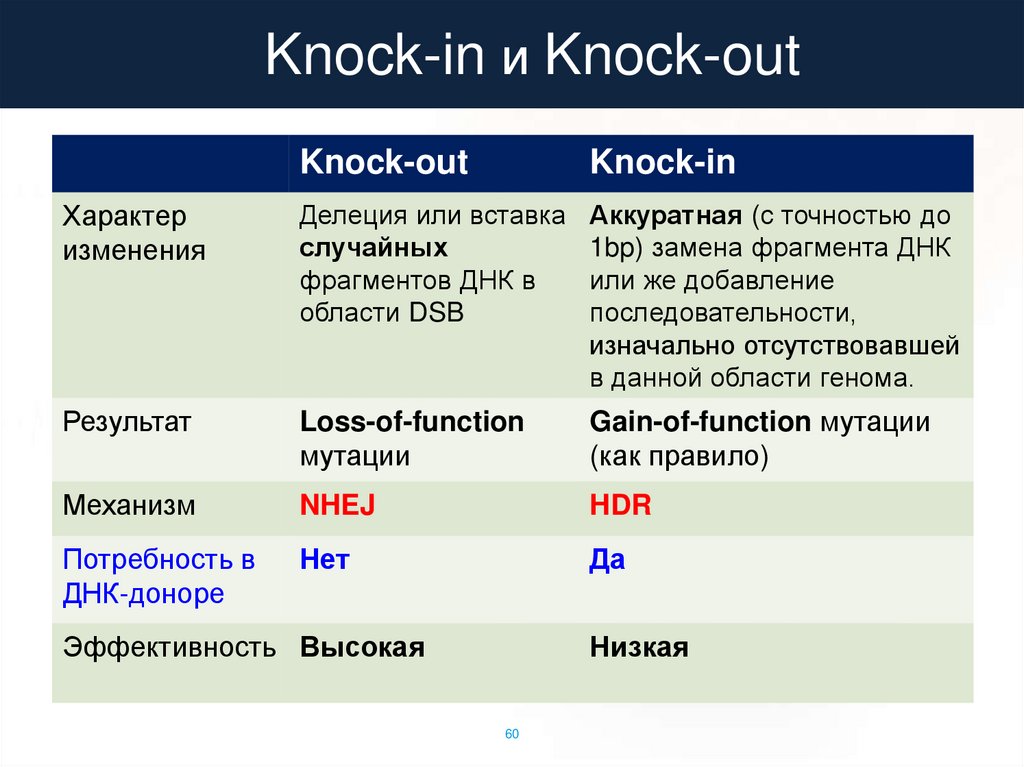
Knock-in и Knock-outKnock-out
Knock-in
Характер
изменения
Делеция или вставка
случайных
фрагментов ДНК в
области DSB
Аккуратная (с точностью до
1bp) замена фрагмента ДНК
или же добавление
последовательности,
изначально отсутствовавшей
в данной области генома.
Результат
Loss-of-function
мутации
Gain-of-function мутации
(как правило)
Механизм
NHEJ
HDR
Потребность в
ДНК-доноре
Нет
Да
Эффективность Высокая
Низкая
60
61.
Геномное редактированиеВариант генной инженерии, при котором происходят
направленные вставки, удаления или перемещения
фрагментов ДНК в выбранной области генома
61
62.
Три «Д» CRISPR-Cas9 редактированияДизайн
выбор сайтовмишеней (для
внесения DSB)
дизайн и создание
подходящих
инструментов
(gRNA, Cas9 и, при
необходимости, ДНКдонор)
Доставка
Введение
выбранных
инструментов в
здоровые,
жизнеспособные
клетки наиболее
эффективным и
наименее
травматичным
способом
62
Детекция
Анализ внесенных
изменений
Оценка эффективности
(% редактированных
геномов) и точности
процесса
















































 biology
biology








