Similar presentations:
Химия и технология лития
1. ХИМИЯ И ТЕХНОЛОГИЯ ЛИТИЯ
Северский технологический институтСТИ НИЯУ МИФИ
ХИМИЯ И ТЕХНОЛОГИЯ
ЛИТИЯ
Макасеев Ю.Н.
доцент, к.х.н.
2. СВОЙСТВА ЭЛЕМЕНТОВ ГЛАВНОЙ ПОДГРУППЫ IA
СГТИСВОЙСТВА ЭЛЕМЕНТОВ ГЛАВНОЙ ПОДГРУППЫ IA
Свойства
2
Li
Na
K
Rb
Cs
Атомный номер
3
11
19
37
55
Атомная масса
6,94
22,99
39,1
85,47
132,91
Плотность, г/см3
0,53
0,97
0,86
1,52
1,89
Температура плавления, C
180,5
99,7
63,7
39
28,6
Температура кипения, C
1317
880
762,8
698
670
Энергия ионизации, эВ
5,39
5,18
4,35
4,15
3,96
Атомный радиус, нм
0,155
0,189
0,236
0,248
0,268
Радиус гидратированного иона, нм
0,340
0,276
0,232
0,228
0,229
71
4
3,7
12
50
3,39
1,2
0,74
0,33
0,21
Сечение захвата тепловых
нейтронов, барн
Удельная теплоемкость Дж/(г град)
Изотопный состав природного лития:
Сечение захвата тепловых нейтронов, барн:
(7,52%) и 7Li (92,48%)
6Li (912) и 7Li (0,033)
6Li
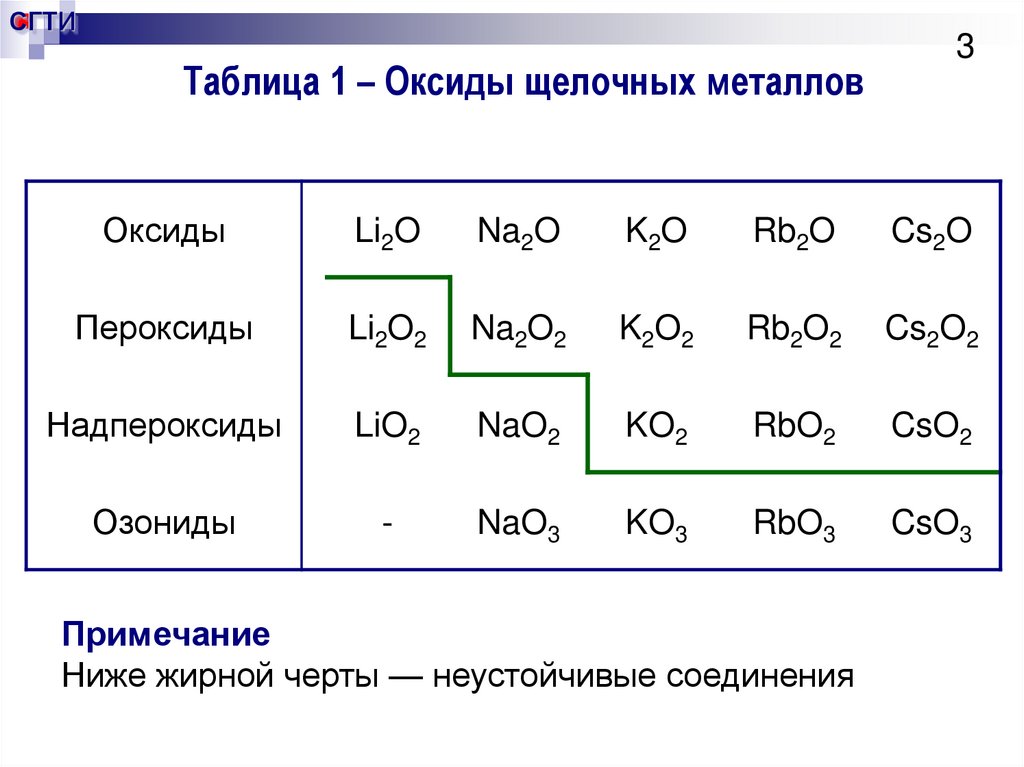
3. Таблица 1 – Оксиды щелочных металлов
СГТИТаблица 1 – Оксиды щелочных металлов
3
Оксиды
Li2O
Na2O
K2O
Rb2O
Cs2O
Пероксиды
Li2O2
Na2O2
K2O2
Rb2O2
Cs2O2
Надпероксиды
LiO2
NaO2
KO2
RbO2
CsO2
Озониды
-
NaO3
KO3
RbO3
CsO3
Примечание
Ниже жирной черты — неустойчивые соединения
4. Таблица 2 – Энтальпия и энергия Гиббса образования кристаллических оксидов щелочных металлов, кДж на 2 г-атома металла
СГТИ4
Таблица 2 – Энтальпия и энергия Гиббса образования
кристаллических оксидов щелочных металлов,
кДж на 2 г-атома металла
– H 298(f)
– G 298(f)
Оксид
Li
Na
K
Rb
Cs
Li
Na
K
Rb
Cs
M2 O
597
416
362
331
318
561
393
322
301
318
M2O2
634
511
494
425
402
565
435
418
314
289
2MO2
611
520
566
570
580
469
377
427
427
435
2MO3
527
456
519
439
439
301
230
293
289
289
5. Оксид лития
СГТИ5
Оксид лития
Li2O – самый устойчивый оксид
Тпл. = 1400 – 1600 С
Ткип. = 2600 – 2700 С
Но при Т > 1000 С оксид сублимирует:
Li2Oтв Li2Oгаз
При Т > 1400 С разлагается:
Li2Oтв
Li газ + O2 газ + Li2Oгаз + Li2O2 газ
90%
~10%
0,2%
Оксид получают следующими способами:
4Li + O2 ⇄ 2Li2O,
( T > 200 С);
Li2CO3 ⇄ Li2Oтв + CO2 газ (Т > 800 С, H2 сухой);
2LiOH ⇄ Li2O + H2O
(T > 800 С, H2 сухой).
6. Свойства оксида лития
СГТИСвойства оксида лития
6
Химические свойства
Li2Oтв. + H2Oгаз ⇄ LiOH
Li2Oтв. + CO2 газ ⇄ Li2CO3
Образует двойные оксиды:
LiNbO3
LiTaO3
LiAlO2
(1,1 – 2)Li2O 11Al2O3
– сегнетоэлектрики;
– монокристаллы оптического качества
– моноалюминат;
– полиалюминат – твердый
электролит с очень высокой
электропроводностью 3,7 10-3 Ом-1 см-1
Химически активен по отношению к многим металлам и
только
Ni, Au, Pt устойчивы до 1000 С.
Сплав (Pt + 40%Rh) устойчив выше 1000 С.
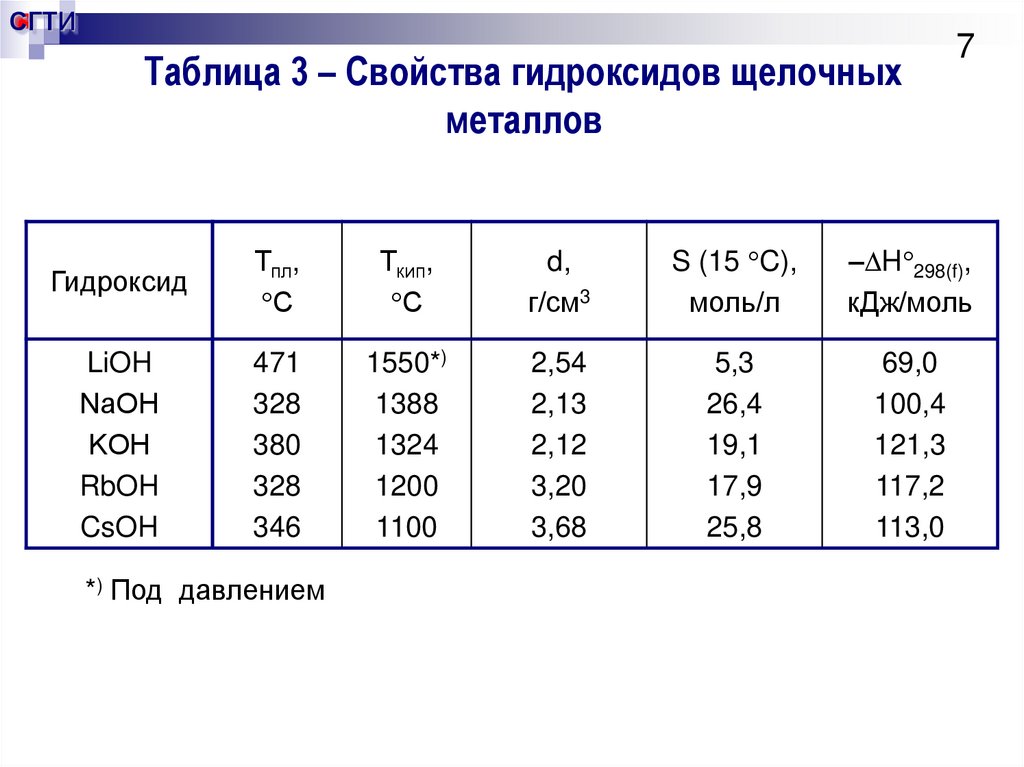
7. Таблица 3 – Свойства гидроксидов щелочных металлов
СГТИТаблица 3 – Свойства гидроксидов щелочных
металлов
7
Гидроксид
Тпл,
С
Ткип,
С
d,
г/см3
S (15 C),
моль/л
– H 298(f),
кДж/моль
LiOH
NаОН
KОН
RbOH
CsOH
471
328
380
328
346
1550*)
1388
1324
1200
1100
2,54
2,13
2,12
3,20
3,68
5,3
26,4
19,1
17,9
25,8
69,0
100,4
121,3
117,2
113,0
*) Под давлением
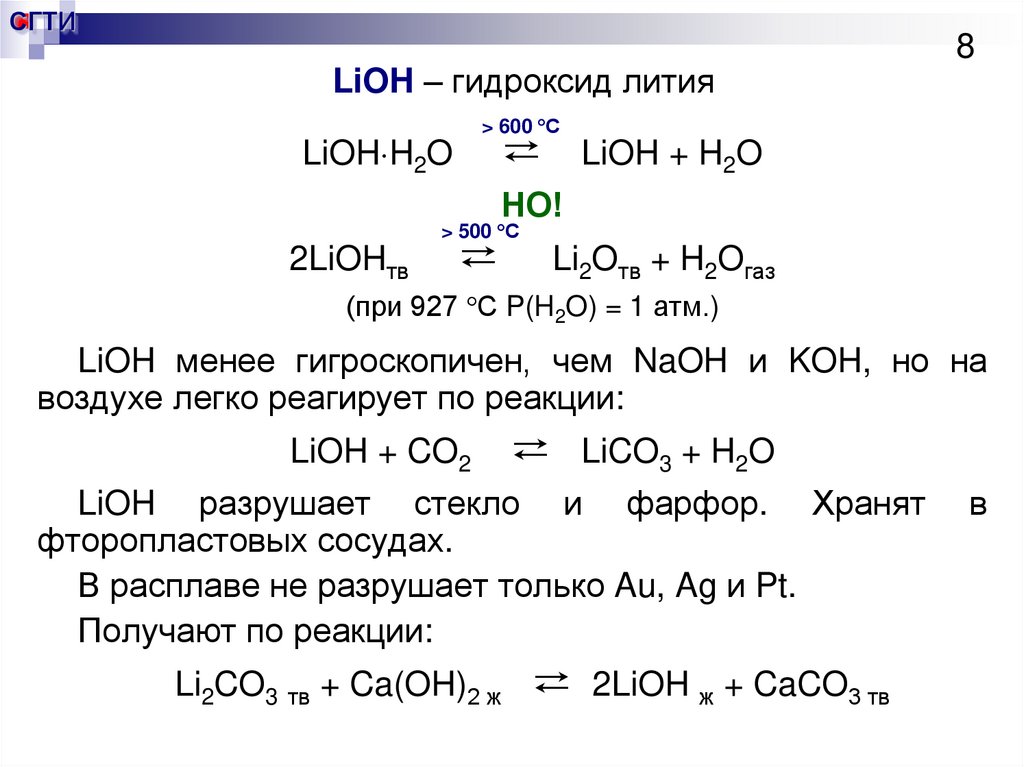
8. LiOH – гидроксид лития
СГТИLiOH – гидроксид лития
8
> 600 С
⇄
LiOH H2O
LiOH + H2O
НО!
> 500 С
2LiOHтв
⇄
Li2Oтв + H2Oгаз
(при 927 С P(H2O) = 1 атм.)
LiOH менее гигроскопичен, чем NaOH и KOH, но на
воздухе легко реагирует по реакции:
LiOH + CO2
⇄
LiCO3 + H2O
LiOH разрушает стекло и фарфор. Хранят
фторопластовых сосудах.
В расплаве не разрушает только Au, Ag и Pt.
Получают по реакции:
Li2CO3 тв + Ca(OH)2 ж
⇄
2LiOH ж + CaCO3 тв
в
9. Рисунок 3 – Политерма растворимости LiOH в воде
СГТИРисунок 3 – Политерма растворимости LiOH в воде
LiOH
г/л
160
140
120
0
40
80
t, C
9
10. Соли кислородсодержащих кислот
СГТИСоли кислородсодержащих кислот
10
Li2SO4 – наиболее устойчив, хорошо растворим в воде;
образует двойные соли типа NaLiSO4, Na3Li(SO4)2 и др.
LiNO3 – термически неустойчив, очень гигроскопичен,
хорошо растворим в воде, образует пересыщенные
растворы (до 70% при 100 С), разлагается с выделением
O2 и (NO+NO2);
2LiNO3 Li2O + O2 + NO+NO2
11. Фосфат лития
СГТИФосфат лития
11
Li3PO4 – термически устойчив, наименее растворим в
воде (0,034 г/100г H2O при 18 С). Из раствора выделяется
Li3PO4 2H2O, который при 120 С обезвоживается. В
растворах сильных кислот Н3РО4, HCl, HNO3 образует
кислые соли Li2HPO4 и LiH2PO4, более растворимые.
Поэтому среднюю соль выделяют в присутствии NaOH
при доизвлечении лития при осаждении Li2CO3. Затем
фосфат переводят в гидроксид или хлорид:
2Li3PO4 тв + 3Ca(OH)2 р-р = Ca3(PO4)2 тв +6LiOH р-р;
2Li3PO4 тв + 3CaCl2 р-р = Ca3(PO4)2 тв + 6LiCl р-р.
12. Карбонат лития
СГТИКарбонат лития
12
Li2CO3 – термически неустойчив, труднорастворим в
воде (1,3 % при 20 С), плавится при 732 С и
диссоциирует по реакции:
Li2CO3 распл ⇄ Li2Oтв + CO2 газ
Li2CO3 не образует двойных и комплексных соединений,
поэтому хорошо высаливается одноименным ионом.
Li2CO3 растворяется при действии CO2:
Li2CO3 + CO2 + H2O = 2LiHCO3.
13. Силикаты лития
СГТИСиликаты лития
13
Li2SiO3, Li2Si2O5 и Li4SiO4 не растворимы в воде в
отличие от силикатов Na и K. Разлагаются кислотами с
выделением SiO2 H2O. Ортосиликат Li4SiO4 разлагается
водой и поэтому из раствора его не выделяют:
3Li4SiO4 + 4H2O = Li2SiO3 + Li2Si2O5 + 8LiOH.
Известны алюмосиликаты лития: LiAl(Si2O6) – минерал
сподумен и Li(AlSiO4) –эвкриптит.
14. Галогениды лития
СГТИ14
Галогениды лития
Фтор
самый
электроотрицательный
элемент,
исключительно химически активен, что обусловлено
относительной слабостью связи F—F в молекуле фтора
(159 кДж/моль). Для молекулы хлора энергия связи Сl—Сl
равна 243 кДж/моль.
Таблица 4 – Свойства галогенов
Элементы
rат, нм rx-, нм
X
F
Сl
Вг
I
0,060
0,099
0,119
0,136
0,115
0,167
0,182
0,206
J, эв
J -,
эВ
Энергия
диссоциации
молекул X2,
кДж/моль
ЭО (по
Полингу)
20,86
15,03
13,10
12,67
3,50
3,82
3,54
3,23
159
243
190
149
4,0
3,2
3,0
2,6
15. Галогениды лития
СГТИ15
Галогениды лития
Фториды — наиболее прочные галогениды, например
энергия связи Li—F 573, a Li—Cl 506 кДж/моль (табл. 5).
Все галогениды щелочных металлов — ионные
соединения
с
относительно
небольшой
долей
ковалентной составляющей.
Таблица 5 – Свойства галогенидов лития
Соединение
Tпл,
°C
Tкип,
°C
– H 298(f)
кДж/моль
d,
г/см3
LiF
LiCl
LiBr
Lil
848
607
550
469
1681
1385
1310
1171
617
405
349
271
2,2
2,07
2,9
3,5
16. Галогениды лития
СГТИГалогениды лития
16
Фтор в соединениях проявляет степень окисления
только -1; хлор, бром, йод — от -1 до +7.
Фториды имеют, как правило:
более высокие температуры плавления и кипения;
из растворов кристаллизуются в виде безводных солей
или
с
меньшим
содержанием
молекул
кристаллизационной воды, чем другие галогениды
щелочных элементов;
некоторые фториды плохо растворяются в воде.
17. Фторид лития
СГТИФторид лития
17
Фторид лития LiF — не гигроскопичен, в воде
растворяется плохо, при 25 °С его растворимость 0,13
г/100г Н2О. Растворимость LiF понижается в присутствии
аммиака и особенно NH4F, в азотной и серной кислотах
растворяется при комнатной температуре. В плавиковой
кислоте образуется гидродифторид LiHF2, который
растворяется в воде несколько лучше LiF. При нагревании
он разлагается на LiF и HF. Фторид лития не растворяется
в спиртах, ацетоне и других органических растворителях
самое тугоплавкое соединение из всех галогенидов
щелочных элементов.
18. Хлорид лития
СГТИ18
Хлорид лития
Хлорид лития LiCl — бесцветное кристаллическое
вещество с решеткой типа NaCl, имеет довольно высокие
температуры плавления и кипения. Заметное испарение
LiCl начинается при температуре > 880 °С. Хлорид лития в
отличие от NaCl и КСl гигроскопичен, на воздухе
расплывается сильнее СаСl2, хорошо растворяется в
воде, при повышении температуры растворимость
увеличивается:
Температура, С
Растворимость, %
0
25
40,89 45,85
50
75
49,06 52,18
19. Хлорид лития
СГТИХлорид лития
19
Из
водных
растворов
выделяется
в
виде
кристаллогидратов LiCl H2O. Выше 94 °С может быть
выделен безводный LiCl.
В водных растворах LiCl сильно диссоциирован:
LiCl = Li+ aq + ClПоэтому LiCl нельзя высолить из раствора ни
добавлением концентрированной соляной кислоты, ни
пропусканием
через
раствор
газообразного
НСl.
Вследствие этой же способности иона Li к гидратации LiCl
является сильным высаливателем и дегидратирующим
агентом.
20. Хлорид лития
СГТИХлорид лития
20
Растворы
LiCl
поглощают
аммиак
вследствие
образования комплексных ионов [Li(NH3)n]+; твердый
безводный LiCl поглощает из воздуха пары аммиака с
образованием LiCl nNH3, где n изменяется от 1 до 4.
Система LiCl—KСl имеет эвтектическую фазовую
диаграмму (эвтектика 58 % LiCl, температура плавления
348—358 °С) с небольшими областями твердых растворов
на основе LiCl и KСl. В то же время в системе NaCl—KCl
образуются непрерывные твердые растворы.
21. Рисунок 4 – Фазовая диаграмма системы Li-Na
СГТИРисунок 4 – Фазовая диаграмма системы Li-Na
21
22. Свойства галогенидов лития
СГТИСвойства галогенидов лития
22
Бромид лития LiBr более гигроскопичен, чем LiCl,
хорошо растворим в воде, при повышении температуры
растворимость увеличивается (при 20 °С 177 г/100г воды).
Иодид лития Lil — самый неустойчивый галогенид
лития. Расплавленный Lil разрушает стекло, фарфор,
платину; очень гигроскопичен, хорошо растворяется в
воде (при 19 °С 164 г/100г Н2О).
23. Взаимодействие лития с неметаллами
СГТИВзаимодействие лития с неметаллами
23
Литий активно взаимодействует cо всеми неметаллами:
с некоторыми из них при обычной температуре, с другими
— при нагревании.
Образование соединений с ними предопределяет
использование лития в качестве дегазатора сплавов
черных и цветных металлов.
24. Взаимодействие лития с водородом
СГТИВзаимодействие лития с водородом
24
Литий — водород
При
непосредственном
взаимодействии
расплавленного
лития
с
газообразным
хорошо
очищенным от примесей водородом образуется твердый
гидрид лития LiH. Реакция начинается при 400 °С и
заканчивается при 700 °С.
2Li(ж)+Н2(г) ⇄ 2LiН(тв) ; - H 298 = – 181,4 кДж
Молекула LiH по характеру химической связи
приближается к типу ионных соединений Li+Н–, в ней
имеет
место
частичная
ионизация
водорода,
эффективный заряд которого –0,35 (Н–0,35).
Тпл = 680-700 °С. Интенсивно разлагается при 850 С. В
вакууме сублимируется при 220 °С.
25. Свойства гидрида лития
СГТИСвойства гидрида лития
25
С кислородом LiH реагирует при 500 – 600 °С.
При нагревании с азотом образуется нитрид Li3N.
С хлором, серой, углеродом, кремнием и фосфором
реагирует также при повышенной температуре.
С водой LiH реагирует очень бурно:
LiН(тв) + Н2О(г) ⇄ LiOH(тв) + H2(г); – H 298 = 155кДж
При гидролизе 1 кг LiH выделяется 2,8 м3 газообразного
водорода. Это предопределило использование его в
качестве легкодоступного и простого аккумулятора
водорода для автономных потребителей небольшой
мощности.
26. Свойства гидрида лития
СГТИСвойства гидрида лития
26
С жидким аммиаком при комнатной температуре, а с
газообразным при 440—460 °С образуется амид
LiH + NH3 ⇄ LiNH2 + H2.
При высокой температуре LiН активно взаимодействует
с металлами, SiO2 и силикатами, разрушает аппаратуру из
стекла и фарфора.
Гидрид лития вступает в реакции обмена почти со
всеми галогенидами металлов и неметаллов. Реакции
обмена используются для получения многих гидридов;
таким образом можно получить, например, моносилан
SiCl4 + 4LiH ⇄ SiH4 + 4LiCl
27. Свойства гидрида лития
СГТИСвойства гидрида лития
27
Гидрид LiH обнаруживает склонность к образованию
двойных гидридов, из которых наибольший интерес
представляют LiAlH4 и LiBH4. Реакция получения LiAIH4
протекает при температуре от 0 до –4 °С в эфирном
растворе
4LiH+AlCl3
⇄ LiАlН4 + 3LiСl; – H 298 = 101 кДж
Тетрагидридоалюминат лития LiAIH4 – твердое
нелетучее соединение с плотностью 0,92 г/см3. В сухом
воздухе начинает медленно разлагаться при нагревании
до 120 °С, водой бурно гидролизуется:
2LiAlH4 ⇄ 2LiH + 3H2 + 2Al
28. Свойства гидрида лития
СГТИСвойства гидрида лития
28
Хорошо
растворяется
во
многих
органических
растворителях, что имеет большое значение для его
использования в различных реакциях. С его помощью по
реакциям обмена были получены летучие гидриды В, Al,
Si, Ge, Sn, As и Sb
4MX + LiAlH4 ⇄ 4MH + LiX + AlX3
В органическом синтезе он используется как
гидрирующий агент и как восстановитель. Реакции
восстановления протекают количественно и с высокой
чистотой. При действии LiAIH4 альдегиды, кетоны,
ангидриды, сложные эфиры легко превращаются в
спирты.
29. Свойства гидрида лития
СГТИСвойства гидрида лития
29
Тетрагидридоборат
LiBH4
получается
при
взаимодействии диборана В2H6 с LiH в среде этилового
эфира при температуре его кипения 34,6°С. Это вещество
с плотностью 0,66 г/см3, термически устойчивое, плавится
при 275 °С, при нагревании при 275 – 280 °С разлагается
с выделением водорода
B2H2 + 2LiH ⇄ 2LiBH4; – H 298 = 185 кДж
Водой и спиртами LiВН4 легко разлагается; при его
полном гидролизе из 1 кг образуется 4,1 м3 водорода. В
гидриде лития водород составляет 12,5 %, в борогидриде
лития 18,2 %, т.е. как аккумулятор водорода он более
эффективен, чем гидрид.
30. Применение гидридов лития
СГТИПрименение гидридов лития
30
Оба гидрида LiH и LiBH4 обладают высокой теплотой
сгорания, их добавляют к ракетному топливу с целью
повышения его эффективности и стабильности горения.
Вообще теплота сгорания борогидридов значительно
выше углеводородов. Например, теплота сгорания
керосина равна 43 МДж/кг, а пентаборана В5Н9
71
МДж/кг.
31. Применение гидрида лития
СГТИПрименение гидрида лития
31
Особое значение гидриды имеют для термоядерного
синтеза, одной из основных реакций которого является
реакция, хотя в смеси 21D и 31Т могут идти и другие
ядерные реакции. Для поддержания реакции необходимы
реакции производства трития
3
4
1
1D + 1Т 2He + 0n + 17,6 MэB;
6 Li + 1 n 4 He + 3 Т + 4,8 MэB.
3
0
2
1
2
Для осуществления термоядерного синтеза в качестве
топлива используют дейтерид лития-6. При температуре
108 – 109 К протекают одновременно реакции синтеза
трития и образования ядер гелия с выделением энергии
22,4 МэВ на одну молекулу LiD (2,16 109 кДж/моль LiD)
32. Применение гидрида лития
СГТИПрименение гидрида лития
32
Гидрид лития-6 используют для нейтронной защиты
ядерных реакторов. Перспективно использование для
охлаждения термоядерных реакторов и воспроизводства
трития таких соединений, как Li2BeF4, обогащенных
изотопом 6Li. Они оказывают меньшее коррозионное
действие, чем металлический литий. Отсюда проблема
разделения изотопов лития.
Кроме этого известны соединения лития с углеродом,
кремнием, фосфором, азотом и серой.
33. Сплавы лития с металлами
СГТИСплавы лития с металлами
33
Литий — самый легкий металл, имеет малые атомные
размеры и относительно прочную кристаллическую
структуру. Со многими металлами (Al, Mg, Cu, Pb, Zn и др.)
образует ограниченные твердые растворы и интерметалл
иды,
отличающиеся
большой
прочностью
и
тугоплавкостью.
Литий не взаимодействует с железом и никелем, что
имеет большое практическое значение, так как позволяет
для работы с ним использовать тигли из высокочистого
никеля и некоторых нержавеющих сталей. До 900 °С в
расплавленном литии устойчивы титан, ниобий и тантал.
34. Сплавы лития
СГТИСплавы лития
34
Из систем, образуемых литием с другими металлами,
наибольшее внимание привлекают сплавы лития с:
алюминием;
магнием;
медью.
35. Сплавы лития
СГТИСплавы лития
35
Сплавы Li—Аl. В системе Li—Аl установлены
интерметаллиды AlLi и AlLi2, предполагается также
образование метастабильного AlLi. Растворимость лития в
алюминии имеет максимальное значение при температуре
эвтектики (600 C) 9,9 % или [~30 % (ат.)]. Растворимость
алюминия в литии ничтожна. Интерметаллид AlLi имеет
широкую область гомогенности [45—56% (ат.) Li], а
интерметаллид AlLi2 образуется по перитектической
реакции. Выcокая растворимость лития в алюминии
объясняется близостью атомных радиусов.
Литий принадлежит к числу металлов с наибольшей
растворимостью в алюминии (Ag, Zn, Mg). Сплавы (Аl, Li)
обладают
сочетанием
пониженной
плотности
с
повышенным модулем упругости, отличаются большей
пластичностью. Такой эффект не может быть получен при
легировании алюминия любым другим металлом.
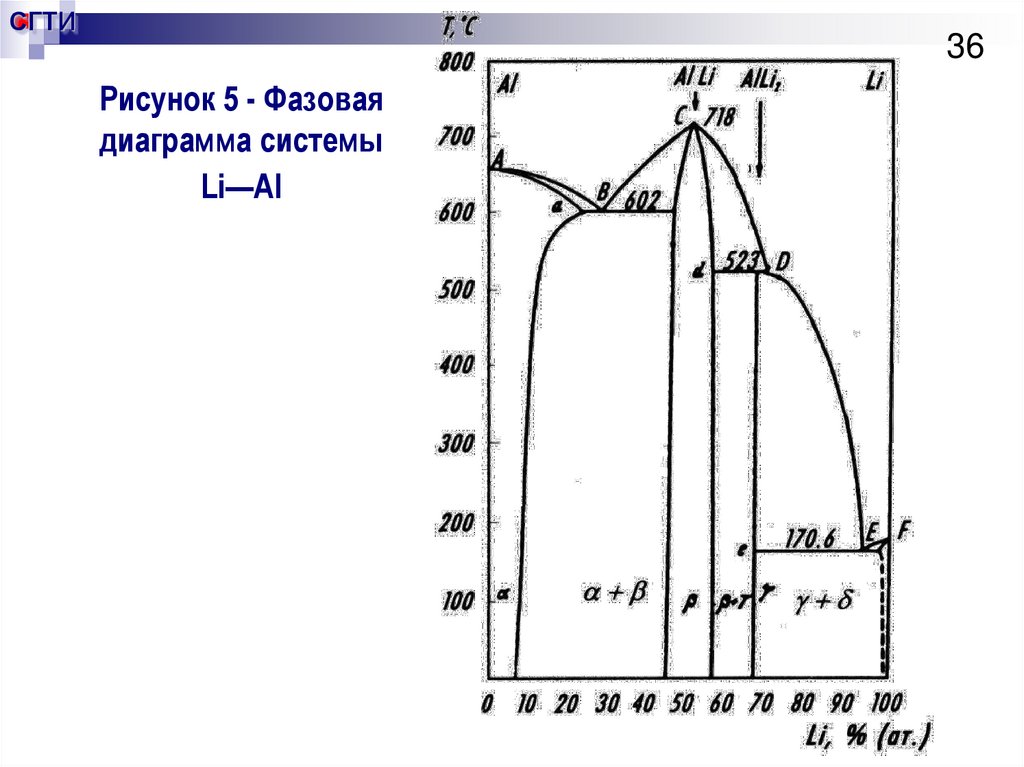
36. Рисунок 5 - Фазовая диаграмма системы Li—Al
СГТИ36
Рисунок 5 - Фазовая
диаграмма системы
Li—Al
37. Рисунок 6 – Плотность сплавов алюминия, легированных разными металлами
СГТИРисунок 6 – Плотность сплавов алюминия, легированных
разными металлами
1 — Li;
2 — Mg;
3 — Be;
4 — Сu;
37
38. Сплавы лития
СГТИСплавы лития
38
Литий,
кроме
того,
обладает
удивительной
способностью
сообщать
алюминиевым
сплавам
повышенную устойчивость против коррозии. Наиболее
устойчив против нее сплав, содержащий 2,94 % (ат.)
(0,77%) лития, отличающийся также повышенной
пластичностью. Уменьшение растворимости лития в
алюминии
позволяет
для
упрочнения
сплавов
использовать закалку, а образование интерметаллидов,
имеющих, как правило, более высокую твердость,
позволяет получать двухфазные сплавы с нужными
механическими свойствами.
39. Сплавы лития
СГТИСплавы лития
39
Добавки меди к двойным сплавам Аl—Li приводят к
значительному уменьшению растворимости лития (при
515 C 1,5%), в тройной системе образуются
интерметаллиды Cu4LiAl7, CuLiAl2 и СuLi3Аl6. Разработаны
сложнолегированные сплавы с суммарным содержанием
легирующих металлов (Li, Сu, Zr, Mg) 5—6%; такие сплавы
имеют
исключительно
высокие
эксплуатационные
характеристики.
Сплавы Li—Mg. В системе Li—Mg образуется один
LiMg2 с tпл 600 С Сплав приобретает ковкость при
низкой температуре.
40. Важнейшие области применения лития и его соединений
СГТИВажнейшие области применения лития и его
соединений
40
Электролитическое получение алюминия (до 45 %);
Добавки Li2CO3 в электролит:
снижают температуру плавления электролита;
уменьшают выделение фтора;
увеличивают электропроводность электролита;
уменьшают расход анода и криолита;
уменьшают расход электроэнергии;
снижают себестоимость металла;
увеличивают производительность.
41.
СГТИ41
Производство стекла и керамики (до 40 %).
Добавки Li2CO3, Li2SiO3.
улучшают качество фарфора и керамики;
повышают их химическую стойкость и термостойкость;
глазури и эмали с литием более плотны и блестящи,
более устойчивы к атмосферным воздействиям;
снижают температуру плавления и вязкость расплава;
повышают производительность труда;
уменьшают расход топлива.
42.
СГТИ42
Цветная и черная металлургия.
Сплавы
Li–Si–Ca
активные
раскислители,
десульфуризаторы и дегидрирующие агенты.
43.
СГТИ43
Авиаракетно-космическая техника.
алюминийлитиевые сплавы например, %: 94,98 Аl; 2,2
Li; 2,7 Сu; 0,12 Zr и 95,2 Al; 2,5 Li; 1,3 Сu; 0,9 Mg; 0,1 Zr
уменьшают плотность стандартных алюминиевых
сплавов на 8 —12%;
повышают устойчивость к коррозии;
повышают прочность;
снижают массу самолета на 20 %;
обеспечивают экономию топлива.
44.
СГТИ44
Применение сдерживается высокой стоимостью (в 6-10
раз дороже), снижение которой возможно при массовом
производстве.
Консистентные смазки, содержащие до 10 % стеарата
лития, эффективно работают при температурах от -50 до
+150 °С.
45.
СГТИ45
Химические источники тока (ХИТ),
В 2012 году произведено 2 млрд. шт. литий-ионных
аккумуляторов на сумму 80 млрд. долларов.
Ежегодный прирост производства составляет 8%.
Перспективными
материалами
для
электродов
являются соединения LixCoO2, LixMoO4 и другие.
Катализаторы при синтезе синтетического каучука и
других органических соединений.
46. Ядерная энергетика
СГТИЯдерная энергетика
46
Ядерная энергетика
Легкий изотоп 6Li – основной компонент термоядерных
реакторов (ТЯР), а сплавы Cu—Li, Al—Mg—Li, по всей
вероятности,
будут
использоваться
в
качестве
конструкционных материалов ТЯР.
47. Ядерная энергетика
СГТИЯдерная энергетика
47
Тяжелый изотоп 7Li в качестве жидкометаллического
теплоносителя атомных реакторов:
прозрачен для тепловых нейтронов;
имеет широкую область жидкого состояния (180—1336
°С);
имеет высокую удельную теплоемкость, превышающую
у калия, ртути, свинца и висмута, поэтому обеспечивает
интенсивный отвод тепла от ТВЭЛов;
обеспечивает
возможность
создания
высокотемпературного
контура
(450-650
°С)
при
атмосферном давлении;
48. Электронные приборы
СГТИЭлектронные приборы
48
ниобаты и танталаты лития, устройства для модуляции
и отклонения лазерного луча, устройства для обработки и
отображения информации, запоминающие устройства и
т.д.
приемники и преобразователи ИК-излучений в СВЧдиапазоне.
49.
СГТИ49
По объему потребления лития:
на первом месте стоят США; на их долю приходится
около 40 % мирового потребления лития
далее идет Западная Европа 27 и Япония 18 %.
50. Минералы лития
СГТИМинералы лития
50
Сподумен – силикат лития и алюминия LiAl[Si2O6].
Теоретическое содержание Li2O 8,1 %.
Фактически 7,5% вследствие замещения его магнием,
железом (II), марганцем и натрием.
плотность 3,10 – 3,20 г/см3;
температура плавления 1430 °С.
51.
СГТИ51
Основу структуры сподумена составляют непрерывно
связанные между собой кремнекислородные тетраэдры
[SiO4], образующие цепочки, вытянутые вдоль оси с. Ионы
Li+, Al3+ и другие располагаются между цепочками.
Неполярная связь Si–О–Si более прочна, чем связь
кремнекислородных тетраэдров с ионами Li+, Al3+, поэтому
эти ионы обладают определенной подвижностью; связь же
между тетраэдрами [SiO4] разрушить довольно трудно.
Кристаллы сподумена обладают совершенной спайностью
вдоль оси с, на него не действуют кислоты.
52.
СГТИ52
При нагревании сподумен монотропно переходит в
высокотемпературную
модификацию.
Переход
сопровождается
увеличением
удельного
объема
минерала на 24 % и уменьшением плотности до 2,4 г/см3,
вследствие возникновения термических напряжений
минерал рассыпается в порошок. Переход природного сподумена в высокотемпературную
-модификацию
происходит при 950 – 1150 С. Высокотемпературная
модификация
–
алюмосиликат
с
тетрагональной
кристаллической решеткой; в нем в каждом третьем
кремнийкислородном
тетраэдре
кремний
замещен
атомами алюминия. Возникают связи Si–O–Al, которые,
видимо, менее прочны, чем связи Si–О–Si; это находит
отражение в том, что
-сподумен довольно легко
разрушается кислотами.
53.
СГТИ53
Под
действием
гидротермальных
растворов,
обогащенных
натрием,
происходит
превращение
сподумена в альбит (силикат натрия и алюминия) и
литиевый минерал эвкриптит (алюмосиликат лития), часть
лития переходит в водорастворимую форму
4LiAl[Si2O6] + Na2O ⇄ 2NaAl[Si3O8] + 2Li[AlSiO4] + Li2O
Теоретическое содержание Li2O в эвкриптите 11,9%,
сингония
гексагональная,
встречается
вместе
со
сподуменом, относительно легко разлагается кислотами.
54.
СГТИ54
Петалит
–
алюмосиликат
(Li,Na)[AlSi4O10];
теоретическое содержание Li2O 4,9 %.
плотность 2,3 – 2,5 г/см3, сингония моноклинная.
Относится к каркасным алюмосиликатам, в которых
тетраэдры [SiO4] и [АlO4] образуют трехмерный каркас, где
каждая вершина тетраэдра соединена с четырьмя
другими тетраэдрами. Эта особенность структуры, а также
то, что только в одном из пяти кислородных тетраэдров
кремний замещен алюминием, делает структуру петалита
довольно прочной, кислоты на него не действуют. Но для
него характерна реакция
Li[AlSi4O10] ⇄ -Li[AlSi2O6] + 2SiO2
Процесс распада петалита на кварц и -сподумен
обратим, при 680 – 700 С он сдвинут в сторону
образования сподумена.
55.
СГТИ55
Лепидолит – водный алюмосиликат из группы
литиевых слюд KLi1,5Al1,5[AlSi3O10](F,OH)2; содержание Li2O
1,20 – 5,90%.
плотность минерала 2,8 – 3,3 г/см3, сингония
моноклинная.
Как и во всех слюдоподобных минералах тетраэдры
[SiO4] и [АlO4] образуют плоские слои с гексагональными
кольцами, расположенные перпендикулярно оси с.
Алюминий в структуре лепидолита играет двоякую роль:
часть его атомов замещает атомы кремния в
кремнекислородных тетраэдрах, а часть располагается
вместе с другими катионами (Li+ Mg2+ Fe2+ и др.) между
слоями.
56.
СГТИ56
Между слоями располагаются также анионы ОН– и F– и
другие, иногда лепидолит содержит до 3,73 % Cs2O и
Rb2O. Минерал обладает совершенной спайностью, легко
расщепляется на тонкие листочки. Связь между слоями,
осуществляемая через катионы и анионы, несомненно
слабее связи между тетраэдрами [SiO4] и [АlO4], но тем не
менее
лепидолит
довольно
устойчив
в
зоне
выветривания, с трудом разлагается кислотами.
57.
СГТИ57
Циннвальдит – водный алюмосиликат из группы
литиевых слюд KLiFeIIAl[AlSi3O10](F,OH)2; содержание Li2O
1,0 – 5,0%.
плотность 2,9 – 3,2 г/см3, сингония моноклинная.
Кроме обычных примесей содержит в небольших
количествах Cs2O и Rb2O, менее распространен и менее
устойчив, чем лепидолит, разлагается кислотами.
58.
СГТИ58
Амблигонит – фторсодержаций фосфат лития и
алюминия LiAl[PO4](F,OH); теоретическое содержание Li2O
10,10 %, фактическое 7 – 9,5 %.
плотность 2,98 – 3,15 г/см3.
Разлагается серной кислотой.
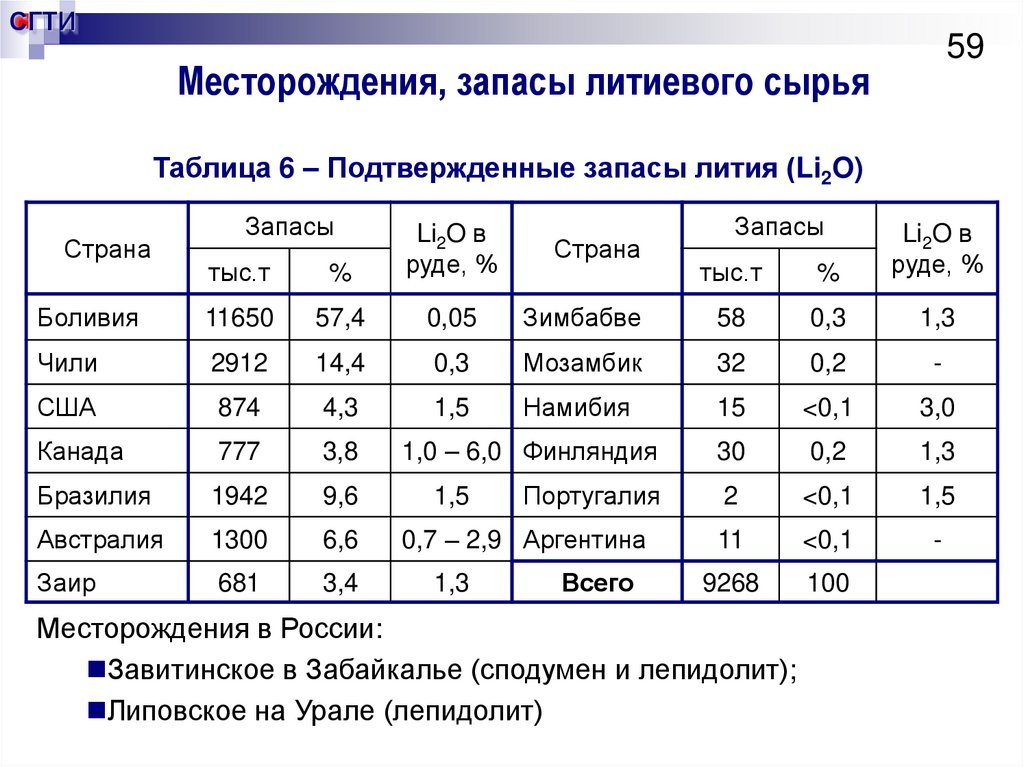
59. Месторождения, запасы литиевого сырья
СГТИ59
Месторождения, запасы литиевого сырья
Таблица 6 – Подтвержденные запасы лития (Li2O)
Запасы
тыс.т
%
Li2O в
руде, %
Боливия
11650
57,4
0,05
Чили
2912
14,4
США
874
4,3
Канада
777
3,8
Бразилия
1942
9,6
Австралия
1300
6,6
Заир
681
3,4
Страна
Запасы
тыс.т
%
Li2O в
руде, %
Зимбабве
58
0,3
1,3
0,3
Мозамбик
32
0,2
-
1,5
Намибия
15
<0,1
3,0
1,0 – 6,0 Финляндия
30
0,2
1,3
Португалия
2
<0,1
1,5
11
<0,1
-
9268
100
1,5
Страна
0,7 – 2,9 Аргентина
1,3
Всего
Месторождения в России:
Завитинское в Забайкалье (сподумен и лепидолит);
Липовское на Урале (лепидолит)
60. Таблица 7 – Производство Li2O в концентратах и рапе
СГТИ60
Таблица 7 – Производство Li2O в концентратах и рапе
Страны
США
Канада
Чили
Бразилия
Аргентина
Зимбабве
Намибия
Австралия
Португалия
Всего
т
доля в мировом
производстве, %
8600
942
3850
128
4
685
64
3200
нет св
49,2
5,4
22,0
0,7
0,1
3,9
0,4
18,3
17473
100
61. Методы переработки концентратов
СГТИМетоды переработки концентратов
61
кислотные
(реагент – серная кислота)
щелочные
(реагент – оксиды, гидроксиды и карбонаты щелочных и
щелочноземельных металлов)
щелочно – содовые
(реагенты – смесь оксидов, карбонатов или гидроксидов
и средних солей. Например: известково-сульфатные и
известково-хлоридные смеси)
62. Сернокислотный метод переработки сподумена
СГТИОбогащённая руда, 3-5% Li2O
Сернокислотный
метод
переработки
сподумена
62
Декрипитация, T = 1100ocC
(Li,Na) Al[Si2O6] Li(Na) [AlSi2O6]
Охлаждение до T = 120ocC
Измельчение
93% H2SO4
Сульфатизация T = 250ocC
Li [AlSi2O6] + H2SO4 Li2SO4 + H [AlSi2O6]
Принципиальная
схема
переработки
сподумена
сернокислотным способом
CaCO3
Выщелачивание
Фильтрование
Технологические
показатели:
Извлечение Li: 85 – 90 %
Выход Li2CO3 из руды: 50
– 55 %
Раствор Li2SO4
Ca(OH)2
Шлам
Вода
Na2CO3
Осаждение Mg, Ca
Промывка
Фильтрование
Фильтрование
Осадок гидроксидов
Mg, Ca
На выщелачивание
(по мере накопления)
Сажа
Шлам (в отвал)
Промывная
вода
10%-ный раствор Li2SO4
H2SO4
63.
СГТИОсадок гидроксидов
Mg, Ca
На выщелачивание
(по мере накопления)
Шлам (в отвал)
Промывная
вода
63
10%-ный раствор Li2SO4
Сажа
H2SO4
Упаривание
Осадок
гидроксидов
AL и Fe
Фильтрование
20%-ный раствор Li2SO4
Насыщенный раствор
Na2CO3
Осаждение Li2СО3
Маточный
раствор
Фильтрование
Кристаллы Li2СО3
Горячая вода
Промывка
Промывная
вода
Фильтрование
Кристаллы Li2СО3
Сушка
Li2СО3
64.
СГТИ64
Достоинства:
Резкое сокращение энергоемких операций (стадии
декрипитации и сульфатизации требуют для своего
завершения 10 – 20 мин.)
Использование нелетучей серной кислоты
65. Щелочной метод переработки сподумена
СГТИСподумен (6% Li2O)
CaCO3
Мокрое
измельчение
Щелочной метод
переработки
сподумена
65
Мокрое
измельчение
Пульпа
Пульпа
Смешение
Пульпа (65% твёрдого)
Спекание, T = 1000 - 2000 oc
C
Принципиальная
схема
переработки
сподумена спеканием с
известью (известняком)
Мокрое измельчение
Выщелачивание
Пески
I Сгущение
Кек на
выщелачивание
II Сгущение
Технологические
показатели:
Извлечение Li: 70 %
Извлечение
Li
из
руды: 50 %
Слив
Пески
Фильтрование
Раствор
III Сгущение
Пески
Слив
Упаривание
Слив
Кристаллизация
Маточный раствор
IV Сгущение
Слив
Центрифугирование
Пески
Кристаллы LiOH·H2O
V Сгущение
Пески
Сушка
Слив
VI Сгущение
Слив
Пески
(в отвал)
LiOH·H2O
66.
СГТИ66
Основные реакции:
LiAl[Si2O6] + 4CaO LiAlO2 + 2CaSiO4
2LiAlO2 (тв) + Ca(OH)2 (р-р) LiOH (р-р) + CaAl2O4 (тв)
Достоинства:
возможность прямого получения гидроксида лития;
универсальность;
доступность и дешевизна реагентов.
Недостатки:
для богатых концентратов, не менее 5 – 6 % Li2O;
большая энергоемкость (тонкий помол шихты и спёка,
упаривание больших объемов растворов)
67. Автоклавный вариант переработки сподумена
СГТИАвтоклавный вариант переработки сподумена
67
-Сподумен + CaO в соотношении 1:2 + вода
нагревание пульпы в течении двух часов при 190 – 200
C в автоклаве, при этом идет реакция:
-Li(AlSi2O6) + 2CaO + 2H2O LiOH + Al(OH)3 + 2CaSiO3
68. Щелочно-содовый метод переработки сподумена
СГТИЩелочно-содовый метод переработки сподумена
68
-Сподумен выщелачивают раствором соды при 200 С.
Полученную смесь обрабатывают под давлением
углекислым газом, при этом карбонат лития переходит в
растворимый гидрокарбонат, который отделяют от осадка
и декарбонизируют при 90 C (промышленный способ).
2 -Li(AlSi2O6) + Na2CO3 Li2CO3 + 2Na[AlSi2O6]
Li2CO3 (тв.)+ CO2 + H2O = 2LiHCO3 (р-р).
69. Щелочно-солевой метод переработки сподумена
СГТИЩелочно-солевой метод переработки сподумена
69
Способ возгонки LiCl из сподумена может оказаться
одним из лучших, т. к. применим для комплексных руд,
содержащих Be, Nb и Ta, хлориды которых тоже летучи.
Спекание сподумена со смесью CaO – CaCl2 при 1100 –
1200 С позволяет перевести в хлорид до 98 % лития.
8LiAl[Si2O6] + 30CaO + 4CaCl2
8LiCl (газ) + 13[ -2CaO SiO2] + 5CaO 3Al2O3 +
+ 3CaO Al2O3 3SiO2
70. Переработка карбоната лития на гидроксид и хлорид
СГТИ70
Переработка карбоната лития на гидроксид и хлорид
Получение гидроксида лития каустификацией известью
карбоната лития по реакции:
Li2CO3 + Ca(OH)2 2LiOH + CaCO3
Соединение
Li2CO3
Растворимость, 0,13
г/100г H2O
Ca(OH)2
0,165
LiOH
12,8
CaCO3
0,0013
Однако максимальная концентрация LiOH в растворе не
может быть выше 36 г/л в системе Li2CO3-Ca(OH)2-H2O.
71. Технологическая схема получения гидроксида лития каустификацией
СГТИТехнологическая
схема получения
гидроксида лития
каустификацией
CaO
Влажный Li2CO3
Ca(OH)2
Каустификация
Li2CO3 + Ca(OH)2 2LiOH + CaCO3
Каустификация
Декантация
Шлам
Раствор LiOH (30 г/л)
I Промывка
Упаривание
Декантация
Охлаждение и
кристаллизация
Технологические
показатели:
Извлечение Li: 85 – 90
%
Приготовление
известкового молока
CaO + H2O Ca(OH)2
Шлам
II Промывка
Центрифугирование
Кристаллы
LiOH·H2O
Декантация
Маточный
раствор
Раствор
Вода
Растворение
Вода
Фильтрование
Раствор
Нерастворимый
остаток
Центрифугирование
Кристаллы
LiOH·H2O
Шлам
III Промывка
Декантация
Шлам
(в отвал)
Охлаждение и
кристаллизация
Маточный
раствор
Раствор
Раствор
71
72. Недостатки способа
СГТИНедостатки способа
72
Основной недостаток – это высокие требования к
чистоте исходных продуктов (Li2CO3, CaO), особенно
хлоридов. Алюминий образует алюминат лития – источник
безвозвратных потерь.
Энергоемкие операции упаривания растворов низкой
концентрации.
Необходимость
очистки
кристаллов
LiOH·H2O
перекристаллизацией.
Невысокий выход лития в LiOH·H2O.
Трудоемкость отмывки LiOH из осадков CaCO3 .
73. Получение хлорида лития
СГТИПолучение хлорида лития
Li2CO3
HCI
Растворение
Li2CO3 + 2HCl 2LiCl + H2O + CO2
BaCI2
Очистка от иона
2SO4
Li2CO3, LiOH
Нейтрализация
Нагревание,
фильтрование
Раствор LiCI
Упаривание,
кристаллизация
LiOH·H2O
Обезвоживание,
сушка
LiCI
Отвальный кек
Гидроксиды,
карбонаты
Ca, Mg, Ba, Fe
73
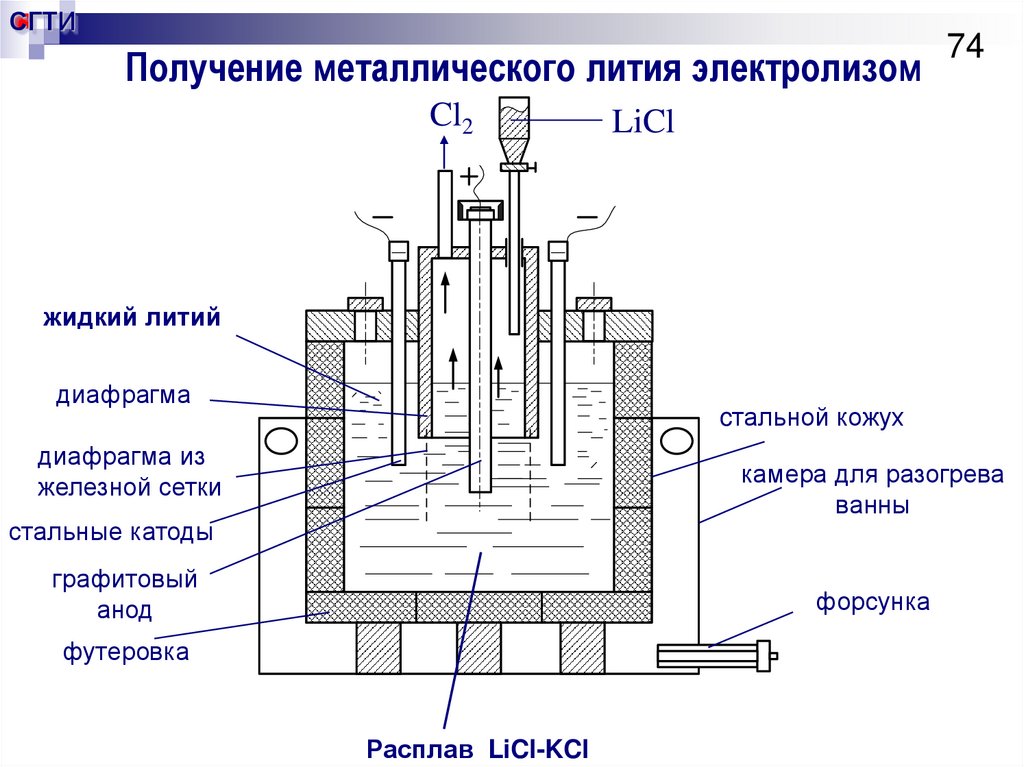
74. Получение металлического лития электролизом
СГТИПолучение металлического лития электролизом
Cl2
74
LiCl
жидкий литий
диафрагма
cтальной кожух
диафрагма из
железной сетки
камера для разогрева
ванны
стальные катоды
графитовый
анод
форсунка
футеровка
Расплав LiCl-KCl
75. Получение металлического лития
СГТИПолучение металлического лития
75
Получение электролизом расплава LiCl-KСl
LiCl : KCl = 1:1. Tпл эвтектики = 361 °C.
Tэлектролиза = 400 – 430 °C.
Расход электроэнергии на 1кг лития 144 кВт·ч.
Плотность тока на катоде 2 – 5 А/см2, на аноде 0,8 –
1,5 А/см2.
Выход по току 90 – 93 %.
Поддержание в ванне СLiCl = 55 – 57 %, если ниже,
то на катоде выделяется калий.
Хлор в абсорбер с LiOH с возвратом в виде LiCl.
76. Электролиз расплава LiCl-KCl
СГТИЭлектролиз расплава LiCl-KCl
76
Почему KCl? Так как φразл.KCl >φразл.LiCl
При температуре 405°С φLiCl = 3,78 В, φKCl = 3,89 В.
Элементы Mg, Ca и Na будут восстанавливаться на катоде
раньше Li и будут загрязнять металл.
77. Электролиз расплава LiCl-KCl
СГТИЭлектролиз расплава LiCl-KCl
77
Рабочее напряжение на ванне UB=6 – 6,6В.
UB=Eразл. + ΔUэл.+ΔUa+ΔUk+ΔU1
ΔUэл. – падение напряжения в электролите, в;
ΔUa – ΔUk – падение напряжения в анодном и катодном
узлах, ΔUa= 0,6в; ΔUk= 0,1 в;
ΔU1 – падение напряжения в проводниках первого рода,
ΔU~15% от суммы Eразл. + ΔUэл.+ΔUa+ΔUk;
Eразл.= – nFΔG; 2LiCl=2Li*+Cl2 – ΔG;
Содержание примесей в электролитическом литии, %:
0,3 – 2,5 Na;
0,02 – 1,50 К;
0,002 – 0,12 Аl;
0,003 Mg;
0,001 – 0,04 Са, Fe, Сu;
0,004 – 0,8 Si;
78. Электролиз расплава LiCl-KCl
СГТИЭлектролиз расплава LiCl-KCl
78
Недостатки:
необходим безводный хлорид лития высокой чистоты,
который является дорогим продуктом;
получающийся
металлический
литий
загрязнен
примесями, прежде всего натрием, что требует
дополнительной его очистки;
выделяющийся при электролизе хлор необходимо
обезвреживать.
79. Методы вакуумтермического восстановления
СГТИМетоды вакуумтермического восстановления
79
Восстановление оксида лития
4Li2O + Si= 2Liгаз.+2Li2O·SiO2;
Повторное восстановление:
2Li2O·SiO2+Si+ 4CaO = 4Liгаз+2(2CaO·SiO2);
Восстановление в одну стадию:
2Li2O + Si + 2CaO = 4Liгаз+2CaO·SiO2;
При 950-1000°С и вакууме 0,001мм рт. ст. литий
возгоняется и конденсируется. Выход 75 – 93%.
Основные примеси 0,01% Si и 0,04% Ca.
80. Вакуумтермические методы
СГТИВакуумтермические методы
Прокаливание смеси Li2(CO3) и Al2O3
Восстановление алюмината лития алюминием:
3(Li2O·Al2O3) + 2Al = 6Liгаз + 4Al2O3
Температура 1150-1200°С,
Вакуум 0,1-0,5 мм рт. ст.;
Выход лития 95-98%.
Можно получить весьма чистый литий.
80
81. Рафинирование лития
СГТИРафинирование лития
81
Очистка от примесей Na,K,Mg,Ca,Al,Si,Fe.
Переплавка под вазелиновым маслом.
Фильтрование через сетчатые фильтры из Fe,Ti, Mo.
Губчатые Ti и Zr – поглотители O2 и N2 (800°С 24 ч).
Различие в термической устойчивости гидридов.
Дистилляция в вакууме – наиболее чистый литий
При 450 °С отгоняются основные примеси.
При 600 - 800 °С и P = 10-5 мм рт.ст испарение Li.
Tконденсатора = 340 – 420 °С.
Выход Li = 85 – 90 %.
Установка из Fe, Ti, Nb, Mo, Ta.
Содержание натрия снижается до 0,001-0,003%.
82. Меры безопасности, упаковка и хранение
СГТИМеры безопасности, упаковка и
хранение
При загорании:
Засыпать сухим NaCl, LiCl, Na2CO3, специальной
смесью, вязких органических веществ и добавок
стеаратов и талька.
Залить минеральным маслом.
Выпуск в виде гранул, прутков и проволоки.
Хранение:
Герметичная тара из Fe.
Слой пастообразной массы из парафина и масла
или под газолином.
Герметичные трубчатые Al или Cu оболочки
82












































































 chemistry
chemistry








