Similar presentations:
Теоретические основы хроматографии
1.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫХРОМАТОГРАФИИ
Лектор – проф. Васюк С. А.
2016
2. План
Способы получения хроматограмм
Основные понятия хроматографии
Теория хроматографического разделения
Теория теоретических тарелок
Кинетическая теория хроматографии
Параметры разделения
Газовая хроматография
Газотвердофазная (газоадсорбционная)
хроматография
Газожидкостная хроматография
Жидкостная хроматография
3.
Способы получения хроматограмм:элюентная
вытеснительная
фронтальная
4.
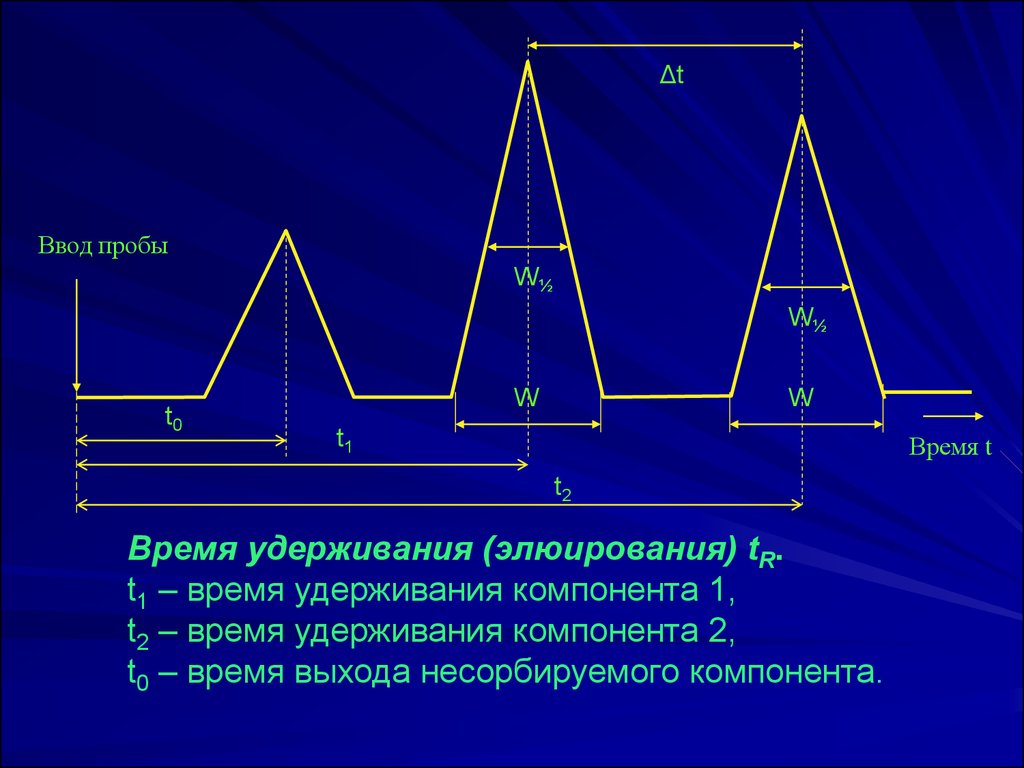
ΔtВвод пробы
W½
W½
t0
W
W
t1
Время t
t2
Время удерживания (элюирования) tR.
t1 – время удерживания компонента 1,
t2 – время удерживания компонента 2,
t0 – время выхода несорбируемого компонента.
5.
Время выхода t0 несорбируемогокомпонента
t0 = L/ υ ,
где L - длина хроматографической колонки,
υ - скорость потока.
6.
Исправленное время удерживания tR'tR' = tR - t0
7.
Удерживаемый объем VR - объем ПФ, которыйнужно пропустить через колонку с определенной
скоростью, чтобы элюировать вещество:
VR = tR ∙ υ
8.
Исправленный удерживаемый объемVR' = VR - V0
9.
Коэффициент удерживания(замедления)
L / t R t0
R
L / t0 t R
10.
Коэффициент емкостиk = tR′ / t0
11.
Число теоретических тарелок рассчитывают непосредственноиз хроматограммы, сравнивая ширину пика w и время
пребывания tR компонента в колонке:
N=16
tR
w
2
Или
tR
N 5,55
w1 / 2
2
где w1/2 - полуширина пика, выраженная в тех же единицах, что и tR.
12. Если длина хроматографической колонки составляет L, а число теоретических тарелок равно N, то величина Н (ВЭТТ): Н = L/ N Эффективность колонки
Если длина хроматографической колонки составляет L,а число теоретических тарелок равно N, то величина Н
(ВЭТТ):
Н = L/ N
Эффективность колонки тем выше, чем меньше Н и
больше N.
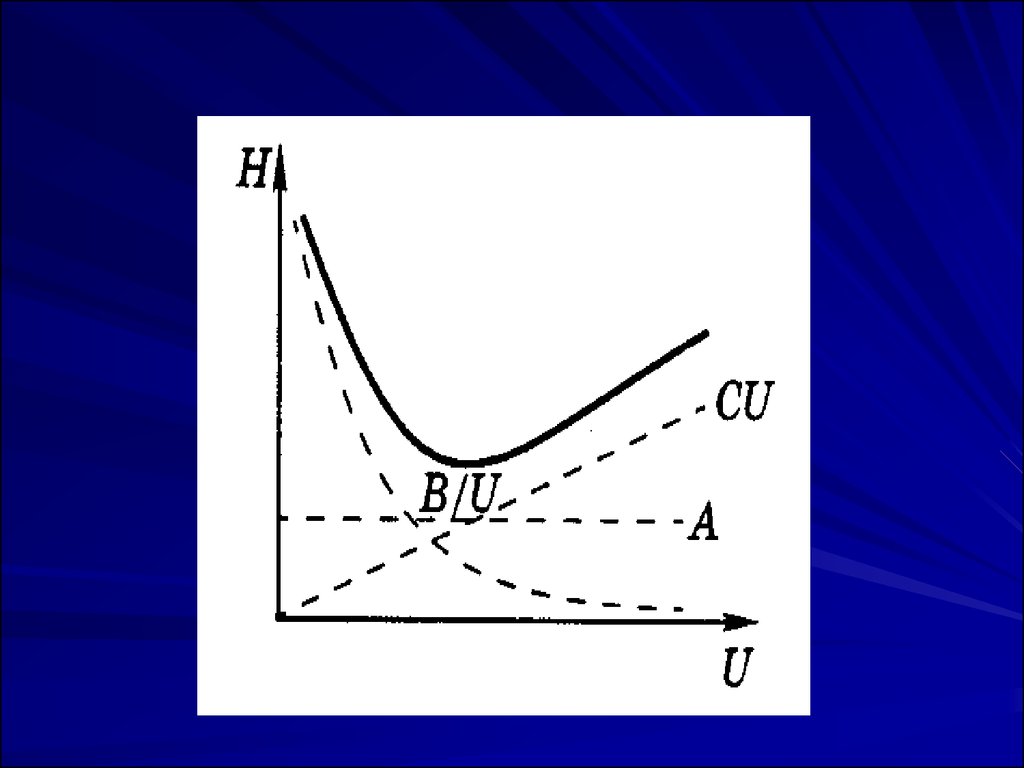
13. Кинетическая теория хроматографии, предложена датскими химиками Ван-Деемтером и Клинкенбергом Высота, эквивалентная теоретической тарел
Кинетическая теория хроматографии, предложенадатскими химиками Ван-Деемтером и Клинкенбергом
Высота, эквивалентная теоретической тарелке, связана
со скоростью потока уравнению Ван-Деемтера:
Н = А + В/υ + Сυ,
где А, В/υ, Сυ – члены, учитывающие неравномерность
движения потока ПФ (вихревая диффузия),
молекулярную диффузию и отклонение от
сорбционного равновесия (сопротивление
массопереносу) соответственно;
υ – линейная скорость потока.
14.
Вихревая диффузия А зависит от структурысорбента и изменяется по длине колонки.
Молекулярная (продольная) диффузия В/υ
обусловлена миграцией молекул в ПФ из участков
полосы с большей концентрацией в направлении, где
концентрация меньше.
Сопротивление массопереносу Сυ характеризует
кинетику процесса сорбция-десорбция,
массопередачу и другие эффекты, т.е. скорость
распределения вещества между двумя фазами.
15.
16.
Коэффициент селективности является меройотносительного удерживания или относительной
подвижности разделяемых веществ:
t R2
V R 2
D2 k 2
t R1 V R 1
D1 k 1
где D – коэффициент распределения, равный
отношению концентраций вещества в подвижной и
неподвижной фазах соответственно.
17.
Разделение двух соседних пиков характеризуетсяразрешением пиков RS (степенью разделения),
которое описывается уравнением
RS 2
t R2 t R1
w 2 w1
18.
Коэффициент селективности α и разрешение пиков RSсвязаны соотношением
1 N
RS
4
1/ 2
















 physics
physics








