Similar presentations:
Периодический закон и периодическая система Д.И. Менделеева (Лекция 2)
1. Лекция 2. Периодический закон и периодическая система Д.И. Менделеева
Лектор – доцент кафедры общей инеорганической химии Тюменова
Светлана Ивановна
2. План лекции
1. История Периодической системы элементов2. Периодический закон и периодическая система
Д.И. Менделеева
3. Структура Периодической системы элементов
4. Периодические свойства элементов
3.
1. История Периодической системыэлементов
Существование триад (Дёберейнер, 1817 г.)
Расположение элементов на витках спирали
(А.Э.Б. Де Шанкуртуа, 1862 г.)
Закон октав (Дж.Ньюлендс, 1863 г.)
Периодический закон (Д.И.Менделеев, 1869 г.)
Таблица из 8 колонок (Л.Мейер, 1871 г.)
Открытие инертных газов (Релей, Рамзай, 1894
г.)
• Заряд ядра равен порядковому номеру
• (А.ван ден Брук, 1911 г.)
4.
После открытия электрона иразработки теории ядра атома
голландский физик А. ван ден
Брук в 1911 году предположил,
что заряд ядра атома того или
иного элемента может быть
равен порядковому номеру в
периодической системе.
5.
В 1817 году немецкий химикДёберейнер (1780-1849) показал,
что атомный вес стронция Sr имеет
среднее значение между атомными
весами двух родственных
элементов – кальция Ca и бария
Ba. Позже он установил
существование других триад
подобных элементов
(Cl, Br, I; Li, Na, K).
6.
В 1862 году французский химикА.Э.Б. де Шанкуртуа расположил
элементы в порядке возрастания
атомных весов на
пространственной спиральной
кривой с соответствующими
точками на последовательных
витках спирали (разница в 16
единиц).
7.
В 1863 году Дж.Ньюлендсразделил элементы на 7
групп по 7 элементов и
назвал такую зависимость
«законом октав» по аналогии
с семью интервалами
музыкальной гаммы
8.
В 1871 году Лотар Мейерпредложил таблицу из 8 колонок.
Он разделил каждый длинный
период на период из 7 элементов,
на восьмую группу, содержащую
триады элементов (подобных Fe,
Co, Ni) и на второй период из 7
элементов.
9. 2. Периодический закон и периодическая система Д.И. Менделеева
Д.И.Менделеев (1834-1907)10.
В 1869 году Д.И. Менделеевпредложил периодическую
систему из 17 колонок.
В 1871 году он пересмотрел эту
таблицу и передвинул некоторые
элементы на другие места,
соответствующие уточненным
значениям атомных весов.
11.
Таблица Д.И.Менделеева, 1871г12.
Д.И.Менделееву удалось предсказатьсуществование шести элементов, которые
в то время еще не были открыты и
которые должны были занять
незаполненные места в его таблице.
экабор
экаалюминий
экасилиций
экамарганец
двимарганец
экатантал
скандий Sc
галлий Ga
германий Ge
технеций Tc
рений Re
полоний Po
13.
В 1894 году Релеем и Рамзаембыли открыты аргоноиды
(благородные газы – He, Ne, Ar,
Kr, Xe). В последующие годы к
периодической таблице была
добавлена «нулевая группа»
14.
Периодический законСвойства химических
элементов, а также формы
и свойства их соединений
находятся в периодической
зависимости от величины
заряда ядра их атомов
15.
3. Структура Периодическойсистемы элементов
Период - горизонтальный ряд элементов,
начинающийся щелочным металлом и
заканчивающийся инертным газом
1 короткий из двух элементов (Н и Не),
2 коротких периода по восемь элементов,
2 длинных периода из 18 элементов,
1 очень длинный из 32 элементов и
1 незаконченный период.
16.
Группа – вертикальный ряд,состоящий из элементов малых и
больших периодов
Элементы, входящие в одну и ту же
группу обладают сходными
физическими и химическими
свойствами.
17.
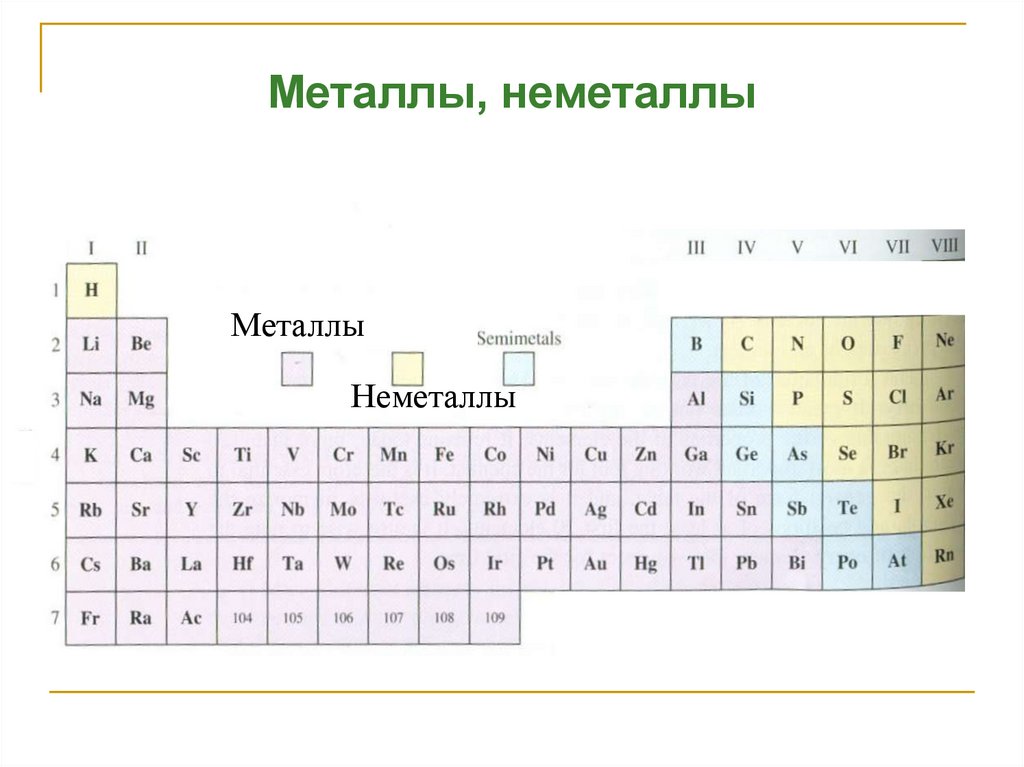
Металлы, неметаллыМеталлы
Неметаллы
18.
ПЕРИОДИЧЕСКИЕ СВОЙСТВАЭЛЕМЕНТОВ
Атомный радиус
Энергия ионизации
Ионный радиус
Сродство к электрону
Электроотрицательность
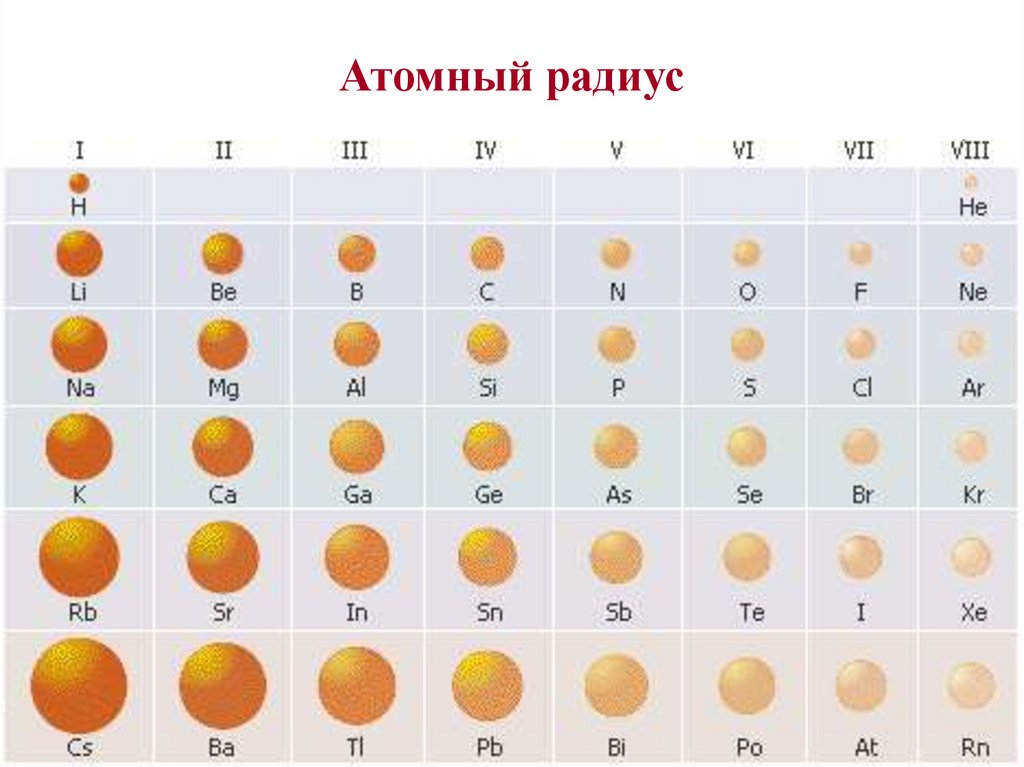
19. Атомный радиус
Равен половине межатомногорасстояния между центрами
атомов в решетке металла, в
молекулах или кристаллах
простых веществ
20.
Атомный радиус21.
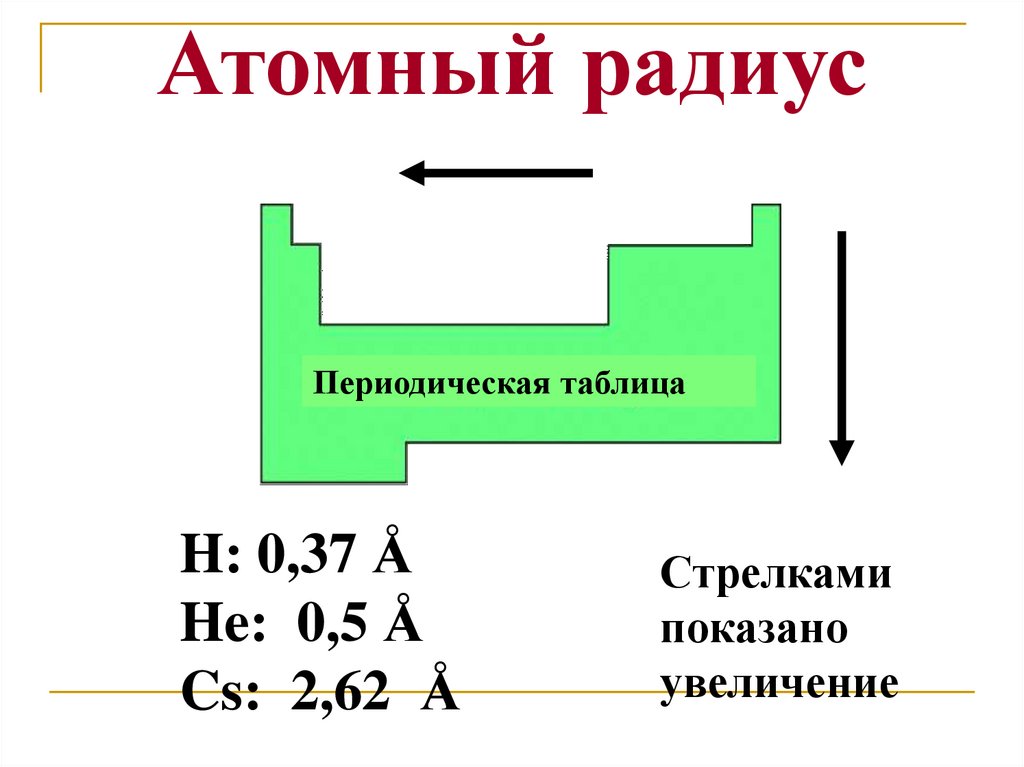
Атомный радиусПериодическая таблица
H: 0,37 Å
He: 0,5 Å
Cs: 2,62 Å
Стрелками
показано
увеличение
22.
Å=-10
10
м
нм =
-9
10 м
пм =
-12
10 м
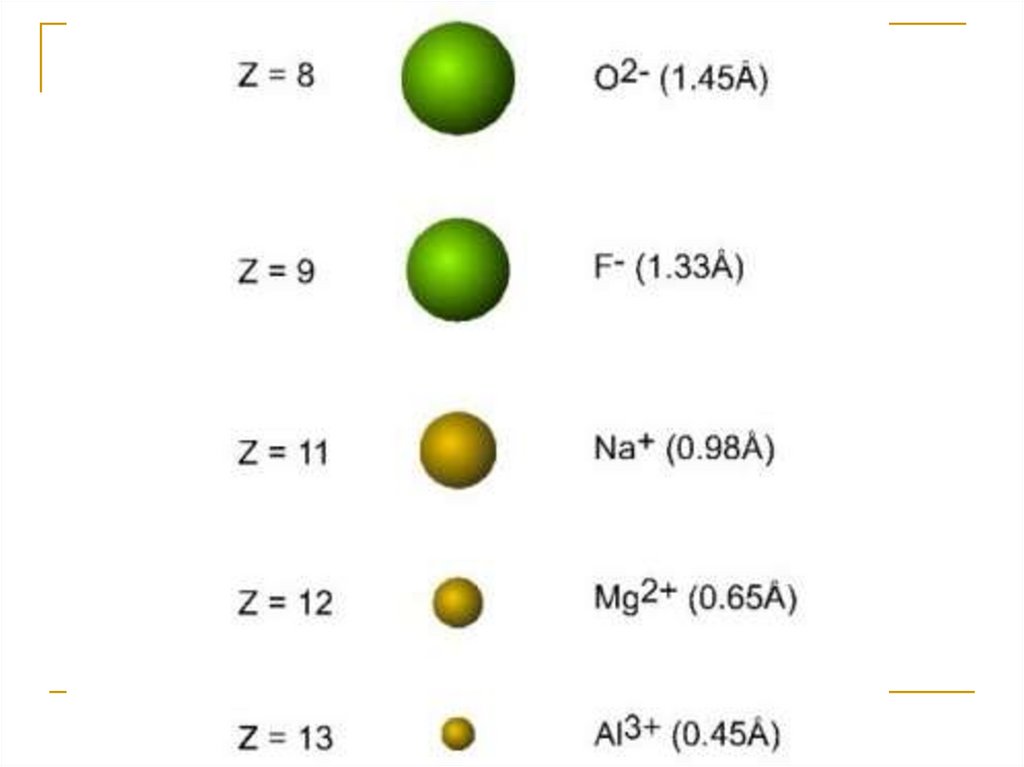
23. Ионные радиусы
Ионные радиусы в веществах с ионной связьюне могут быть определены как полусумма
расстояний между ближайшими ионами.
Как правило, размеры катионов и анионов
резко различаются.
Кроме того, симметрия ионов отличается от
сферической.
Существует несколько подходов к оценке
величины ионных радиусов.
На основании этих подходов оценивают
ионные радиусы элементов, а затем из
экспериментально определенных межатомных
расстояний определяют ионные радиусы
других элементов.
24.
25. Энергия ионизации
Энергия ионизации - энергия,которую необходимо затратить
для отрыва электрона от атома,
находящегося в основном
состоянии
26.
Энергия ионизацииПервая энергия ионизации
Стрелками показано увеличение
энергии ионизации
27.
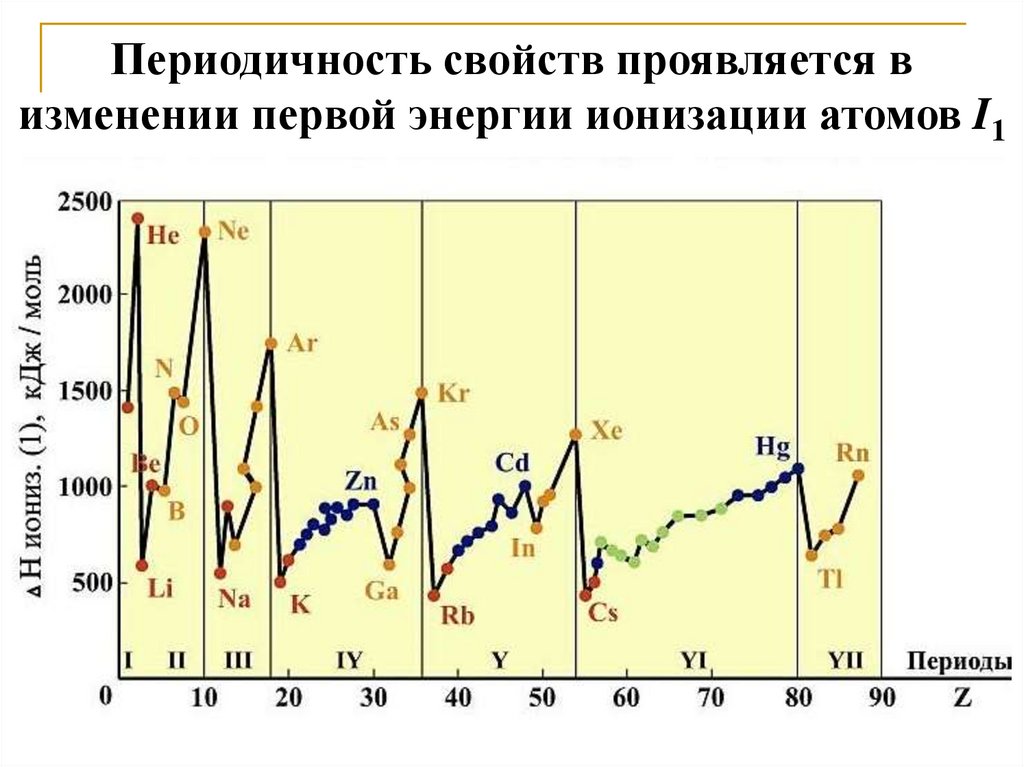
Периодичность свойств проявляется визменении первой энергии ионизации атомов I1
28. 1. Элементы с низкой энергией ионизации образуют ионные соединения
кДж/мольLi
Na
Cs
520
497
376
29. 2. Элементы с промежуточной энергией ионизации образуют ковалентные (молекулярные) соединения за счет спаривания электронов с
другими атомами.кДж/моль
B
C
P
801
1086
1012
30. 3. Элементы с очень высокой энергией ионизации часто присоединяют электрон с образованием отрицательных ионов.
кДж/мольO
F
Cl
1314
1681
1251
31.
Сродство к электронуЭнергия, выделяющаяся при
присоединении электрона к
нейтральному атому, который в
результате переходит в
однозарядный отрицательный
ион, называется сродством
атома к электрону
32.
Сродство к электронуОбщие тенденции
Периодическая таблица
Стрелками показано увеличение
значения сродства к электрону.
33.
Электроотрицательность- способность атомов
притягивать (присоединять)
электроны от атомов других
элементов в химических
соединениях.
34.
ЭлектроотрицательностьПериодическая таблица
Стрелками показано увеличение
электроотрицательности.
35.
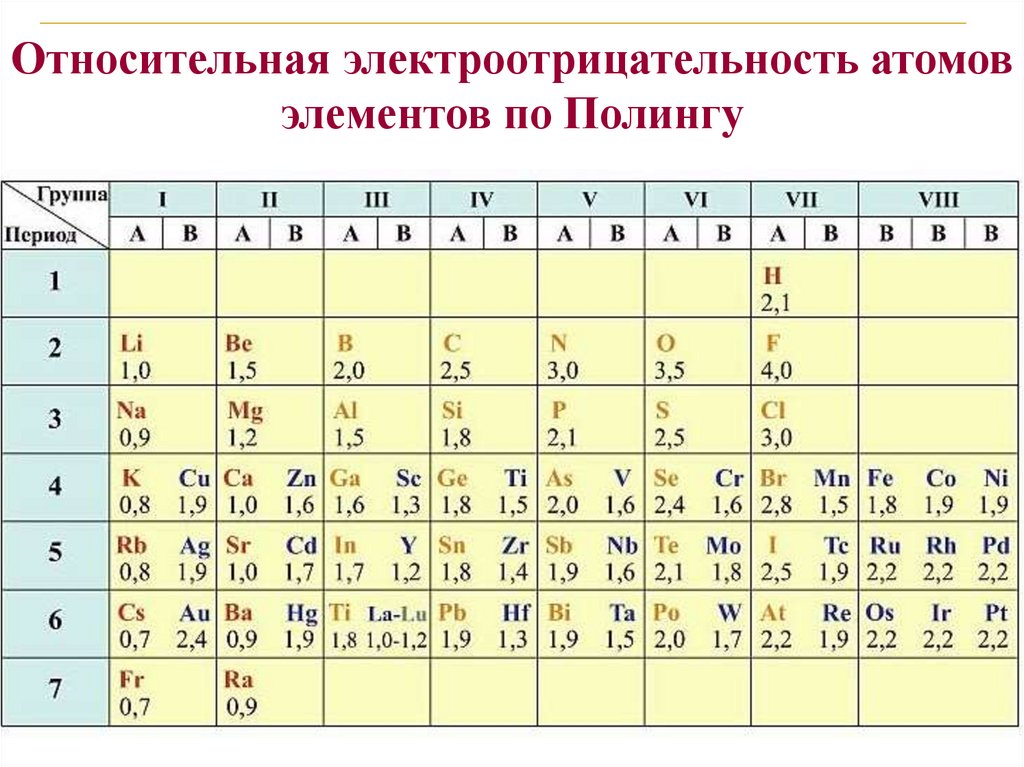
Относительная электроотрицательность атомовэлементов по Полингу
36. Вопросы к лекции
Приведите современную формулировкуПериодического закона и формулировку, данную Д.И.
Менделеевым.
2. Каков физический смысл порядкового номера
химического элемента? Сколько протонов, нейтронов
и электронов содержит атом железа?
3. По какому признаку атомы химических элементов
размещаются в одном периоде? Что общего в
строении атомов химических элементов,
расположенных в 5 периоде?
4. Что общего для элементов одной группы? По какому
признаку элементы объединяются в одну подгруппу?
1.
37.
5. Что общего в строении атомов химическихэлементов, расположенных в одной главной подгруппе?
Сравните строение атомов двух химических элементов,
расположенных в VА группе. Запишите общую
электронную формулу для элементов VА группы.
6. Почему сера и хром находятся в одной группе, но в
разных подгруппах?
7. Какие элементы называются электронными
аналогами. Где они размещаются в периодической
системе? Приведите два примера электронных
аналогов.
8. Дайте определение понятию энергия ионизации.
Каков характер изменения этой величины в пределах
одного периода. С чем это связано? Рассмотрите на
примере элементов второго периода.
38.
9. Дайте определение понятию сродство к электрону.Каков характер изменения этой величины в пределах
одной главной подгруппы. С чем это связано?
Рассмотрите на примере элементов главной подгруппы
четвертой группы.
10. Что называют электроотрицательностью?
Рассмотрите на примере элементов первой группы
главной подгруппы характер изменения этой величины.
С чем связан такой характер изменения ОЭО?
11. Как изменяются радиусы атомов в периоде и
группе? Объясните причины их изменения.






























 chemistry
chemistry








