Similar presentations:
Бруцеллез. Лабораторная диагностика
1. Бруцеллез:
Лабораторнаядиагностика
Доц. Новицкая Ирина Вячеславовна
2021 г.
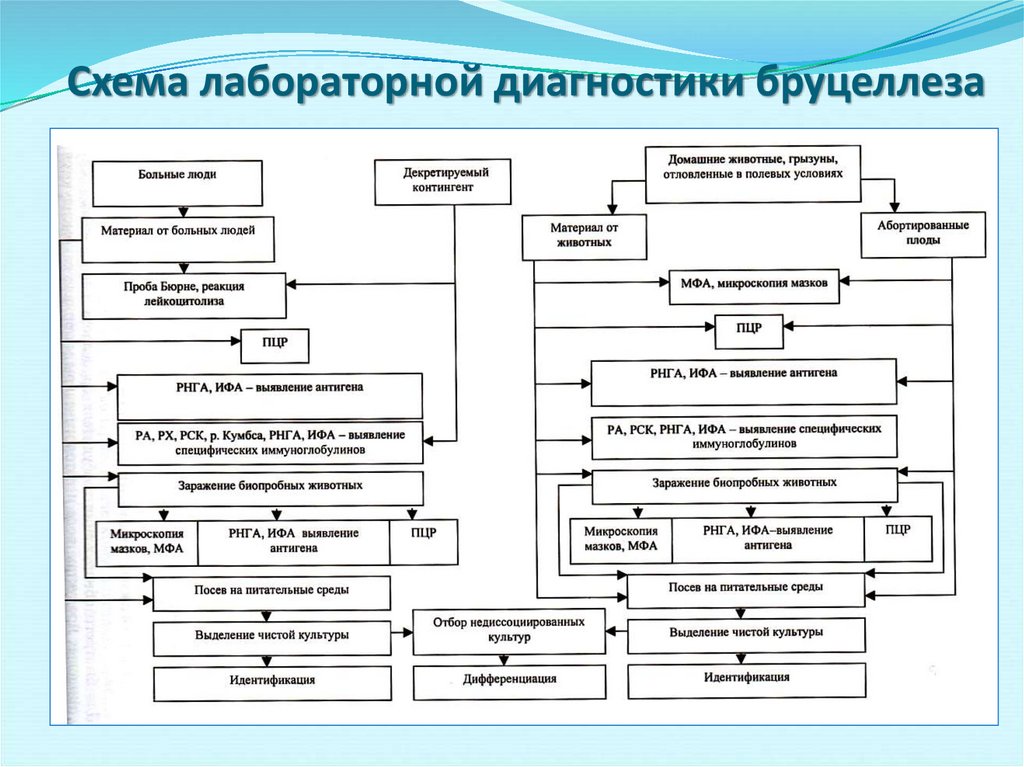
2. Схема лабораторной диагностики бруцеллеза
3. Схема лабораторной диагностики бруцеллеза
4. Лабораторная диагностика бруцеллеза включает:
- проведение диагностических исследований клиническогоматериала от людей для установления диагноза у больных с
подозрением на заболевание бруцеллезом. Клинический
материал: кровь, сыворотка крови, спинномозговая жидкость,
синовиальная жидкость (при артритах), моча, желчь, гной (при
абсцессах), пунктаты костного мозга и лимфатических узлов;
- проведение по эпидпоказаниям лабораторных исследований
материала из сырья животного происхождения (шерсть, кожа),
продовольственного сырья (мясо и мясные продукты, молоко и
молочные продукты) и из объектов окружающей среды (почва,
трава, фураж, подстилка, вода, смывы и т.д.)
Забор материала и лабораторное исследование материала от
больных животных производят ветеринарные службы
5. При работе с материалом, зараженным или подозрительным на зараженность возбудителем бруцеллеза, соблюдают:
СП 3.1.085-96 Санитарные правила «Профилактика иборьба с заразными болезнями, общими для человека
и животных»
ВП 13.3.1302-96 Ветеринарные правила
СП 1.3.3118-13 "Безопасность работы с
микроорганизмами I - II групп патогенности
(опасности)» Санитарно-эпидемиологические правила
МУ 3.1.7.1189-03 «Профилактика и лабораторная диагностика
бруцеллеза людей» (М.,2003)
МУК 4.2.3010-12 «Порядок организации и проведения
лабораторной диагностики бруцеллеза для лабораторий
территориального, регионального и федерального уровней» (М.,
2012)
6. Требования к лабораториям медицинских организаций, осуществляющим исследования на бруцеллез:
Наличие разрешительных и регламентирующих работу документовТребования к обеспечению безопасности работы персонала - инструкций,
определяющих режим безопасной работы сотрудников с учетом характера
работ. Все сотрудники обязаны выполнять требования по обеспечению
безопасности работы с материалом, подозрительным или зараженным
возбудителями инфекционных болезней III-IV групп патогенности
(опасности), в соответствии с действующими нормативными документами
Требования к специалистам и персоналу, участвующим в выполнении
исследований на бруцеллез - Исследования на бруцеллез могут выполнять
специалисты не моложе 18 лет с высшим и средним медицинским,
биологическим образованием, окончившие соответствующие курсы
профессиональной переподготовки с освоением методов безопасной работы с
возбудителями инфекционных болезней I-IV групп патогенности (опасности),
не имеющие противопоказаний к лечению специфическими препаратами и
имеющие допуск к работе с ПБА III-IV групп на основании приказа
руководителя учреждения
Специалисты, осуществляющие деятельность, связанную с использованием
возбудителей инфекционных болезней, должны повышать квалификацию не
реже одного раза в пять лет и иметь сертификат специалиста
7. Возбудителей бруцеллеза относят ко II группе патогенности:
ВидB. melitensis
Биовары
3
Эпидемиологическая значимость
Возбудители эпидемического
бруцеллеза
–
B. abortus
8
B. suis
5
B. neotomae
-
B. ovis
-
B. canis
-
В. maris
-
Возбудители спорадического
бруцеллеза
8. Методы лабораторной диагностики бруцеллеза:
МикроскопическийБактериологический
Биологический
Иммунологический
Аллергический
Молекулярно-генетический
9. Микроскопический метод:
Материал для микроскопияеского иссследования: органыабортированного плода, плацента и выделениях из родовых
путей больных животных, биологический материал от людей, а
также выделенные культуры на этапах их идентификации
Окрашивание по Граму или по Козловскому - по Граму
окрашиваются отрицательно, при окраске по методу Козловского
бруцеллы приобретают розово-красный цвет сафранина (в то
время как другие микроорганизмы – зеленые)
«Раздавленная капля» – неподвижны
Спорообразование - отсутствует
В мазке: полиморфизм, кокковидная или палочковидная формы
клеток с закругленными концами размером 0,5-2 мкм в длину и
0,3-0,7 мкм в ширину. В одном препарате, особенно в молодых
культурах, возможно беспорядочное присутствие всех
морфологических форм
Бруцеллы вида B.melitensis чаще представлены кокковидными формами, а
микроорганизмы B.abortus и B.suis – палочками с закругленными концами
Клетки B.suis несколько крупнее остальных видов бруцелл
10. Бактериологический метод - «золотой стандарт микробиологии»
Бактериологическое подтверждение инфицированияорганизма возбудителем бруцеллеза обеспечивается
не всегда. Эффективность бактериологической
диагностики бруцеллезной инфекции во многом
зависит от качества используемых для выделения
возбудителя питательных сред и используемых
селективных добавок
11. Материал для бактериологического исследования:
от людей - кровь, костный мозг, спинномозговаяжидкость, пунктат из лимфоузлов, моча, суставная
жидкость, ликвор, гнойное отделяемое, мокрота и
другой клинический материал - осуществляют при
поступлении до начала антибиотикотерапии;
от животных - абортированные плоды, плодные
оболочки, желудок плода с его содержимым,
лимфатические узлы, влагалищные выделения,
молоко;
пищевые продукты - сливки, сыры, творог, мясо;
объекты внешней среды - вода, почва, навоз,
подстилки животных, кормушки и т.д.
12. Бактериологическое исследование посевов от биопробных животных:
Перед посевом органов на питательные среды ихцелесообразно раздавить (Таран И.Ф., Лямкин Г.Н., 1996)
Для этого кусочки органов берут в стерильную чашку или
керамическую ступку, которые заворачивают в салфетку,
смоченную дезраствором. В таком виде материал переносят
из вскрывочной комнаты в лабораторный бокс, где
раздавленную стерильной деревянной палочкой или
пестиком ткань органа втирают в плотные питательные
среды
Культуры выдерживают при 37 0С в течение 25-30 сут
Просмотр посевов производят каждые 3-4 сут
Выделенные микроорганизмы подвергают видовой
идентификации и дифференциации
13. Питательные среды для выделения и культивирования бруцелл:
Мясо-пептонный, печеночный, глюкозо-глицериновый,сывороточно-декстрозный бульоны и агары
Агары Мартена и Альбими
Среды «Д», «4Д»
Среда Мюллер-Хинтона
Эритрит-агар с добавлением 1% глюкозы и 2% глицерина (г. Махачкала)
- Среда особенно эффективна при выделении первой генерации возбудителя,
однако при последующих пересевах на эритрит-агаре культура бруцелл нередко
диссоциирует
Бруцеллагар, разработанный Государственным Научным Центром прикладной
микробиологии (г. Оболенск Московской обл.), как и
FT(«туляремийный»)-агар, которые при добавлении глюкозы (до 1%) и
глицерина (до конечной концентрации 2%) также на 3 сут обеспечивают рост
колоний возбудителя бруцеллеза
Среда для культивирования B. ovis (печеночный или мясопептонный
агар c добавлением 1% D-глюкозы и 2% глицерина, 20% нормальной
сыворотки КРС или 10% аминопептида и 10% сыворотки
Среда для выделения и культивирования L-форм бруцелл и др.
14. Рекомендуемые добавки:
Декстроза (D-глюкоза) (до 1%)Глицерин (до 2%)
Дефибринированная кровь барана или
лошади (до 5%)
Липоевая кислота (5 мг/л)
Витамин К
Витамин В1 (тиамина гидрохлорид)
15. Другие коммерческие сухие среды:
В настоящее время ряд зарубежных фирм (в частности, «Hi Media Laboratories Pvt.Ltd»,Индия) для лабораторной диагностики бруцеллеза производят коммерческие сухие
сертифицированные в соответствии с Европейским стандартом качества (СЕ) питательные
основы сред и селективные добавки
Brucella Selective Medium Base (w/o Supplement) + Selective
Supplement
Eugonic Agar/Broth
Tryptose Soya Agar
Brucella Selective Medium Base агар
рекомендуют для селективного
выделения и культивирования
бруцелл
Баранья кровь и настой говяжьего
сердца облегчают
культивирование различных
прихотливых микроорганизмов
Триптоза, желатин, глюкоза источники необходимых
питательных веществ
Присутствие антибиотиков
делает среду высоко селективной
в отношение бруцелл
Ингредиенты
грамм/литр
Настой говяжьего сердца
500,00
Триптоза
10,00
Натрия хлорид
5,00
Желатин
1,00
Глюкоза
2,50
Агар-агар
15,00
Конечное значение рН (при 25°С) 7,4 ± 0,2
Инструкция по применению: Размешать 21,75 г
порошка в 500 мл дистиллированной воды и
прокипятить. Стерилизовать автоклавированием
при 1,1 атм (121°С) 15 мин
Остудить до 50 °С и асептически добавить
растворенное в 50 %-м метаноле содержимое 1
флакона со специальной добавкой (FD161). Тщательно
перемешать и разлить в посуду
16. Этапы бактериологичекого исследования при подозрении на бруцеллез (Ляпустина Л.В.,1998):
Перевод исследуемого материала в жидкую фазу:эмульгация в 0,85% растворе NaCl или бульоне
Концентрирование возбудителя в исследуемом
материале (центрифугирование пробы при 3000 g в
течение 2 ч, фильтрация и добавление к осадку
специфической бруцеллезной агглютинирующей
сыворотки в соотношении 1:100
Посев на соответствующие питательные среды
17. Транспортные среды для взятия материала в полевых условиях:
Использование транспортных сред позволило повысить эффективностьбактериологической диагностики бруцеллеза до 70% (Богданов И.К., 1999,
Ляпустина Л.В.,2005)
В состав транспортной среды входят: питательная основа (гидролизат
говяжьего мяса), хлорид натрия, цитрат натрия, глицерин, глюкоза,
липоевая кислота
Для транспортных целей возможно применение печеночного бульона с
добавлением 1% пептона, а также
0,85% раствора NaCl, разлитого в пенициллиновые флаконы, куда
стерильно через резиновую пробку шприцем вносят по 1 мл посевного
материала (крови, спинномозговой жидкости, синовиального экссудата,
биоптата из очагов)
Упаковка проб: принцип тройной упаковки (водонепроницаемый
герметичный контейнер, адсорбирующий материал, вторичная упаковка и
наружная упаковка не менее 10х10 см, опечатанная, маркированная, с
надписью «верх, осторожно»). Транспорт – специально выделенный
Недопустимо помещение сопроводительных документов в тару с пробами
В условиях специализированной лаборатории из транспортной среды
делают высев на соответствующие питательные агары
18. Посев материала, загрязненного посторонней микрофлорой:
Посев проб из объектов внешней среды или трупного материалаот животных осуществляют на питательные среды с
ингибиторами роста микробов-контаминантов:
генцианвиолет 1:200.000 или
антибиотики (пенициллин 25 мкг/мл, полимиксин 3 мкг/мл,
амфоглюкамин 3 мкг/мл, кефзол 3 мкг/мл, амфотерицин 1 мкг/мл),
не препятствующие росту бруцелл
19. Посев молока:
Исследование молока из больших емкостей проводят путемзабора 100 мл пробы из верхнего слоя и последующего взятия
после перемешивания еще 100 мл
Результативным бывает посев сливок, полученных
центрифугированием молока при 2000g в течение 3-5 мин или
после его отстаивания при 40 0С в течение 1 сут
Консервацию молока при проведении отсроченного анализа
осуществляют добавлением в него сухой борной кислоты (на
10 мл пробы 0,1 г борной кислоты), генцианвиолета до
конечной концентрации 1 : 250 000 или малахитгрюна 1 : 500 000
20. Посев крови:
Посев крови от больного наиболее целесообразноосуществлять во время лихорадочного периода, хотя
положительный результат возможен и вне его
Кровь (по 5 мл) засевают в 2 флакона с бифазной средой или в
жидкие питательные среды для транспортировки
При исследовании крови в жидкие питательные среды перед
посевом рекомендуют добавлять стерильный раствор цитрата
натрия до конечной концентрации 0,2%
Кровь берут у постели больного и тут же засевают на питательные
среды. Рекомендуется осуществлять эти процедуры вдвоем. Один
медицинский работник проводит обработку кожи больного и
венопункцию, второй в это время открывает над пламенем спиртовки
пробки флаконов со средами, подставляет их под струю крови из
шприца, обжигает и закрывает горлышки флаконов
Посевы крови инкубируют при 370С не менее 30 сут
во флаконах в вертикальном положении
21. Посев крови на плотные среды (или высев из бульонной культуры)
Также осуществляют во флаконы с широким горлом наскошенный агар
Инкубация 370С – 30 сут в обычных условиях и
условиях 10% СО2
1 раз в 2-3 дня посевы осторожно перемешивают,
смачивая поверхность питательной среды
При появлении типичных колоний проводят их
идентификацию
22. Культивирование бруцелл:
Бруцеллы требовательны к условиямкультивирования и обладают замедленным ростом
(от 3 до 14 сут и более)
Наиболее медленно растут культуры бруцелл,
выделенные из организма в первых генерациях
Лабораторные штаммы
появляются на агаре через 24-48 ч
после посева
Оптимум температуры 370С
рН 7,2
23. Потребность в СО2:
С учетом потребностей B. abortus и B. suis вповышенном (5-10%) содержании СО2 в атмосфере
посевы дублируют в СО2-инкубаторах (или
эксикаторе) и в обычных условиях
24. Автоматизированные системы учета посевов крови:
В зарубежной практике исследование крови на гемокультуру является одним изнаиболее массовых видов лабораторных исследований
Применение автоматизированных систем для индикации микробного роста в
посевах крови позволяет ускорить получение результата
Приборы для этой цели выпускаются многими фирмами. Они отличаются друг
от друга производительностью, уровнем автоматизации, но главное - способами
детекции микробного роста
Одним из наиболее популярных в Европе анализаторов для детекции культур
крови является прибор VITAL, предлагаемый фирмой bioMerieux. Этот прибор
позволяет одновременно исследовать до 1200 образцов
Пробу крови объемом 5-10 мл засевают во флакон со специальной питательной
средой. Флакон устанавливают в блок детекции прибора и инкубируют при
осторожном встряхивании
Каждые 15 минут с помощью специальной флюоресцентной технологии прибор
осуществляет детекцию микробного роста по продукции СО2, изменению рН и
модификации окислительно-восстановительного потенциала среды
Информация о получении положительного сигнала отражается звуковым
сигналом, выводится на монитор компъютера и дублируется внутри модуля
детекции, рядом с нужным флаконом. Время детекции от 9 до 120 часов
25.
Широкое распространение за рубежом получиласистема для обнаружения микроорганизмов в крови фирмы Oxoid –
«Signal blood system»
Система состоит из двух сосудов, соединенных между собой с
помощью полой иглы. Нижний сосуд заполнен специальной
питательной средой и укупорен резиновой пробкой
После посева в пробку вставляют полую иглу, канюля которой
вмонтирована в дно верхнего сосуда, исполняющего роль
индикатора
При росте микроорганизмов образуются газообразные продукты
метаболизма. В нижнем флаконе повышается давление, и часть
питательной среды с кровью через иглу выдавливается в верхний
индикаторный сосуд. Открыв крышку индикаторного сосуда,
можно интактно взять материал для посева или приготовления
мазка
Такой подход позволяет регистрировать наличие бактериального
роста на ранних этапах и резко упрощает процедуру ревизии
посевов
При посевных дозах 1-13 клеток рост бактерий разных видов
проявляется через 17-72 часа
26. Для получения капсульных форм бруцелл используют:
Среды с иммунной сывороткойЯичные среды Петрова, Дорсе, Петраньяни
Культивирование в курином эмбрионе или
в присутствии специфического бактериофага
27. L-формы бруцелл появляются после антибиотикотерапии:
Способ посева бактериологического материала для выделенияL-культур идентичен с методом выделения бактериальных
гемокультур
Посевы выдерживаются в термостате не менее 35 - 40 дней
Среда для выделения и культивирования L-культур бруцелл:
Основа –печеночный бульон, мясная вода, пептон, рН 7,8, с добавлением
глицерина и глюкозы
Заготовленный агар по мере надобности (перед посевом крови)
расплавляют в водяной бане, охлаждают до 50 °C и к нему добавляют
25% нормальной лошадиной сыворотки (предварительно
простерилизованной через фильтр Зейтца), 25% печеночного или
мясопептонного бульона (в соответствии с основой агара),
содержащего 50 - 100 ед. пенициллина на 1 мл среды
Посев крови, в объеме не менее 5 мл, пунктатов костного мозга и
лимфоузлов производят на питательную среду сразу же после застывания
агара и добавления бульона (метод предложен НИИЭМ им. Н.Ф. Гамалеи)
28. Дифференциация S- и R-форм бруцелл по White & Wilson:
Дифференциация S- и R-форм бруцелл поWhite & Wilson:
Исследуемые колонии засевают на Альбими-агар,
разлитый в чашки Петри и подсушенный в течение 24 час
Посевы выдерживают при 370С в течение 96 час
На поверхность культур наслаивают водный раствор
кристаллвиолета 1:2000 на 15 сек
Краску сливают в дезраствор, колонии
микроскопируют или просматривают
в проходящем свете
Шероховатые колонии приобретают красную или
сине-красную окраску, S-формы остаются бледносиневатыми или бледно-фиолетовыми
Некоторые виды (B. ovis, B. canis) существуют преимущественно в
R-форме
29. Родовую идентификацию выделенных культур проводят на основании:
Изучения морфологии колонийМикроскопии мазков, окрашенных по Граму или
Козловскому
По результатам прямого иммунофлуоресцентного
метода и
Реакции агглютинации на стекле с поливалентной
и монорецепторными сыворотками
Окраска по
Граму
Г-
РА
МФА
+
+
B. melitensis
Г-
+
+
B. suis
Г-
+
+
B. abortus
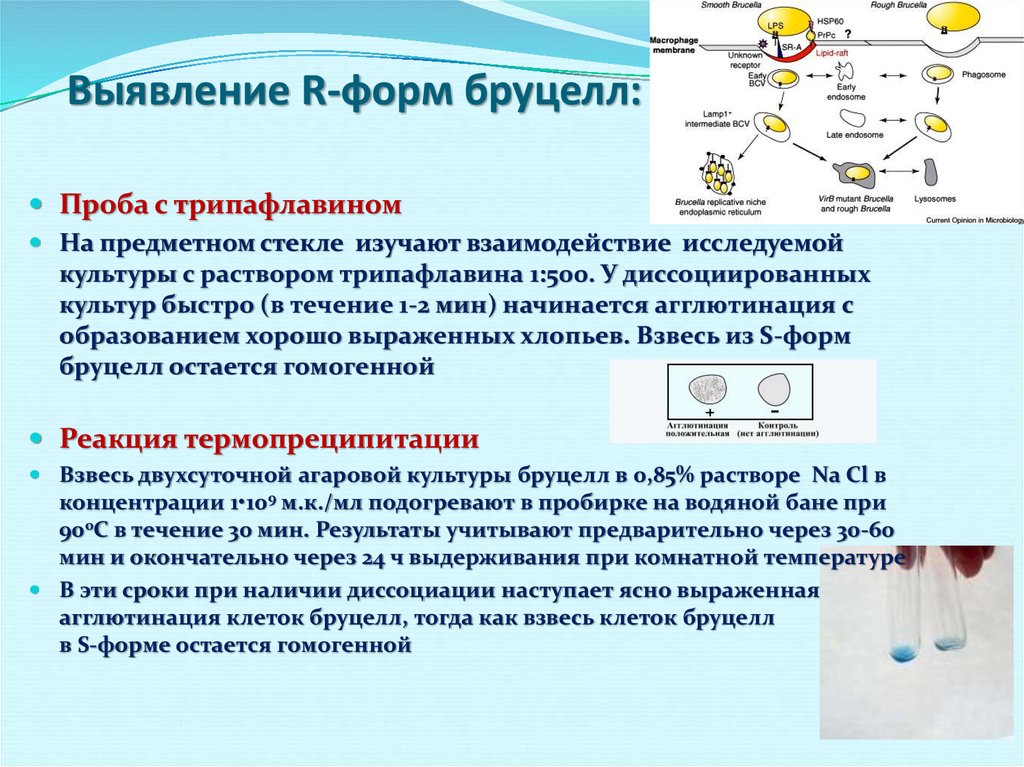
30. Выявление R-форм бруцелл:
Проба с трипафлавиномНа предметном стекле изучают взаимодействие исследуемой
культуры с раствором трипафлавина 1:500. У диссоциированных
культур быстро (в течение 1-2 мин) начинается агглютинация с
образованием хорошо выраженных хлопьев. Взвесь из S-форм
бруцелл остается гомогенной
Реакция термопреципитации
Взвесь двухсуточной агаровой культуры бруцелл в 0,85% растворе Na Cl в
концентрации 1•109 м.к./мл подогревают в пробирке на водяной бане при
900С в течение 30 мин. Результаты учитывают предварительно через 30-60
мин и окончательно через 24 ч выдерживания при комнатной температуре
В эти сроки при наличии диссоциации наступает ясно выраженная
агглютинация клеток бруцелл, тогда как взвесь клеток бруцелл
в S-форме остается гомогенной
31. Проба с трипафлавином (реакция Алессандрини и Сабатучи):
Трипафлавин – солянокислая соль 3,6-диамино-10-метилакридина
Диссоциированные культуры бруцелл вызывают
агглютинацию на стекле в капле 0,2% раствора
трипафлавина в 0,15М NaCl,
Клетки недиссоциированных штаммов дают
гомогенную взвесь
Диссоциированные культуры
не сразу дают колонии R-формы,
хотя реакция термопреципитации и проба с
трипафлавином уже будут положительными
32. Феномен термопреципитации Бюрне:
Реакция направлена на выявлениедиссоциированных штаммов, которые при
прогревании их культуральной взвеси при 85-90 0С в
течение 30 мин дают спонтанную агглютинацию
Считают, что в процессе
диссоциации
у бруцелл нарастает
количество белков с
гидрофобными
свойствами
33. Единые Видовые идентификационные тесты для выделенных культур (видовая дифференциация бруцелл):
Определены Подкомитетом по таксономии бруцелл Международногокомитета номенклатуры бактерий и Объединенным комитетом
ФАО/ВОЗ по бруцеллезу и включают:
изучение условий культивирования выделенных культур
определение их чувствительности к анилиновым краскам
определение способности образовывать сероводород
определение уреазной активности
изучение окислительно-метаболических реакций
изучение чувствительности к бруцеллезным фагам Tb ,Bk, Wb, Fi
выявление агглютинабельности монорецепторными (анти-abortus
и анти-melitensis) сыворотками, а также
изучение вирулентности для лабораторных животных и
ряда других признаков
34. Отношение к атмосферному СО2:
В отличие от B. melitensis и B. suis, культурыB. abortus и B. ovis в первых генерациях растут лишь
при повышенном до 5-10% содержании СО2 в
атмосфере термостата
Вид бруцелл
Потребность в СО2
B.melitensis
-
B.abortus
+
B.suis
-
B.ovis
+
35. Редуцирующая активность в отношении основного фуксина и тионина:
Возбудители бруцеллеза относительно устойчивы к бактериостатическомудействию красителей – основного фуксина и тионина
Различная устойчивость к анилиновым краскам лежит в основе видовой
дифференциации бруцелл:
Фуксин 1:50000 не влияет на рост B. abortus, но ингибирует рост B. suis
Тионин 1:50000 не влияет на B. suis, но может ингибировать B. abortus
B. melitensis хорошо растет в присутствии всех анилиновых красителей
К расплавленному питательному агару добавляют основной раствор
красок (0,1 г краски, 20 мл 960 спирта, 80 мл дистиллированной воды) до
концентрации 20 мкг/мл и разливают пипеткой по 20-25 мл в каждую
чашку. Среды пригодны в течение 10-14 дней. Обесцвеченные среды не
используют
Посевы производят секторами из взвеси 2-суточной агаровой культуры
бруцелл в концентрации 2•109 м.к./мл
Иногда используют диски с красками, которые помещают в чашки Петри
на плотную питательную среду с исследуемой культурой
Учет результатов осуществляют через каждые 48 ч при 370С в течение 6сут.
36. Редуцирующая активность бруцелл в отношении красителей:
Основной фуксин1:50 000
Тионин
1:50 000(25 000)
+
+
-
+
+
B. melitensis
B. abortus
B. suis
фуксин
тионин
37. Сульфатредуцирующая активность бруцелл:
Способность к образованию сероводорода выявляют на средах,содержащих серу в легко редуцируемом состоянии (цистин, цистеин,
тиогликолевая кислота, тиомочевина)
Взвесь 2-суточной изучаемой культуры в концентрации 2•109 м.к./мл
засевают петлей диаметром 2 мм на пробирку с агаром. Под пробку
помещают полоску фильтровальной бумаги, смоченную насыщенным
раствором уксуснокислого свинца так, чтобы ее свободный конец не
касался посева. Посевы инкубируют в термостате при 370С. Результаты
учитывают через каждые 48 ч в течение 6 сут.
Показателем интенсивности образования сероводорода является
почернение свободного края фильтровальной бумаги, которое
измеряют в мм. При каждом учете почерневшую полоску заменяют
новой. Для окончательной оценки способности культур к образованию
H2S все три показателя складывают
Возбудители B.melitensis,
B.ovis, B.canis Н2S не образуют
Для культур вида B. suis (1 биовар) суммарный показатель
составляет примерно 12-20 мм, для B. abortus (1 биовар) – около 57 мм, у культур B. neotomae равен 5-8 мм
38. Образование H2S:
Суммарный показательB.melitensis
B.abortus (1 биовар)
B.suis (1 биовар)
B.ovis
B.neotomae
B.canis
5-7 мм
15-20 мм
5-8 мм
-
Реакция ацетата свинца с сероводородом с
образованием черного осадка сульфида свинца:
39. Уреазной активностью обладают все эпидемиологически значимые виды бруцелл:
Виды B.melitensis, B.abortus и B.suis гидролизуют мочевину всреде Кристенсена с образованием аммиака и углекислоты, в
результате чего происходит изменение цвета среды из желтого
в розовый или малиновый
Наиболее выражена уреазная активность у бруцелл вида
B.suis, B.melitensis, B.neotomae, B.ovis, наименее – у B.abortus
Наиболее быстро и интенсивно изменение цвета среды
Кристенсена происходит при высеве культур B. suis
Менее интенсивно цвет среды изменяется при посеве культур
B. melitensis, наиболее медленно и слабо – при росте B. abortus
Проведение дифференцирующих тестов осуществляют
параллельно и с референтными штаммами бруцелл
B.melitensis 16M, B.abortus 544, B.suis 1330 (биовар 1)
Уреаза - гидролитический фермент из группы амидаз, обладающий
специфическим свойством катализировать гидролиз мочевины до
диоксида углерода и аммиака: CO(NH2)2 + H2O → CO2 + 2NH3
40. Определение дезаминазной активности бруцелл:
основано на качественном определенииаммиака, образующегося в результате
дезаминирования аденина до гипоксантина
Взвесь 2-сут агаровой культуры исследуемого штамма в 0,15 М NaCl рН 7,2
3•109 м.к./мл делят на 2 части
В опытную пробирку добавляют 1 мл 1% раствора аденина, в
контрольную – 1 мл дистиллированной воды – инкубация при 370С - 24 ч,
после чего
В каждую пробу добавляют по 0,2 мл реактива Несслера
Учет результатов производят визуально:
Если исследуемая культура не обладает дезаминазной активностью в
отношении аденина (отрицательная проба) – раствор обесцвечен
или слегка окрашен в желтовато-зеленый цвет, как и в контроле
При наличии дезаминазной активности (положительная проба)
наблюдается ярко-красное окрашивание
Культуры бруцелл видов B. abortus и B. melitensis не обладают
дезаминазной активностью, для B. suis она характерна
41. Агглютинация монорецепторными А- и М-сыворотками:
Агглютинация монорецепторными А- и Мсыворотками:Монорецепторные (anti-abortus и anti-melitensis) сыворотки в объеме
0,5 мл титруют в 0,15 М растворе NaCl от 1:10 до их предельного титра
Во все опытные пробирки добавляют взвесь 2-суточной агаровой
культуры изучаемого штамма в концентрации 2•109 м.к./мл в 0,15 М
растворе NaCl по 0,5 мл
Контролями служат эталонные штаммы B.abortus 544 и B.melitensis
16М
Инкубация 370С- 2 ч, комн t 18-20 ч
Агглютинацию на 2+ и более с разведения 1: 20
учитывают как положительный результат
Бруцеллы вида B.melitensis (1 биовар) образуют
хлопья агглютината с монорецепторной
сывороткой anti-В.melitensis,
культуры вида B.abortus (1 биовар) – сывороткой anti-В.abortus
Для культур бруцелл видов B.ovis и B.canis и других, находящихся в Rформе, при проведении реакции агглютинации используют Rсыворотку, которую титруют в ФБР рН 8,2-8,4
42.
43.
Пробы с фагами:44. Чувствительность к бруцеллезным диагностическим бактериофагам:
Для постановки теста используют набор бактериофаговбруцеллезных диагностических Тb; Wb, BK2, Fi (производства
ФГУЗ СтавропольНИПЧИ Роспотребнадзора) в рабочем
диагностическом титре (РДТ)
Для посева применяют 1-2-суточную взвесь агаровой культуры
в концентрации 2•109 м.к./мл в 0,15 М растворе NaCl
Посев изучаемых культур осуществляют «газоном», на
который «дорожкой» или петлей наслаивают бактериофаги,
Пробу с бактериофагами можно проводить двуслойным
методом
Необходимым условием успешной постановки пробы
является подсушивание посева культуры до нанесения
бактериофагов
Результаты учитываются через 24-36 ч инкубации при 370С
45. Проба с фагом (двуслойный метод):
0,7% полужидкий агар в пробирке растапливают над пламенемспиртовки, пока столбик агара не начнет образовывать пузыри
и подниматься вверх
Пробирку остужают до 45 0С
В охлажденный до 45 0С агар добавляют бульонную культуру
исследуемого штамма «средней мутности» (109 м.к./мл – 0,3-0,4
мл)
Выливают через край на чашку Петри с питательной средой и
оставляют в приоткрытом виде
После подсушивания (37 0С 30 мин)
в сооответствии с предварительно
произведенной разметкой наносят
краем петли раствор фага
46. Проба с фагами методом дисков:
Фаголизабельность исследуемого штамма бруцелл такжеможет быть выявлена с помощью дисков,
импрегнированных бактериофагами
Диски помещают в чашки Петри с плотной питательной
средой, засеянной газоном исследуемой культуры
47. Чувствительность различных видов Brucella к специфическим бактериофагам:
ТбилисиТВ
Weybridge
Wb
Firenze
Fi
Berkley
Bk2
B.abortus
+
+
+
+
B.melitensis
–
–
–
+
B.suis
–
+
±
+
B.neotomae
±
+
+
+
Примечание:
ТВ – фаг Тбилиси;
Wb – фаг Weybridge;
Fi – фаг Firenze;
Bk2 – фаг Berkley;
РДТ – рабочий диагностический титр;
«+» – полный лизис культуры
«±» – частичный лизис культуры
«-» – отсутствие лизиса
48. Биохимическая идентификация бруцелл:
Процесс дифференциации бруцелл может быть дополненопределением окислительно-метаболической активности в
отношении 12 субстратов (L-аланин, L-аспарагин, Lглутаминовая кислота, L-аргинин, L-цитрулин, DLорнитин, L-лизин, D-рибоза, D-ксилоза, D-галактоза, Dглюкоза, эритритол), а также выявлением адениндезаминазной активности возбудителя бруцеллеза
Бруцеллы разлагают углеводы до образования кислоты и
газа, кроме ферментации глюкозы и арабинозы
49. Упрощенная схема видовой дифференциации культур рода Brucella:
Условияроста
Бактериостатическое
действие красок:
Фуксин
Тионин
1:50 тыс
1:25 тыс
Образова
ние H2S
ADAактивност
ь
B. melitensis
О2
+
+
-
-
B. аbortus
О2
-
+
+
-
B. suis
5-10%
СО2
+
-
+
+
50. Биологический метод в лабораторной диагностике бруцеллеза:
Биологический метод диагностики бруцеллеза применяетсяпараллельно с бактериологическим при исследовании
материала, контаминированного посторонней микробиотой
(органы трупа, выделения больного, пищевые продукты, вода,
почва и т.д.) или материала с заведомо невысокой
концентрацией бруцелл
Нередко чистую культуру возбудителя бруцеллеза возможно
выделить только через биопробу
51. Биологическая проба при исследовании на бруцеллез:
Используют морских свинок (250-300 г) или белых мышей (17-20 г)Исследуемый материал вводят подкожно в паховую область в дозах не
более 0,5 мл для мышей или 1,0 мл – для морских свинок
При исследовании крови или другого материала, не содержащего
посторонней микробиоты, заражение биопробных животных
производят внутрибрюшинно
Исследуемый материал вводят одновременно 6 б/мышам и 2 м/свинкам
Из 6 белых мышей 3 б/м вскрывают на 21 сут после введения материала и
3 – через 30 дней после заражения
На 30 день после заражения органы 1 морской свинки подвергают
бактериологическому исследованию
При отрицательном результате еще через 15 дней вскрывают 2-ую м/св
У биопробных животных бактериологически исследуют паховые,
аксиллярные, подчелюстные, шейные, парааортальные
лимфатические узлы, печень и селезенку
0
21 с
30 с
45 с
6 б/м и 2 м/с
3 б/м
3 б/м
1 м/с
1 м/с
52. Иммунологическая диагностика бруцеллеза:
ИммуноанализПоиск
антител
Поиск
антигенов
53. Реакции, направленные на поиск антигенов возбудителя бруцеллеза:
Метод флуоресцирующих антителРНГА с иммуноглобулиновым эритроцитарным
бруцеллезным диагностикумом
ТИФМ
Кольцепреципитация
ПЦР
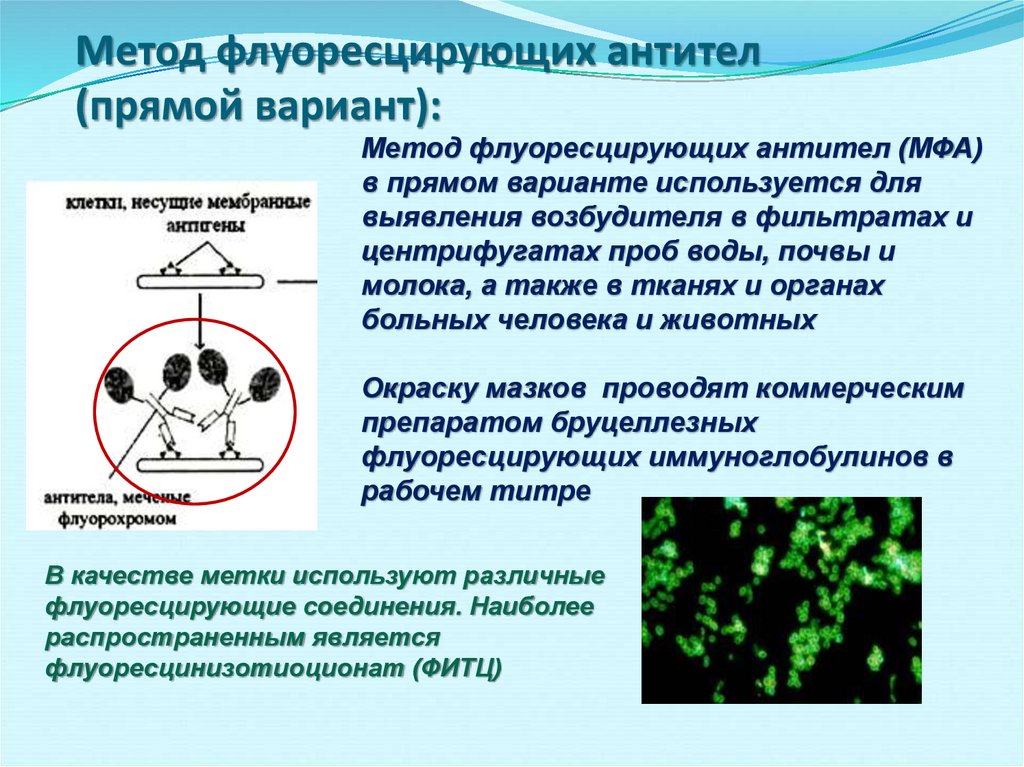
54. Метод флуоресцирующих антител (прямой вариант):
Метод флуоресцирующих антител (МФА)в прямом варианте используется для
выявления возбудителя в фильтратах и
центрифугатах проб воды, почвы и
молока, а также в тканях и органах
больных человека и животных
Окраску мазков проводят коммерческим
препаратом бруцеллезных
флуоресцирующих иммуноглобулинов в
рабочем титре
В качестве метки используют различные
флуоресцирующие соединения. Наиболее
распространенным является
флуоресцинизотиоционат (ФИТЦ)
55. Метод флуоресцирующих антител:
МФА применяют для исследования клинического материалаот больных людей и животных, а также проб из объектов
внешней среды, пищевых продуктов и т.д.
Использование МФА предусматривает проведение
концентрирования бактерий в нативном материале путем
центрифугирования пробы (3000 g, 20-30 мин) или ее
фильтрации через мембранные фильтры (0,22 или 0,45 мкм) с
последующим смывом осадка с поверхности фильтра
Из исследуемых проб или осадка делают мазки-отпечатки,
которые после их фиксации подвергают окрашиванию
Просмотр препарата в люминесцентном микроскопе
осуществляют не менее чем в 25 полях зрения
Специфическим считается свечение клеточной стенки на 3-4
креста, центральная часть клетки при этом остается
неокрашенной (феномен Кумбса)
56. Методика окрашивания мазков для исследования в прямом МФА:
На поверхность фиксированного и высушенного мазка,помещенного во влажную камеру (чашку Петри с
влажной фильтровальной бумагой или ватой), пипеткой
наносят каплю иммуноглобулинов диагностических
флуоресцирующих бруцеллезных моноклональных в рабочем
разведении
Через 20 мин инкубации при комнатной температуре мазки
ополаскивают дистиллированной водой
Стекла промывают 0,15М раствором натрия хлорида два раза по 5
мин
Затем мазки ополаскивают дистиллированной водой и
высушивают на воздухе
На готовые мазки наносят каплю раствора глицерина
(9 объемных частей глицерина и 1 часть фосфатного буфера,
рН 7,0), накрывают покровным стеклом и просматривают в
люминесцентном микроскопе
57. Разрешающая способность (чувствительность) МФА составляет 105-106 м.к./мл
С целью повышения чувствительности МФА разработан способиндикации возбудителя бруцеллеза, предполагающий
предварительную инъекцию исследуемого материала
биопробным животным
При этом подкожно белым мышам в область спины вводят 0,5-0,1
мл суспензии исследуемого материала в 0,15 М растворе хлорида
натрия, которую предварительно смешивают с
гепаринизированной кровью в соотношении 1:0,5 – 1:0,7
К полученной смеси из расчета на одно животное можно
добавить 0,5 мл куриного желтка, 5-7 мг кортизона и 90-120 мг
сухого молока
Из содержимого, полученного с места введения, готовят мазки,
которые окрашивают препаратом флуоресцирующих
бруцеллезных иммуноглобулинов
Таким способом выявляют возбудителя бруцеллеза при его
минимальной концентрации в исследуемом материале
58. РНГА с эритроцитарным бруцеллезным иммуноглобулиновым диагностикумом:
59. Чувствительность РНГА 105-106 м.к./мл
РНГА может быть использована при исследовании выделенных культурмикроорганизмов, а также проб как из объектов окружающей среды,
так и от больных и животных
Исследуемую пробу разливают в лунки полистироловой пластины в
объеме 0,025 мл . Первая лунка является опытной, вторая – контрольной
(РТНГА)
В опытную лунку вносят 0,025 мл нормальной кроличьей сыворотки, во
вторую – 0,025 мл иммунной сыворотки в разведении 1:10,
инактивированной при 56 0С 30 мин
Через 15-20 мин инкубации при комнатной t в обе лунки добавляют 0,025
мл 1% взвеси диагностикума, нагруженного специфическими
иммуноглобулинами
Результат реакции учитывают через 2 час и 24 час
В опытной лунке эритроциты, выпавшие «зонтиком», учитываются как
положительный результат
В РТНГА должен быть отрицательный результат («пуговка»)
Если обе лунки «положительны», реакцию следует переставить с
разбавленной в 10 раз пробой (м.б. избыток антигена)
60. Иммуноферментный метод
Твердофазный иммуноферментный метод [ТИФМ (внастоящее время чаще используют термин ИФА) или ELISA]
отличается высокой чувствительностью (5•104 м.к./мл или 1
мкг/мл растворимого белкового антигена) и специфичностью
Результат анализа можно получить спустя 4-5 ч от начала
исследования. С помощью этого метода при поиске антигенов
выявляют специфические антигенные комплексы
возбудителя бруцеллеза как в различных биопробах, так и в
объектах внешней среды
Для выполнения ИФА используют «Тест-систему
диагностическую иммуноферментную для определения
бруцеллезного антигена иммуноферментным методом»,
выпускаемую предприятием по производству бактериальных
препаратов НИИЭМ им. Н.Ф. Гамалеи РАМН (Москва) и ФКУЗ
СтавропольНИПЧИ
61. Чувствительность ТИФМ 104 м.к./мл
Сэндвич-вариант ИФА62. Реакция преципитации (кольцевая проба) для исследования проб молока:
63. ПЦР – метод амплификации специфичной нуклеотидной последовательности
Используется наДенатурация
Отжиг праймеров
Элонгация
этапах выявления АГ
Наибольшая чувствительность –
103-104 м.к./мл
Срок анализа - 4-8 час
Позволяет идентифицировать
также
Нетипичные
формы бруцелл
64. Реакции, направленные на поиск бруцеллезных антител в сыворотках:
Реакция ХеддльсонаОбъемная реакция агглютинации Райта
НМФА (непрямой вариант)
РНГА с антигенным эритроцитарным
диагностикумом
Реакция Кумбса
ОФР
ТИФМ (непрямой вариант)
65. Метод ускоренной реакции агглютинации на стекле (Хеддльсона) для выявления антител:
Стекло тщательно моют иобезжиривают и расчерчивают
на 6 квадратов по диагонали
Вносят в квадраты исследуемую
сыворотку в дозах: 0,04; 0,02;
0,01 и 0,02 мл (к-ль сыворотки)
К первым 3-м лункам добавляют
по 0,03 мл диагностикума
бруцеллезного жидкого для РА;
В 4-ю лунку вносят 0,03 мл 0,9%
раствора NaCl
В последней лунке смешивают
диагностикум и 0,9% р-р NaCl
(к-ль диагностикума)
Стекло подогревают до 36 0С
над пламенем горелки
66.
67. Объемная (пробирочная) реакция Райта:
Диагностикум разводят 1:10Готовят разведения сыворотки двукратным
шагом от 1:25 до 1:400 в объеме 0,5 мл
Контроль сыворотки проводят с разведением 1:25
В каждую пробирку, кроме контрольной, вносят по 0,5 мл
диагностикума в разведении 1:10
Контроль сыворотки проводят с о,5 мл 0,15 М раствора Na Cl
Контроль диагностикума - в 5 пробирках: смесь диагностикума,
разведенного 1:10, с 0,15 М раствора NaCl (2,0+2,0;
1,0+0;
0,75 +0,25;
0,5 + 0,5;
0,25 +0,75 соответствено
Учет реакции осуществляют через 24 час инкубации при 37 0С
68. Учет реакции Райта:
++++ - полное просветление жидкости с образованиемосадка в виде крупно- и мелкозернистых хлопьев
+++
- почти полное просветление жидкости , хорошо
заметные хлопья
++
- незначительное просветление жидкости с
заметными хлопьями
+
- мутная жидкость с едва заметной зернистостью
-
- равномерно мутная жидкость без агглютинации
69. Антиглобулиновая проба (реакция Кумбса):
Постановка реакции Кумбса основана на выявлениинеполных антител
Для пробы Кумбса отбирают пробирки с исследуемой
сывороткой, в которых в реакции Райта зафиксирован
отрицательный или слабоположительный результат
Эти пробирки центрифугируют: 3000 об/мин - 40 мин
Супернатант удаляют, осадок отмывают трижды 0,85 %
раствором NaCl, после чего к 0,5 мл отмытого антигена
добавляют 0,5 мл антиглобулиновой сыворотки, используемой
специально для реакции Кумбса
Пробирки выдерживают в термостате при 37 0С в течение 18-24 ч
Учет реакции осуществляют аналогично реакции пробирочной
агглютинации Райта
Метод Кумбса принципиально не отличается от метода
иммунофлюоресценции, но последний является более простым
70. Опсоно-фагоцитарная реакция (ОФР):
Реакция основана на способностиполинуклеарных нейтрофилов
фагоцитировать бруцеллы в
присутствии специфических
опсонинов, которые нарастают в
крови человека или животного в
процессе бруцеллезной инфекции
или в связи с введением им
бруцеллезной вакцины
Реакция высокочувствительна и может применяться в комплексе с
другими диагностическими реакциями
Ее преимущества: техническая простота выполнения и высокий
процент (до 96%) положительных реакций при хронических формах
К недостаткам следует отнести ложноположительные реакции, особенно
во время лихорадки, или (в 6-8% случаев) появление отрицательных
проб у бруцеллезных больных
Относительно высокий фагоцитоз отмечается у лиц, которые не болели,
но сталкивались с возбудителем заболевания
71.
При добавлении культуры бруцелл к кровизараженного бруцеллезом человека микробы
энергично фагоцитируются нейтрофильными
лейкоцитами вследствие наличия у них
специфических опсонинов и тропинов
Реакция учитывается путем подсчета
количества фагоцитированных бруцелл в 25
нейтрофильных лейкоцитах из нескольких
мест мазка
Показатель 10—24 характеризует слабо
положительную реакцию; 25—49 — ясно
выраженную; 50—75 — резкую
У здоровых людей показатель в большинстве
случаев составляет 0 или 1, достигая в редких
случаях 4—5
72. Метод флуоресцирующих антител (непрямой вариант):
Для быстрой серологической дифференциации первых биовароввидов B. abortus и B. melitensis, выявления диссоциированных (Rформ) бруцелл можно использовать метод флуоресцирующих
антител в непрямом варианте, при котором постановку МФА
осуществляют в 2 этапа: на первом мазок обрабатывают немеченой
бруцеллезной сывороткой, на втором – антивидовыми
флуоресцирующими иммуноглобулинами
73. НМФА для выявления специфических сывороточных антител:
На предварительно сделанные и фиксированныемазки, сделанные из взвеси бруцелл 109 м.к./мл,
наслаивают исследуемую сыворотку в различных
разведениях, инкубируют 20 мин при комнатной t,
после чего отмывают и наносят антивидовые
антитела, меченные ФИТЦ
После инкубации 20 мин при комнатной t в темноте
просматривают в люминесцентном микроскопе
Реакцию иммунофлюоресценции считают
положительной при наличии специфического
свечения бруцелл с сывороткой в ее титре 1:50
74.
75. ИФА, направленный на выявление антител в сыворотках:
76. Аллергодиагностика бруцеллеза (проба Бюрне) – кожная проба:
Становится положительной к концу 1-го месяца отначала инфекции в 80-90 % случаев
Иногда – с первой декады от начала болезни
Иногда сохраняется много лет и даже пожизненно
У больных хроническим бруцеллезом кожная проба
положительна в 90-95% случаев
Может отсутствовать при иммунодефицитных
состояниях или
Может быть положительной после вакцинации
77. Аллергическая кожная проба (Бюрне)
Проба Бюрне вполне специфична и отличаетсявесьма высокой чувствительностью
Техника внутрикожного
введения бруцеллина при
постановке пробы Бюрне
Определяет способность организма,
зараженного бруцеллезом, специфически
отвечать местной реакцией кожи на
внутрикожное введение бруцеллина — фильтра
3-недельного роста бульонной культуры бруцелл
любого типа.
Реакция становится положительной на 3—4-й
неделе от начала болезни, но бывают случаи и
более раннего появления
В дальнейшем она сохраняется с большим
постоянством на протяжении очень длительного
периода (иногда до нескольких лет), даже после
полного клинического выздоровления
78. При постановке реакции Бюрне
бруцеллин в дозе 0,1 мл вводят строго внутрикожно в среднюю треть ладоннойповерхности предплечья
Через 6—12 часов на месте инъекции появляется отек и покраснение, которые
достигают максимального развития через 24 и 48 часов
В редких случаях внутрикожная проба становится положительной к 72 часам —
это так называемые поздние реакции
При оценке реакции принимают во внимание, главным образом,
воспалительный болезненный отек; гиперемия кожи на месте инъекции
без отека диагностического значения не имеет. Отсутствие болезненности
и изменения цвета кожи, обычно сопровождающих отек, не исключает
положительной оценки пробы
Интенсивность реакции учитывают:
1) отрицательная реакция (—) — полное отсутствие местных изменений;
2) сомнительная реакция (±) — наличие асимметрии кожной складки по
сравнению с контрольной
3) слабо положительная ( + )—наличие слабо выраженного отека и
красноты диаметром 2—3 см
4) положительная реакция ( + + )— отечность 4—5 см, иногда с аденитом
5) резко положительная (+ + + ) —при отеке 6—8 см; аденит
79. Комплексный сероаллергологический метод – основа некультуральной диагностики бруцеллезной инфекции
на протяжении первых десяти дней заболевания реакцияРайта и проба Бюрне равноценны и выпадают
положительными приблизительно в 28% случаев
Во второй декаде заметно расхождение: реакция Райта
дает до 90% положительных результатов, а
проба Бюрне – только 63%
Бруцеллиновая проба даже в более поздние периоды
инфекции в отдельных случаях может быть
отрицательной при положительной реакции
агглютинации, поэтому только комплексное их
применение обеспечит высокий процент выявления
инфекции
80.
Общая схемаисследования
на бруцеллез:
ПЦР
МФА
ПЦР
НМФА













































































 medicine
medicine








