Similar presentations:
Дисперсные системы и поверхностные явления
1. ДИСПЕРСНЫЕ СИСТЕМЫ И ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Коровин Н.В. Общая химия. ─М.: Высш. шк., 2000. ─ 558 с. §§ 6.3, 8.7
Сидоров.В.И. Общая химия. ─
М.: Издательство АСВ, 2002─ 224 с. § 7.8
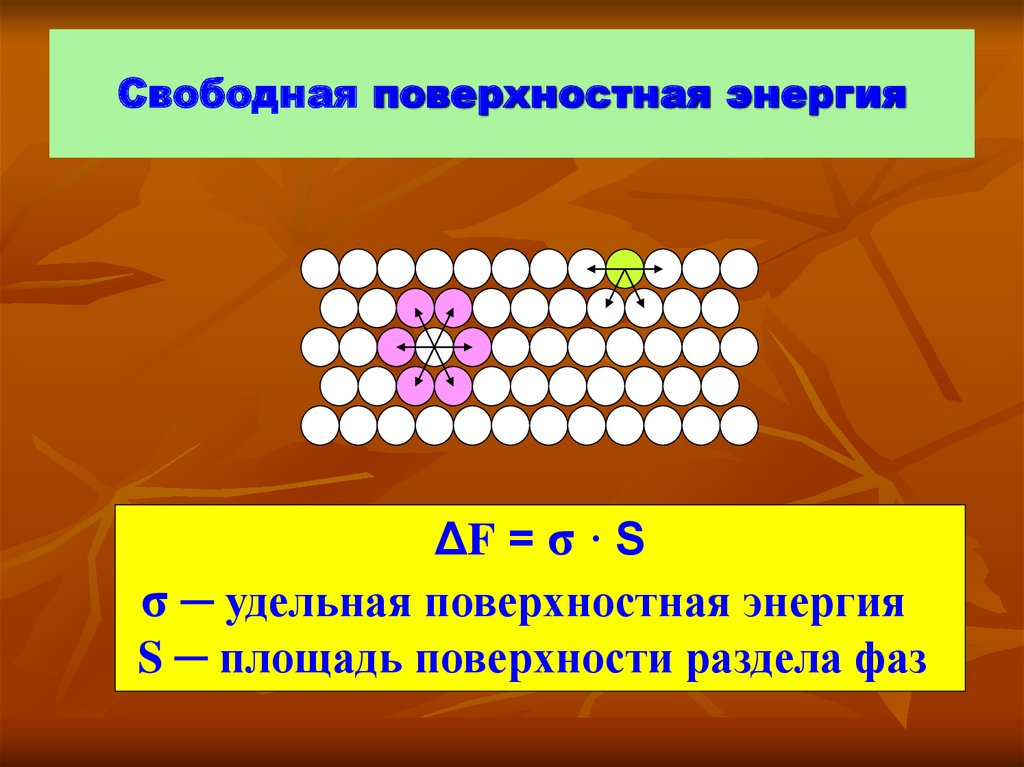
2. Свободная поверхностная энергия
ΔF = σ · Sσ ─ удельная поверхностная энергия
S ─ площадь поверхности раздела фаз
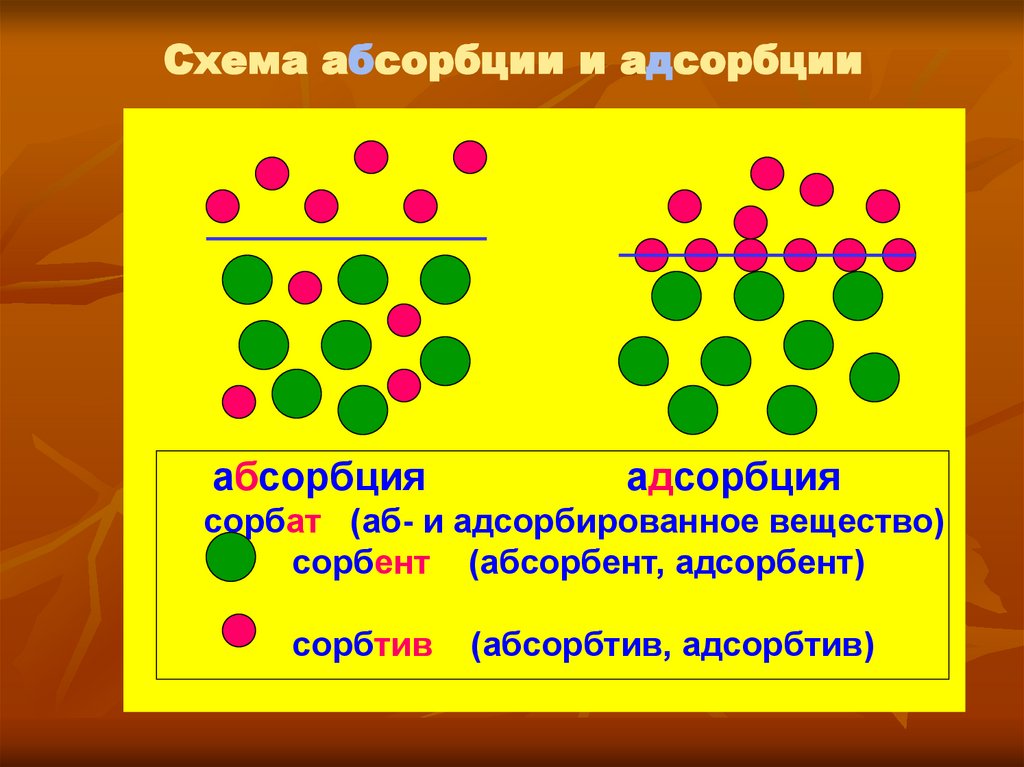
3. Схема абсорбции и адсорбции
абсорбцияадсорбция
сорбат (аб- и адсорбированное вещество)
сорбент (абсорбент, адсорбент)
сорбтив
(абсорбтив, адсорбтив)
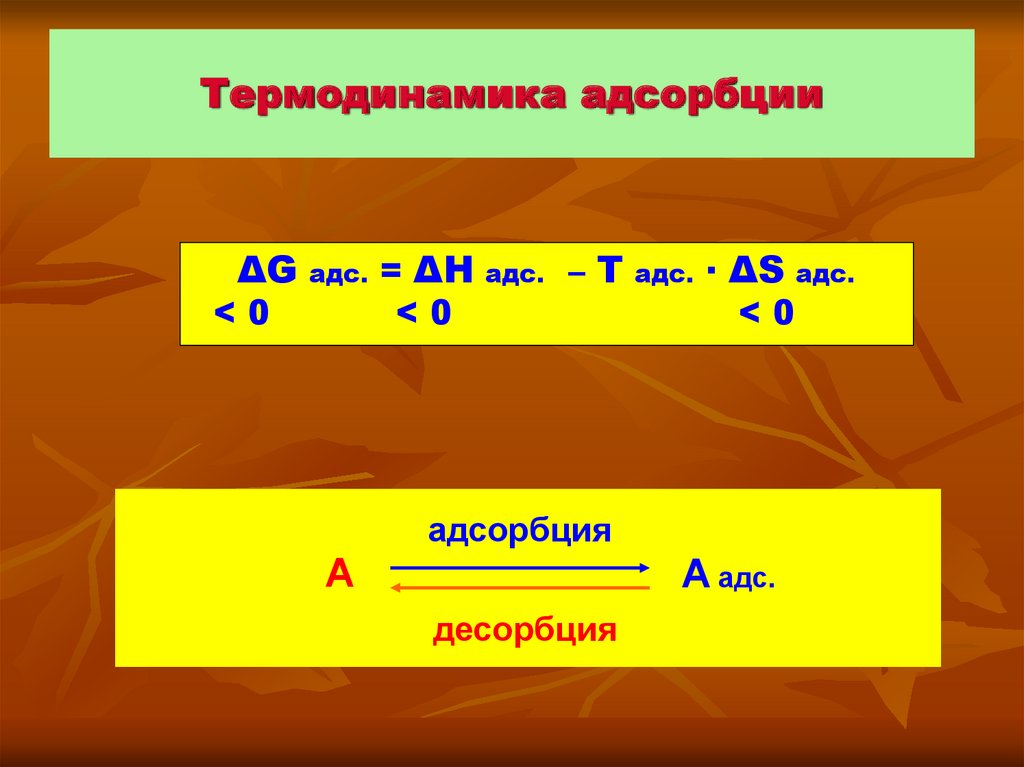
4. Термодинамика адсорбции
ΔG<0
адс.
= ΔН
<0
адс.
–Т
адс.
· ΔS адс.
<0
адсорбция
А
А адс.
десорбция
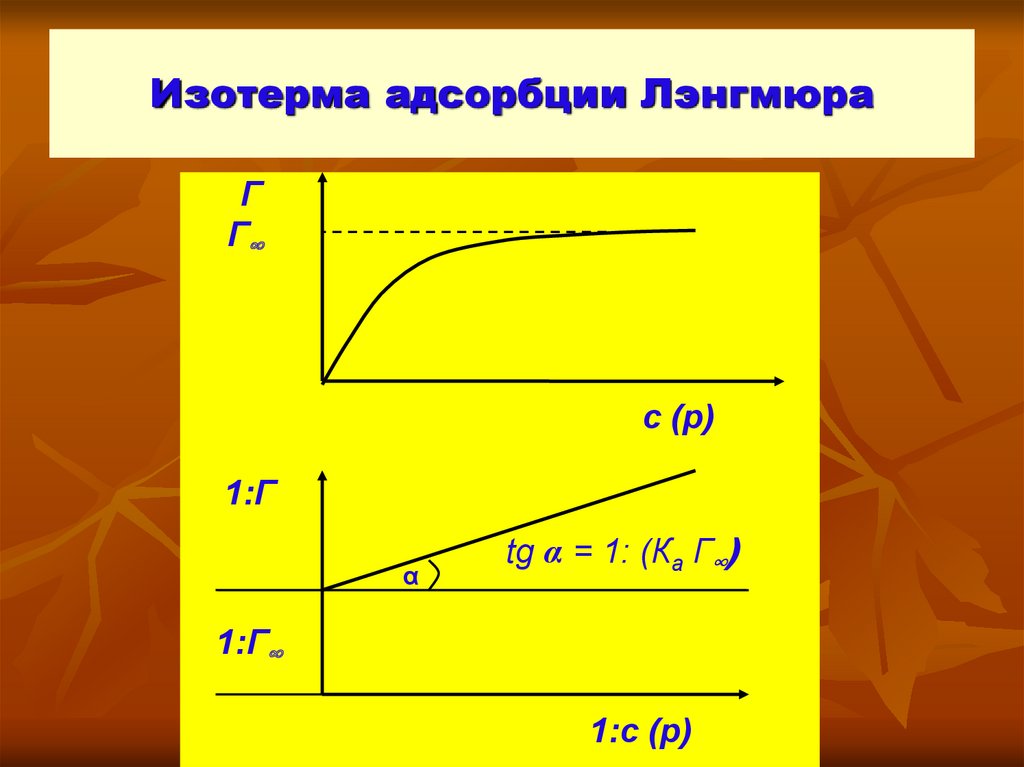
5. Изотермы адсорбции
Уравнение ЛэнгмюраК а с ( р)
Г Г
,
1 К а с ( р)
Г∞ ─ адсорбция при максимальном заполнении;
с (р) ─ равновесная концентрация (давление);
Ка ─ константа равновесия процесса адсорбции
Уравнение Генри
Г = Г∞ Ка с (р)
Уравнение Фрейндлиха
Г = Кф рn
Кф и n ─ постоянные
6. Изотерма адсорбции Лэнгмюра
ГГ∞
с (р)
1:Г
α
tg α = 1: (Ка Г∞)
1:Г∞
1:с (р)
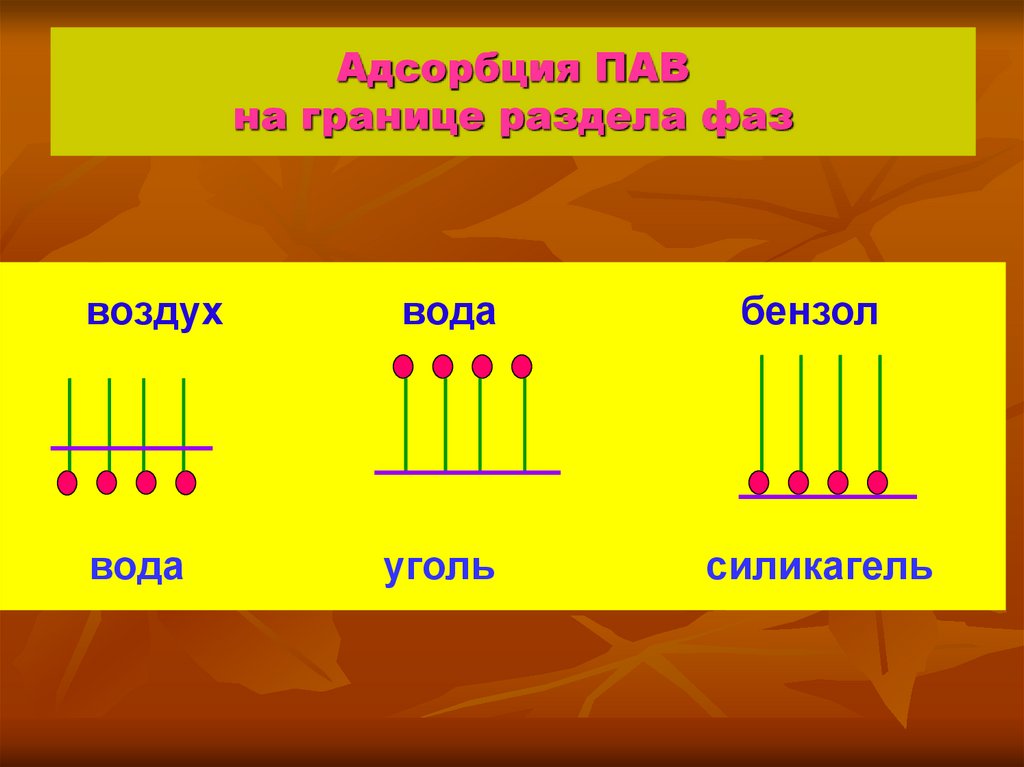
7. Адсорбция ПАВ на границе раздела фаз
воздухвода
вода
бензол
уголь
силикагель
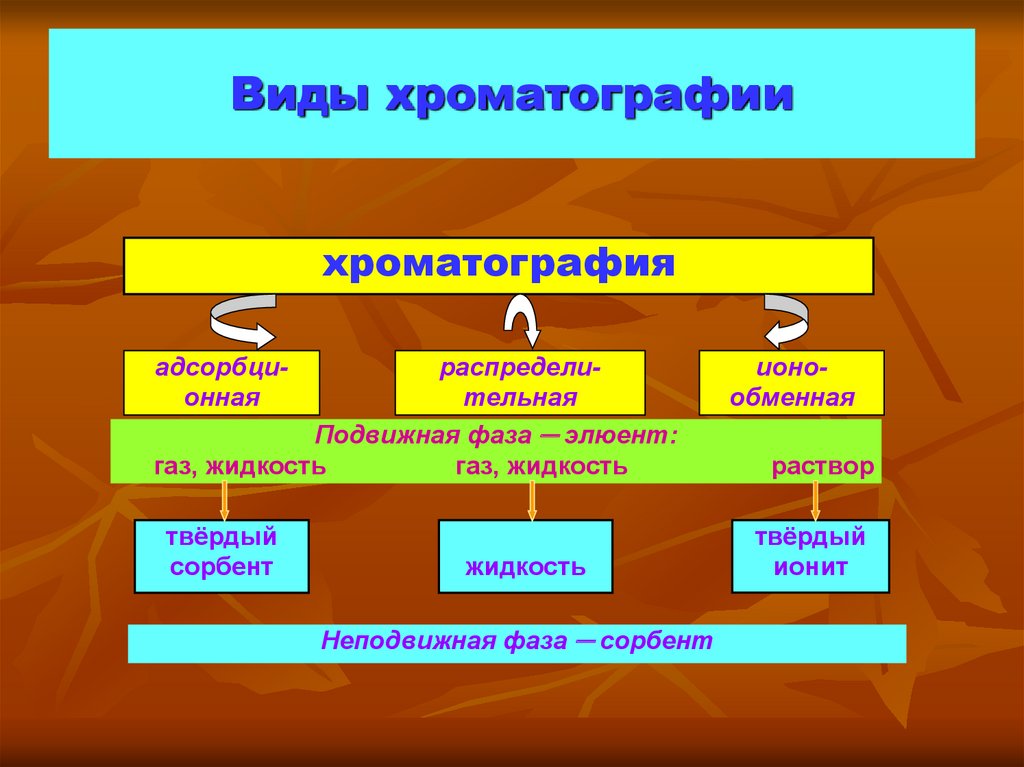
8. Виды хроматографии
хроматографияадсорбционная
распределительная
Подвижная фаза ─ элюент:
газ, жидкость
газ, жидкость
твёрдый
сорбент
жидкость
Неподвижная фаза ─ сорбент
ионообменная
раствор
твёрдый
ионит
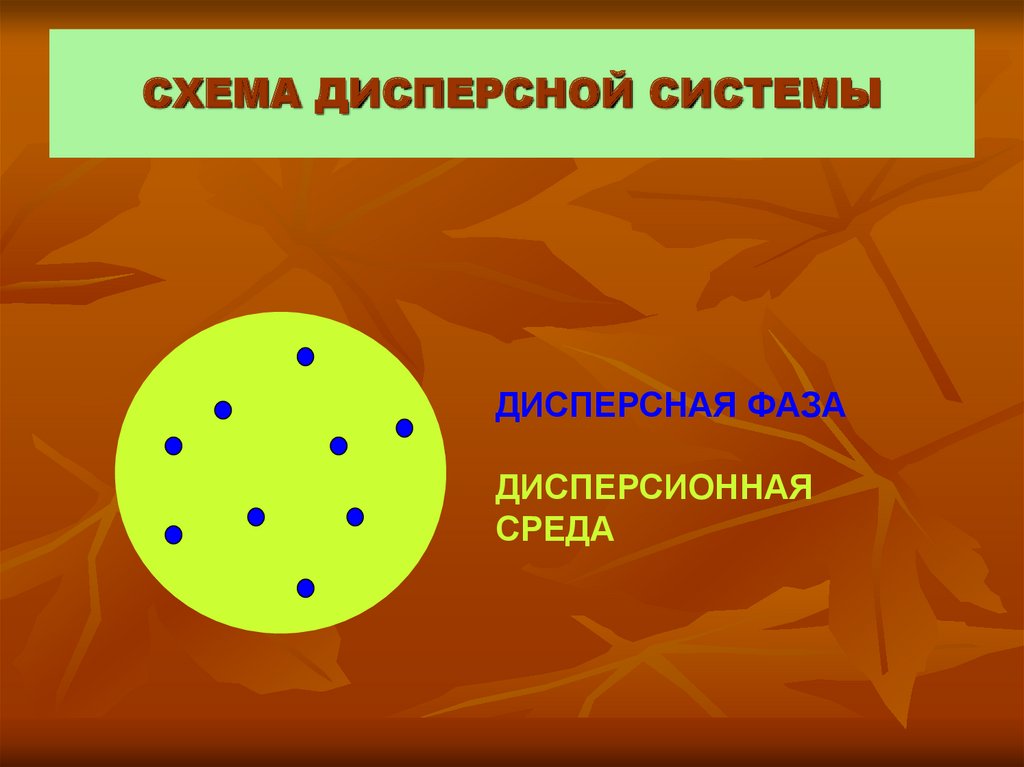
9. СХЕМА ДИСПЕРСНОЙ СИСТЕМЫ
ДИСПЕРСНАЯ ФАЗАДИСПЕРСИОННАЯ
СРЕДА
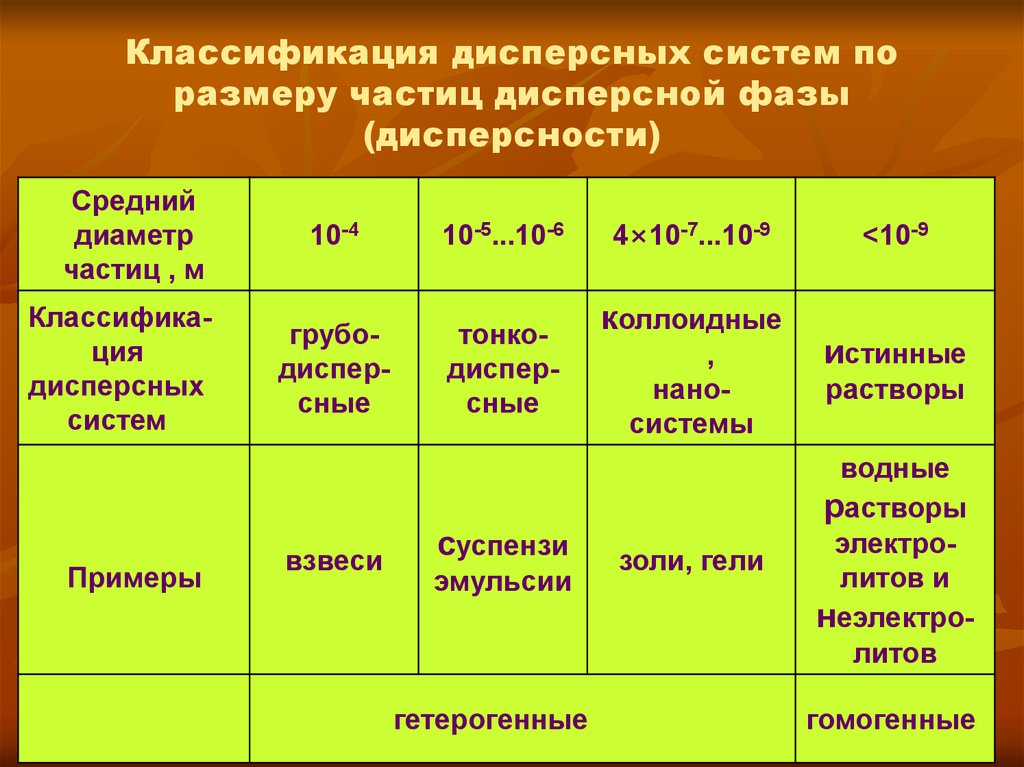
10. Классификация дисперсных систем по размеру частиц дисперсной фазы (дисперсности)
Среднийдиаметр
частиц , м
Классификация
дисперсных
систем
Примеры
10-4
10-5...10-6
грубодисперсные
тонкодисперсные
взвеси
суспензи
эмульсии
гетерогенные
4×10-7...10-9
коллоидные
,
наносистемы
золи, гели
<10-9
истинные
растворы
водные
растворы
электролитов и
неэлектролитов
гомогенные
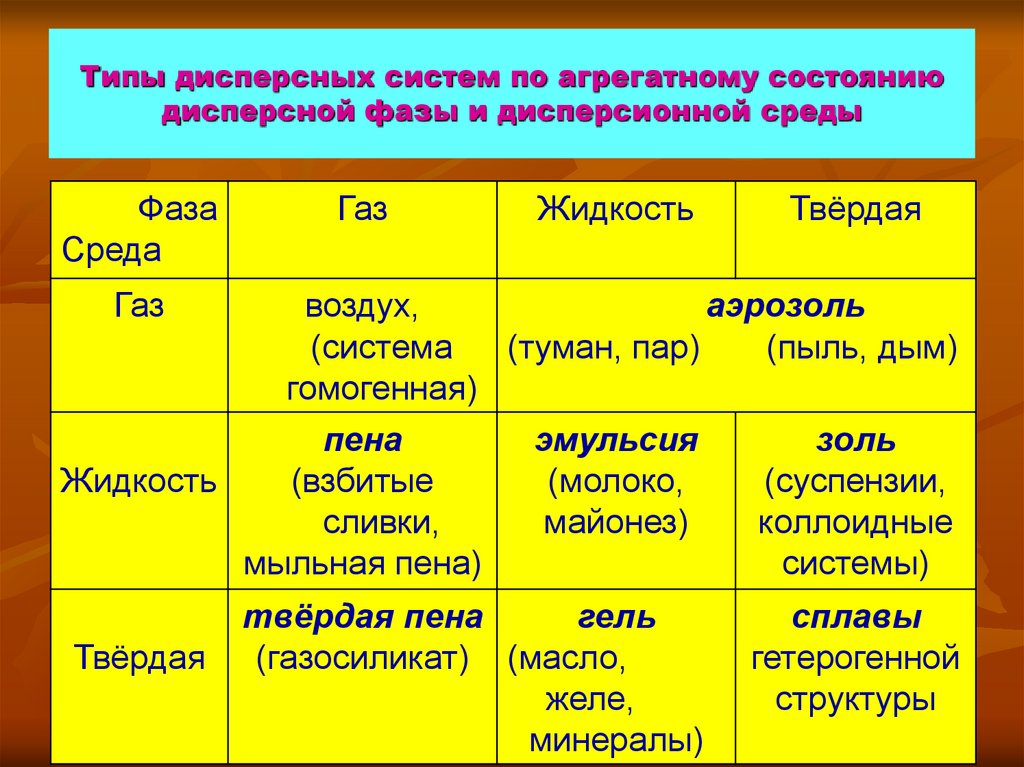
11. Типы дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
ФазаСреда
Газ
Жидкость
Твёрдая
Газ
воздух,
аэрозоль
(система
(туман, пар)
(пыль, дым)
гомогенная)
пена
эмульсия
золь
Жидкость
(взбитые
(молоко,
(суспензии,
сливки,
майонез)
коллоидные
мыльная пена)
системы)
Твёрдая
твёрдая пена
гель
(газосиликат) (масло,
желе,
минералы)
сплавы
гетерогенной
структуры
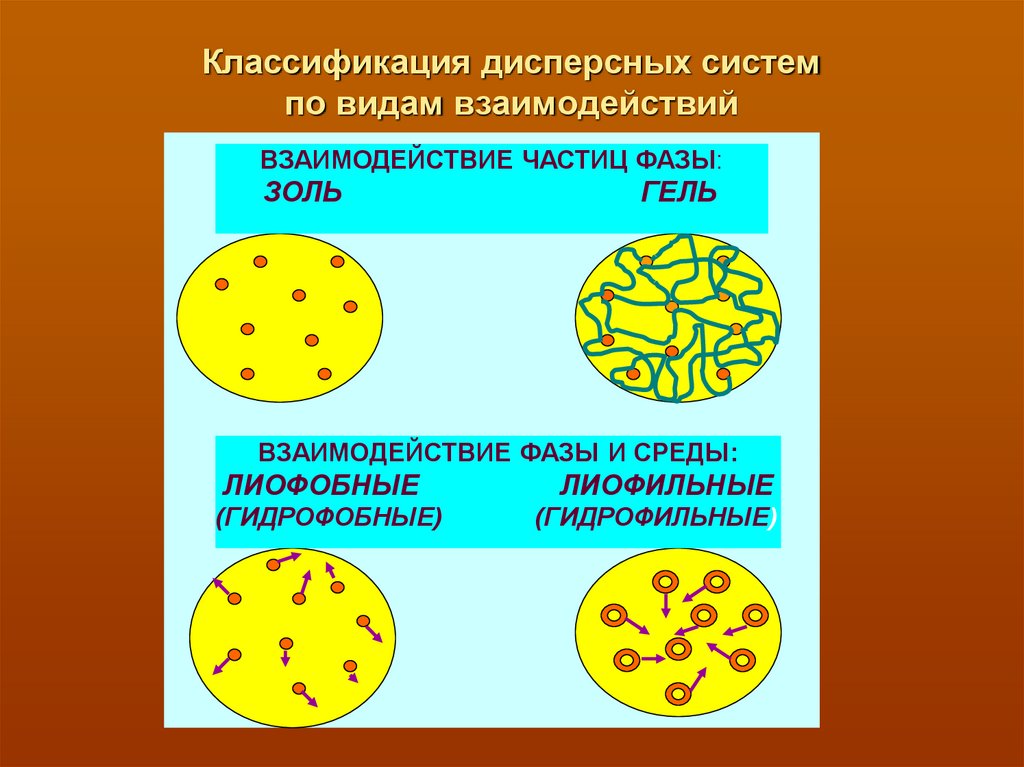
12. Классификация дисперсных систем по видам взаимодействий
ВЗАИМОДЕЙСТВИЕ ЧАСТИЦ ФАЗЫ:ЗОЛЬ
ГЕЛЬ
ВЗАИМОДЕЙСТВИЕ ФАЗЫ И СРЕДЫ:
ЛИОФОБНЫЕ
(ГИДРОФОБНЫЕ)
ЛИОФИЛЬНЫЕ
(ГИДРОФИЛЬНЫЕ)
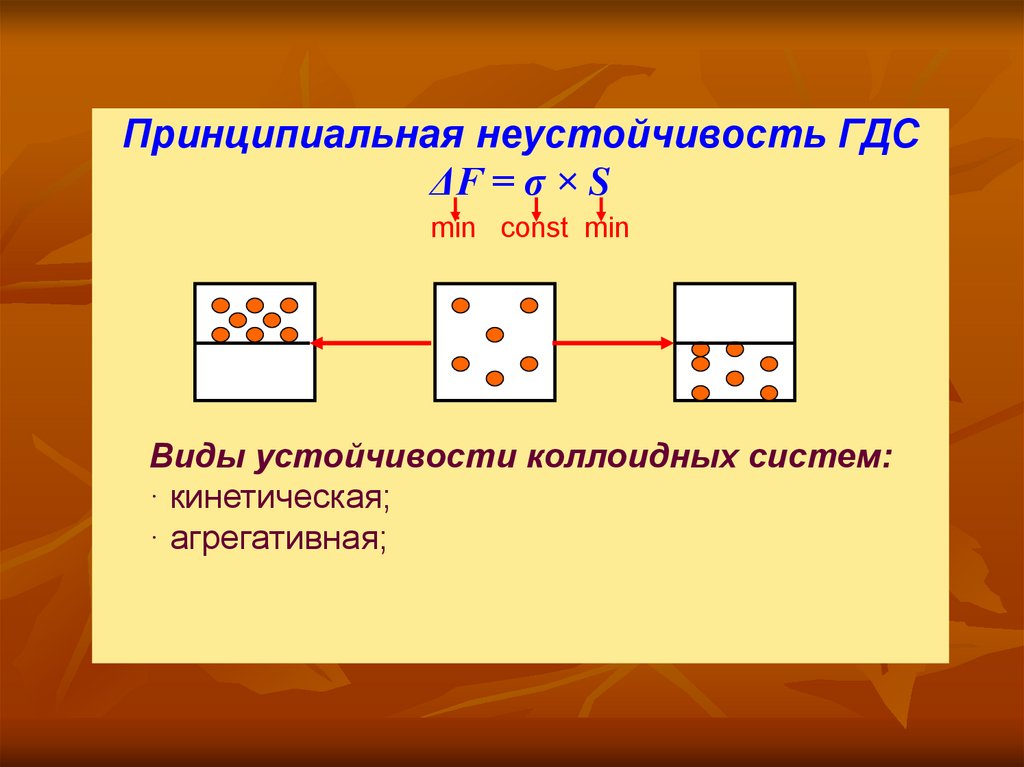
13.
Принципиальная неустойчивость ГДСΔF = σ × S
min const min
Виды устойчивости коллоидных систем:
· кинетическая;
· агрегативная;
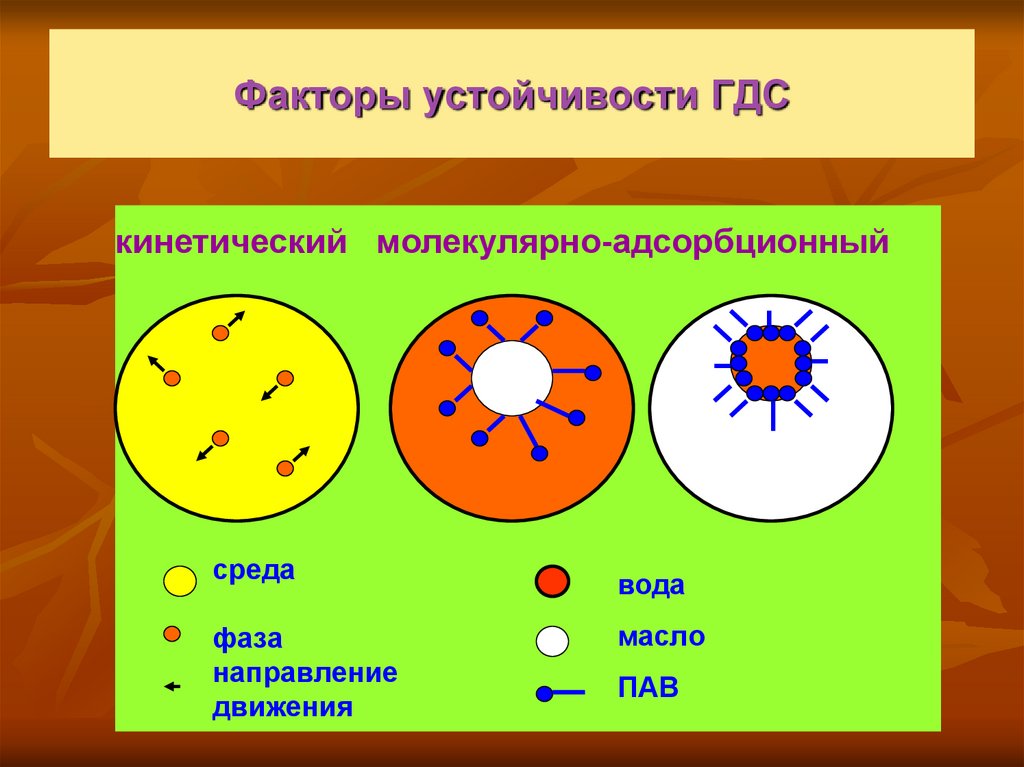
14. Факторы устойчивости ГДС
кинетический молекулярно-адсорбционныйсреда
фаза
направление
движения
вода
масло
ПАВ
15. Реакция получения и схема мицеллы золя сульфата бория
Na2SO4 + BaCl2 → BaSO4 + 2NaCl2Na+ + SO4
избыток
2‾ + Ba2++2Cl‾→BaSO
избыток
избыток
4
+2Na+ + 2Cl‾
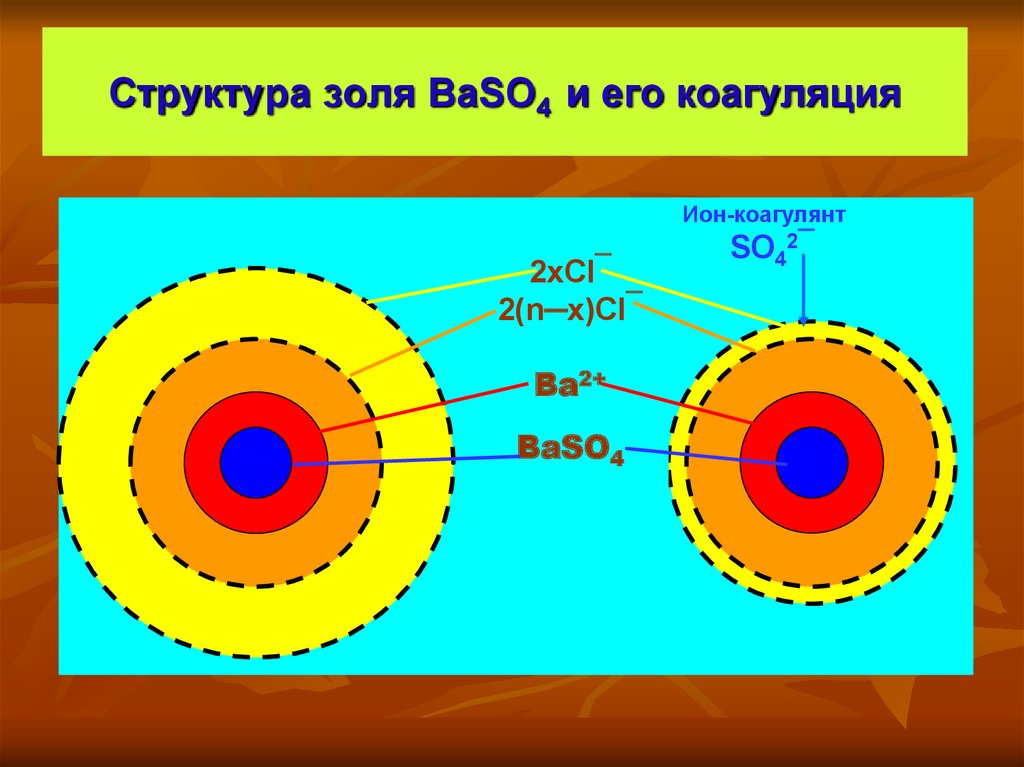
Структура мицеллы
ζ– потенциал
{[(m BaSO4) ∙ n Ba2+ ∙ 2 (n─x) Cl‾ ∙ уH2O ]2х+ + 2x Cl‾ ∙ zH2O }
ядро
потенциаладсорбционный
определяющие
слой
ионы
противоионов
[….......... коллоидная частица ……………………. ]
диффузный
слой
противоионов
{ ________________________ мицелла ______________________ }
16. Структура золя BaSO4 и его коагуляция
Ион-коагулянт2хCl‾
2(n─х)Cl‾
Ba2+
BaSO4
SO42‾



 chemistry
chemistry