Similar presentations:
Степень окисления
1.
Степень окисления8 класс
2.
Электроотрицательность (ЭО)условная величина,
характеризующая
способность атома в
химическом соединении
притягивать к себе
электроны.
3.
Степень окисления (С.О.)это условный заряд атомов
химического элемента в
соединении, если
предположить, что оно
состоит только из ионов.
4.
Ионное соединение5.
• При химическом взаимодействииобщая электронная пара смещена
в сторону более
электроотрицательного атома
• Например:
+1
-1
Н Cl
Заряды +1 и -1 – степени окисления
6.
Степень окисления• Может иметь отрицательное,
положительное или нулевое
значение, которые обычно
ставятся над символом
элемента сверху, например:
7.
Правила определения С.О.1) Отрицательное значение С.О.
имеют атомы, принимающие
электроны от NaF
других
атомов.
→ F (-1)
(Отрицательную степень
окисления имеют только
неметаллы). NaF → F (-1)
8.
Правила определения С.О.2) С.О. Фтора всегда равна (-1)
Например:NaF → F (-1)
9.
Правила определения С.О.3) Положительное значение
С.О. имеют атомы, отдающие
свои электроны другим
атомам. (Положительную
степень окисления имеют
металлы и неметаллы (кроме
F, He, Ne))
10.
Правила определения С.О.4) -Металлы имеют
только положительное
значение С.О.
-У металлов А групп она
совпадает с
валентностью
11.
Правила определения С.О.5)Металлы I-III групп
главных подгрупп имеют
постоянную С.О.: +1, +2,
+3 соответственно, кроме
меди Cu и золота Au
12.
Правила определения С.О.6)Элемент в простом веществе имеет С.О. ,
равную нулю
N2, H2, S8, Cu, O3
и других веществ
Например:
13.
Правила определения С.О.7) С.О. кислорода почти
всегда равна (-2),
+2
кроме O F2 и
-1
пероксидов (Н2О2 )
14.
Правила определения С.О.8) С.О. водорода в
соединениях с неметаллами
равна (+1): +1 -1
Н Cl
с металлами (-1): CaH2, KH, LiH
15.
Правила определения С.О.9) Минимальная
степень окисления =
№ группы – 8:
-3
Например: у N
16.
Правила определения С.О.Алгебраическая сумма С.О.
атомов в соединении всегда
равна нулю:
Например: H3+1P+5O4-2
(+1).3+(+5).1+(-2).4=0
17.
Правила определения С.О.а в сложном ионе –
заряду иона:
+6
-2
Например: [Cr2 O7 ]
(+6).2+(-2).7=-2
18.
• Валентность – это числосвязей,
• Степень окисления –
условный заряд атомов
• Степень окисления не
всегда численно совпадает
с валентностью
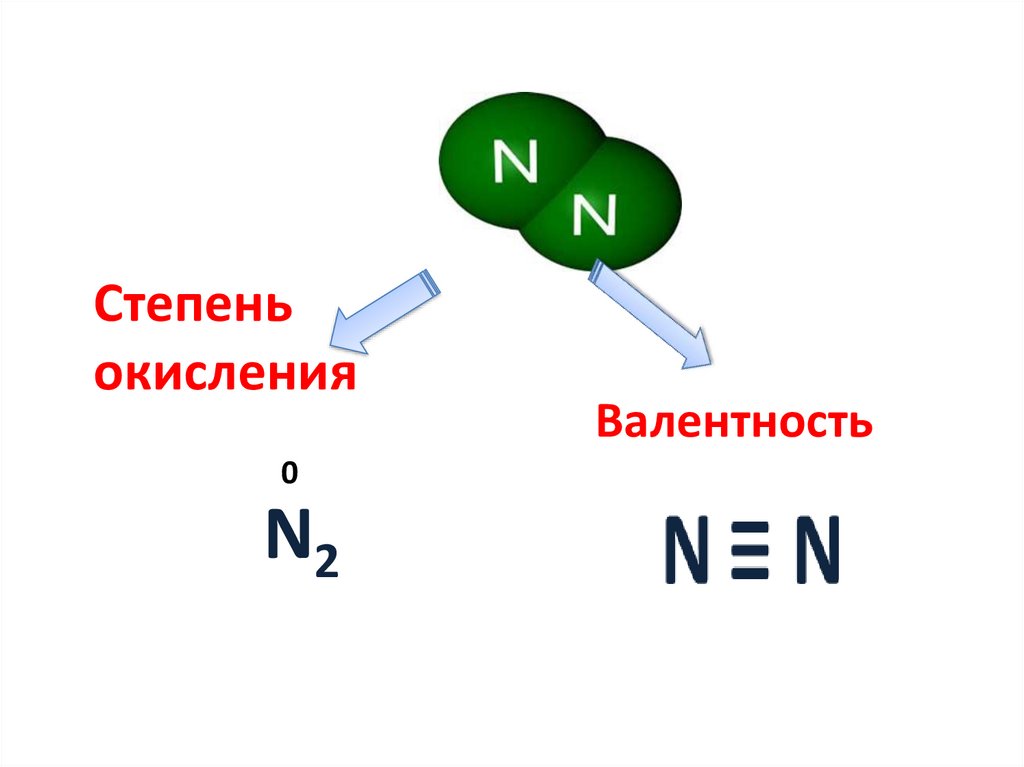
19.
Степеньокисления
0
N2
Валентность
20.
Источники• Варавва Н.Э. Химия в схемах и
таблицах /Н.Э.Варавва.- М.: Эксмо,
2014.- 208 с.- (Наглядно и доступно).
• Габриелян О.С. Химия. 8 класс:учеб.
Для общеобразоват. учреждений/
О.С.Габриелян.- 15-е изд., стереотип.М.: Дрофа, 2009.- 270 (2) с.:ил.
21.
Домашнее задание•П.17 Упр.1,2 с.90
•Задачи 5,6 с.91
22.
• Автор: Калитина Тамара Михайловна• Место работы: МБОУ СОШ №2 с.АлександровГай Саратовской области
• Должность: учитель химии.
• Дополнительные сведения: сайт
http://kalitina.okis.ru/
• Мини-сайт http://www.nsportal.ru/kalitinatamara-mikhailovna





















 chemistry
chemistry








