Similar presentations:
Степень окисления
1. Степень окисления
2. Определите химическую связь для веществ
Определите химическуюН связь для веществ
2
НСl
NаСl
Са
• ионная
• ковалентная неполярная
• ковалентная полярная
• металлическая
3. Степень окисления.
• Степень окисления - это условныйзаряд атомов, вычисленный из
предположения, что вещество состоит
только из ионов.
4.
Степень окисления.• порядок выставления с. о. в
химических формулах: вверху над
символом элемента, причем вначале
пишется заряд («+» или «-»), а затем
число (1, 2, 3).
• Nа2+1S -2, Н2+10-2, Сl2°.
5.
25/12/231. На первом месте находится элемент с положительной
степенью окисления.
2. На последнем месте находится элемент с отрицательной
степенью окисления.
+1
H2 O
-2
6. Правила для определения степени окисления.
Положительная
(положительное
значение с.о.
имеют элементы
с меньшим
значением эо)
Степень окисления
Отрицательная
(отрицательное
значение с.о.
имеют
элементы с
большим
значением эо)
Нулевая
(нулевое значение
с.о. имеют атомы в
молекулах простых
веществ и атомы в
свободном
состоянии)
7. Постоянная степень окисления.
• Уметаллов
степень окисления
всегда положительна и равна номеру
группы
(для
металлов
главных
подгрупп).
1) У металлов I группы С.О.= +1
2) У металлов II группы С.О.= +2
3) У металлов III группы С.О.= +3
8. Постоянная степень окисления
• Степень окисления фтора (F) всегдаравна -1
9. Переменная степень окисления
• Все остальные металлы (кромеперечисленных)
• Почти все неметаллы
10. Переменная степень окисления.
• У атома кислорода (О) степеньокисления равна -2, кроме
соединений со фтором (+2)
+2 -1
ОF2,
и в пероксидах (-1)
-1
Н 2О 2
11. Переменная степень окисления.
• У атома водорода степень окисленияравна +1
+1
-2
Н2О,
Кроме соединений с металлами (-1):
+1
-1
NaH
12. Нулевая степень окисления.
• Степень окисления простых веществи свободных атомов всегда равна
нулю (0):
0
О2
0
Cl2
0
Fe
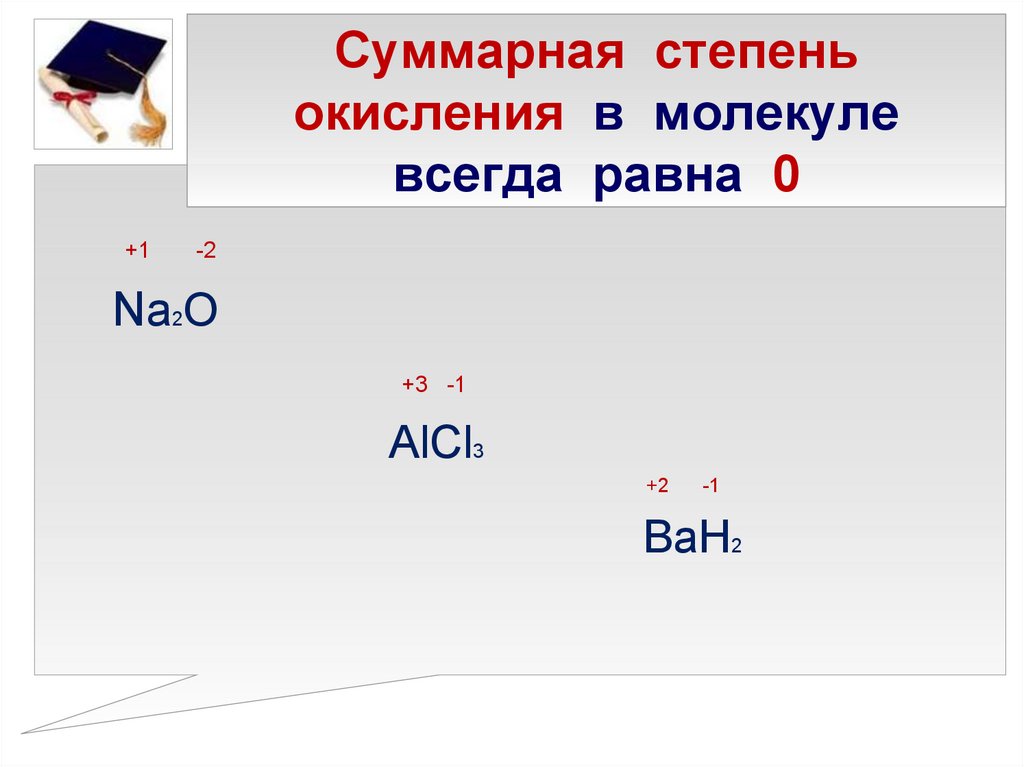
13. Суммарная степень окисления в молекуле всегда равна 0
+1-2
Na2O
+3 -1
AlCl3
+2
-1
BaH2
14.
• Для того, чтобы рассчитать с.о. данногоэлемента в соединении, надо знать с.о.
другого элемента
15. Задание 1: Определить степень окисления в соединениях K2О, AlH3, CaF2
Задание 1: Определить степеньокисления в соединениях K О, AlH3, CaF2
2
+1 -2
K2O
+3 -1
AlH3
+2
-1
CaF2
16. Бинарные соединения.
• Бинарные соединения – этосоединения, состоящие из двух
химических элементов.
17. Бинарные соединения.
• На первом месте всегдазаписывается элемент с
положительной степенью окисления, а
на втором - с отрицательной.
18. Названия бинарных соединений.
• На первом месте в названиибинарного соединения записывается
латинское название элемента с
отрицательной степенью окисления с
суффиксом -ид, а затем название
элемента с положительной степенью
окисления в родительном падеже.
19. Названия бинарных соединений.
Названия элементов с отрицательнойстепенью окисления:
Cl ОНSNPСBr -
хлорид
оксид
гидрид
сульфид
нитрид
фосфид
карбид
бромид
20. Задание 2: назвать бинарные соединения, формулы которых даны.
+1-1
NaCl -
Хлорид натрия
+2 -1
SCl2 +2
-2
CuO –
+1
Хлорид серы (II)
Оксид меди (II)
-2
Cu2O -
Оксид меди (I)
Численное значение
степени окисления
для элементов с
переменной степенью
окисления.
21. Составление формул бинарных соединений по названию.
оксид углерода (IV).1) Записать
символы
химических
элементов образующих соединение:
СО
22. Составление формул бинарных соединений по названию.
оксид углерода (IV).2) Над атомами химических элементов
в соединении проставить их степени
окисления (в скобках указана
переменная степень окисления
элемента – она положительна):
+4
-2
СО
23. Составление формул бинарных соединений по названию.
3) Найти наименьшее общее кратноемежду значениями степеней
окисления:
4
+4 -2
СО
24. Составление формул бинарных соединений по названию.
4) Определить индексы, разделив НОКна значения степеней окисления
каждого элемента.
4
+4 -2
СО 2
Индекс «1» не пишут
СО2
- оксид углерода (IV)
25. Задание 3: Составить формулы веществ по названиям.
• Сульфид лития -Li2S
• Оксид серы (IV) -
SO2
• Оксид азота (V) –
N 2O 5
• Оксид железа (III) - Fe2O3
26. Домашнее задание:
• § 17• Назвать вещества:
NO, N2O, N2O3, PCl3, PCl5, CuCl2.
• Составить формулы веществ по
названиям:
1) хлорид кальция
2) оксид хрома (VI)
3) сульфид железа (II)
27. Источники материалов.
• Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольнаякнига учителя химии. 8 класс. Дрофа, 2002 г.
• Габриелян О.С. Химия 8 класс. Учебник для
общеобразовательных учреждений.
• Ким Е.П. Химия. 8 класс. Тесты: В 2 ч. – Саратов: Лицей, 2011. –
Ч.1.


























 chemistry
chemistry








