Similar presentations:
Галогены. Галогеноводородные кислоты и их соли
1.
2.
3.
Бернар Куртуа4.
Тема урока : ГАЛОГЕНЫ.ГАЛОГЕНОВОДОРОДНЫЕ
КИСЛОТЫ И ИХ СОЛИ.
5.
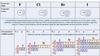
Атомы галогеновF Cl Br
I
6.
Строение атомов галогенов) 2)7 1s22s22p5
1s⇅ 2s ⇅ 2p ⇅⇅↑
17 Cl +17 )2)8)7 1s22s22p53s23p53d0
1s⇅ 2s ⇅ 2p ⇅⇅⇅ 3s ⇅ 3p⇅⇅↑
35 Br +35 )2)8)18)7 ………4s2 4p5
………………………………4s ⇅ 4p⇅⇅↑
53 I +53 )2)8)18)18)7 …..5s25p5
……………………………….5s ⇅ 5p⇅⇅↑
9F
+9
7.
Строение атомов галогенов) 2)7 1s22s22p5
1s⇅ 2s ⇅ 2p ⇅⇅↑
17 Cl +17 )2)8)7 1s22s22p53s23p53d0
1s⇅ 2s ⇅ 2p ⇅⇅⇅ 3s ⇅ 3p⇅⇅↑
35 Br +35 )2)8)18)7 ………4s2 4p5
………………………………4s ⇅ 4p⇅⇅↑
53 I +53 )2)8)18)18)7 …..5s25p5
……………………………….5s ⇅ 5p⇅⇅↑
9F
ОКИСЛИ
ТЕЛЬНАЯ
СПОСОБ
НОСТЬ
УСИЛИВ
АЕТСЯ
+9
8.
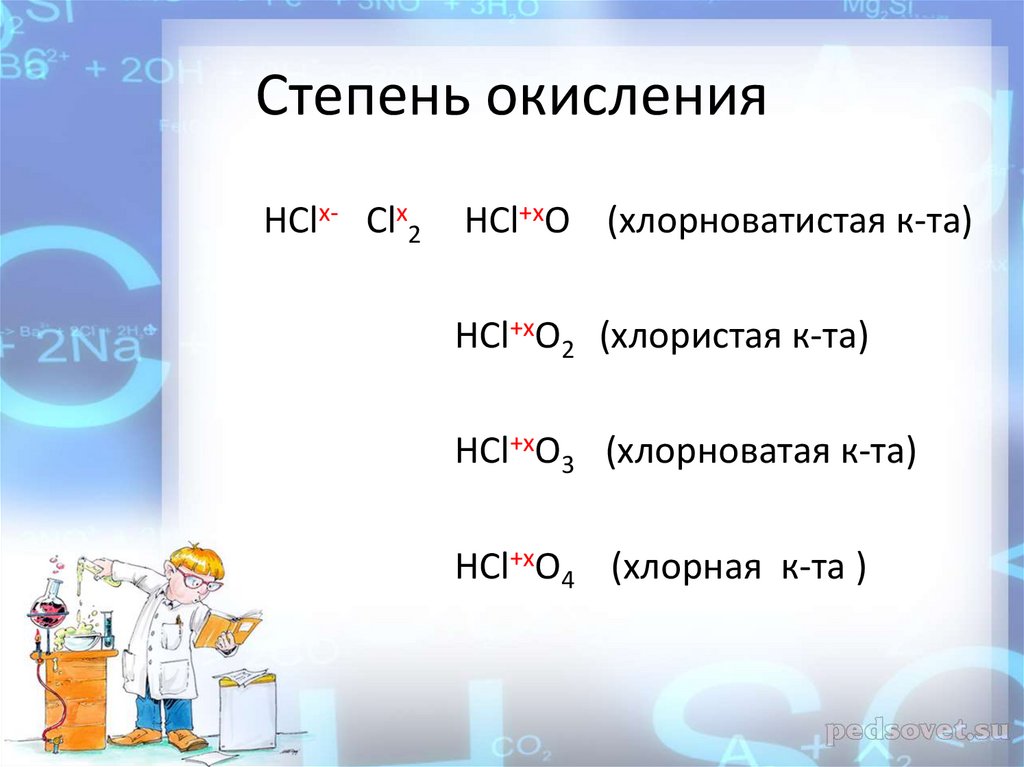
Степень окисления-1 0 +1 +3 +5 +7
9.
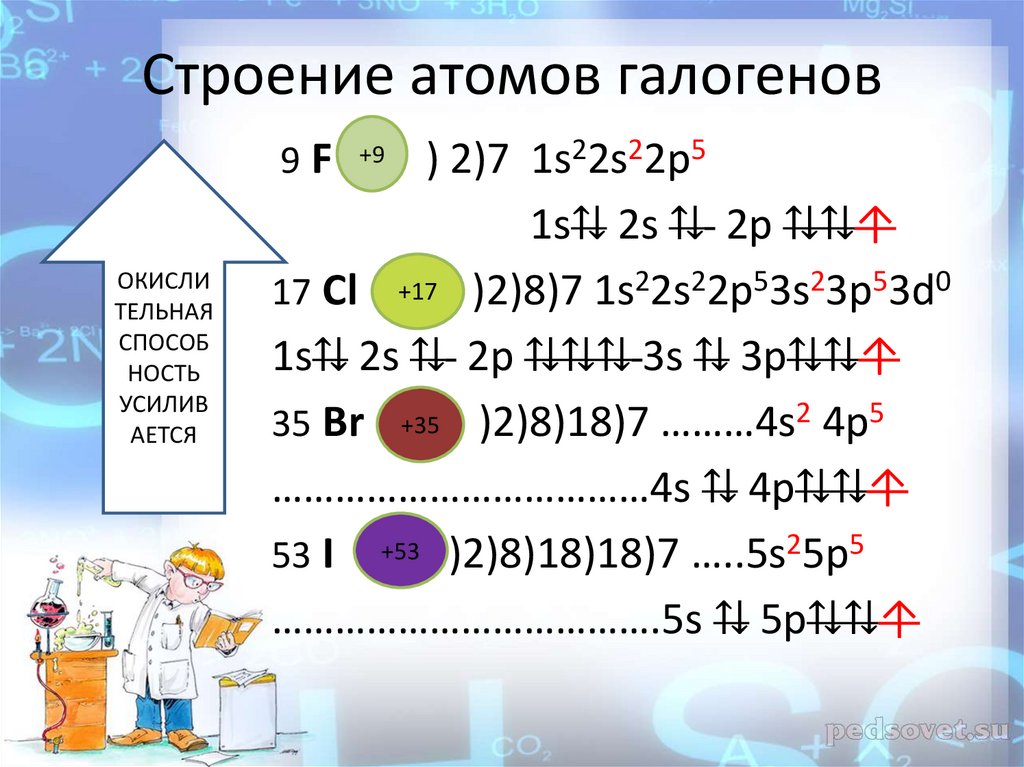
Строение внешних энергетическихуровней
Cl … ……..3s23p53d0
10.
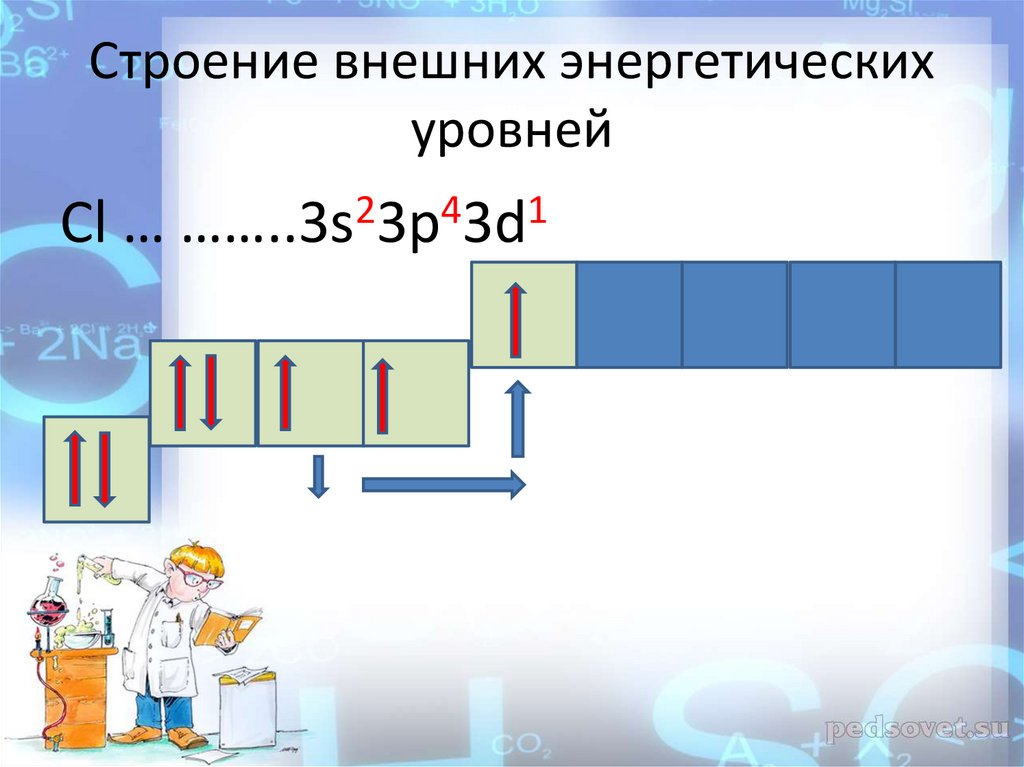
Cтроение внешних энергетическихуровней
Cl … ……..3s23p43d1
11.
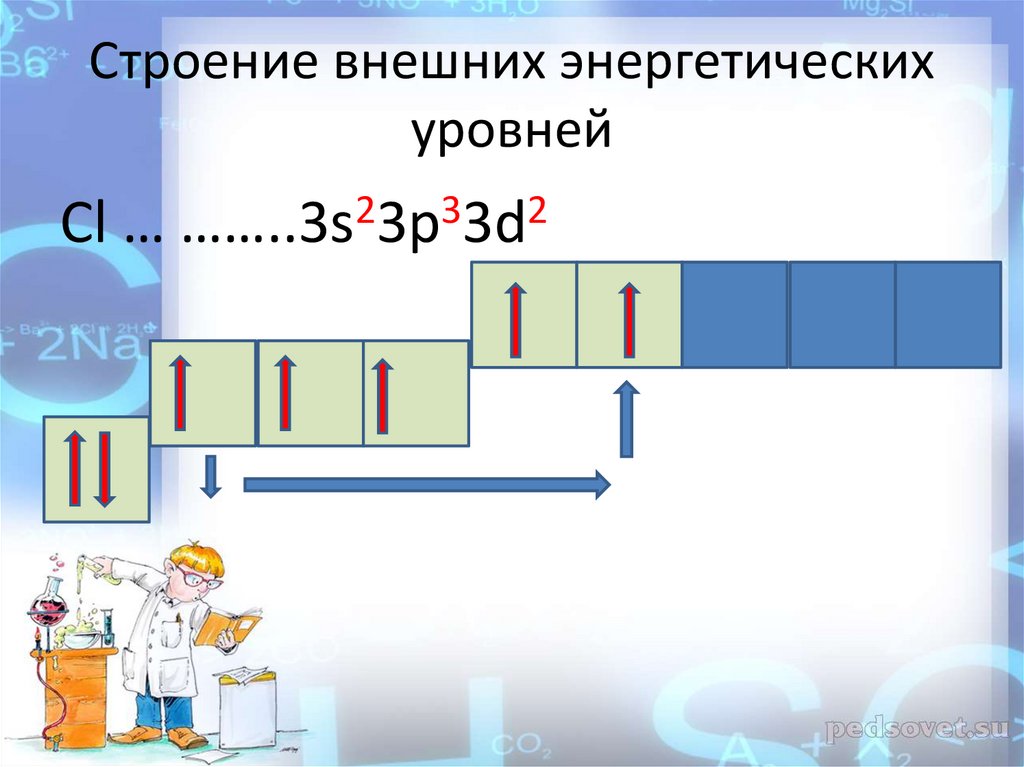
Cтроение внешних энергетическихуровней
Cl … ……..3s23p33d2
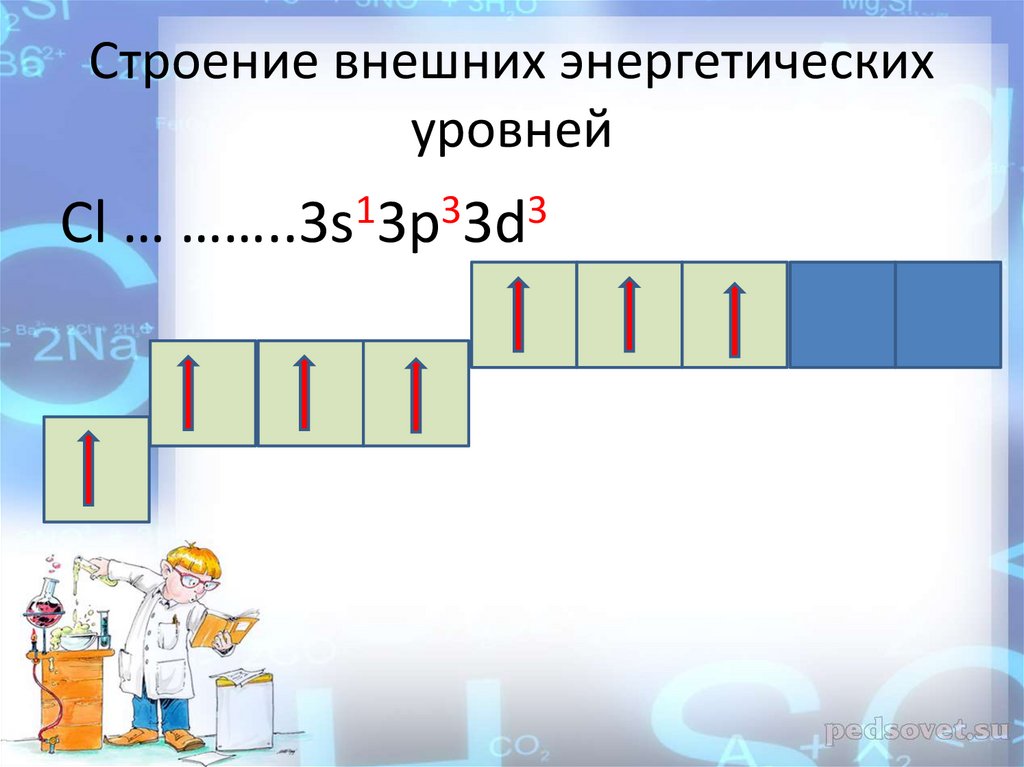
12.
Cтроение внешних энергетическихуровней
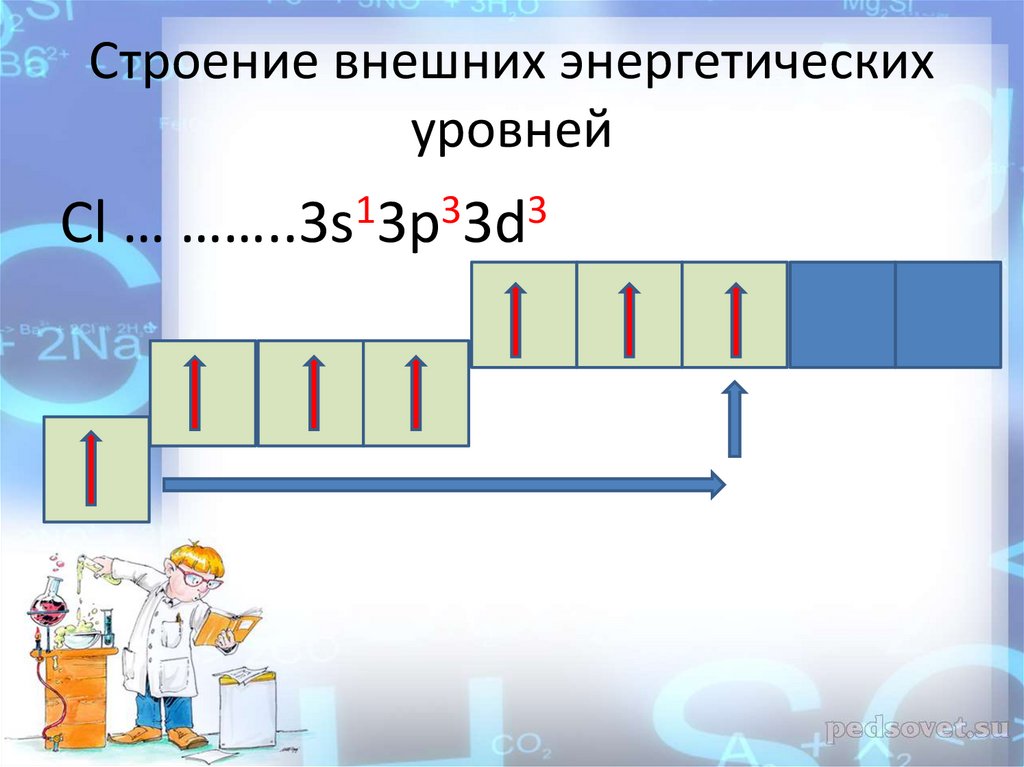
Cl … ……..3s13p33d3
13.
Cтроение внешних энергетическихуровней
Cl … ……..3s13p33d3
14.
Степень окисленияHClх- Clх2
HCl+хO (хлорноватистая к-та)
HCl+хO2 (хлористая к-та)
HCl+хO3 (хлорноватая к-та)
HCl+хO4 (хлорная к-та )
15.
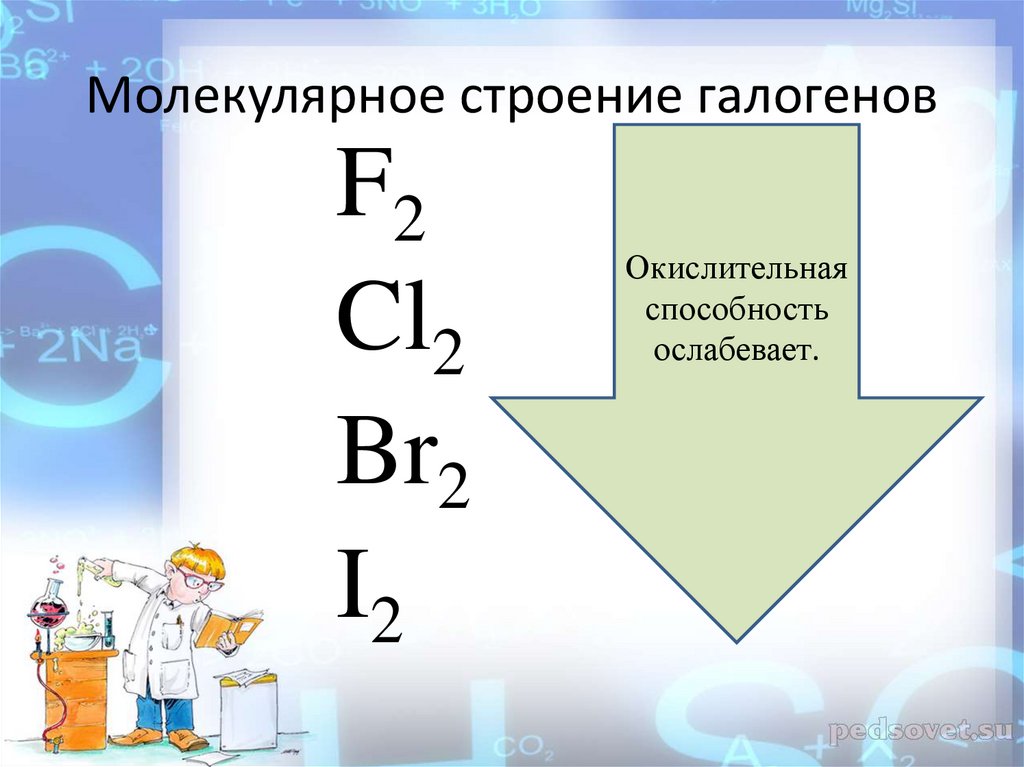
Молекулярное строение галогеновF2 Cl2 Br2
I2
16.
Молекулярное строение галогеновF2
Cl2
Br2
I2
Окислительная
способность
ослабевает.
17.
Взаимодействие с металламиF20 + Zn0 = Zn+2F23Cl20 + 2Fe0 = 2Fe+3Cl3-(t)
Br20 + Cu0 = Cu+2Br2 - (t)
0
0
+3
3I2 + 2Al = 2Al I3 (t)
18.
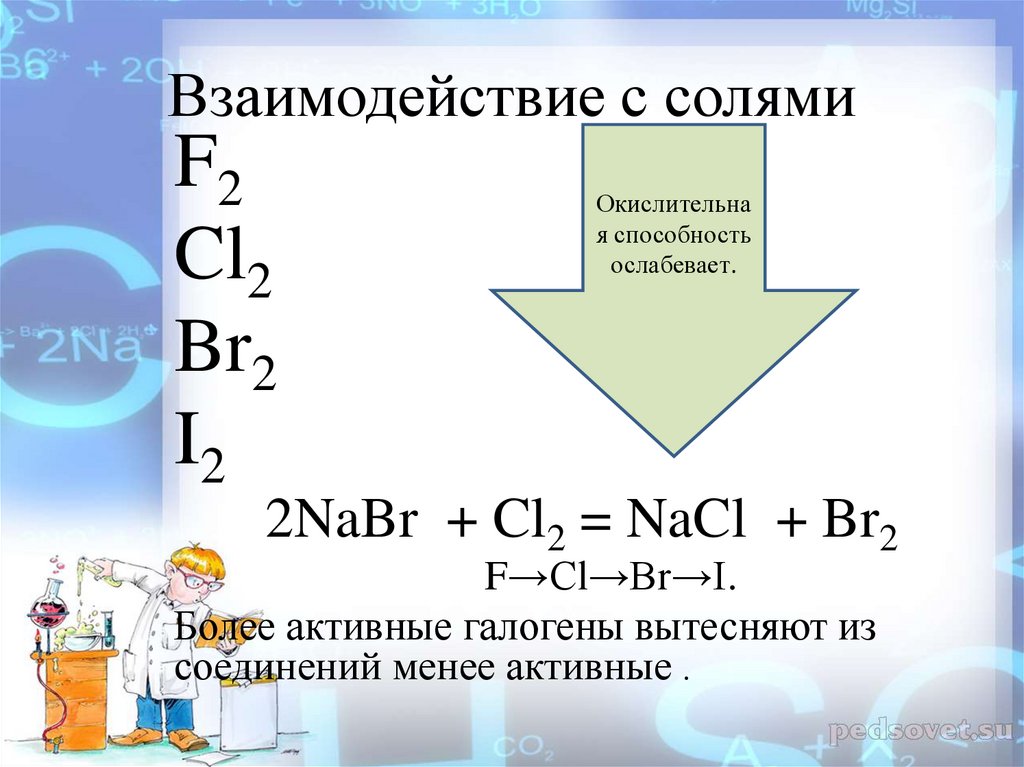
Взаимодействие с солямиF2
Cl2
Br2
I2
Окислительна
я способность
ослабевает.
2NaBr + Cl2 = NaCl + Br2
F→Cl→Br→I.
Более активные галогены вытесняют из
соединений менее активные .
19.
Взаимодействие фтора с водой.0
2F2 + 2H2O =
4HF
+ O2
0
20.
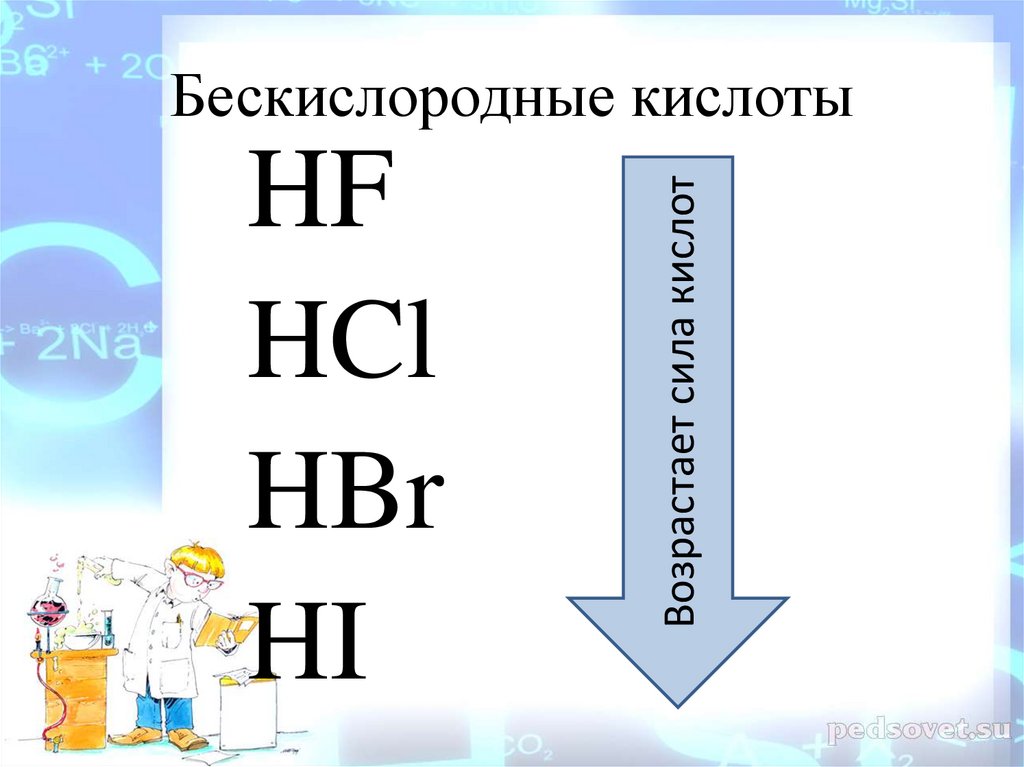
Бескислородные кислотыHF
HCl
HBr
HI
21.
Бескислородные кислотыHF –фтороводородная(плавиковая)к-та
HCl –хлороводородная (соляная) к- та
HBr – бромоводородная к-та
HI – иодоводородная к-та
22.
HFHCl
HBr
HI
Возрастает сила кислот
Бескислородные кислоты
23.
Качественные реакции на хлорид-, бромиди йодид-ионыГалогенид-ионы можно определить с помощью нитрата серебра AgNO3.
1) Приготовьте пробирки с иодидом калия KI, бромидом калия КBr,
хлоридом натрия NaCl.
2) Добавьте нитрат серебра , в каждую пробирку. (Что наблюдаете?)
3) Запишите продукты реакции. Дайте им названия.
• NaCl + AgNO3 = NaNO3 + ______ ↓ (___________________________)
• КBr + AgNO3 = КNO3 +
• KI + AgNO3 = KNO3 +
______↓ (___________________________)
_______↓ (___________________________)
24.
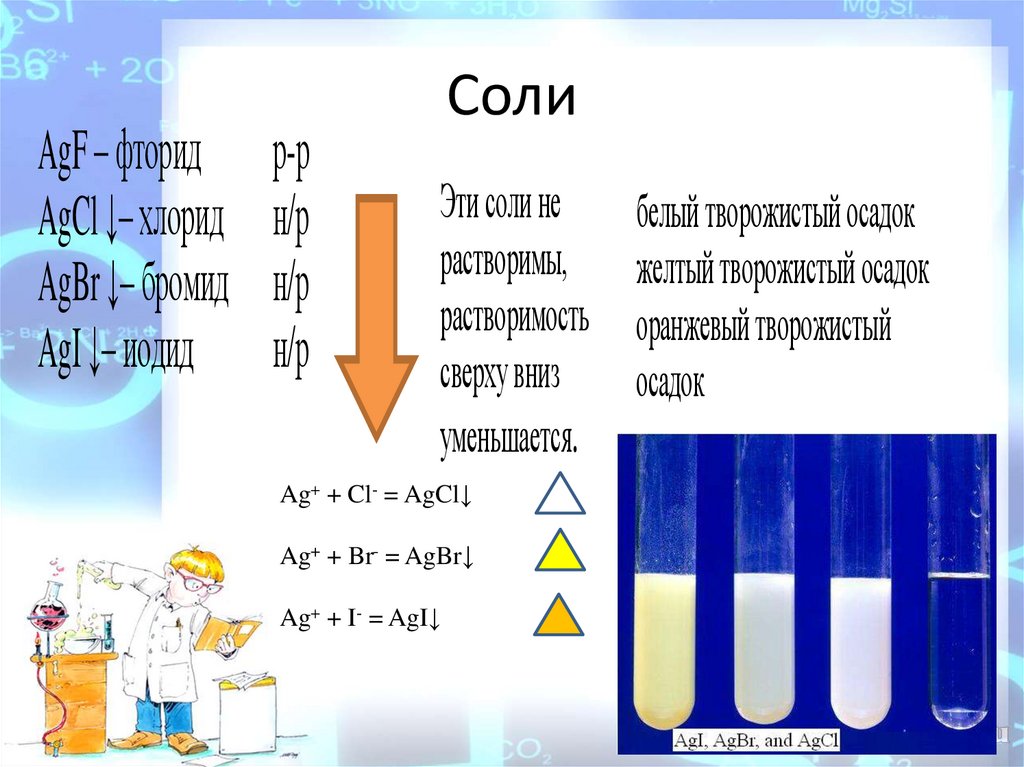
AgF – фторидAgCl ↓– хлорид
AgBr ↓– бромид
AgI ↓– иодид
р-р
н/р
н/р
н/р
Соли
Эти соли не
растворимы,
растворимость
сверху вниз
уменьшается.
Ag+ + Cl- = AgCl↓
Ag+ + Br- = AgBr↓
Ag+ + I- = AgI↓
белый творожистый осадок
желтый творожистый осадок
оранжевый творожистый
осадок
25.
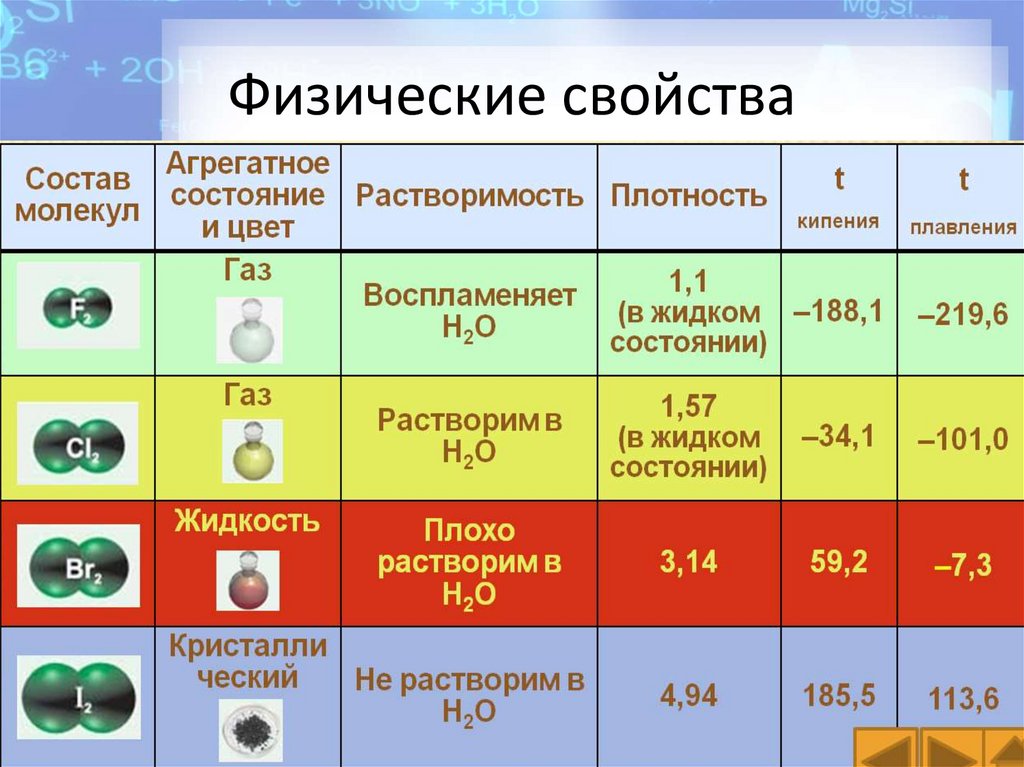
Физические свойства• F2 – светло – зеленый газ, ядовит, имеет резкий
раздражающий , не приятный запах
• Cl2 – желто – зеленый газ, ядовит , имеет резкий
удушающий, не приятный запах
• Br2 – жидкость, летучая, тяжелая, красно – бурая ,
ядовитая
• I2 – фиолетовое, твердое кристаллическое
вещество, с металлическим блеском, летучие, в
воде не растворимое, подвергается сублимации.
26.
КВЕСТ27.
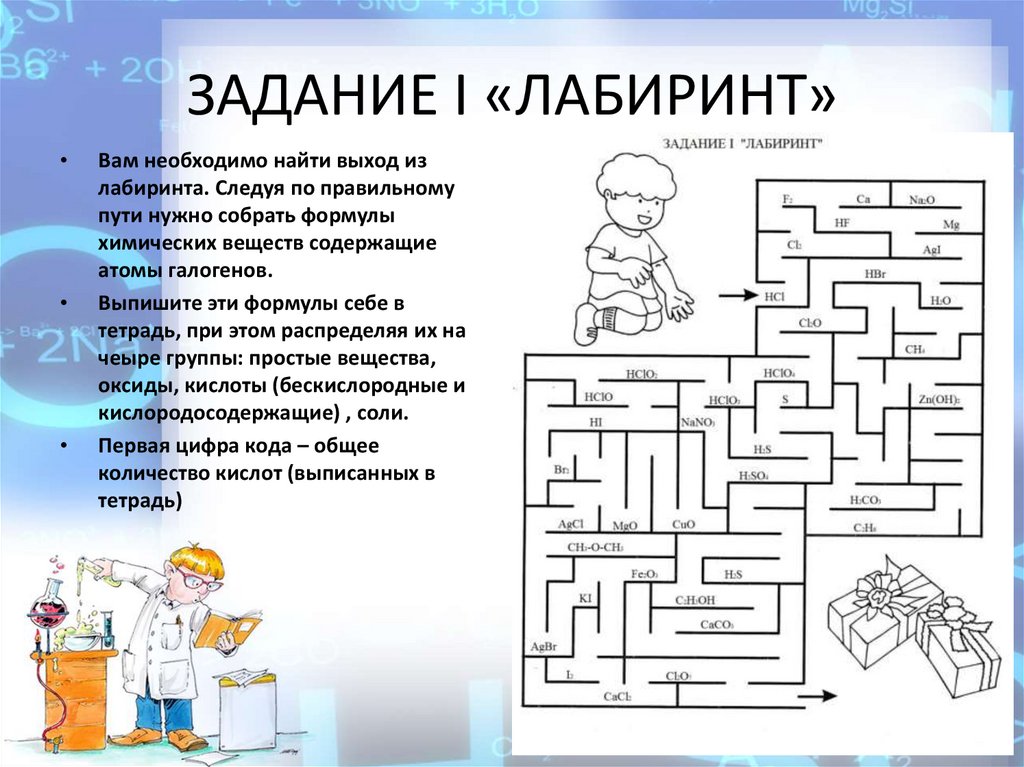
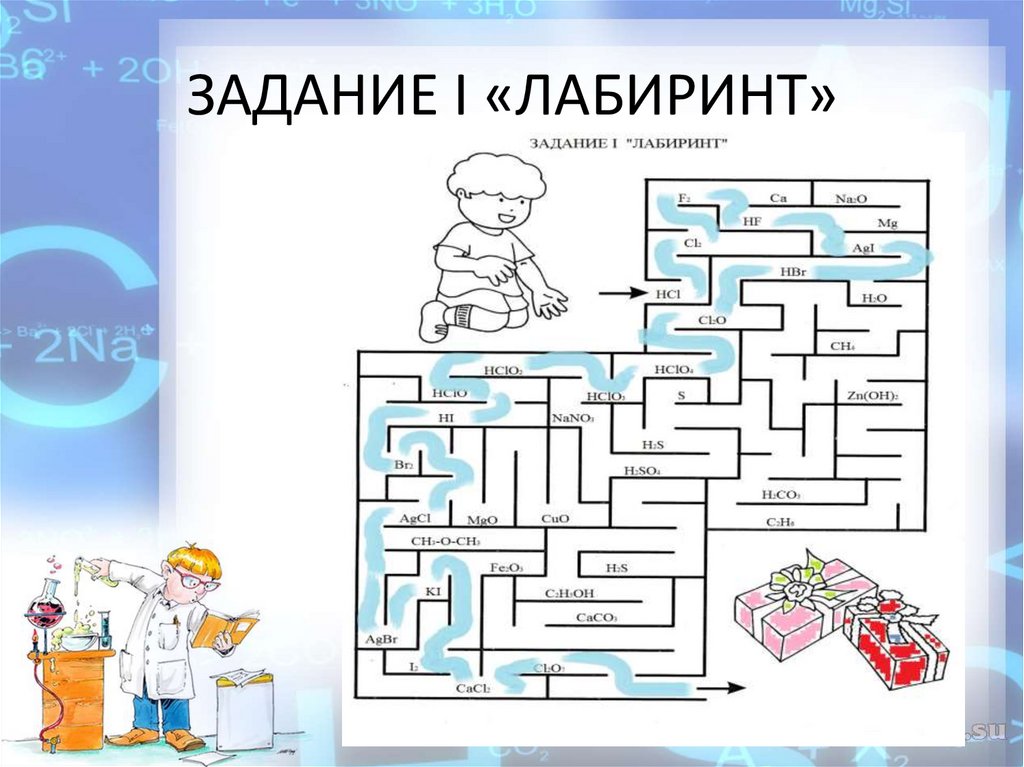
КВЕСТ – ИГРА по химии « В поисках кода! ».
Вам необходимо найти выход из лабиринта. Следуя по правильному пути
нужно собрать формулы химических веществ содержащие атомы галогенов.
Выпишите эти формулы себе в тетрадь, при этом распределяя их на 4 группы:
простые вещества, оксиды, кислоты (бескислородные и
кислородосодержащие) , соли.
Простые вещества
ЗАДАНИЕ I «ЛАБИРИНТ» (приложение 2)
Первая цифра кода – общее количество кислот (выписанных в тетрадь) запиши
цифру _______
ЗАДАНИЕ II «КРОССВОРД» (приложение 3)
Запишите получившуюся цифру по вертикали ______
ЗАДАНИЕ III «ЗНАЙКА» (приложение 4)
Ответь на все вопросы по порядку, ответ запиши соблюдая
последовательность ______________________
ЗАДАНИЕ IV «ОПЫТ» (приложение 5)
Распознай вещества А ,В, С , составь уравнения реакций. Запиши коэффициент
перед восстановителем __________
Код – это полученная последовательность цифр ______________________
28.
ЗАДАНИЕ I «ЛАБИРИНТ»Вам необходимо найти выход из
лабиринта. Следуя по правильному
пути нужно собрать формулы
химических веществ содержащие
атомы галогенов.
Выпишите эти формулы себе в
тетрадь, при этом распределяя их на
чеыре группы: простые вещества,
оксиды, кислоты (бескислородные и
кислородосодержащие) , соли.
Первая цифра кода – общее
количество кислот (выписанных в
тетрадь)
29.
ЗАДАНИЕ I «ЛАБИРИНТ»30.
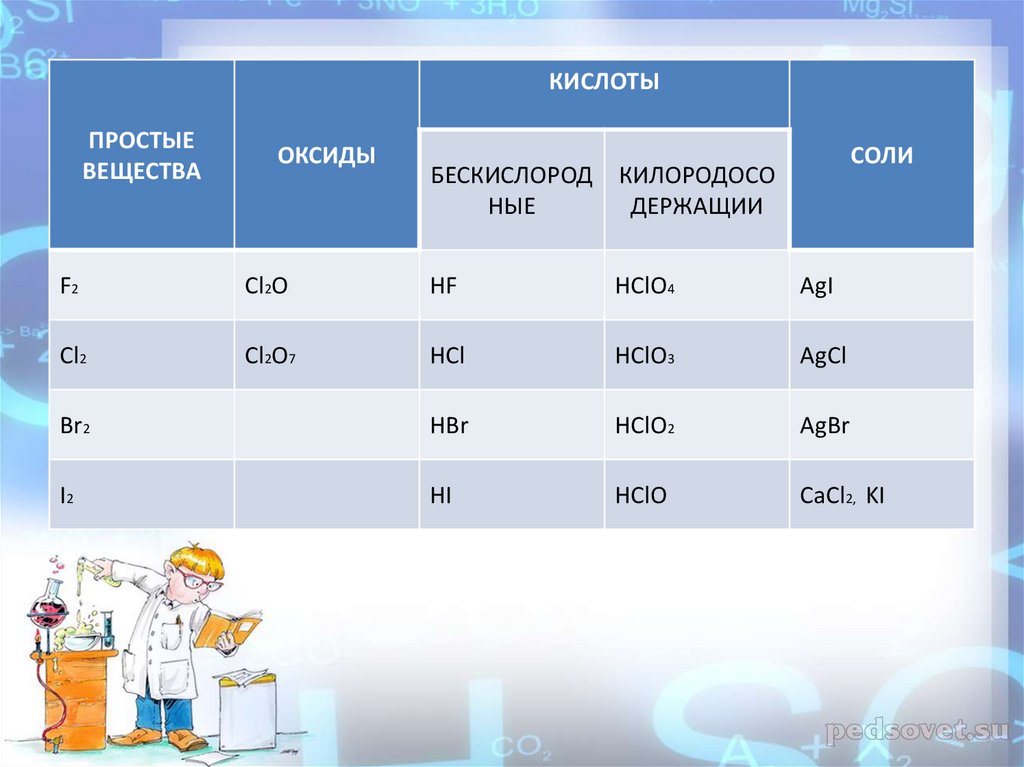
КИСЛОТЫПРОСТЫЕ
ВЕЩЕСТВА
ОКСИДЫ
БЕСКИСЛОРОД
НЫЕ
КИЛОРОДОСО
ДЕРЖАЩИИ
СОЛИ
F2
Cl2O
HF
HClO4
AgI
Cl2
Cl2O7
HCl
HClO3
AgCl
Br2
HBr
HClO2
AgBr
I2
HI
HClO
CaCl2, KI
31.
ЗАДАНИЕ II «КРОССВОРД»1
2
3
4
5
6
1) Этот элемент занимает две
«квартиры» в Периодической системе
Д.И.Менделеева?
2) Это самый электроотрицательные
химический элемент?
3) Первое название галогенов?
4) Если химический элемент
восстановился , значит он - ___?
5) Н – неметалл, Na - _________?
6)Степень окисления у простых
веществ?
32.
водородфт о р
с оле роды
о кис лит е ль
ме т а л л
ноль
33.
ЗАДАНИЕ III «ЗНАЙКА»• Семь электронов на внешнем уровне в атоме
Число протонов в ядре атома фтора
Схема распределения электронов по уровням 2,8,7
соответствует атому
34.
ЗАДАНИЕ III «ЗНАЙКА»• Семь электронов на внешнем
уровне в атоме
• Число протонов в ядре атома
фтора
• Схема распределения электронов
по уровням 2,8,7 соответствует
атому
35.
ЗАДАНИЕ IV «ОПЫТ»• Простое газообразное вещество
А желто-зеленого цвета с резким
запахом реагирует с металлом В
красного цвета с образованием
соли С. При действии щелочи на
водный раствор соли вделается
голубой студенистый осадок.
Напиши уравнения реакции.
36.
Сl2 + Cu = CuCl2CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
37.
КОД ЗАМКА•882241
























 chemistry
chemistry