Similar presentations:
Адсорбация ПАВ на границе раствор - газ
1. Лекция 2
Адсорбция ПАВ награнице раствор – газ.
2.
Поверхностное натяжение как результат асимметриисил когезии на поверхности
Поверхностное натяжение жидкостей вызывает образование
капель и связано с силами притяжения между молекулами
(рис.1, а).
Эти силы притяжения вызывают конденсацию пара в
жидкость.
По природе это дисперсионные, диполь - дипольные и
индукционные взаимодействия, а также водородные
связи.
В объеме жидкости молекулы подвергаются действию этих сил
притяжения со всех сторон, в то время как для молекулы на
поверхности такое притяжение в одном направлении
отсутствует. Такая асимметрия обусловливает возникновение
поверхностной энергии и проявляется в поверхностном
натяжении. Таким образом, поверхностное натяжение является
прямым следствием сил когезии в жидкости.
3.
Взаимодействие молекул в поверхностном слоепроисходит в нескомпенсированном силовом поле.
Молекулы стремятся уйти с поверхности в объем, так
как равнодействующие межмолекулярных сил,
действующих на молекулу в поверхностном поле ≠0. При
увеличении поверхности происходит вывод молекул из
объёма на поверхность, при этом затрачивается работа
против сил межмолекулярного взаимодействия.
Эта работа равна увеличению поверхностной энергии
Fs
1. Поверхностное натяжение - это
обратимая изотермическая работа
образования единицы поверхности, которая
затрачивается на преодоление сил
межмолекулярного взаимодействия и
переходит в свободную поверхностную
энергию
4.
Фундаментальное уравнение Гиббса для плоскогоповерхностного слоя
2.
Удельная свободная энергия поверхностного слоя
3.
Изохорные функции
Изобарные функции
σ- сила, действующая на единицу длины контура,
направленная тангенциально к поверхности и стремящаяся
её сократить.
5.
Поверхностное натяжение (в мН/м)для некоторых жидкостей при 25 °С
Вода 72
Этанол 22
Хлороформ 27
Бромоформ 45
н-Гексан 18
«-Октан 22
н-Додекан 25
н-Гексадекан 27
Диэтиловый эфир 17
Ртуть 480
6.
Методы измерения поверхностного натяженияРавновесное поверхностное натяжение
1. К простым способам измерения поверхностного натяжения
относится метод кольца дю Нуи. Платиновое кольцо притапливают в
жидкости, и измеряется сила, необходимая для вытягивания кольца
через поверхность (рис.2, а). При измерении σ методом отрыва кольца
(тензиометрическим) расчет проводят по формуле:
х
cт х
ст
,
Вместо кольца можно использовать платиновую пластинку. Измеряют
силу втягивания пластинки в жидкость, эта сила зависит от краевого
угла смачивания пластины жидкостью (рис.2,6).
2. Очень простым методом измерения поверхностного натяжения
является измерение подъема смачивающих жидкостей в капиллярах
(рис. 2.,в). Высота подъема h прямо пропорциональна
поверхност¬ ному натяжению согласно уравнению
σ = rhpg/2,
где г—радиус капилляра, р — плотность жидкости, g — ускорение
свободного падения. Это уравнение справедливо только для
жидкостей, идеально смачивающих стенки капилляра, т. е. когда
краевой угол смачивания равен нулю.
7.
3. Одним из наиболее распространенных методов измеренияповерхностного
натяжения
являются
сталагмометрический
и
тензиометрический методы. Сталагмометрический метод основан на том, что
в момент отрыва капли от нижнего конца вертикальной трубки вес капли
уравновешивается
силой
поверхностного
натяжения.
Величину
поверхностного натяжения рассчитывают по формуле:
k 2 r
,
V g
n
где r – внутренний радиус трубки, k – константа прибора, V – объем расширенной
части сталагмометра, ρ – плотность жидкости, n – число капель.
В случае относительного определения σ расчет проводят по формуле:
х ncт
х cт
ст nх
8.
В некоторых системах равновесное состояние устанавливается оченьдолго, и измерения поверхностного натяжения в этих случаях
занимают длительное время. К таким системам относятся растворы
высокомолекулярных ПАВ.
4. Для подобных систем приемлемым методом измерения является
метод висящей капли (рис. 16.11, г). Мерой поверхностного натяжения в
этом случае служит форма капли; капли, близкие к сферическим,
образуются из жидкостей с большим поверхностным натяжением,
удлиненные капли образуются из жидкостей с низким поверхностным
натяжением. Этот метод пригоден также для измерения межфазного
натяжения между двумя взаимно нерастворимыми жидкостями.
9.
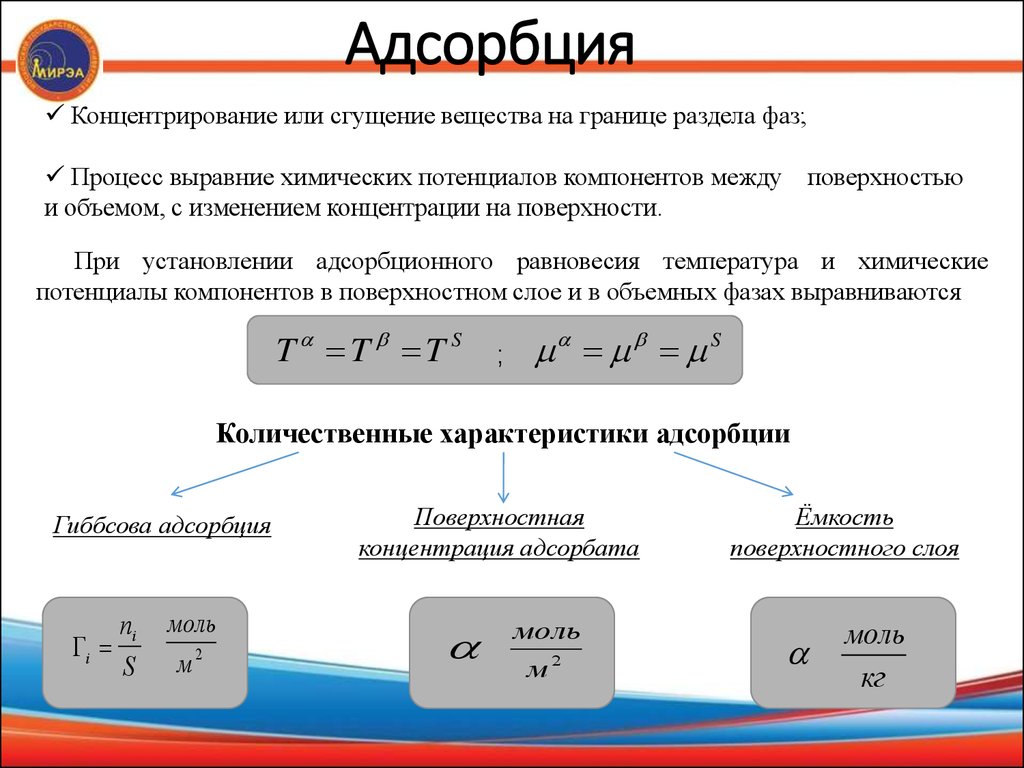
10. Адсорбция
Концентрирование или сгущение вещества на границе раздела фаз;Процесс выравние химических потенциалов компонентов между поверхностью
и объемом, с изменением концентрации на поверхности.
При установлении адсорбционного равновесия температура и химические
потенциалы компонентов в поверхностном слое и в объемных фазах выравниваются
T T T S
;
S
Количественные характеристики адсорбции
Гиббсова адсорбция
ni
i
S
моль
м2
Поверхностная
концентрация адсорбата
моль
м2
Ёмкость
поверхностного слоя
моль
кг
11.
ВЫВОД АДСОРБЦИОННОГО УРАВНЕНИЯ ГИББСА- выражает количественную связь адсорбции с поверхностным натяжением
Запишем фундаментальное уравнение Гиббса для плоского поверхностного слоя
dF ds S dT i dni
S
S
введем внутреннюю энергию поверхностного слоя
продифференцируем это уравнение
приравняем правые части
S
(1)
F S U S T S S
dF S dU S T dS S S S dT
dU S ds T dS i dni
U S s S T i dni
S
(2)
S
(3)
продифференцируем его
(4)
dU S ds S d T ds S S S dT i dni ni d i (5)
S
совместим (4) и (5)
S d S S dT i dni 0
S
общий вид адсорбционного уравнения Гиббса
S
(6)
12.
при Т=const уравнение Гиббса принимает вид:s d N iS d i 0 |: s
d Г i d i 0
(7)
N iS – мера избыточного содержания компонента в поверхностном слое,
т.к. Г i
S
мера адсорбции, т. е. величина гиббсовой адсорбции.
d Гi d i
для бинарной системы:
(8)
,
d Г1 d 1 Г 2 d 2
(9)
где индекс 1 относится к растворителю, 2 – к растворенному веществу.
При таком выборе разделяющей поверхности можно считать, что адсорбция
растворителя отсутствует
d Г d
13.
Перейдем к концентрации:R T ln a R T ln C ,
где С – равновесная концентрация в объеме.
d R T ln C
dC
d Г R T
C
С d
Г
R T dC
(10)
14.
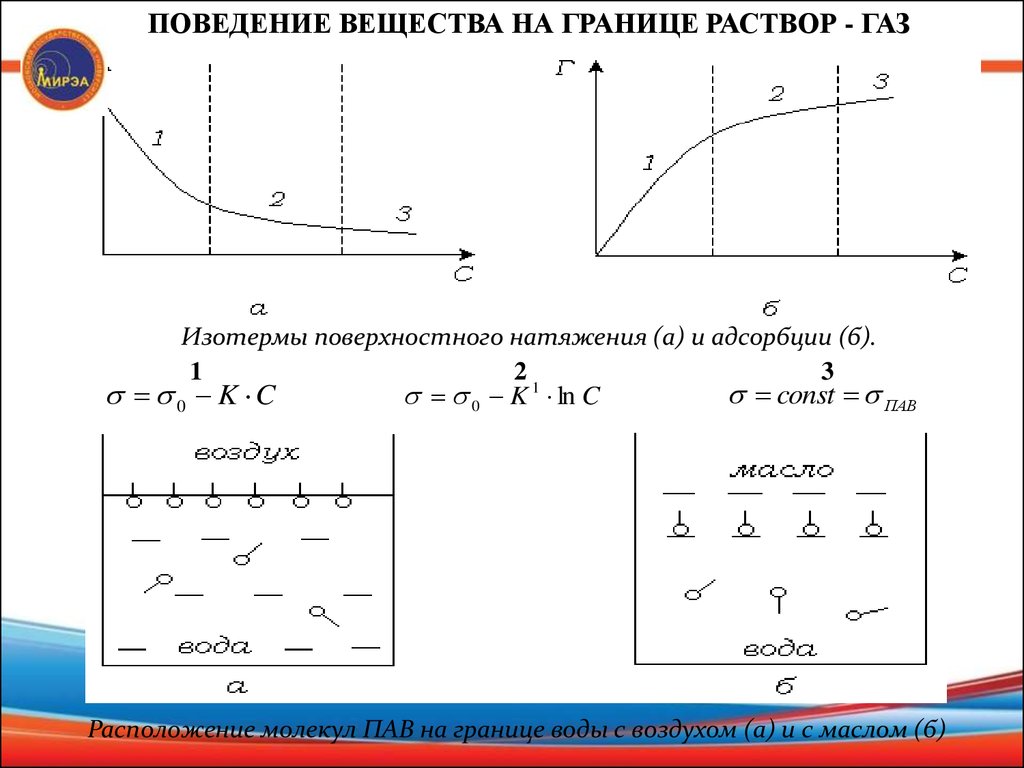
ПОВЕДЕНИЕ ВЕЩЕСТВА НА ГРАНИЦЕ РАСТВОР - ГАЗИзотермы поверхностного натяжения (а) и адсорбции (б).
1
21
3
const ПАВ
0 K ln C
0 K C
Расположение молекул ПАВ на границе воды с воздухом (а) и с маслом (б)
15.
ТИПЫ ВЕЩЕСТВПИАВ
ПАВ
d
0 Г 0
dC
ПАВ р ля
Г 0
(мыло, спирты, карбоновые к-ты)
Для кривой
f (C )
d
0
dC
ПНВ
Г 0
d
0
dC
ПИАВ р ля
р ра р ля
(электролиты)
(сахара)
как убывающей функции характерна отрицательная первая
производная , называемая поверхностной активностью.
d
0
dC C 0
ПАВ
ПИАВ
ПНВ
ПАВ
ПНВ
ПИАВ
16.
Построение изотермы адсорбции графическим методом и определениехарактеристик поверхностного слоя
d
z catg ca
dc
2
Г = f (c)
z
Г
RT
c
1
с
Г Гмаксk Гмакс
Z
а
1
f (c)
sмол
с
а
с
Построение изотермы адсорбции
по изотерме поверхностного натяжения :
1- изотерма поверхностного натяжения;
2- изотерма адсорбции.
1
Г максNA
ГмаксM
17.
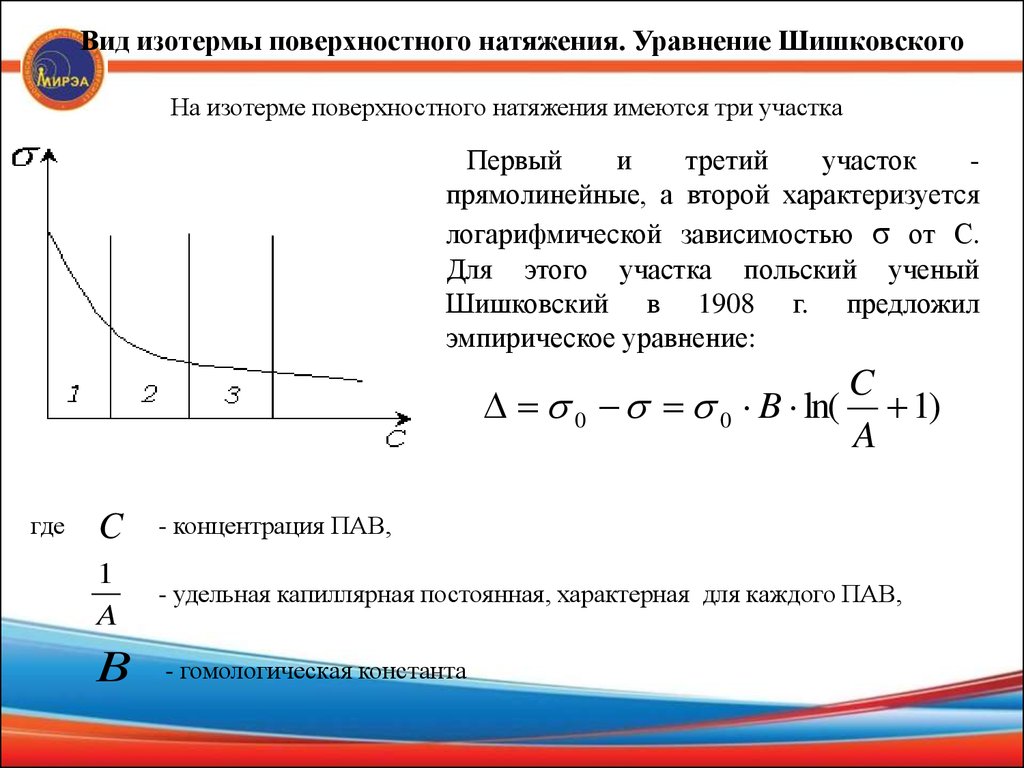
Вид изотермы поверхностного натяжения. Уравнение ШишковскогоНа изотерме поверхностного натяжения имеются три участка
Первый
и
третий
участок
прямолинейные, а второй характеризуется
логарифмической зависимостью σ от С.
Для этого участка польский ученый
Шишковский в 1908 г. предложил
эмпирическое уравнение:
C
0 0 B ln( 1)
A
где
C
- концентрация ПАВ,
1
A
- удельная капиллярная постоянная, характерная для каждого ПАВ,
B
- гомологическая константа
18.
При малыхC
:
C
C
ln( 1)
A
A
по формуле разложения в ряд уравнение принимает вид:
C
0 0 B
A
т. е. описывает первый прямолинейный участок. После дифференцирования
1
d 0 B dC
A
;
d
B
0
dC
A
,
т. е. можно определить поверхностную активность.
Для определения констант уравнения Шишковского рассмотрим второй участок
изотермы поверхностного натяжения. При больших С можно пренебречь единицей,
и тогда
C
0 0 B ln
A
Это уравнение прямой линии в координатах
ln C
19.
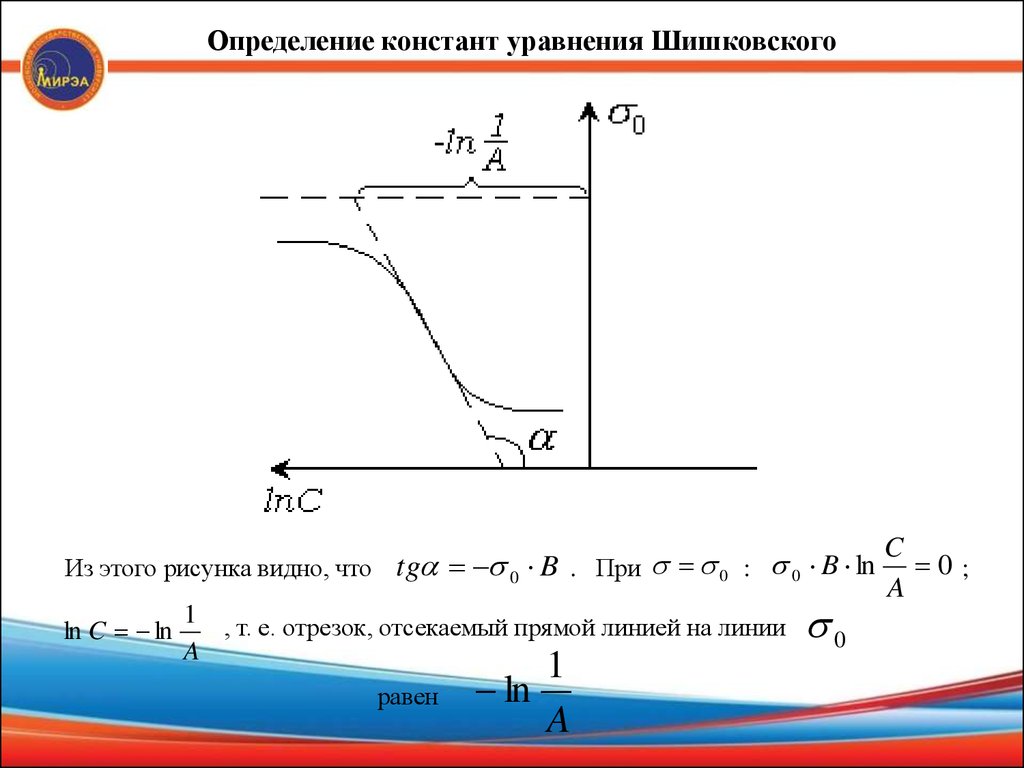
Определение констант уравнения ШишковскогоИз этого рисунка видно, что tg 0 B . При 0 : 0 B ln
ln C ln
1
, т. е. отрезок, отсекаемый прямой линией на линии
A
равен
1
ln
A
0
C
0;
A
20.
Связь уравнений Ленгмюра и Гиббса с помощью уравнения ШишковскогоУравнение Шишковского является эмпирическим. После разработки представлений о
мономолекулярной адсорбции Ленгмюр теоретически получил уравнение, носящее его имя:
Г Г max
K C
1 K C
(1)
Оказалось возможным получить уравнение на основе уравнений Ленгмюра и Гиббса. Запишем
уравнение Гиббса.
С d
Г
R T dC
C d
K C
Г
Приравниваем уравнения (1) и (2):
max
R T dC
1 K C
(2)
Разделим переменные и проинтегрируем:
K dC
; 0 Г max R T ln( 1 K C ) ,
1
K
C
0
C
d Г max R T
0
Сравнивая с уравнением Шишковского, видим, что
Г max
R T 0 B ; а K
1
A
Таким образом, уравнения, описывающие изотермы адсорбции и поверхностного
натяжения, взаимосвязаны между собой. Определив константы уравнения поверхностного
натяжения, можно определить константы уравнения Ленгмюра.
21.
ПРАВИЛО ТРАУБЕВ гомологическом ряду алифатических соединений при увеличении длины цепи на
одну группу CH 2 поверхностная активность увеличивается в 3,2 раза.
. Правило Траубе относится только к границе водный раствор – воздух. Его можно
записать в виде:
.
Т.к.
d
1
0 B
dC
A
следовательно,
d
d
3,2
dC n 1 dC n
то 0
B
постоянно для всех членов ряда
K n 1
3,2
Kn
d 1
K
dC A
Адсорбция – работа обратимого переноса
1 моля растворенного вещества из объема в
поверхностный слой.
An 1 An R T ln K n 1 R T ln K n 690
кал
моль
Сущность правила Траубе в том, что работа
адсорбции
на
каждую
группу
СН2постоянна и равна 690 кал/моль
Изотермы для трех ПАВ – соседних
членов гомологического ряда

















 physics
physics








