Similar presentations:
Химическое равновесие
1.
Акимова И.П. учитель химии МБОУ «Гимназия №3» г.Горняк Локтевский район Алтайский крайХимическое равновесие
1
2.
2SO2 + O2 ↔ 2SO3Химические реакции, идущие во взаимно
противоположных направлениях,
называются обратимыми.
2
3.
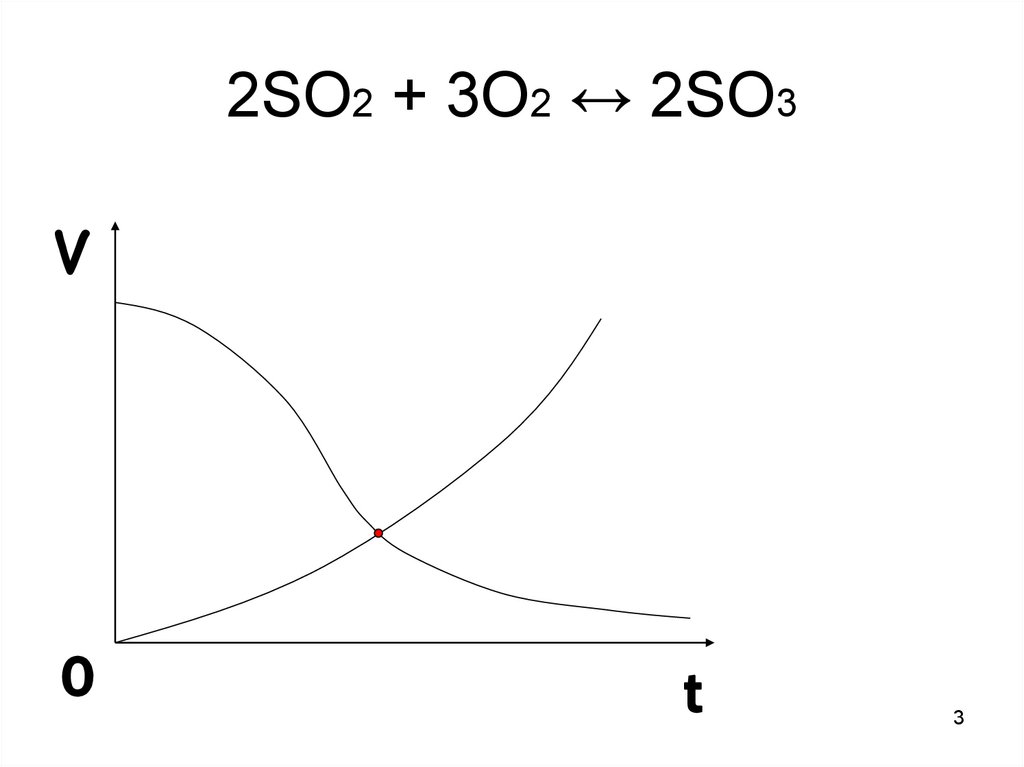
2SO2 + 3O2 ↔ 2SO3V
0
t
3
4.
Химическое равновесие это такое состояние системы, прикотором скорость прямой реакции
равна скорости обратной реакции.
4
5.
Условия смещения равновесия• Концентрация (C)
•Давление (P)
•Температура (T)
5
6.
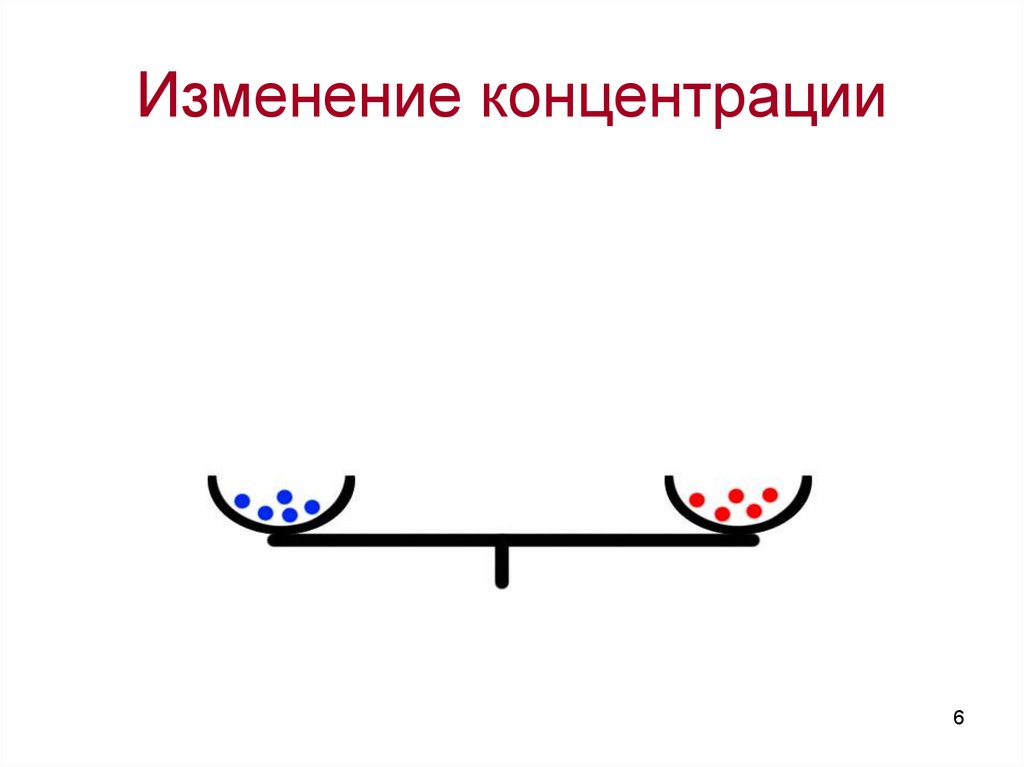
Изменение концентрации6
7.
Влияние концентрации нахимическое равновесие:
Увеличение концентрации исходных
веществ ведет к смещению равновесия
в сторону образования продуктов
реакции.
7
8.
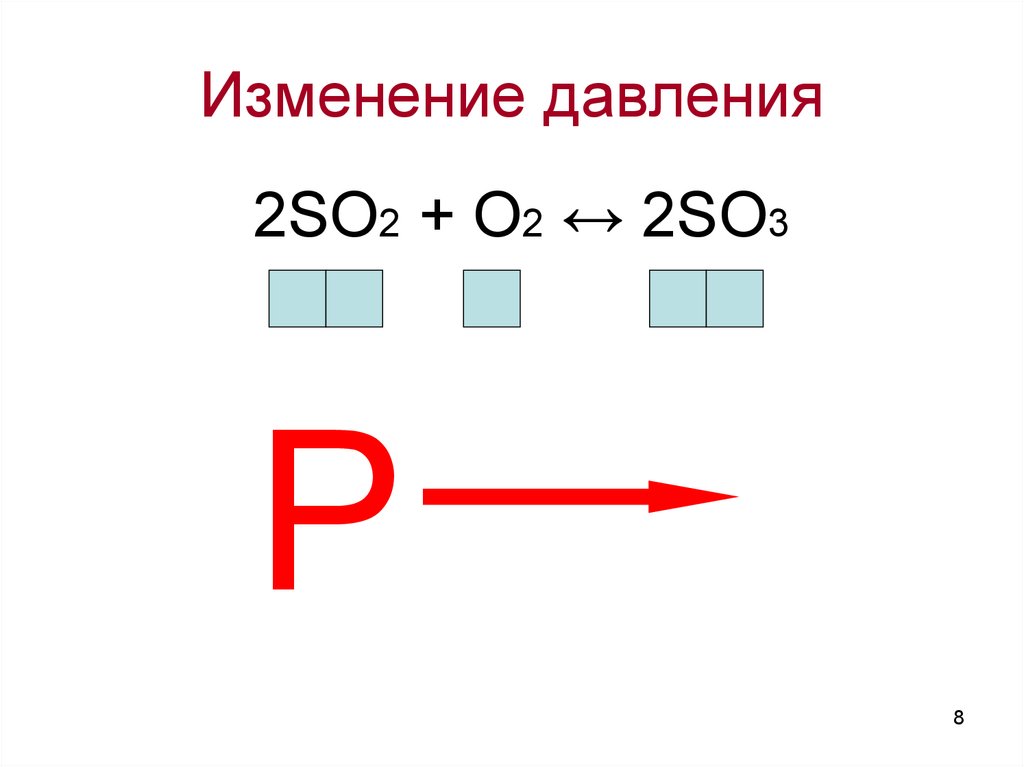
Изменение давления2SO2 + O2 ↔ 2SO3
P
8
9.
Влияние давления на смещениехимического равновесия:
Увеличение давления в системе ведет к
смещению химического равновесия в
сторону той реакции, которая идет с
уменьшением объема.
9
10.
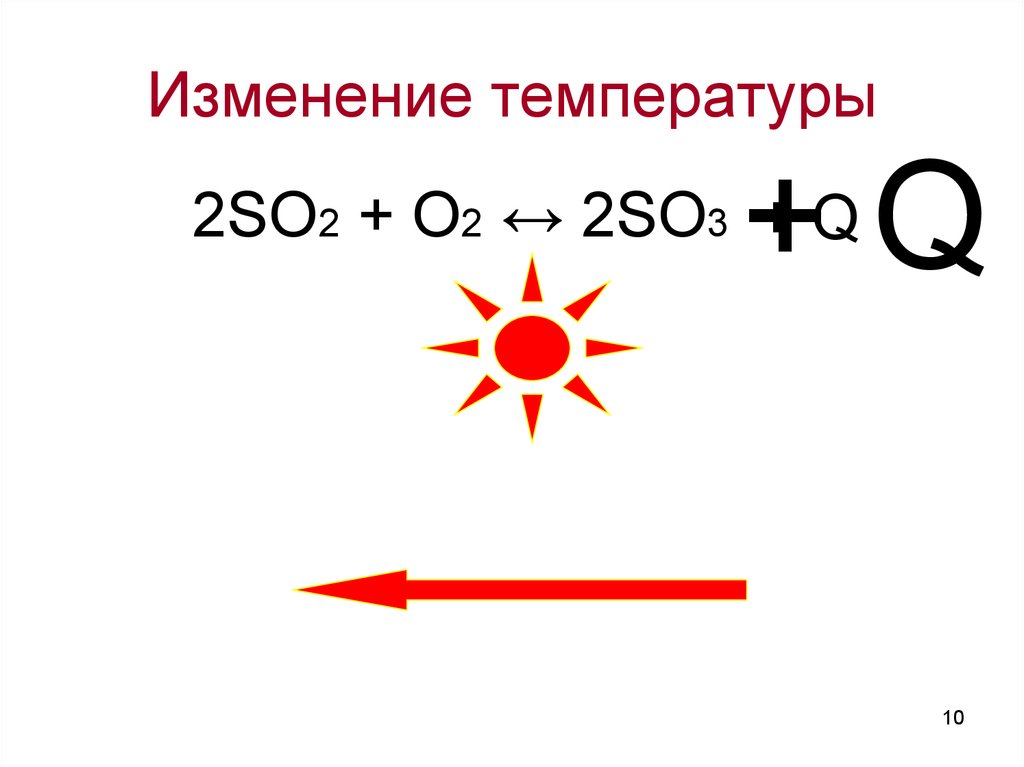
Изменение температуры+Q
2SO2 + O2 ↔ 2SO3 + Q
10
11.
Влияние температуры насмещение равновесия:
Повышение температуры ведет к
смещению химического равновесия в
сторону эндотермической реакции.
11
12.
Принцип Ле Шателье:При изменении внешних условий (С, Р, Т)
химическое равновесие смещается в
сторону той реакции (прямой или
обратной), которая ослабляет это
внешнее воздействие.
12
13.
Анри Луи Ле ШательеФранцузский физик и химик,
(1850-1936)
Большинство работ
посвящены прикладным
проблемам, разработал
пирометр, оптический прибор,
измеряющий температуру
раскаленных тел по цвету,
создал металлографический
микроскоп, сформулировал
принцип динамического
равновесия, носящий его имя.
13
14.
N2 + 3H2 ↔ 2NH3 +QЧтобы сместить равновесие вправо,
необходимо:
1. Концентрацию исходных веществ
а) увеличить; б) уменьшить.
2. Давление
а) увеличить; б) уменьшить.
3. Температуру…
а) увеличить; б) уменьшить.
14










 chemistry
chemistry








