Similar presentations:
Кислород
1.
2.
Вспомним о водороде.Химический знак водорода. Его
положение в ПСХЭ.
Распространение водорода.
Способы получения и определения.
Физические свойства.
Химические свойства. Чем является
водород в ХР?
Применение.
3.
Запишем д/з:§14 прочитать, составить
кроссворд из 10 любых
химических терминов.
4.
Нахождение в природеКислород самый распространенный на Земле
элемент.
1. В атмосфере около 21% по V;
2. В литосфере (твердой оболочке Земли) 47% по m - (он входит в состав большинства
горных пород и более чем 1000 минералов);
3. В гидросфере (водной оболочке нашей
планеты) -почти 86% по m.
Образуется в ходе процесса фотосинтеза
СО2 + Н2О → С6Н12О6 +О2 ↑
Уравните ХР
5.
Открытиекислорода
Официально открытие принадлежит Джозефу Присли.
(1 августа 1774 году путём разложения оксида ртути в герметично закрытом
сосуде. Пристли направлял на это соединение солнечные лучи с помощью
мощной линзы).
HgO=Hg +O2
уравнить
В 1775 году Антуан Лавуазье установил, что кислород является составной
частью воздуха, кислот и содержится во многих веществах.
В 1771 году кислород получил шведский химик Карл Шееле.
6.
АЛЛОТРОПИЯ КИСЛОРОДА: элементу-Осоответствуют 2 простых вещества
1.Газ кислород -О2
2.Газ озон - О3 образуется из
кислорода под действием УФ или
эл.разряда
3О2↔2О3
7.
Физические свойства1.Кислород-газ без цвета, запаха и вкуса, мало
растворим в воде, тяжелее воздуха, Ткип.=-183 0С;
Тпл.=-218,8 0С
2. Озон-газ синего цвета с характерным запахом, в
жидком виде -фиолетового цвета (при Т=-1110С), в
твердом виде- черного цвета (при Т=-2510С), в 10 раз
лучше растворяется в воде, чем кислород, гораздо
тяжелее воздуха
8.
Получениекислорода
1. KMnO4 →K2MnO4+MnO2 +O2
2.KNO3 →KNO2 +O2
3.H2O2 →H2O + O2
4. Уравнить
9.
Химические свойства кислорода10.
Горение железа.Fe + О2 → Fe2O3
уравнить
11.
Горение фосфора.Р + О2 → Р2O5
уравнить
12.
Горение серы.S + О2 → SO2
уравнить
13.
ПРАВИЛА ДОПИСЫВАНИЯ УРАВНЕНИЙ РЕАКЦИЙСОЕДИНЕНИЯ.
1.Записать элементы вместе.
2.Поставить с.о. элементов. Снести
их крест-накрест, если, надосократить.
3.Определить индексы.
4.Расставить коэффициенты.
14.
Дописать и уравнить:1.
2.
3.
4.
5.
Ca + O2 →
H2 + O2 →
Si + O2 →
N 2 + O2 →
С2H6 + O2 →
15.
Угадать пропущенное вещество… + O2 → As2O3
Li + O2 →…
Mg + … → MgO
… + O2 → NO
Be + O2 → …
16.
Применение1.Медицина
Абсолютно необходимый элемент системы жизнеобеспечения любой больницы. Применяется при
анестезии, для работы ИВЛ, физиотерапии.
2.Ветеринария
При анестезии животных, озонировании для дезинфекции.
3.Косметология, спорт и фитнес
Оксигенотерапия в косметологии, оздоровительные процедуры в виде кислородных коктейлей и
ароматерапии.
4.Металлургия
Кислород в больших объемах используется при производстве черных и цветных металлов.
5.Газовая сварка, резка и пайка металлов
Одно из самых важных и распространенных областей применения кислорода.
6.Стекольная промышленность.В стекловаренных печах для повышения температуры.
7.Химическая и нефтехимическая промышленность
Широко используется для окисления исходных реагентов.
8.Озонирование для водоподготовки, очистки сточных вод, отбеливания целлюлозы и т. д.
9.Рыборазведение.Способствует увеличению выхода мальков, сокращению срока инкубации и т. д.
10.Утилизация отходов в мусоросжигательных печах.
17.
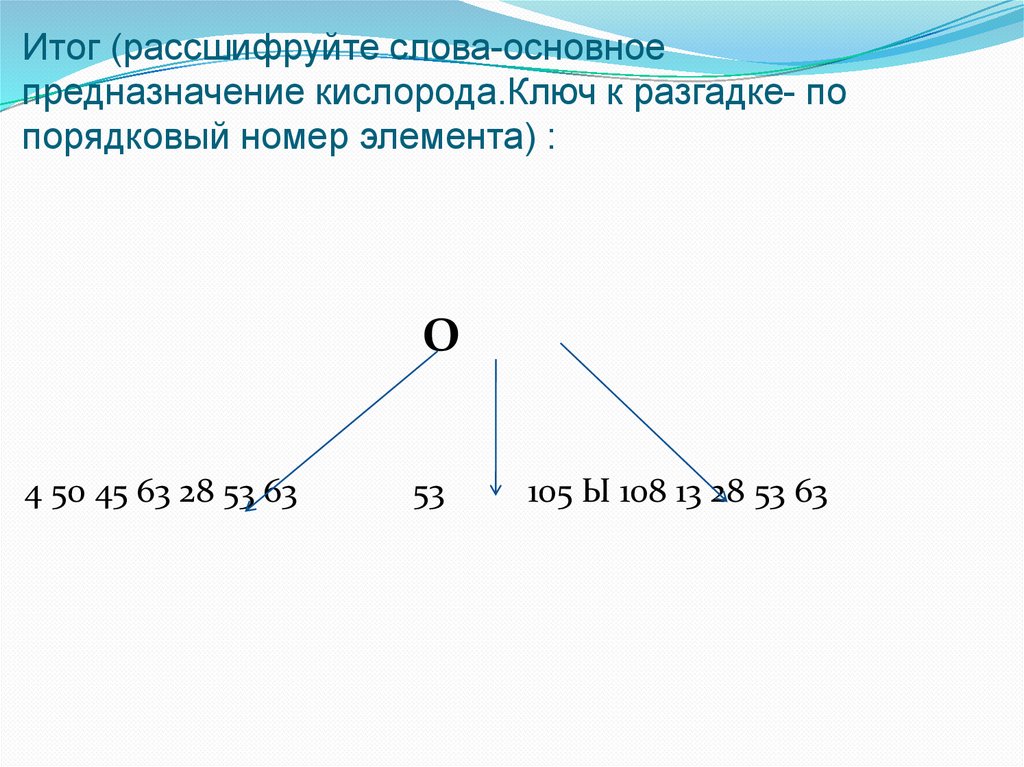
Итог (рассшифруйте слова-основноепредназначение кислорода.Ключ к разгадке- по
порядковый номер элемента) :
O
4 50 45 63 28 53 63
53
105 Ы 108 13 28 53 63
18.
ДЫХАНИЕ И ГОРЕНИЕ19.
Ответы кхимическому
диктанту
1+;2-;3+;4+;5-;6-;7+;8-;9;10+;11+;12-;13+;14+;15+;16-;18;19-;20+;21+;22-;23-;24-;25+;26;27-;28+;29+;30+.


















 chemistry
chemistry








