Similar presentations:
Гидролиз солей
1.
ГИДРОЛИЗ СОЛЕЙПРЕЗЕНТАЦИЯ ПО ХИМИИ ДЛЯ (9) 11 КЛАССОВ
ВЫПОЛНЕНА УЧИТЕЛЕМ ХИМИИ ГБОУ СОШ №160 САНКТ-ПЕТЕРБУРГА
ЦВЕТКОВОЙ О.В.
2.
Гидролиз – это обменная реакциямежду химическим соединением и
водой, приводящая к разложению водой
исходного вещества.
3.
Пожалуй, начнем с повторения:• Какие процессы
являются
необратимыми?
• Какие вещества
относят к слабым
электролитам?
• Что такое индикатор?
Приведите примеры.
4.
Рассмотримразные
случаи
гидролиза
5.
K+ [ NO2 ]-H+
OH-
Гидролиз по аниону
Каким основанием и какой
кислотой (с точки зрения
силы электролита)
образована эта соль?
Попробуйте описать
увиденное с помощью
ионного
и молекулярного уравнений.
Каков характер среды в
растворе нитрита калия?
Почему этому процессу
дано такое название?
6.
Проверь себя:Нитрит калия – это соль,
образованная сильным основанием (KOH)
и слабой кислотой (HNO2).
Анион соли (нитрит-ион)
в ходе реакции вошел в состав слабого
электролита
(азотистой кислоты).
Реакция необратима.
KNO2 + H2O
K+ + NO2- + H2O
NO2- + H2O
KOH + HNO2↑
K+ + OH- + HNO2↑
KOH и HNO2↑
HNO2↑ + OH-
характер среды - щелочной
7.
Гидролиз по катиону2+
Zn SO42-
H+
[
OH
-
]+
Каким основанием и
какой кислотой (с точки
зрения силы электролита)
образована эта соль?
Попробуйте описать
увиденное
с помощью ионного
и молекулярного
уравнений.
Каков характер среды в
растворе сульфата цинка?
Почему этому процессу
дано такое название?
8.
Проверь себя:Сульфат цинка образован слабым основанием (Zn(OH)2 )
и сильной кислотой (H2SO4 ).
При протекании первой ступени гидролиза соли многокислотного
основания ион цинка вошел в состав более сложного катиона –
гидроксоцинка.
Эта ступень гидролиза является обратимой, т.к. среди продуктов
реакции нет малодиссоциирующего вещества.
2ZnSO4 + 2H2O
Zn2+ +SO42- + H2O
Zn2+ + H2O
(ZnOH)2SO4 + H2SO4
ZnOH+ + H+ +SO42-
ZnOH+ и HSO4-
ZnOH+ + H+
среда кислая
9.
Вторая ступень гидролиза является необратимой, нопри обычных условиях протекает в наименьшей
степени, чем первая, поэтому ограничимся
написанием гидролиза по первой ступени.
(ZnOH)2SO4 + H2O
Zn(OH)2 + H2SO4
2ZnOH+ + SO42- + 2H2O
ZnOH+ + H2O
2Zn(OH)2 + 2H+ + SO42-
Zn(OH)2 + H+
среда кислая
10.
Гидролиз по катиону и анионуAl2S3
+6
H2O
Чем принципиально
отличается этот процесс от
двух предыдущих?
2 Al(OH)3 + 3H2S
11.
А какой случай стоит ещепопробовать?
12.
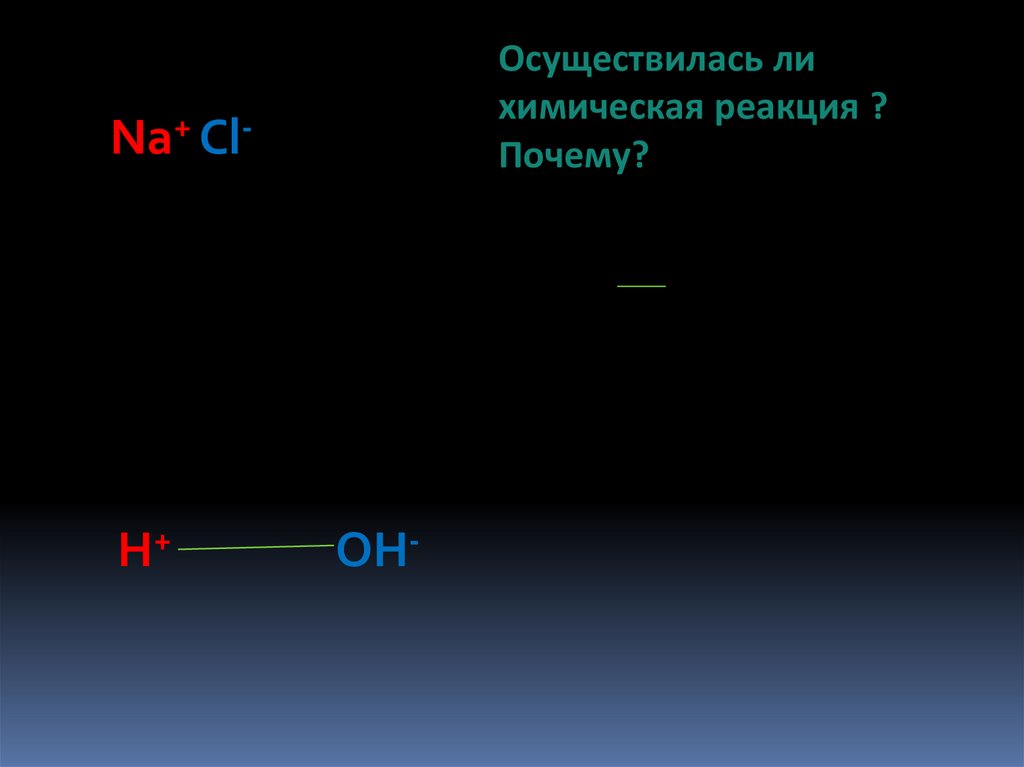
Осуществилась лихимическая реакция ?
Почему?
Na+ Cl-
H+
OH-
13.
Можно ли усилить гидролиз? Да,нагреванием.
Посмотрим эксперимент: Усиление
гидролиза солей при нагревании раствора
14.
Выводы:Определение
гидролиза
солей:
Взаимодействие в водных
растворах катионов и (или)
анионов солей с
молекулами воды, в
результате которого к
катиону может
присоединиться
гидроксильная группа, а к
аниону – ион водорода
молекулы воды.
15.
Выводы:Типы гидролиза:
по катиону;
по аниону;
по катиону и по
аниону
16.
Выводы:С точки зрения
обратимый
обратимости:
Соли многоосновных
кислот и
многокислотных
оснований
диссоциируют
Каждая последующая
ступень гидролиза
протекает
усилению гидролиза
способствует
необратимый
ступенчато
хуже, чем предыдущая
нагревание
17.
Тип солисоли, образованные сильным
основанием и слабой кислотой
соли, образованные слабым
основанием и сильной кислотой
соли, образованные слабым
основанием и слабой кислотой
соль, образованная сильным
основанием и сильной
кислотой
Продукты гидролиза
подвергается гидролизу по аниону, в
результате чего образуется слабый
электролит и гидроксид – ион.
подвергается гидролизу по катиону, в
результате гидролиза образуется
слабый электролит и катион
водорода.
гидролизуется и по катиону, и по аниону,
в результате образуется
малодиссоциирующие основание и
кислота
гидролизу подвергаться не будет, так
как в этом случае слабый электролит не
образуется.
18.
КроссвордЗаполни пробелы в предложении
Найди соответствия
19.
ИНДИКАТОРЫ (от лат. indicator — указатель) — вещества,позволяющие следить за составом среды или
за протеканием химической реакции. Одни из самых
распространенных — кислотно-основные индикаторы,
которые изменяют цвет в зависимости от кислотности
раствора. Происходит это потому, что в кислой и щелочной
среде молекулы индикатора имеют разное строение.
В кислой среде лакмус окрашен в красный цвет, в
щелочной — в синий.
В нейтральных и кислых растворах фенолфталеин бесцветен, в слабощелочных – малиново-красного цвета
Метиловый оранжевый — от красной в кислой среде, до
желтой - в щелочной.
20.
К слабым электролитам относятся:почти все органические кислоты
(CH3COOH, C2H5COOH и др.);
некоторые неорганические кислоты
(H2CO3, H2S, HF, HCLO, HNO2, H2SiO3 и др.);
почти все малорастворимые в воде
соли, основания и гидроксид аммония
(Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
вода
21.
При составлении презентации были использованы материалы:o региональной коллекции видеоматериалов "Неорганическая
химия. Видеоопыты."
http://collection.edu.yar.ru/catalog/rubr/eb17b17a-6bcc-01ab-0e3aa1cd26d56d67/23537/?interface=themcol
o
ПО «Hot potatoes»




















 chemistry
chemistry








