Similar presentations:
Алюминий – металл будущего
1. Алюминий – металл будущего
Учебнаяпрезентация
для 9 класса
2. Цели урока:
Изучить свойства металлов 3 А группы на примереалюминия.
Дать характеристику элемента по его положению в
периодической системе химических элементов.
На основе строения атома рассмотреть его
физические и химические свойства, указать
способы получения и области применения
алюминия.
Ответить на вопрос: « Почему алюминий называют
металлом будущего?»
3. «Серебро из глины»
Немецкий учёный Ф. Велер (1827 г.)получил алюминий при нагревании
хлорида алюминия со щелочными
металлами калий и натрий.
А.Сент-Клер Девиль.
Впервые получил алюминий
промышленным способом
(1855г.). AlCl3+ 3K=3KCl+Al
4. Из истории открытия
В период открытия алюминия металл был дороже золота. Англичанехотели почтить богатым подарком
великого русского химика Д.И
Менделеева, подарили ему
химические весы, в которых одна
чашка была изготовлена из золота,
другая - из алюминия. Чашка из
алюминия стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных, но
и промышленников и даже
императора Франции.
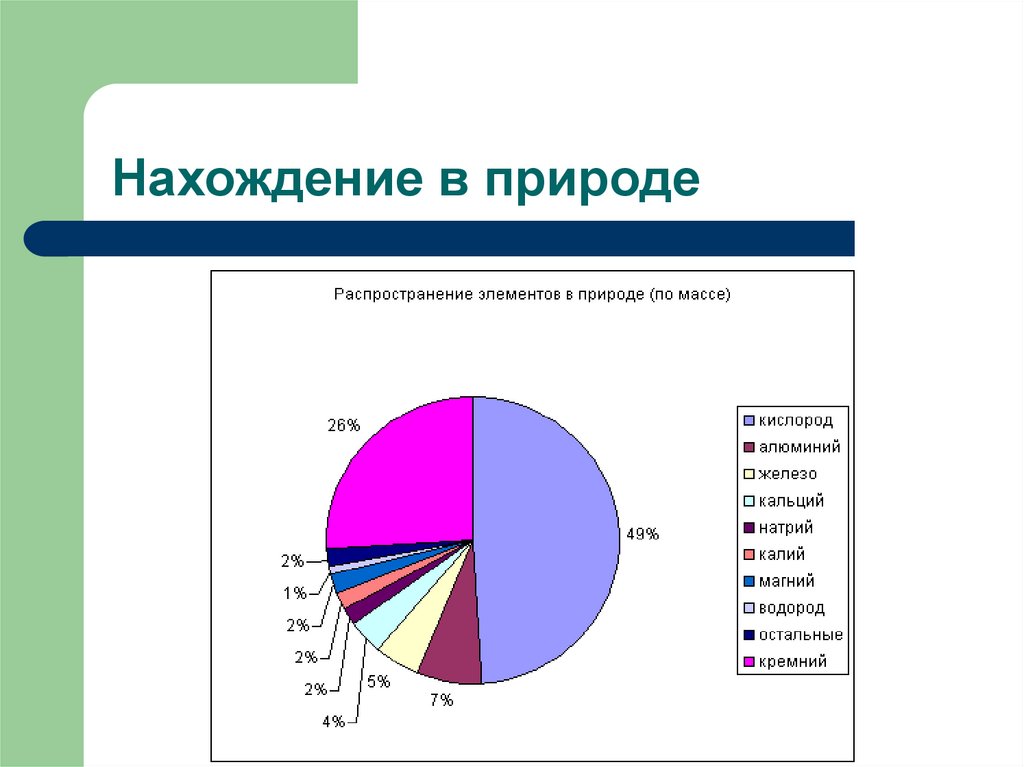
5. Нахождение в природе
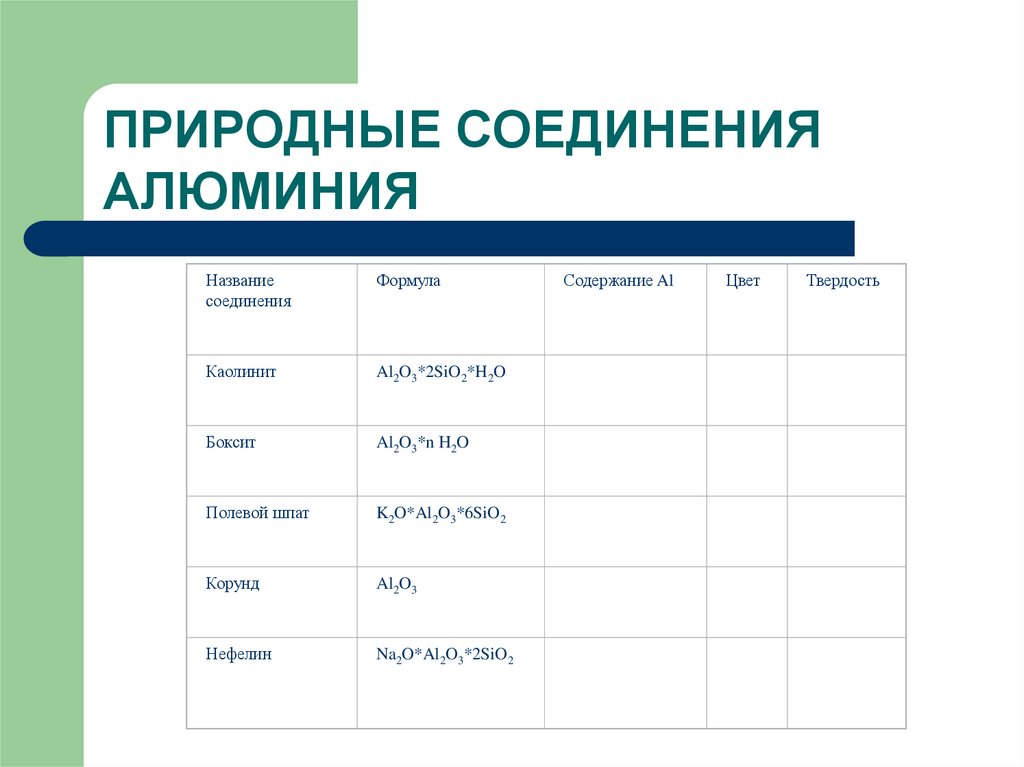
6.
ПРИРОДНЫЕ СОЕДИНЕНИЯАЛЮМИНИЯ
Название
соединения
Формула
Каолинит
Al2O3*2SiO2*H2O
Боксит
Al2O3*n H2O
Полевой шпат
K2O*Al2O3*6SiO2
Корунд
Al2O3
Нефелин
Na2O*Al2O3*2SiO2
Содержание Al
Цвет
Твердость
7. Физические свойства
Алюминий – металл серебристо- белогоцвета, лёгкий ( q- 2,7 г./ см.3), плавится при
температуре 6600С. обладает хорошей
ковкостью, пластичностью, электрической
проводимостью и теплопроводностью,
легко поддаётся обработке, образует лёгкие
и прочные сплавы.
8. Химические свойства
Алюминий при нагревании восстанавливает всеметаллы, находящиеся справа от него в
электрохимическом ряду напряжения металлов:
2Аl+3HgCl3= 2АlCl3 + 3Hg
Алюминий восстанавливает простые вещества –
неметаллы: 2Al+ 3S = Al2S3
Из сложных соединений алюминий
восстанавливает ионы водорода и ионы менее
активных металлов: 2Al+6HCl= 2АlCl3 +3H2;
2Al+CuSO4= Al2(SO4)3+3Cu Однако при комнатной
температуре на воздухе алюминий не изменяется,
поскольку его поверхность покрыта защитной
оксидной плёнкой.
9. Применение алюминия
10. Металл будущего
Вывод: Обладая такими свойствами каклёгкость, прочность,
коррозионноустойчивость, устойчивость к
действию сильных химических реагентов алюминий нашёл большое занимают в
авиационном и космическом транспорте
применение во многих отраслях народного
хозяйства. Особое место алюминий и его
сплавы, электротехнике, а за ними будущее
нашей науки и техники.
11. Выполните
Упр.6,7 с. 130 в учеб.Д/з. § 42, упр. 5, 4. с. 130









 chemistry
chemistry