Similar presentations:
Положение в ПСХЭ
1.
Положение вПСХЭ
Примене-
Строение
ние
атома
Химические
свойства
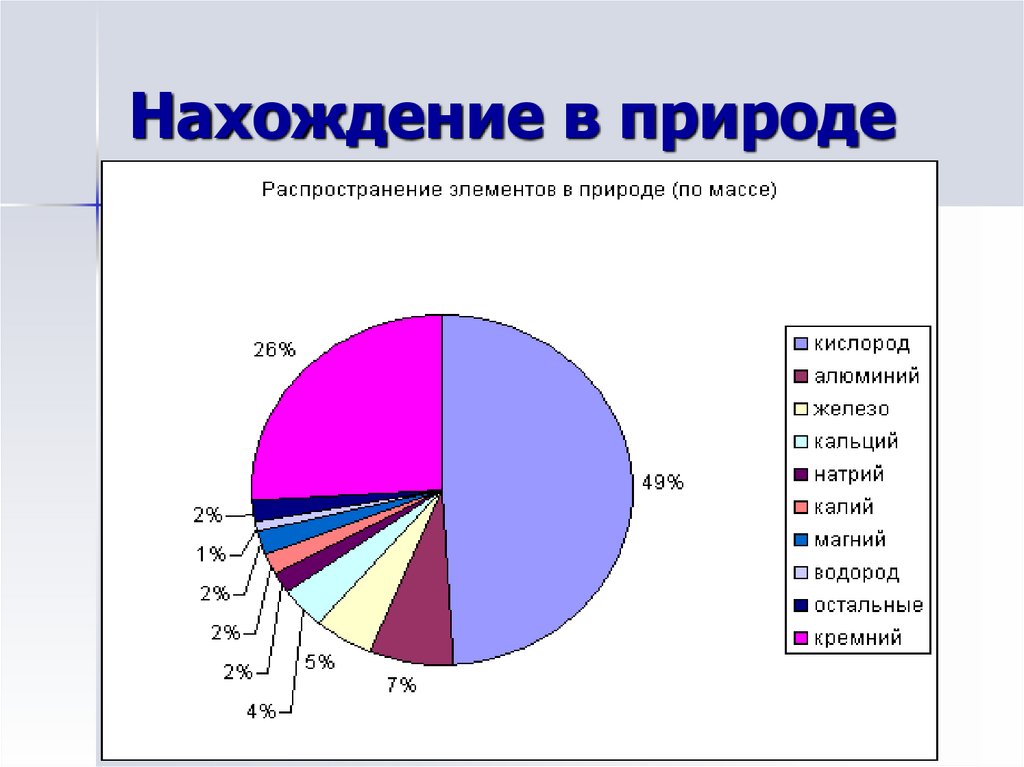
2. Нахождение в природе
3.
Он входит в состав глин, полевых шпатов, слюд.Важнейший минерал алюминия – боксит содержит
28-60% глинозёма - оксида алюминия Al2O3 .
В чистом виде его впервые получил датский физик
Х. Эрстед в 1825 г. Немецкий химик Ф.Вёлер получил
металлический алюминий в слитке. В 1854 г.
француз А. Сент- Клер Девиль получил его
посредством электролиза.
нефелин
боксит
4. Из истории открытия
В период открытия алюминия металл был дороже золота.Англичане хотели почтить богатым
подарком великого русского химика
Д.И Менделеева, подарили ему
химические весы, в которых одна
чашка была изготовлена из золота,
другая - из алюминия. Чашка из
алюминия стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных,
но и промышленников и даже
императора Франции.
5. Алюминий
6.
Утверждения Стадиявызова
1. Металлические свойства
алюминия слабее, чем у
магния
2.У алюминия 2 электрона
на внешнем уровне
3. Восстановительные
свойства у алюминия
слабее, чем у бора
4. Алюминий S –элемент
5. Подвергается коррозии
6. Алюминий – самый
распространенный металл
7.Алюминий – тяжелый,
ковкий и пластичный
8. Алюминий реагирует и со
щелочами и с кислотами.
Стадия
рефлексии
7. Вопросы для 1 группы
Расскажите о положении атомаалюминия в ПСХЭ
Какими физическими свойствами
обладает алюминий
Применение алюминия
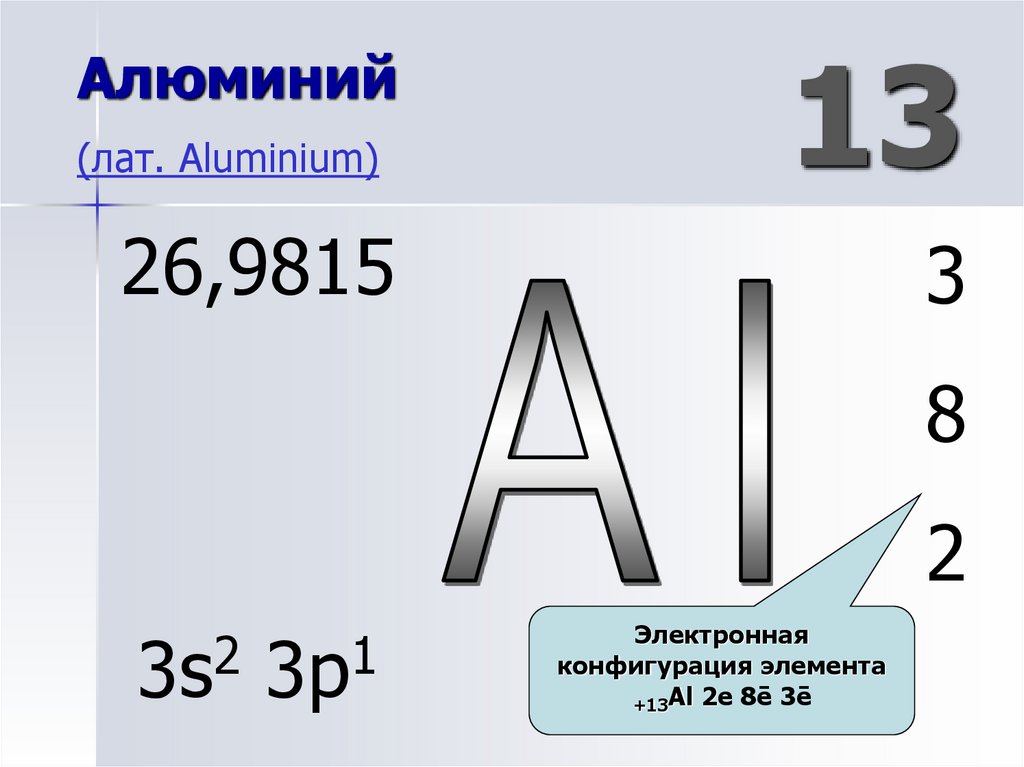
8. Алюминий (лат. Aluminium)
26,9815Порядковый номер.
Химический элемент
III группы главной
подгруппы 3-го
периода.
13
3
8
2
2
3s
1
3p
9. Физические свойства вещества
Al – серебристо-белый металл,пластичный, легкий, хорошо проводит
тепло и электрический ток, обладает
хорошей ковкостью, легко поддаётся
обработке, образует лёгкие и прочные
сплавы.
=2,7 г/см3
tпл.=6600С
10. Вопросы для второй группы
Сколько электронов на внешнемэлектронном уровне у атома
алюминия?
Какая степень окисления атома
в соединениях характерна для
алюминия?
11. Алюминий (лат. Aluminium)
1326,9815
3
8
2
2
3s
1
3p
Электронная
конфигурация элемента
+13Al 2е 8ē 3ē
12. Схема расположения электронов на энергетических подуровнях
2 2s2 2p6 3s2 3p1Al
1s
+13
3s
2s
3p
2p
1s
в соединениях проявляет степень окисления +3
13. Al – типичный металл
Схема образования веществаAl 0- 3ē Al+3
Тип химической связи -металлическая
14. Вопросы для 3 группы
Какие химические свойствахарактерны для алюминия как
простого вещества?
15. Химические свойства вещества
Al активный металл восстанавливает всеэлементы, находящиеся справа от него в
электрохимическом ряду напряжения
металлов,
простые
вещества
–
неметаллы. Из сложных соединений
алюминий
восстанавливает
ионы
водорода и ионы менее активных
металлов.
Однако
при
комнатной
температуре на воздухе алюминий не
изменяется, поскольку его поверхность
покрыта защитной оксидной плёнкой Al2
16. Алюминий реагирует:
1. 2Al+3O2 = 2Al2O3 + O – покрываетсяпленкой оксида, но в мелкораздробленном виде горит с выделением большого
количества теплоты.
2. 2Al + 3Cl2 = 2 AlCl3 (Br2, I3) – на холоду
3. 2Al + 3S = Al2S3 - при нагревании
4. 4Al + 3С = Al4С3 - при нагревании
5. Алюминотермия – получение металлов:
Fe, Cr, Mn, Ti, W и другие, например:
3Al + 3Fe3O4 = 4Al2O3 + 9Fe
17. Применение Al
18. Металл будущего
Вывод: Обладая такими свойствами каклёгкость,
прочность,
коррозионноустойчивость, устойчивость к
действию сильных химических реагентов алюминий нашёл большое значение в
авиационном и космическом транспорте,
применение во многих отраслях народного
хозяйства. Особое место занял алюминий и
его сплавы в электротехнике, а за ними
будущее нашей науки и техники.
19. Информация о домашнем задании
П.13 с. 68-71Сообщение на тему «Соединения
алюминия»
















 chemistry
chemistry








