Similar presentations:
Дикарбоновые кислоты
1.
ДИКАРБОНОВЫЕ КИСЛОТЫПо номенклатуре ИЮПАК названия алифатических дикарбоновых
кислот образуют прибавлением суффикса –диовая кислота к
названию соответствующего углеводорода
CO2H
CO2H
Щавелевая
CO2H
CO2H
Малоновая
CO2H
CO2H
янтарная
CO2H
CO2H
CO2H
CO2H
глутаровая
Адипиновая
2.
ДИКАРБОНОВЫЕ КИСЛОТЫCOOH
COOH
COOH
COOH
COOH
COOH
Бензол1,2-дикарбоновая
(фталевая кислота)
Бензол1,3-дикарбоновая
(изофталевая кислота)
Бензол1,2-дикарбоновая
(терефталевая кислота)
3.
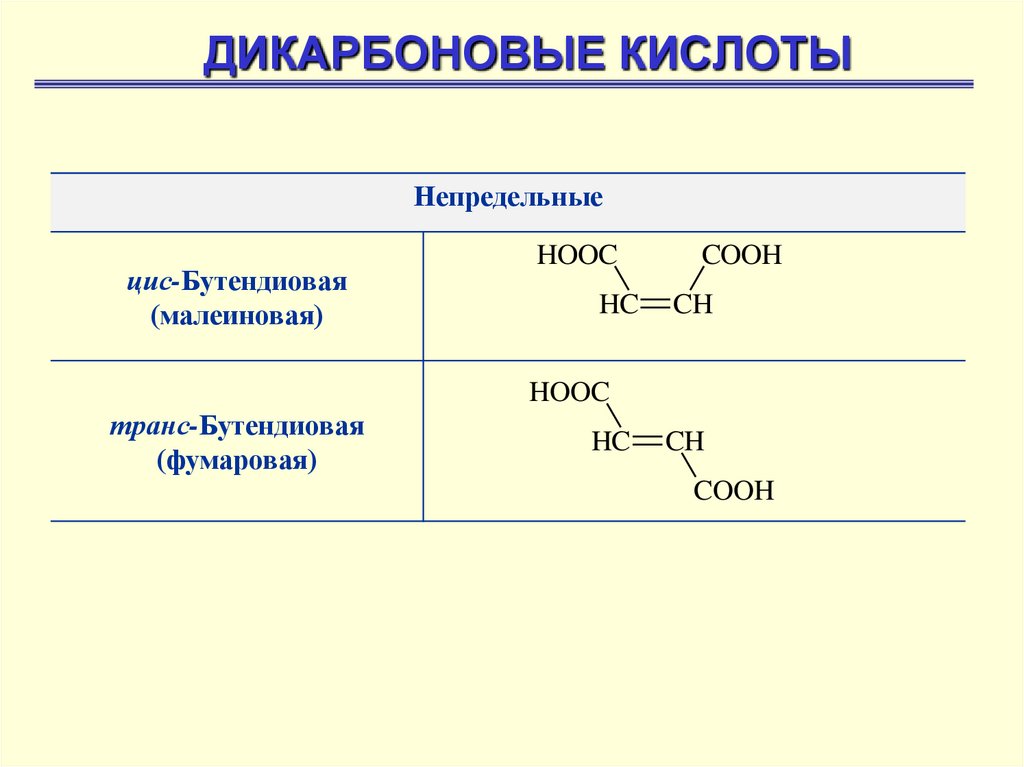
ДИКАРБОНОВЫЕ КИСЛОТЫНепредельные
цис-Бутендиовая
(малеиновая)
HOOC
HC
COOH
CH
HOOC
транс-Бутендиовая
(фумаровая)
HC
CH
COOH
4.
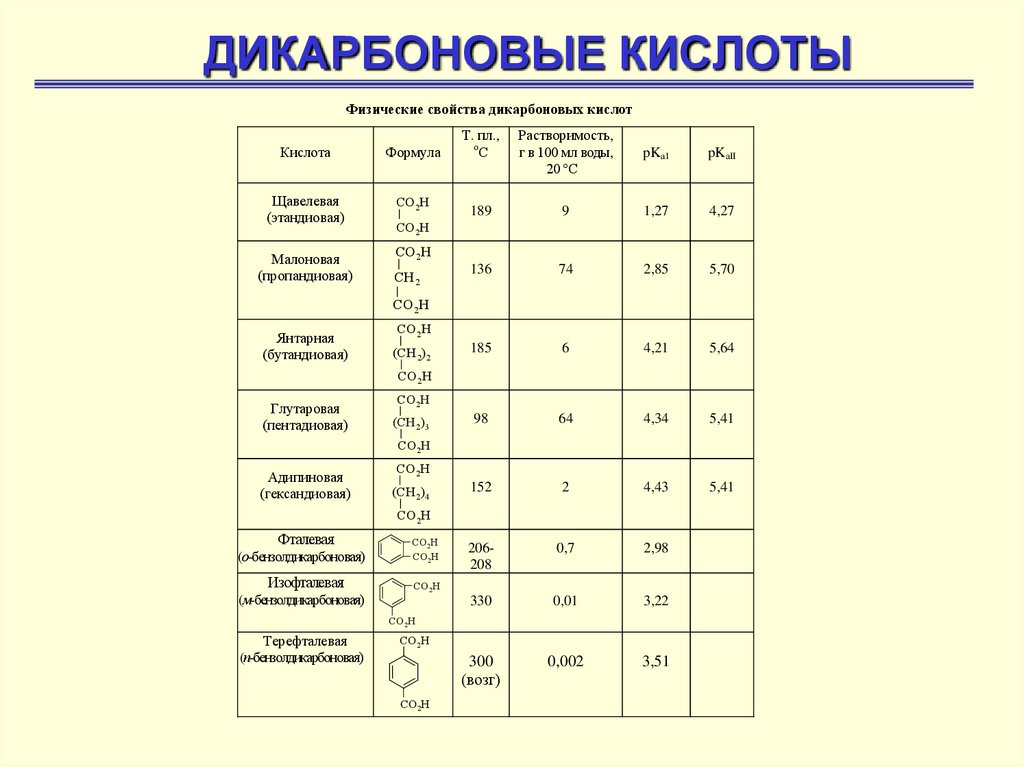
ДИКАРБОНОВЫЕ КИСЛОТЫФизические свойства дикарбоновых кислот
Кислота
Формула
Щавелевая
(этандиовая)
СО 2Н
Малоновая
(пропандиовая)
Т. пл.,
о
С
Растворимость,
г в 100 мл воды,
20 °С
pKa1
pKaII
189
9
1,27
4,27
136
74
2,85
5,70
185
6
4,21
5,64
98
64
4,34
5,41
152
2
4,43
5,41
206208
0,7
2,98
330
0,01
3,22
300
(возг)
0,002
3,51
СО 2Н
СО 2Н
СН 2
СО 2Н
Янтарная
(бутандиовая)
СО 2Н
(СН 2)2
СО 2Н
Глутаровая
(пентадиовая)
СО 2Н
(СН 2)3
СО 2Н
Адипиновая
(гександиовая)
СО 2Н
(СН 2)4
СО 2Н
Фталевая
(о-бензолдикарбоновая)
Изофталевая
СО 2Н
СО 2Н
СО 2Н
(м-бензолдикарбоновая)
СО 2Н
Терефталевая
(п-бензолдикарбоновая)
СО 2Н
СО 2Н
5.
ДИКАРБОНОВЫЕ КИСЛОТЫКислотность дикарбоновых кислот
Дикарбоновые кислоты (в соответствии с pKa1) являются более
сильными, чем уксусная кислота (pKa=4,76). Самой сильной
является щавелевая кислота pKa,1 = 1,27
С
С
O
ОН
O
ОН
К1
O
С
О
+ Н
O
С
ОН
+
К2
С
O
О+ Н
O
С
О
+
6.
ДИКАРБОНОВЫЕ КИСЛОТЫКислотность дикарбоновых кислот
Влияние одной карбоксильной группы, проявляющей
электроноакцепторный индукционный эффект, на другую в
этом случае максимально. Сила кислот уменьшается с
увеличением числа углеродных атомов между ними, т.к.
влияние одной карбоксильной группы на другую ослабевает.
Вторая константа диссоциации (К2) меньше вследствие того,
что отрыв второго протона от карбоксилат-иона оказывается
более трудным, чем отрыв первого протона от нейтральной
молекулы
7.
ДИКАРБОНОВЫЕ КИСЛОТЫДекарбоксилирование
Длина цепи, разделяющей карбоксильные группы,
определяет характер превращений при нагревании.
При нагревании щавелевой и малоновой кислот происходит
их декарбоксилирование
НО
O
O
С
С
O
НО
С
ОН
100 о С
O
СН 2
С
ОН
180
O
НО
оС
С
Н
+
СО 2
O
НО
С
СН 2
Н
+
СО 2
8.
ДИКАРБОНОВЫЕ КИСЛОТЫДекарбоксилирование
Если же при декарбоксилировании возможно образование
устойчивых пяти- и шестичленных циклов, то они и
образуются: адипиновая кислота циклизуется в
циклопентанон, а пимелиновая – в циклогексанон
СН2 С
СН2
СН2
O
ОН
ОН
СН2
300 оС
С
СН2
O
Адипиновая
кислота
O
СН2 С
300 оС
ОН
СН2
ОН
С
СН2
O
СН2 СН2
Пимелиновая кислота
СН2
С
СН2
O
+ СО2 + Н2О
СН2
Циклопентанон
СН2 СН2
СН2
СН2
С O + СО2 + Н2О
СН2
Циклогексанон
9.
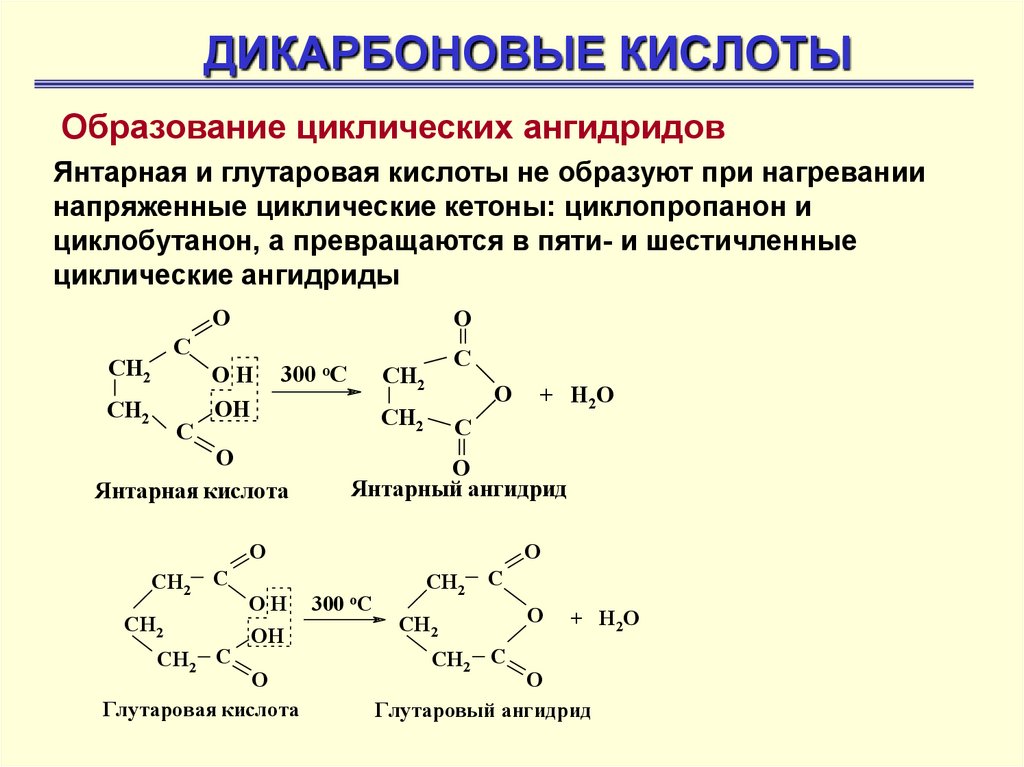
ДИКАРБОНОВЫЕ КИСЛОТЫОбразование циклических ангидридов
Янтарная и глутаровая кислоты не образуют при нагревании
напряженные циклические кетоны: циклопропанон и
циклобутанон, а превращаются в пяти- и шестичленные
циклические ангидриды
O
O
С
СН2
СН2
С
ОН
ОН
300 оС
O
Янтарная кислота
С
СН2
О
СН2
С
O
Янтарный ангидрид
O
O
СН2
С
СН2
СН2 С
ОН
ОН
O
Глутаровая кислота
+ Н2О
300 оС
СН2
С
СН2
СН2 С
О
+ Н2 О
O
Глутаровый ангидрид
10.
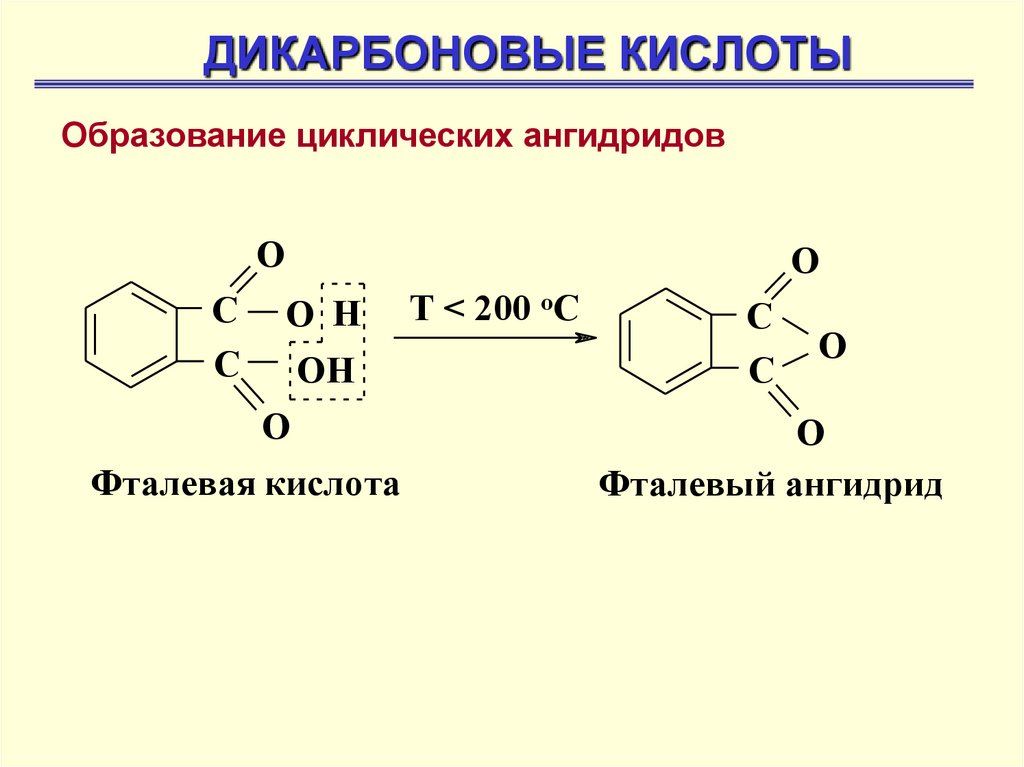
ДИКАРБОНОВЫЕ КИСЛОТЫОбразование циклических ангидридов
O
С
С
O
О Н
ОН
O
Фталевая кислота
Т < 200 оС
С
С
О
O
Фталевый ангидрид
11.
ДИКАРБОНОВЫЕ КИСЛОТЫОбразование циклических имидов
O
H2C
H2C
O
C
O
C
2 NH3
H2C
t OC
H2C
O
янтарный
ангидрид
+ NH4OH
C
O
O
фталевый
ангидрид
NH
O
O
O
C
2 NH3
NH
t OC
O
+
NH4OH
12.
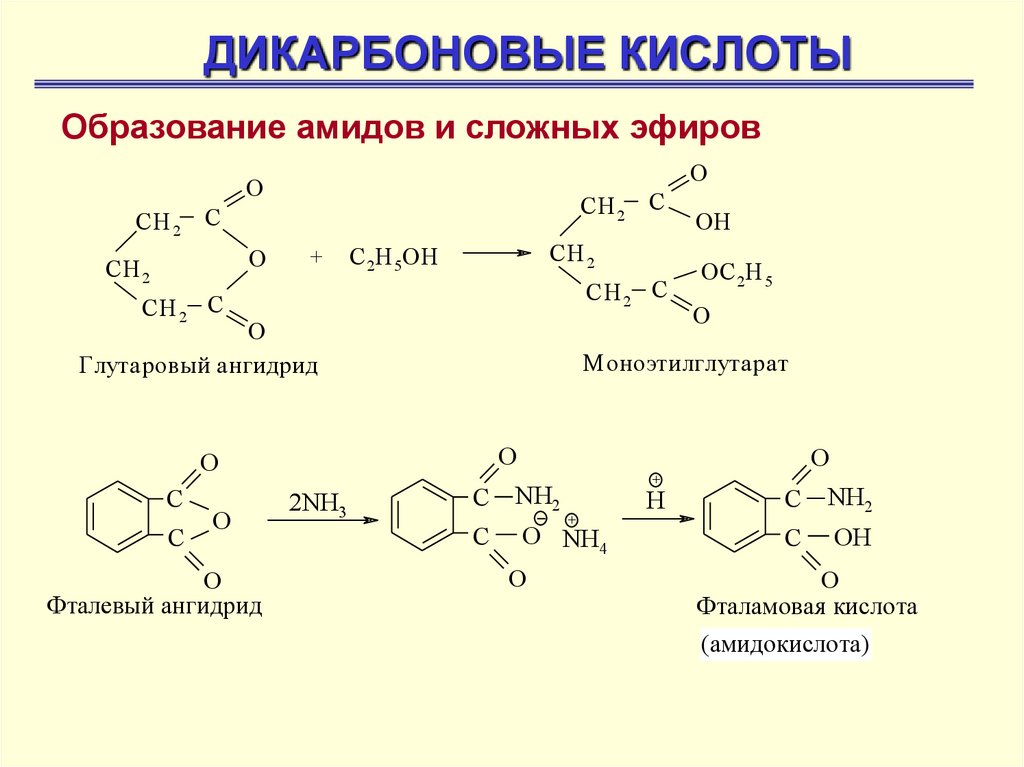
ДИКАРБОНОВЫЕ КИСЛОТЫОбразование амидов и сложных эфиров
O
O
СН 2
СН 2
С
О
СН 2
+
СН 2
С 2Н 5ОН
СН 2 С
СН 2 С
O
Глутаровый ангидрид
С
О
O
Фталевый ангидрид
ОН
ОС 2Н 5
O
М оноэтилглутарат
O
O
С
С
2NH3
O
+
С
NH2
С
O NH4
O
+
H
С
NH2
С
OH
O
Фталамовая кислота
(амидокислота)
13.
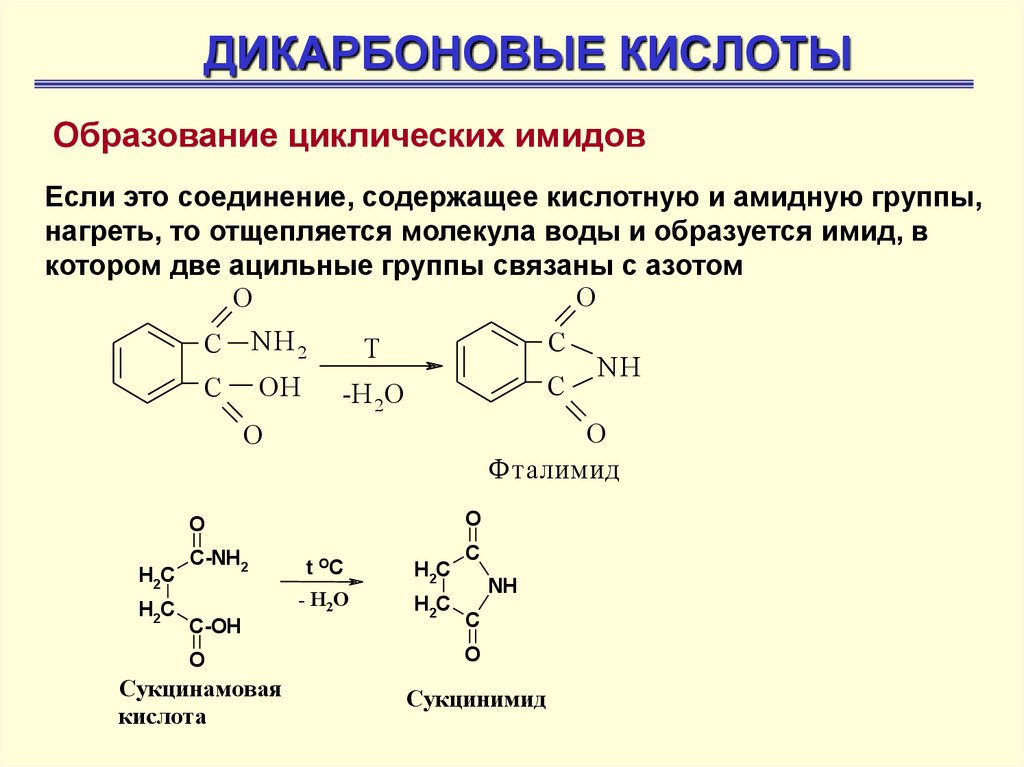
ДИКАРБОНОВЫЕ КИСЛОТЫОбразование циклических имидов
Если это соединение, содержащее кислотную и амидную группы,
нагреть, то отщепляется молекула воды и образуется имид, в
котором две ацильные группы связаны с азотом
O
O
С
NH 2
С
OH
Т
С
-Н 2О
С
O
Фталимид
O
O
O
H2C
H2C
C-NH2
C-OH
NH
t OC
H2C
- H2 O
H2C
C
NH
C
O
O
Сукцинамовая
кислота
Сукцинимид
14.
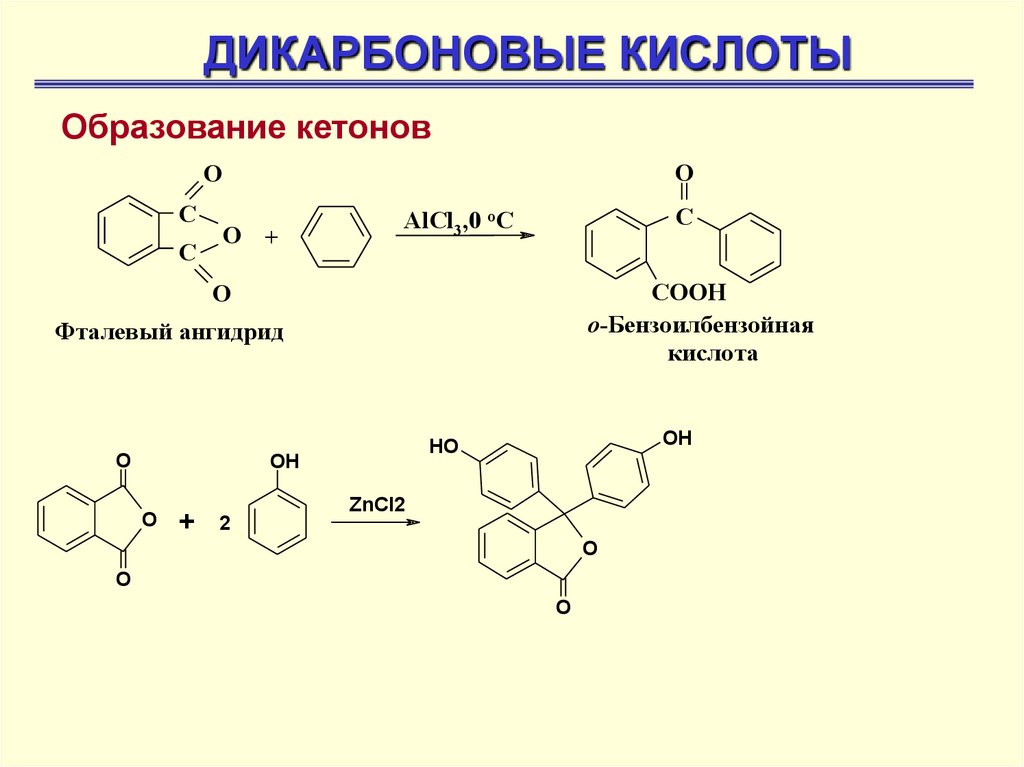
ДИКАРБОНОВЫЕ КИСЛОТЫОбразование кетонов
O
O
С
С
О +
С
AlCl3,0 оС
СООН
о-Бензоилбензойная
кислота
O
Фталевый ангидрид
O
OH
O
+
OH
HO
ZnCl2
2
O
O
O
15.
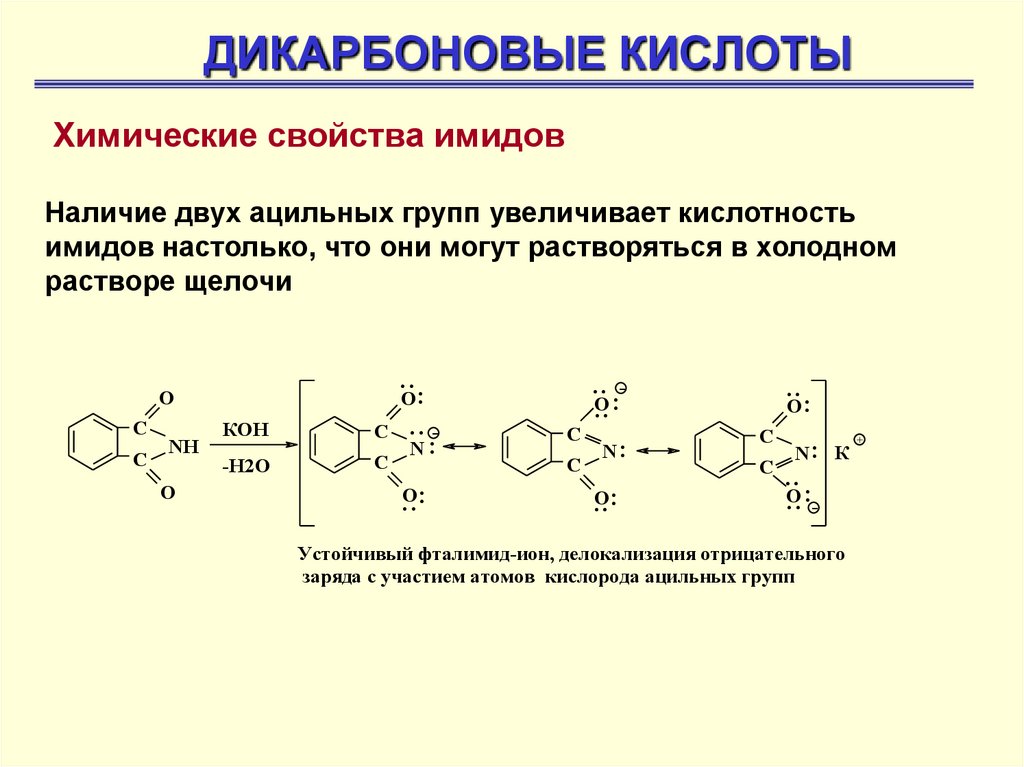
ДИКАРБОНОВЫЕ КИСЛОТЫХимические свойства имидов
Наличие двух ацильных групп увеличивает кислотность
имидов настолько, что они могут растворяться в холодном
растворе щелочи
..
O:
O
С
С
NH
O
КОН
С
-Н2О
С
.. N:
O
..:
С
С
.. О
.. :
N:
O:
..
..
O:
С
С
N: К
..
О
.. :-
Устойчивый фталимид-ион, делокализация отрицательного
заряда с участием атомов кислорода ацильных групп
+
16.
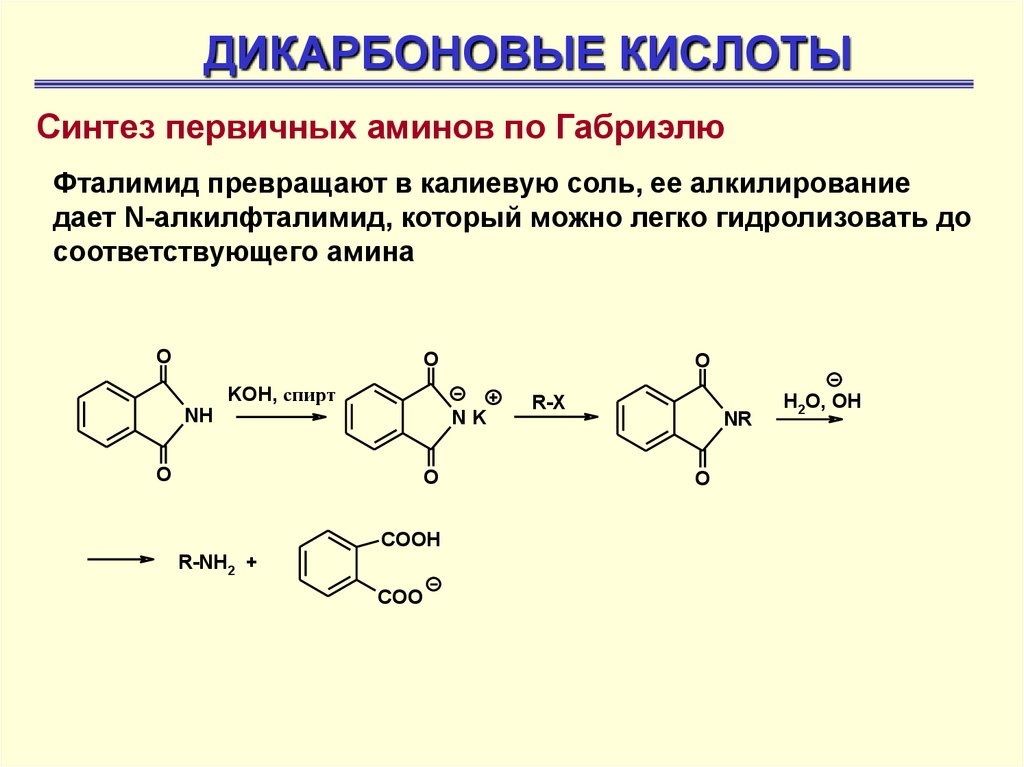
ДИКАРБОНОВЫЕ КИСЛОТЫСинтез первичных аминов по Габриэлю
Фталимид превращают в калиевую соль, ее алкилирование
дает N-алкилфталимид, который можно легко гидролизовать до
соответствующего амина
O
O
O
KOH, спирт
NH
NK
O
O
COOH
R-NH2 +
COO
R-X
NR
O
H2O, OH
17.
ДИКАРБОНОВЫЕ КИСЛОТЫПоликонденсация
Синтез полимеров взаимодействием би- или
полифункциональных мономеров и (или) олигомеров, обычно
сопровождающийся выделением низкомолекулярного продукта
(воды, спирта, NH3, галогеноводорода и др.)·
n HOOC (CH2)4 COOH
адипиновая к-та
O
OOC (CH2)4 C
+
n H2N (CH2)6 NH2
-n H2O
гексаметилендиамин
O
O
NH (CH2)6 NH C (CH2)4 C
полиамид ("найлон-6,6")
+
NH (CH2)6 NH3
n
18.
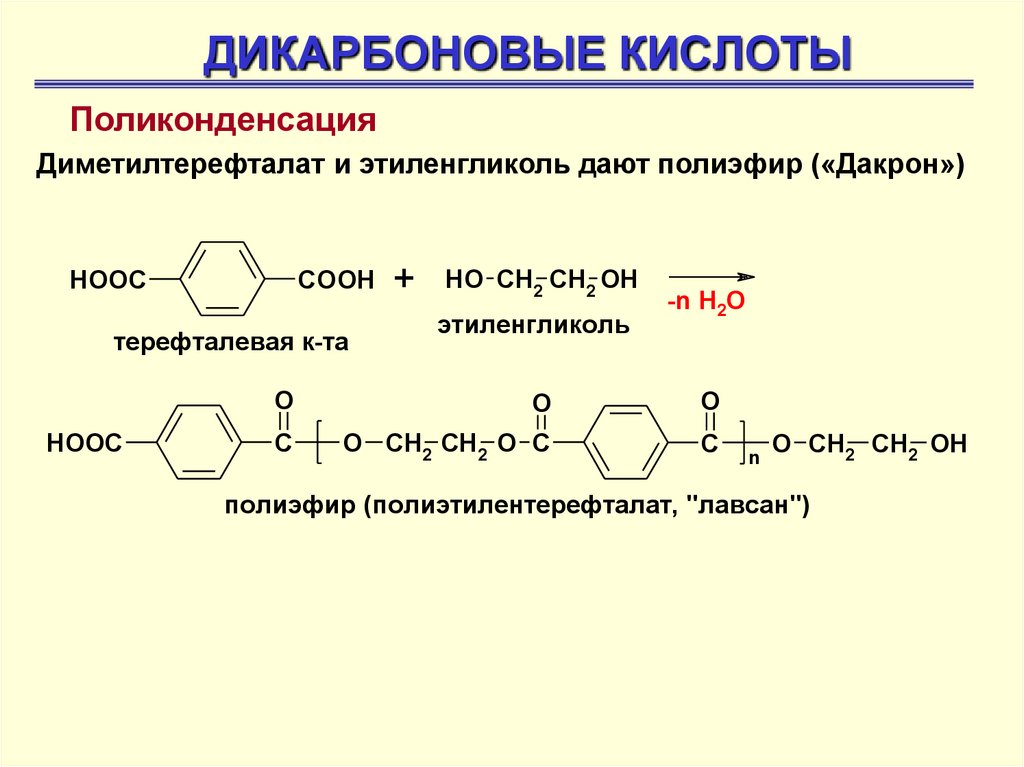
ДИКАРБОНОВЫЕ КИСЛОТЫПоликонденсация
Диметилтерефталат и этиленгликоль дают полиэфир («Дакрон»)
COOH
HOOC
терефталевая к-та
HOOC
+
HO CH2 CH2 OH
этиленгликоль
-n H2O
O
O
O
C
O CH2 CH2 O C
C
n
O CH2 CH2 OH
полиэфир (полиэтилентерефталат, "лавсан")
19.
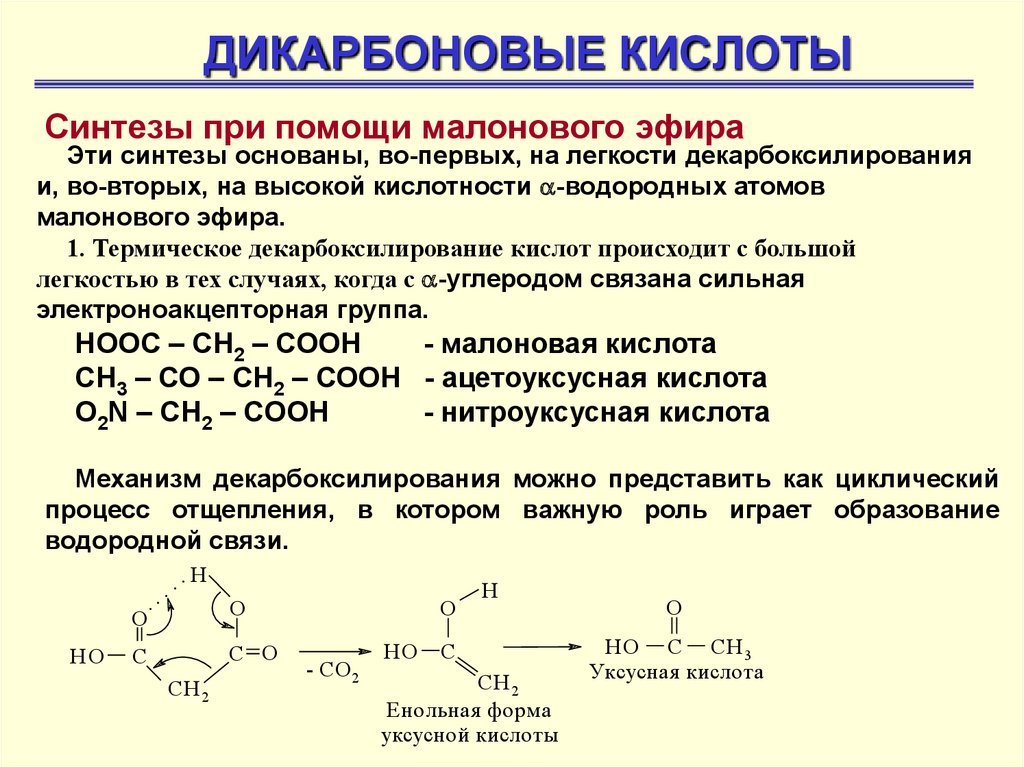
ДИКАРБОНОВЫЕ КИСЛОТЫСинтезы при помощи малонового эфира
Эти синтезы основаны, во-первых, на легкости декарбоксилирования
и, во-вторых, на высокой кислотности -водородных атомов
малонового эфира.
1. Термическое декарбоксилирование кислот происходит с большой
легкостью в тех случаях, когда с -углеродом связана сильная
электроноакцепторная группа.
НООС – СН2 – СООН
- малоновая кислота
СН3 – СО – СН2 – СООН - ацетоуксусная кислота
О2N – CH2 – COOH
- нитроуксусная кислота
Механизм декарбоксилирования можно представить как циклический
процесс отщепления, в котором важную роль играет образование
водородной связи.
..
.
..
HO
H
O
O
C
C O
CH 2
O
- СО 2
HO
H
C
CH 2
Енольная форма
уксусной кислоты
O
НО С СН 3
Уксусная кислота
20.
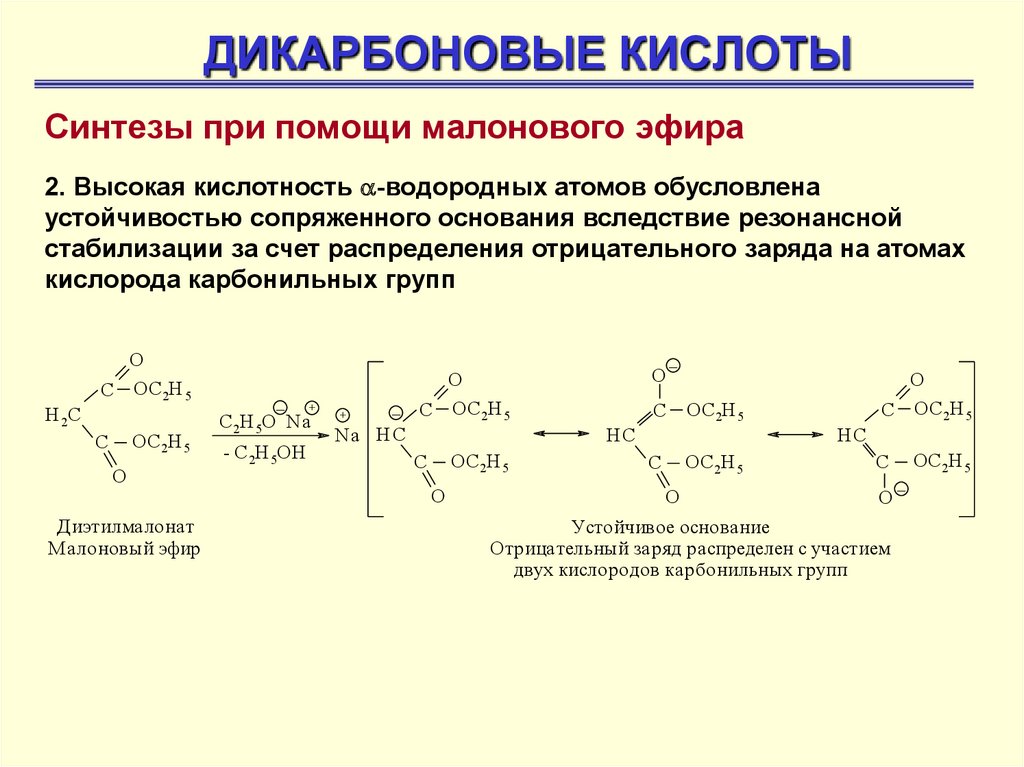
ДИКАРБОНОВЫЕ КИСЛОТЫСинтезы при помощи малонового эфира
2. Высокая кислотность -водородных атомов обусловлена
устойчивостью сопряженного основания вследствие резонансной
стабилизации за счет распределения отрицательного заряда на атомах
кислорода карбонильных групп
O
С
ОС 2Н 5
Н 2С
ОС 2Н 5
С
O
Диэтилмалонат
Малоновый эфир
_
+
С 2Н 5О Na
- С 2Н 5ОН
+
_
С
O
O
ОС 2Н 5
С
Na НС
_
O
ОС 2Н 5
НС
ОС 2Н 5
С
O
ОС 2Н 5
С
НС
ОС 2Н 5
С
O
С
O
Устойчивое основание
Отрицательный заря д распределен с участием
двух кислородов карбонильных групп
_
ОС 2Н 5
21.
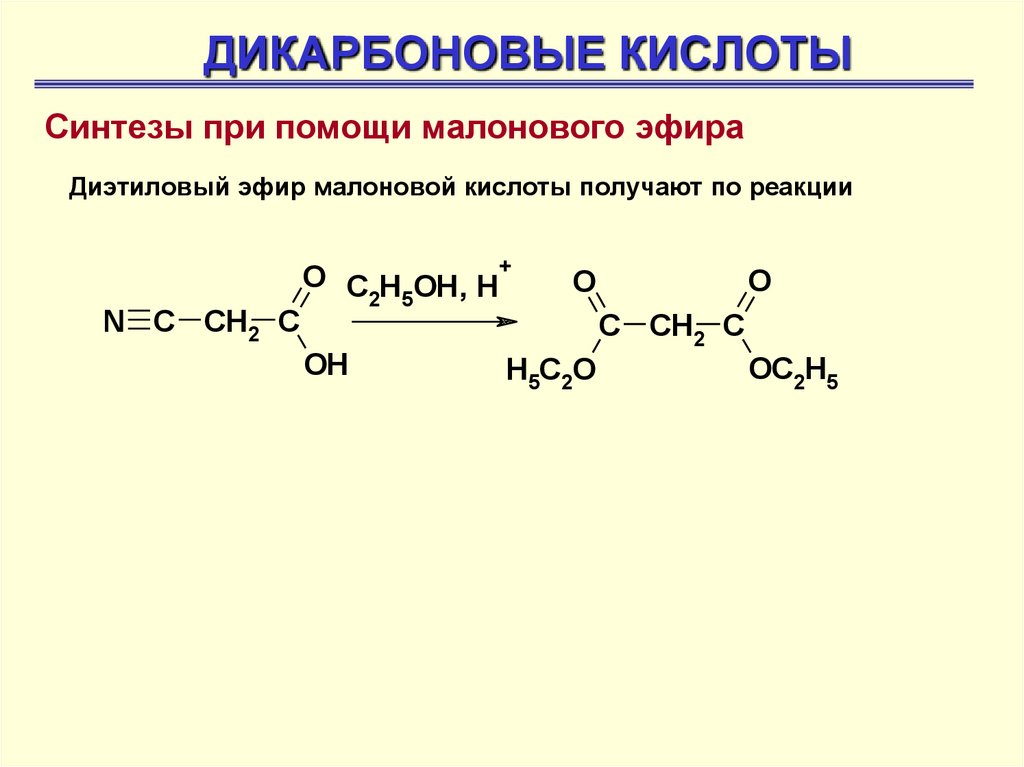
ДИКАРБОНОВЫЕ КИСЛОТЫСинтезы при помощи малонового эфира
Диэтиловый эфир малоновой кислоты получают по реакции
N C CH2 C
O C H OH, H+
2 5
OH
O
O
H5C2O
C CH2 C
OC2H5
22.
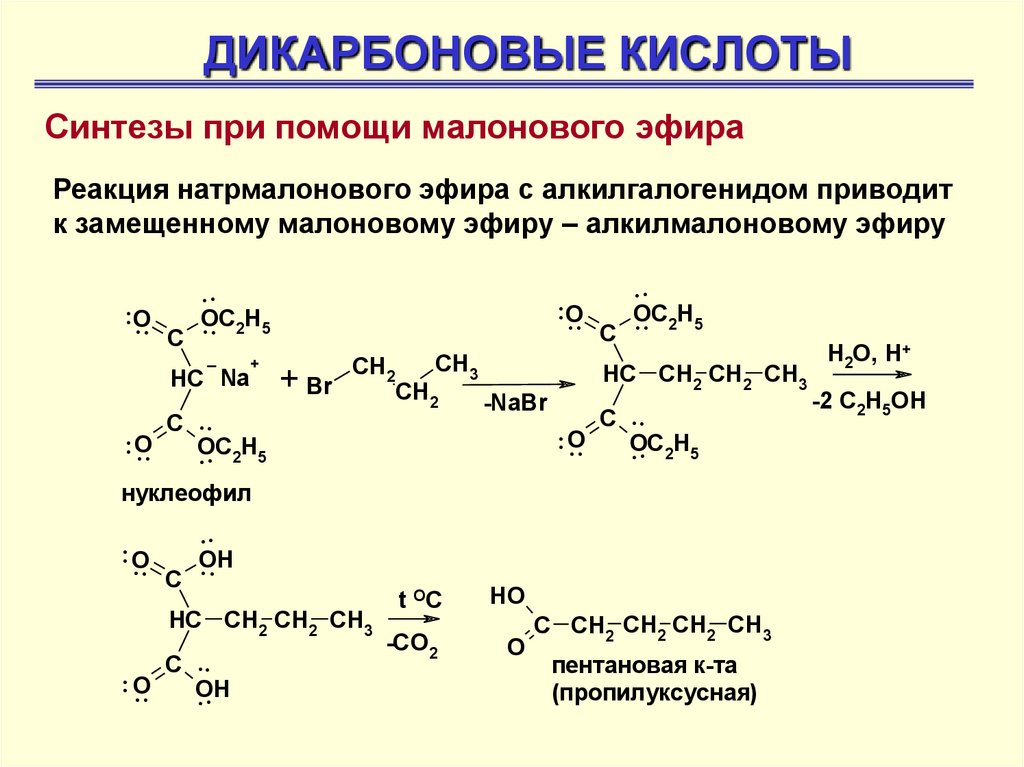
ДИКАРБОНОВЫЕ КИСЛОТЫСинтезы при помощи малонового эфира
Реакция натрмалонового эфира с алкилгалогенидом приводит
к замещенному малоновому эфиру – алкилмалоновому эфиру
.. O
..
C
..
OC
. . 2H5
HC Na
.. O
..
+
.. O
..
+ Br
CH2
C ..
OC
. . 2H5
CH3
CH2
-NaBr
t OC
HO
-CO2
O
C
..
OC
. . 2H5
HC CH2 CH2 CH3
C ..
.. O
OC
..
. . 2H5
нуклеофил
..
O
..
C
..
OH
..
HC CH2 CH2 CH3
..
.. O C
OH
..
..
C CH2 CH2 CH2 CH3
пентановая к-та
(пропилуксусная)
H2O, H+
-2 C2H5OH
23.
ДИКАРБОНОВЫЕ КИСЛОТЫСинтезы при помощи малонового эфира
Эта реакция представляет собой нуклеофильное замещение в
галогеналканах с наибольшим выходом в случае первичных
галогеналканов, с меньшим – с использованием вторичных.
Реакция не имеет практической ценности в случае третичных
галогеналканов
24.
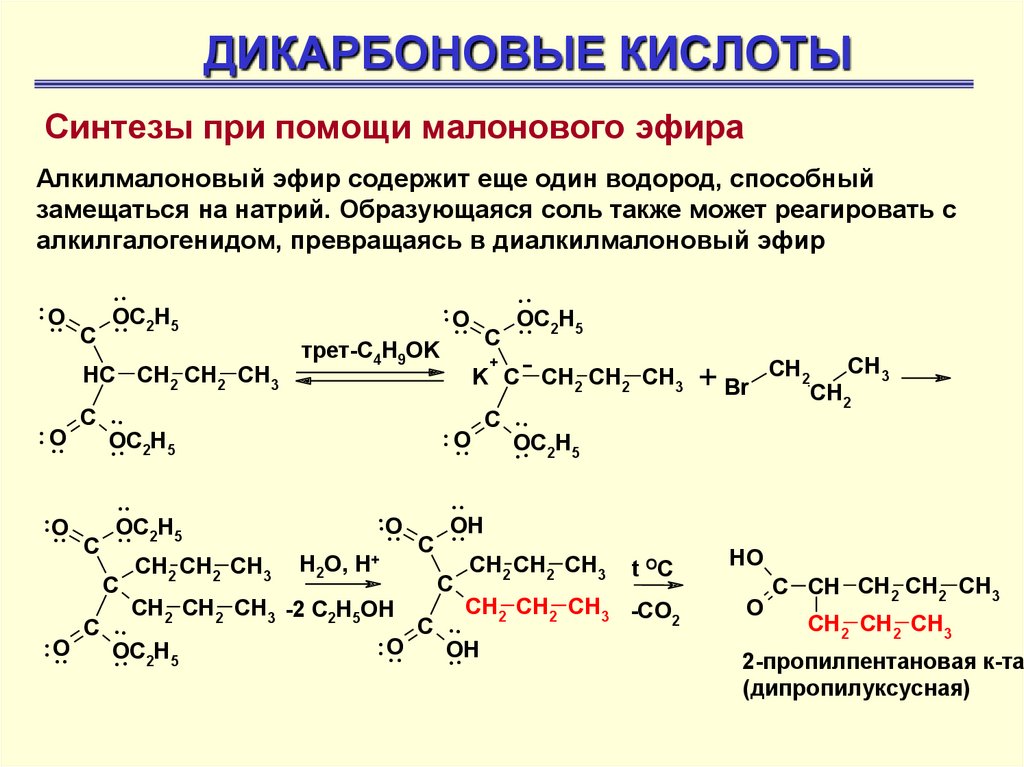
ДИКАРБОНОВЫЕ КИСЛОТЫСинтезы при помощи малонового эфира
Алкилмалоновый эфир содержит еще один водород, способный
замещаться на натрий. Образующаяся соль также может реагировать с
алкилгалогенидом, превращаясь в диалкилмалоновый эфир
..
..
OC
O
.. 2H5
..
C
HC CH2 CH2 CH3
.
.. O C .
OC
..
. . 2H5
трет-C4H9OK
..
O
..
C
..
OC
. . 2H5
+
K C CH2 CH2 CH3
.
.. O C .
OC
..
. . 2H5
..
..
..
OH
O
OC
..
..
. . 2H5
C
C
CH2 CH2 CH3 t OC
CH2 CH2 CH3 H2O, H+
C
C
CH2 CH2 CH3 -CO
CH2 CH2 CH3 -2 C2H5OH
2
C ..
C ..
.. O
.. O
OH
H
OC
..
..
..
.
5
2
.
..
O
..
+ Br
CH2
CH3
CH2
HO
O
C CH CH2 CH2 CH3
CH2 CH2 CH3
2-пропилпентановая к-та
(дипропилуксусная)
25.
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
Малоновую кислоту синтезируют из уксусной кислоты
СН 3СООН
Уксусная
кислота
N
Сl2
C
ClСН 2СООН
Хлоруксусная
кислота
-
+
CH 2 COO Na
-
NaOH
H 2O
H 3O,
+
+
ClСН 2СОО Na
T
NaС N
H 2O
HOOC CH 2 COOH
Малоновая кислота
26.
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
Янтарную и глутаровую кислоты можно получить через
соответствующие динитрилы
Br
(CH 2)n
2NaCN
Br
N
(ДМСО)
HOOC
(CH 2)n
C
COOH,
(CH 2)n
C
N
где n= 2 или 3
H 2O (изб.)
H 2SO 4, T
27.
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
Янтарную кислоту получают также и по следующей схеме
O
Бензол
О 2/V2O 3
H
450 o C
H
O
H 2O, T
O
М алеиновый
ангидрид
H
H
СOOH
СOOH
М алеиновая
кислота
H 2, Pt CH 2
COOH
CH 2
COOH
Янтарная кислота
28.
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
Глутаровая и адипиновая кислоты образуются окислением
циклопентанона и циклогексанона соответственно. При этом в
промышленности
в
качестве
окислителя
применяют
разбавленную азотную кислоту
O
HNO 3 (50 %), T
HOOC CH 2CН 2CH 2 COOH
Глутаровая кислота
O
H N O 3 (50 %), T
HOOC
CH 2СН 2CН 2CH 2 COOH
Адипиновая кислота
29.
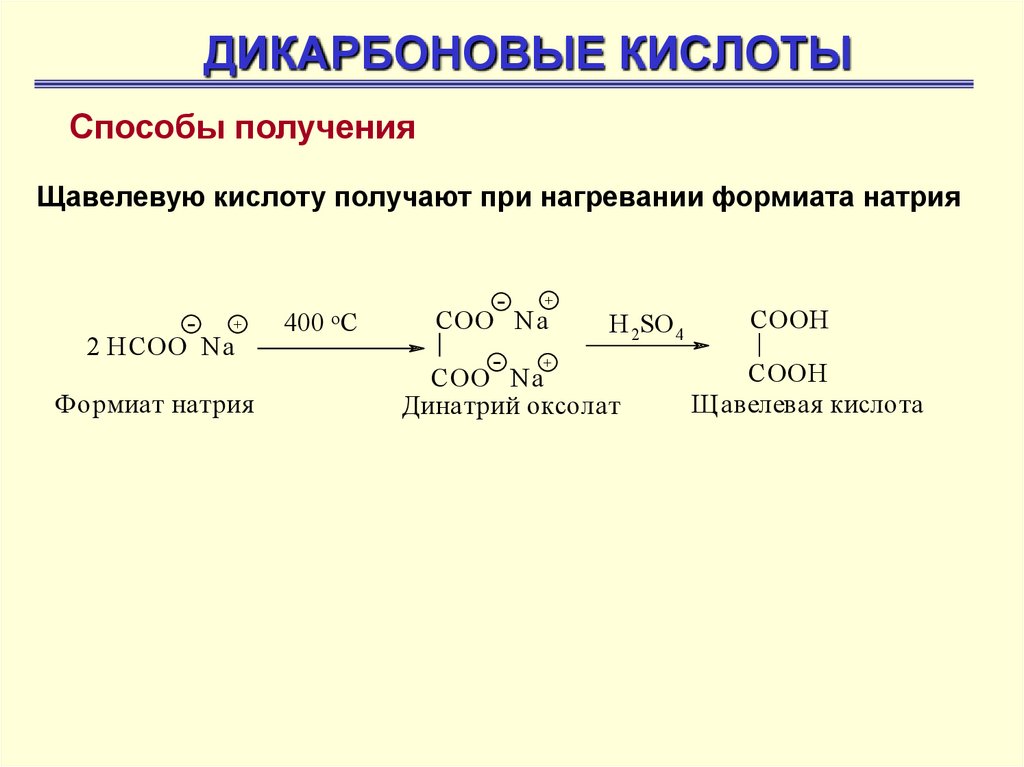
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
Щавелевую кислоту получают при нагревании формиата натрия
- +
2 НСОО Na
Формиат натрия
400 o C
-
+
СOO Na
H 2SO 4
+
СOO Na
Динатрий оксолат
СOOH
СOOH
Щ авелевая кислота
30.
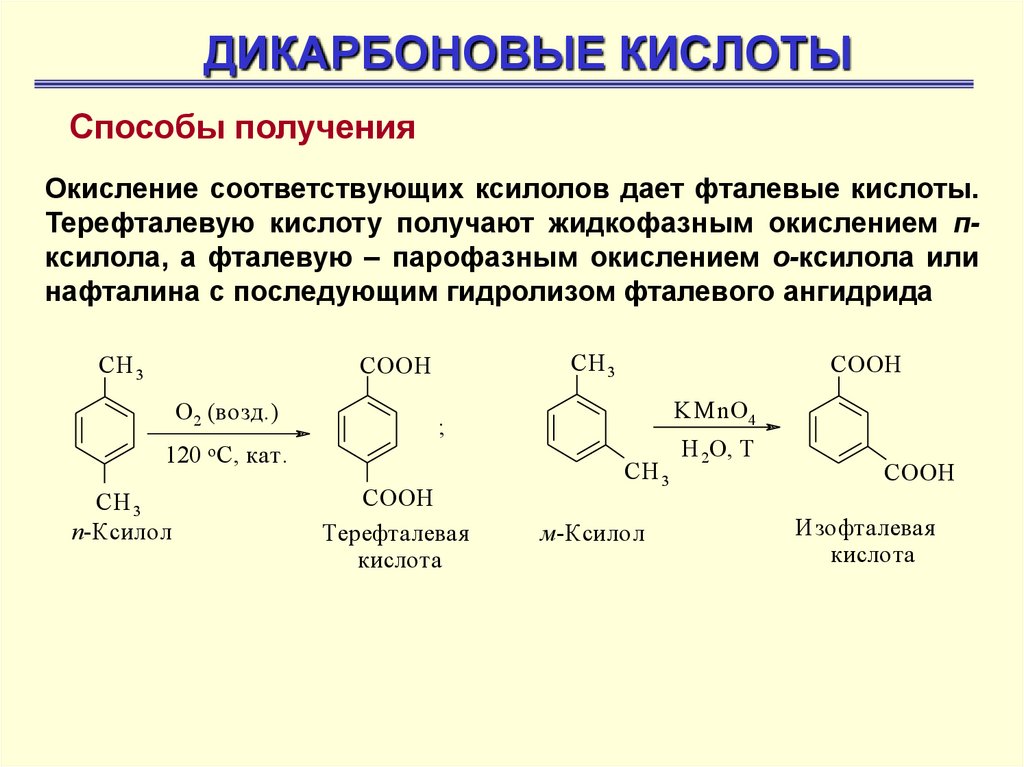
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
Окисление соответствующих ксилолов дает фталевые кислоты.
Терефталевую кислоту получают жидкофазным окислением пксилола, а фталевую – парофазным окислением о-ксилола или
нафталина с последующим гидролизом фталевого ангидрида
СН 3
СН 3
СООН
О 2 (возд.)
KM nO 4
;
120 о С, кат.
СН 3
п-Ксилол
СООН
СООН
Терефталевая
кислота
СН 3
м-Ксилол
H 2O, T
СООН
Изофталевая
кислота
31.
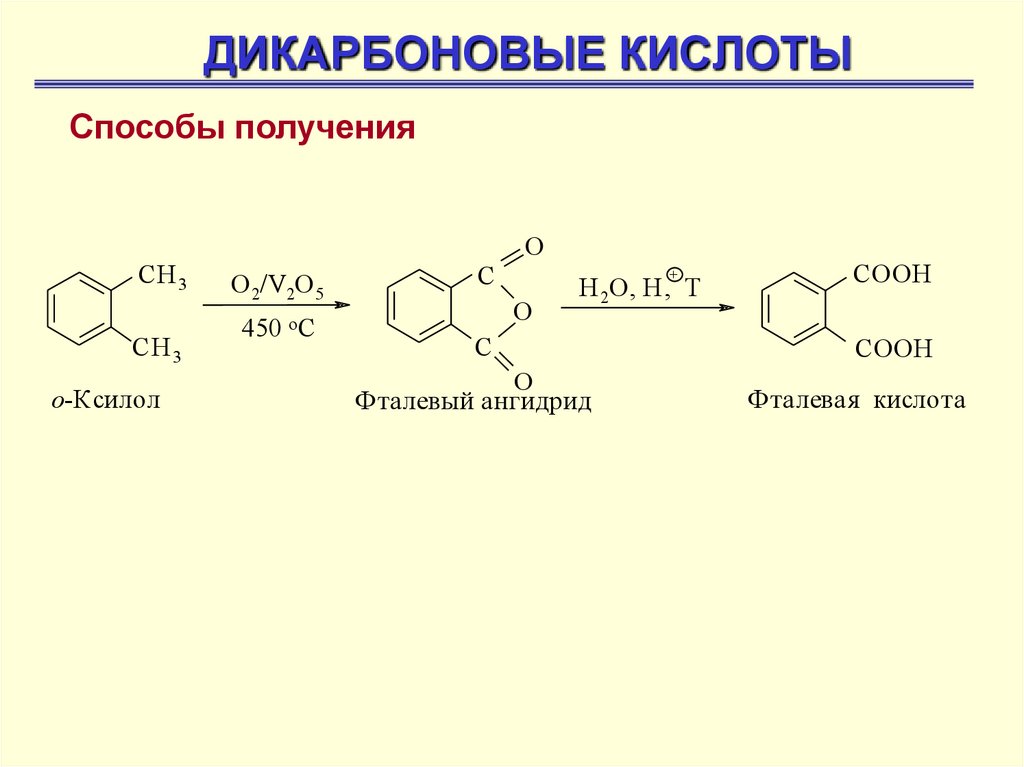
ДИКАРБОНОВЫЕ КИСЛОТЫСпособы получения
СН 3
СН 3
о-Ксилол
O
О 2/V2O 5
450 о С
C
+
O
H 2O, H, T
C
O
Фталевый ангидрид
СООН
СООН
Фталевая кислота
32.
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫакриловая кислота, пропеновая
CH3-CH=CH-COOH кротоновая кислота, 2-бутеновая
CH2=CH-CH2-COOH
винилуксусная кислта,
3-бутеновая
CH2=C-COOH
-метилакриловая кислота,
метакриловая, метилпропеновая
CH3
CH2=CH-COOH
CH3-(CH2)7-CH=CH-(CH2)7-COOH
олеиновая кислота
CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7 -COOH
Цис,цис-октадекадиен-9,12-овая к-та (линолевая
кислота)
СH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)7-COOH
цис,цис,цис-октадекатриен-9,12,15-овая (линоленовая
кислота)
33.
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫСвойства ненасыщенных карбоновых кислот типа
RCH=CH-(CH2)nCOOH в тех случаях, когда n велико и
функциональные группы удалены друг от друга на большое
расстояние, обычно соответствуют свойствам изолированных
двойных связей и изолированных карбоксильных групп.
Специфические свойства проявляют , -ненасыщенные
карбоновые кислоты
34.
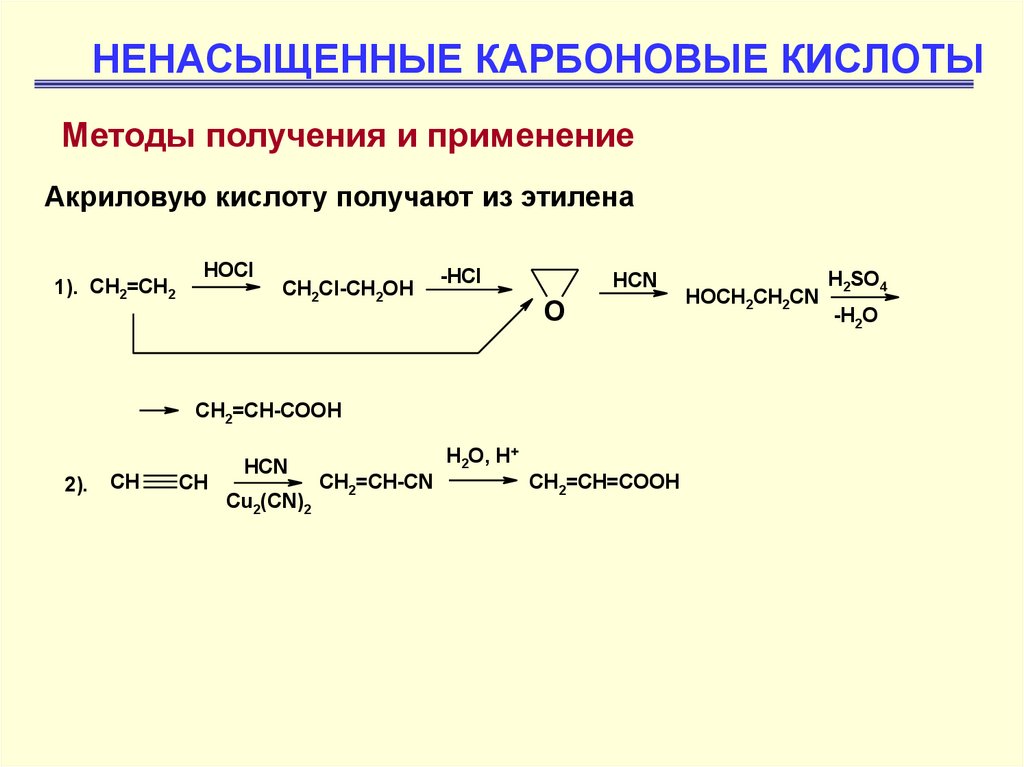
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫМетоды получения и применение
Акриловую кислоту получают из этилена
1). CH2=CH2
HOCl
CH2Cl-CH2OH
-HCl
HCN
O
CH2=CH-COOH
2).
CH
CH
HCN
Cu2(CN)2
H2O, H+
CH2=CH-CN
CH2=CH=COOH
HOCH2CH2CN
H2SO4
-H2O
35.
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫМетоды получения и применение
Метилакрилат получают из этиленциангидрина (нитрил оксипропионовой кислоты) или из акрилонитрила
HOCH2CH2CN + CH3OH
H2SO4
CH2=CH-COOCH3 + NH3
Серная кислота способствует дегидратации и омылению
нитрила, а также образованию эфира
36.
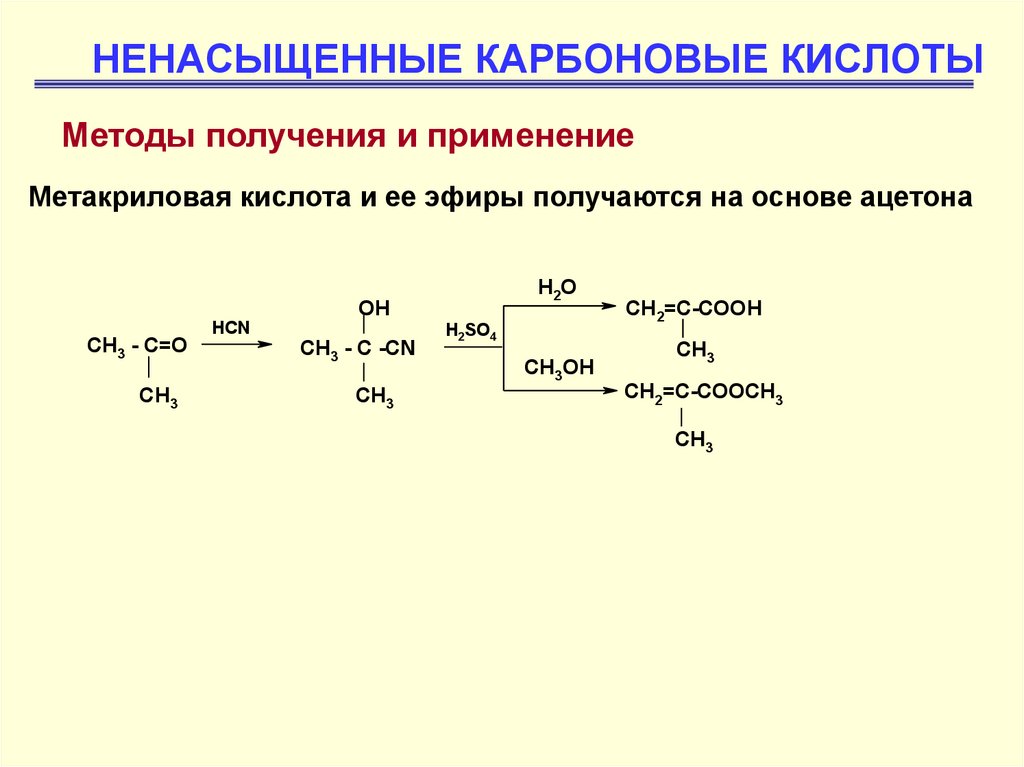
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫМетоды получения и применение
Метакриловая кислота и ее эфиры получаются на основе ацетона
H2O
OH
CH3 - C=O
CH3
HCN
CH3 - C -CN
CH3
H2SO4
CH3OH
CH2=C-COOH
CH3
CH2=C-COOCH3
CH3
37.
НЕНАСЫЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫМетоды получения и применение
Метилметакрилат и другие акрилаты при полимеризации и
сополимеризации образуют стекловидные полимеры с ценными
техническими свойствами
CO2CH3 CO2CH3 CO2CH3
n
CH2 = C - COOCH3
CH3
AdR
-CH2 - C - CH2 - C - CH2 - C CH3
CH3
CH3
Олеиновая, линолевая и линоленовая и другие кислоты входят
в состав растительных и животных жиров – простых липидов

















 chemistry
chemistry








