Similar presentations:
Дикарбоновые , гидроксикислоты
1.
Дикарбоновые кислоты
Ароматические кислоты
Гидроксикислоты
1
2.
Предельные дикарбоновые кислотыФормула
HOOC – COOH
HOOC – CH2 – COOH
HOOC – (CH2)2 –COOH
HOOC – (CH2)3 –COOH
HOOC – (CH2)4 –COOH
Номенклатура
Кислота
Тривиальная
щавелевая
Систематическая
заместительная
ИЮПАК
этандиовая
Тривиальная
малоновая
ИЮПАК
пропандиовая
Тривиальная
янтарная
ИЮПАК
бутандиовая
Тривиальная
глутаровая
ИЮПАК
пентандиовая
Тривиальная
адипиновая
2
ИЮПАК
гександиовая
Соль и
эфир
Ацил (RCO)
оксалат
оксалил
малонат
малонил
сукцинат
сукцинил
глутарат
глутарил
адипинат
адипинил
2
3.
*Карбоксильнаягруппа проявляет сильные
электроноакцепторные свойства, и поэтому
дикарбоновые
кислоты
являются
более
сильными кислотами, чем соответствующие
монокарбоновые.
*Свойства
дикарбоновых кислот похожи на
свойства
монокарбоновых
кислот,
за
некоторыми исключениями, которые особенно
проявляются
для
первых
членов
гомологического ряда.
3
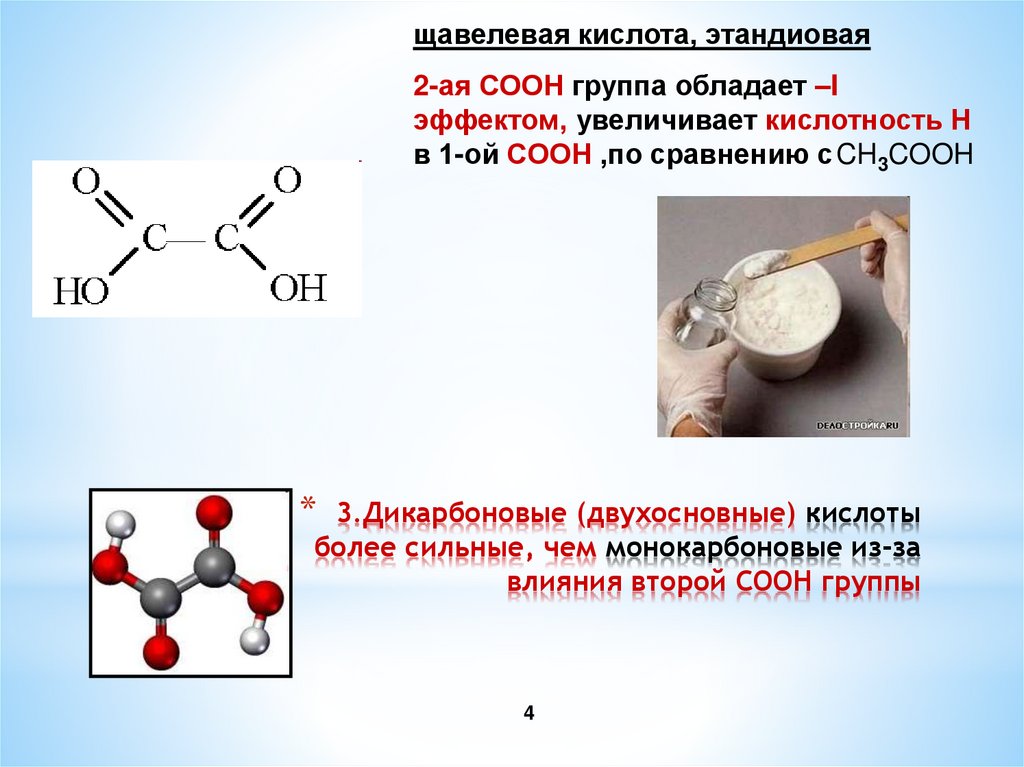
4. 3.Дикарбоновые (двухосновные) кислоты более сильные, чем монокарбоновые из-за влияния второй СООН группы
щавелевая кислота, этандиовая2-ая СООН группа обладает –I
эффектом, увеличивает кислотность Н
в 1-ой СООН ,по сравнению с CH3COOH
*
3.Дикарбоновые (двухосновные) кислоты
более сильные, чем монокарбоновые из-за
влияния второй СООН группы
4
5. Щавелевая кислота
*Щавелевая кислота накапливается, когда
листья стареют, в молодых листьях ее немного
Щавелевая кислота и ее соли токсичны
Оксалатные камни в почках
5
6.
HOOC – CH2 –COOHмалоновая кислота,пропандиовая
кислотность меньше,чем у
щавелевой кислоты ,так как 2СООН
группы разделены
Малоновая кислота участвует в
синтезе барбитуратов
HOOC – (CH2)2 –COOH
янтарная кислота
Чем дальше СООН – группы друг от друга,
тем меньше их взаимное влияние.
6
7.
Янтарная кислота оказывает мощное оздоровительное действиена организм
Получается в результате
переработки натурального
янтаря
Содержится в небольших
количествах- в сыре,
кисломолочных продуктах
и морепродуктах
Используется против
старения кожи
7
8.
* 2. Поведение при нагревании* Декарбоксилирование
150oC
HOOC COOH
HCOOH + CO2
160-180o
CO2
HOOC
COO H
t
CO
H2SO4 (k)
HOOC
+ HCOOH
CH2 COOH
150oC
8
+ CO2
+ H 2O
CH3COOH + CO2
9.
ДегидратацияO
H2C
H2C
C
C
O
OH
t
C
H2C
O
H2C
OH
+
H2O
C
O
O
янтарная кислота
ангидрид янтарной кислоты
!!! Адипиновая кислота в этих условиях подвергается
декарбоксилированию и дегидратации
O
CH 2
C
(CH 2)2
CH 2
C
OH
t = 300
OH
- H2O
- CO2
C
9
O
o
O
10.
* 3. Окисление дикарбоновых кислот10
11.
* АРОМАТИЧЕСКИЕ КИСЛОТЫCOOH
COOH
COOH
COOH
COOH
бензойная кислота
фталевая кислота
11
терефталевая кислота
12.
* 1. Химические свойства* Ароматические кислоты проявляют более выраженные
кислотные свойства, чем обычные карбоновые кислоты
жирного ряда.
* Фталевая кислота, являясь дикарбоновой кислоты, при
нагревании образует ангидрид
O
O
C OH
C
t
O
C OH
C
O
O
12
+
H2O
13.
* 2. Получение ароматических карбоновых кислотCH3
COOH
[O]
Бензойная кислота, C6H5COOH, бесцветные кристаллы, tпл 122,4 °C.
Применяют в производстве красителей, лекарственных и душистых
веществ, алкидных смол, в медицине применяется как наружное средство
противомикробного и фунгицидного действия; бензоат натрия —
отхаркивающее средство, консервант для пищевых продуктов. Бензойная
кислота является одной из наиболее давно известных органических
кислот. Ещё в начале 17 века её получили, возгоняя бензойную смолу
(отсюда название и бензойной кислоты и бензола).
13
14.
CH3COOH
[O]
CH3
п-ксилол
COOH
терефталевая кислота
Терефталевая кислота и её диметиловый эфир используются для
производства полиэтилентерефталата, из которого получают полиэфирное
волокно лавсан, более известный как полиэстер.
Хлорангидрид терефталевой кислоты используется для изготовления
сверхпрочного полимера кевлара
Нижник Я.П.
http://norgchem.professorjournal.ru
14
30.05.2022
15.
OO
C
C OH
O2, V2O5, t
нафталин
O
H2O
C
C OH
O
O
фталевый ангидрид
фталевая кислота
Фталевый ангидрид, бесцветные кристаллы, tпл 130,8 °С (с возгонкой).
Сырье в производстве алкидных смол (глифталевых смол), пластификаторов
(эфиров фталевой кислоты), многообразных красителей, лекарственных
препаратов.
В частности из фталевого ангидрида и фенола синтезируют фенолфталеин –
индикатор и лекарственный препарат слабительного действия (пурген).
15
30.05.2022
16.
* ГИДРОКСИКИСЛОТЫ (ОКСИКИСЛОТЫ)Гидроксикислоты содержат в молекуле две функциональные группы –
карбоксильную (COOH) и гидроксильную (OH)
1. Номенклатура
Карбоксильная группа (COOH) по номенклатурным
правилам является более старшей, чем гидроксигруппа
(OH), поэтому карбоксильная группа определяет в
названии кислоты окончание (-овая), а гидроксигруппа –
приставку
CH3 CH COOH
OH
2-гидроксипропановая кислота
16
17.
ФормулаCH2 COOH
Название по IUPAC
Тривиальное
названия Т.
[рациональное название]
кислоты и соли
oC
Гидроксиэтановая
Гликолевая,
80
кислота
Гликолаты
2-гидроксипропановая
Молочная,
кислота,
Лактаты
[a-оксипропионовая]
(лат. lactis – молоко)
Гидроксибутандиовая
Яблочная кислота
кислота,
Малаты
пл.
*
OH
CH3 CH COOH
OH
HOOC CH2 CH COOH [оксиянтарная]
OH
(лат. malus – яблоня)
17
18
128
18.
2-гидрокси-1,2,3-COOH
Лимонная кислота,
153
пропантрикарбоновая кислота Цитраты
CH2
(лат. citrus – лимон)
HO C COOH
CH2
COOH
1-гидрокси-1,2,3-
COOH
Изолимонная
100
пропантрикарбоновая кислота кислота,
HO CH
CH COOH
Изоцитраты
CH2
COOH
2,3-дигидроксибутандиовая
HOOC CH CH COOH
OH OH
COOH
OH
кислота,
Винная кислота,
205
Тартраты
[a,b-диоксиянтарная кислота]
2-гидроксибензойная
Салициловая
кислота,
кислота,
орто-гидроксибензойная
18
Салицилаты
(лат. Salix – ива)
159
30.05.2022
19.
*2. Изомерия* 2.1. Структурная изомерия
* 2.1.1. Изомерия положения гидроксигруппы
CH2 CH2 COOH
CH3 CH COOH
OH
OH
2-гидроксипропановая кислота
3-гидроксипропановая кислота
* 2.1.2. Изомерия углеродного скелета
CH3
CH3 CH2 CH COOH
CH3 C
OH
2-гидроксибутановая кислота
COOH
OH
2-гидрокси-2-метилпропановая кислота
19
20.
* 2.1.3. Межклассовая изомерияCH3 CH COOH
CH3 O CH2 COOH
OH
2-гидроксипропановая кислота
метоксиуксусная кислота
20
30.05.2022
21.
* 2.2. Пространственная изомерия* Пространственная изомерия делится
на
изомерию (энантиомерию) и диастереомерию.
оптическую
* Энантиомерия возможна в том случае, если через молекулу
невозможно провести плоскость симметрии – плоскость,
делящую молекулу на две абсолютно равные половины.
H
CH3 C
COOH
OH
21
30.05.2022
22.
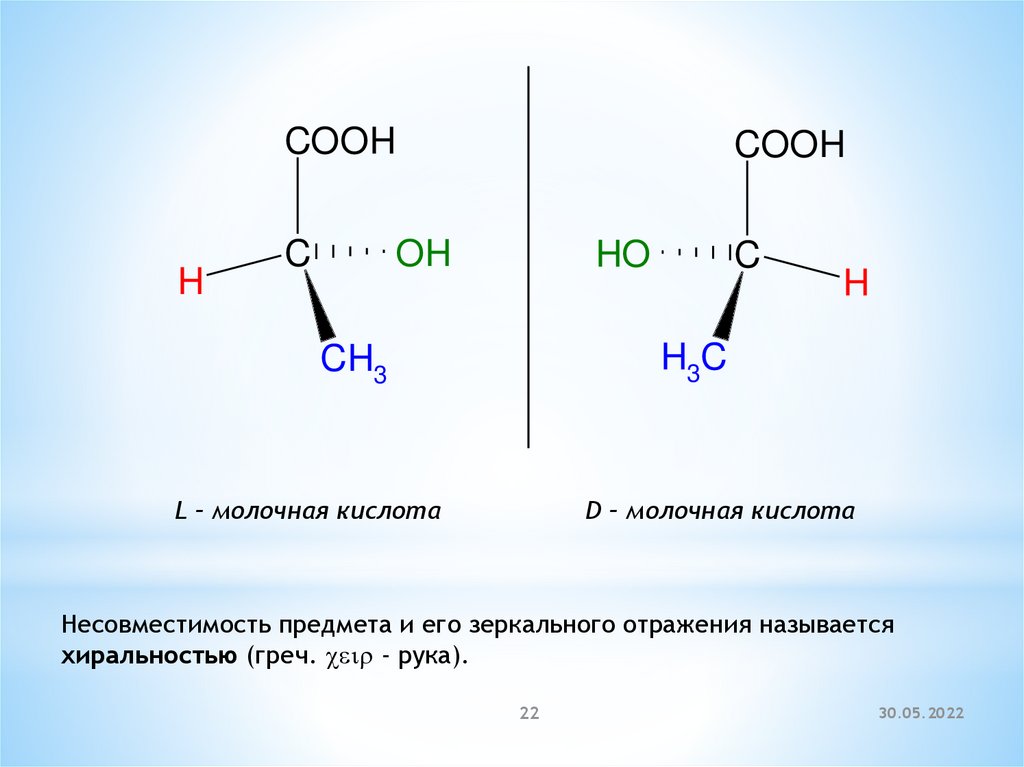
COOHH
C
COOH
OH
HO
C
H
H3C
CH3
L – молочная кислота
D – молочная кислота
Несовместимость предмета и его зеркального отражения называется
хиральностью (греч. ceir - рука).
22
30.05.2022
23.
* 2. Физические и биологические свойства* Гидроксикислоты являются, как правило, твёрдыми
телами.
Рацемическая молочная кислота может быть жидкой (т. пл.
18оС).
* Запахом гидроксикислоты почти не обладают.
* Гидроксикислоты имеют очень большое
значение в
биологической химии; их можно встретить во многих очень
важных метаболических путях – цикле Кребса, гликолизе,
пентозофосфатном цикле, b-окислении жирных кислот,
биосинтезе жирных кислот и т.д.
23
30.05.2022
24.
*3. Химические свойства* Гидроксикислоты являются одновременно и кислотами и спиртами,
поэтому могут проявлять свойства и карбоновых кислот и спиртов.
* 3.1. Кислотные свойства
H3C CH COOH
+
H3C CH COO Ca
Ca(OH)2
OH
OH
молочная кислота
+
2 H2O
2
лактат кальция
Лактат кальция используется как модификатор в кондитерской
промышленности, в медицине как кальциевый препарат, растворы
используются для опрыскивания фруктов с целью их сохранения
24
30.05.2022
25.
* 3.2.Образование сложных эфиров
CH3 CH COOH
+
C2H5OH
H2SO4, t
OH
CH3 CH COOC2H5
+
H2O
OH
этиллактат
Этиллактат (этиловый эфир молочной кислоты), бесцветная жидкость,
т.кип. 154 oC. Используется как растворитель эфиров целлюлозы и олиф и
как ароматизирующее вещество для пищевых продуктов.
O
CH3 CH COOH
+
CH3 C Cl
CH3 CH COOH
OH
+
HCl
O
O C
CH3
2-ацетоксипропановая кислота
ацетилхлорид
25
30.05.2022
26.
COOHCOOH
O
CH3 C
OH
+
O C CH3
O
O
CH3 C
O
+
CH3 C
O
O
салициловая
кислота
уксусный
ангидрид
ацетилсалициловая
кислота
Ацетилсалициловая кислота (аспирин), t.пл. 133-138оС. Анальгезирующее,
противовоспалительное, жаропонижающее и разжижающее кровь средство.
26
30.05.2022
H
27.
* 3.3.Поведение при нагревании
* a-Гидроксикислоты при нагревании дают лактид – циклический
сложный эфир, содержащий две сложноэфирные группы в
составе цикла:
O
O H
CH3 O H
H O
H O
CH3
O
t
O
CH3
+
CH3
O
молочная кислота
O
2 H2O
O
лактид
27
30.05.2022
28.
* b-Гидроксикислоты при нагревании отщепляют воду(реакция элиминирования), образуя ненасыщенные кислоты:
t
CH2 CH2 COOH
CH2 CH COOH
+
H2O
OH
b-гидроксипропионовая
пропеновая (акриловая)
кислота
кислота
28
30.05.2022
29.
* g- и d-гидроксикислоты при нагревании отщепляют воду,циклизуются с образованием лактонов – циклических сложных
эфиров
O
a
b
CH2
O
a
CH2 C
C
OH
t
b CH2
CH2
CH2 O H
g-гидроксимасляная кислота
g-бутиролактон
O
O
C
C H
b C H
a
O H
2
t
O H
d
2
C H
g
H2O
CH2
g
g
a
+
O
C H
2
2
d-гидроксивалериановая кислота
C
C H
2
b C H
2
O
d C H
C H
g
+
H 2O
2
2
d-валеролактон
30.05.2022
29
30.
COOHOH
OH
t
+
30
CO2
30.05.2022




























 chemistry
chemistry








