Similar presentations:
Классические распределения частиц идеального газа
1.
ГЛАВА II. МОЛЕКУЛЯРНАЯФИЗИКА И
ТЕРМОДИНАМИКА
§7. Классические
распределения частиц
идеального газа
О. И. Лубенченко
НИУ МЭИ
Кафедра физики им. В. А. Фабриканта
2020
2.
§7. Распределения молекулI. Функция распределения
Пусть имеется термодинамическая система из N частиц.
ξ — ФВ, характеризующая частицу. Вероятность того, что величина ξ будет
иметь значение ξi:
N
Pi
i
N
Ni — количество частиц, для которых ξ = ξi
Условие нормировки:
Среднее значение ξ:
P 1
Nξ
Pξ
i
ξ
i i
i i
N
Если ξ изменяется непрерывно, то вероятность того, что ξ = (ξ, ξ + dξ)
dP f ξ dξ
f(ξ) — функция распределения вероятности (плотность
вероятности)
f ξ
dP
dξ
2
3.
§7. Распределения молекулПРИМЕР
Распределение Гаусса
Распределение Гаусса — функция вида
f ξ Ae
3
f(ξ)
α ξ ξ 0
2
ξ0 — постоянная
α — положительная постоянная
A находят из условия нормировки
0
ξ0
По такому закону распределяются результаты серии большого числа
случайных измерений.
Свойства функции распределения
• Определённость и непрерывность во всей области определения ξ(a, b)
• Дифференцируемость во всей области определения
• Интегрируемость во всей области определения
b
Условие нормировки (нормируемость):
f ξ dξ 1
a
ξ
4.
§7. Распределения молекул4
Зная функцию распределения, можно найти среднее значение любого
параметра, зависящего от ξ.
Вероятность того, что ξ принимает значение от ξ1 до ξ2:
ξ2
P ξ 1 , ξ 2 f ξ dξ
ξ1
Среднее значение ξ:
b
ξ ξf ξ dξ
a
b
Среднее значение квадрата ξ:
ξ 2 ξ 2 f ξ dξ
a
b
Среднее значение функции φ(ξ):
φ φ ξ f ξ dξ
a
Наиболее вероятное значение ξ:
df ξ
dξ
0
ξ ξ вер
ξвер
5.
§7. Распределения молекул5
II. Распределение молекул идеального газа по скоростям (распределение
Максвелла)
Рассмотрим идеальный газ из N частиц. Случайная ФВ ξ — это модуль
скорости v молекул идеального газа. Найдём функцию распределения f(v).
vz
Рассмотрим подпространство фазового пространства
dv
— пространство скоростей (vx, vy, vz).
Плотность ИТ равна Nf(v).
v
Количество ИТ в сферическом слое радиуса v
толщиной dv: dN Nf v 4π v2d v
vy
O
Вероятность попадания ИТ в этот слой:
dN
vx
dP
f v 4π v2d v
N
Плотность вероятности F v
dP
f v 4π v2
dv
Так как все направления равноправны, f v φ1 v x φ2 v y φ3 vz
Функции φ1, φ2, φ3 одинаковы: φ1 = φ2 = φ3 = φ.
6.
§7. Распределения молекулln f v ln φ v ln φ v ln φ v
x
y
6
z
1 df v v
1 dφ vx
f v d v vx φ vx d vx
v
vx
v2x v2y v2z
vx
2vx
2 v2x v2y v2z
f v
const α
v f v
α v2x
ln φ vx
const
2
vx
v
φ vx
f v
v f v vx φ vx
v
1
1
f v x
φ vx
f v v φ vx
φ v y
f v
v f v v yφ v y
φ vz
f v
v f v vz φ vz
dφ vx
1
α
vx φ vx d vx
φ vx Ae
α v2
x
2
φ v y Ae
dφ vx
φ vx
α v2y
2
α v x d v x
φ vz Ae
α v2z
2
7.
§7. Распределения молекулf v A3e
φ vx d vx
φ v y dv y
α 2 2 2
v x v y vz
2
A3e
α v2
2
A e
α v2x
2
d vx 1
A
3
2
α
f v
e
2π
2
φ vz d vz 1
m0 v2x
7
α v2
2
1 3
kT
3 2
v2x
kT
m0
v
2
x
2
v
x φ vx d vx
α
φ vx
m0
e
2πkT
m v2
0 x
2kT
3
2
m
f v 0 e
2πkT
α
2π
m0 v2
2kT
3
2
m0
kT
m0 v2
2
2kT
m
F v 0 4π v e
2πkT
— функция распределения
Максвелла
8.
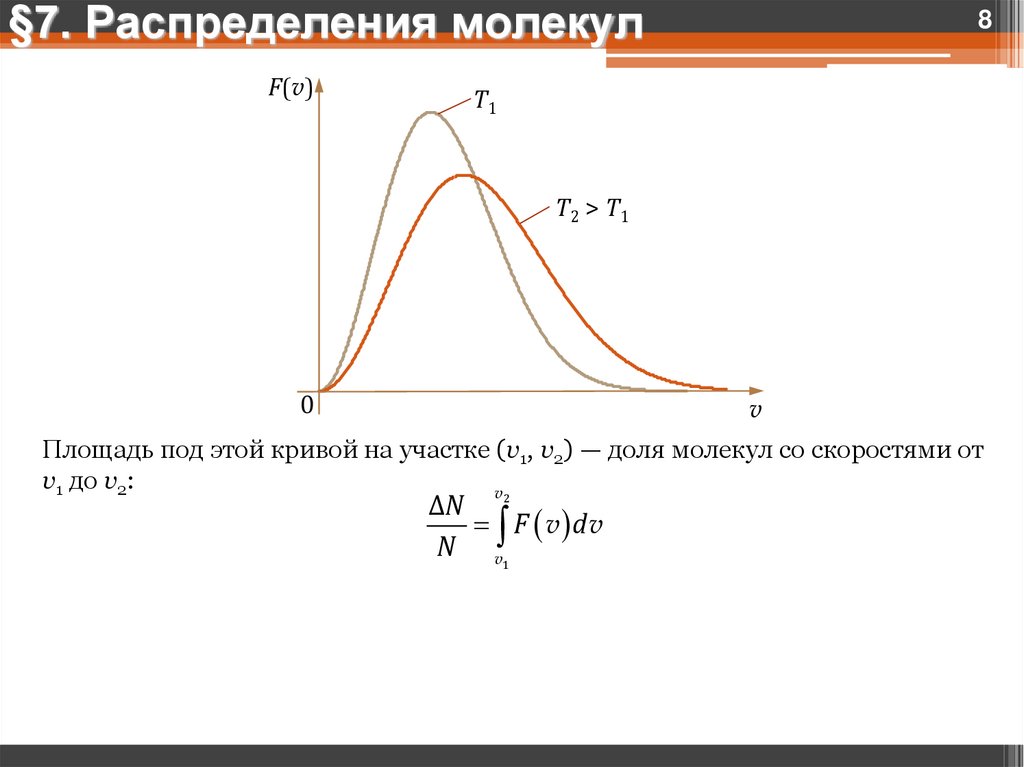
§7. Распределения молекулF(v)
8
T1
T2 > T1
0
v
Площадь под этой кривой на участке (v1, v2) — доля молекул со скоростями от
v1 до v2:
v
ΔN 2
F v dv
N v1
9.
§7. Распределения молекул9
Наивероятнейшая скорость молекулы идеального газа — скорость,
соответствующая максимуму функции распределения F(v):
dF v
dv
0
v vвер
2vверe
vвер
2
m0 vвер
2kT
v
2
вер
m0 2vвер
e
2kT
2
m0 vвер
2kT
0
2kT
2RT
m0
μ
Средняя скорость молекулы идеального газа:
v vF v d v
v
0
8kT
8RT
πm0
πμ
Средняя квадратичная скорость молекулы идеального газа:
v2 v2F v d v
0
3kT
m0
vкв
3kT
3RT
m0
μ
vвер v vкв
10.
§7. Распределения молекул10
F(v)
0
vвер v vкв
v
III. Распределение молекул идеального газа по энергиям
Число молекул с кинетическими энергиями поступательного движения от ε до
ε + dε:
dNε NF ε dε
Эти энергии соответствуют скоростям молекул от v до v + dv: dNε NF v d v
F ε dε F v d v
m0 v2
ε
2
v
2ε
m0
dv
F ε F v
dε
dv
2 1
1
dε
m0 2 ε
2m0 ε
11.
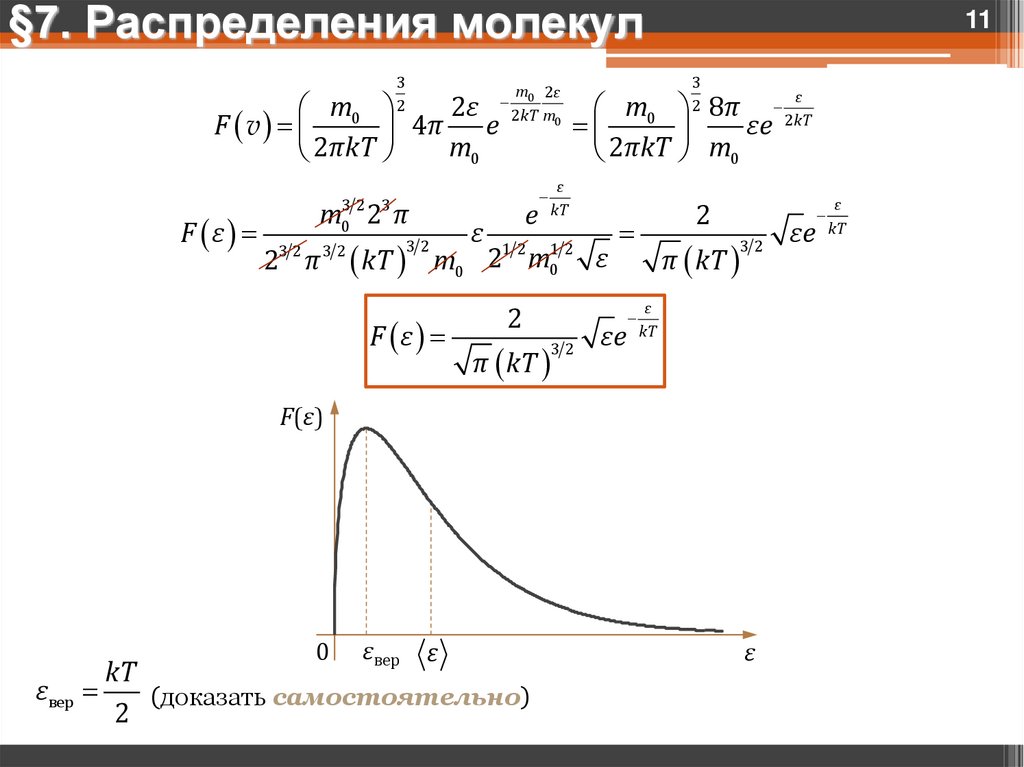
§7. Распределения молекул3
2
2ε
m
F v 0 4π e
m0
2πkT
F ε
m03 2 23 π
32
2 π
32
kT
32
ε
m 2ε
0
2kT m0
e
12
3
2
ε
m0 8π 2kT
εe
2πkT m0
ε
kT
12
0
m0 2 m
F ε
2
π kT
11
32
ε
2
εe
π kT
32
ε
kT
F(ε)
0
εвер
ε
kT
εвер
(доказать самостоятельно)
2
ε
εe
ε
kT
12.
§7. Распределения молекул12
IV. Барометрическая формула
Рассмотрим столб идеального газа (молярная масса µ) в однородном
гравитационном поле (ускорение свободного падения g) при постоянной
температуре T (изотермическая атмосфера). Найдём зависимость давления и
концентрации газа от высоты.
Выделим тонкий слой газа толщиной dh на высоте h.
T
dh
Давление этого слоя
dp ρgdh
p
g ρ — плотность газа
h
p0
pV
mRT
μ
p
mRT
μV
ρRT
μ
pμ
ρ
RT
ρ
0
pμg
dp
dh
RT
p
dp
μg
dh
p
RT
p
h
dp
μg
p p RT 0 dh
0
ln
p
μgh
p0
RT
p0 — давление столба газа на нулевом уровне
p p0e
μgh
RT
— барометрическая формула
ρ ρ0e
μgh
RT
n n0e
μgh
RT
13.
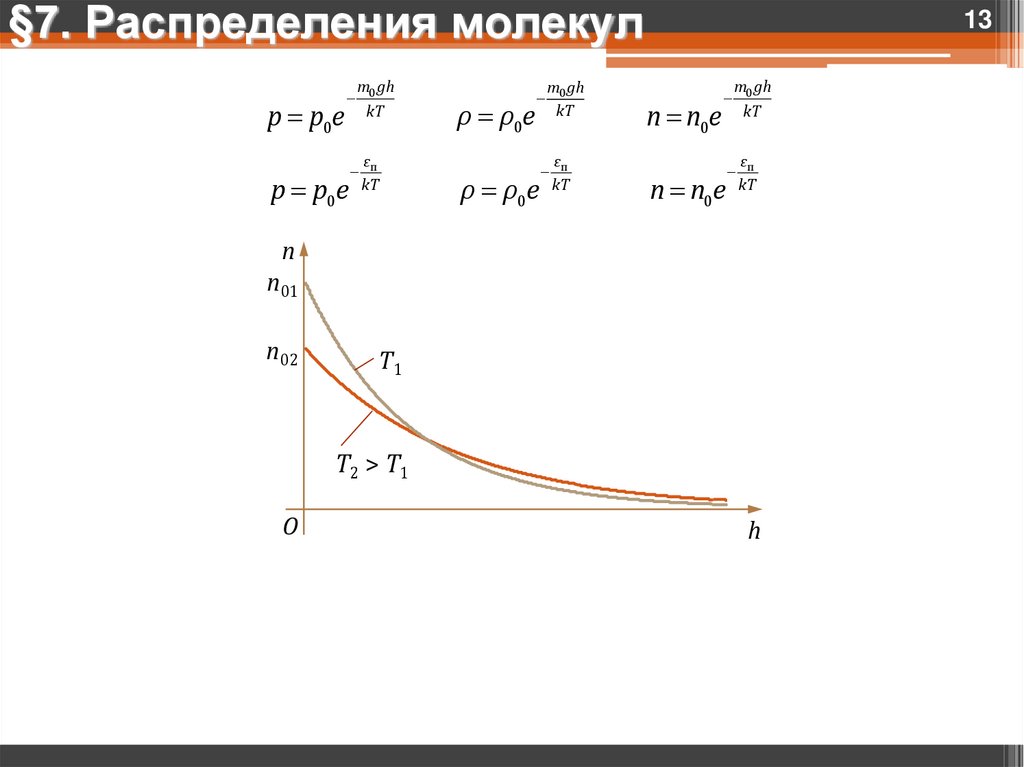
§7. Распределения молекулp p0e
p p0e
m0 gh
kT
εп
kT
ρ ρ0e
ρ ρ0e
m0 gh
kT
εп
kT
13
n n0e
n n0e
m0 gh
kT
εп
kT
n
n01
n02
T1
T2 > T1
O
h
14.
§7. Распределения молекул14
V. Распределение Максвелла-Больцмана
Распределение Больцмана: n n0e
εп
kT
εп — потенциальная энергия молекулы
n0 — концентрация молекул газа на нулевом уровне потенциальной энергии
3
2
Распределение Максвелла:
Распределение Больцмана:
ε
m0 kTк
dNεк N
e d v x d v y d vz
2πkT
dNεп n0e
εп
kT
3
2
dxdydz
ε ε
к п
m0
n0e kT d vx d v y d vz dxdydz
Закон Максвелла-Больцмана: dN
2πkT
— число частиц в элементе объёма фазового пространства
(dx, dy, dz, dvx, dvy, dvz)











 physics
physics








