Similar presentations:
Окислительно-восстановительные электроды
1. КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
2.
Окислительно-восстановительные электроды состоят изинертного металлического проводника, опущенного в раствор,
содержащий окислительно-восстановительную систему:
Ox, Red│Pt.
Потенциалопределяющая реакция: Ox + ze Red.
Уравнение для электродного потенциала:
Окислительно-восстановительные системы подразделяют на
простые и сложные. В простых системах в результате
электродной реакции происходит лишь изменение валентности
компонентов. Например, для электрода Fe3+, Fe2+ Pt
потенциалопределяющая реакция и уравнение электродного
потенциала:
a 3
0 RT
E E
ln Fe
Fe3+ + e Fe2+
F
a 2
Fe
3.
При увеличении рН электролита соль Fe3+ гидролизуется(при рН ≥ 3 образуется Fe(OH)3) и активность Fe3+ определяется
ПРFe(OH)3:
ПР Fe(OH )3
ПР Fe(OH )3
0 RT
E
E
ln
a 3
Fe
F
a3
a 2 a 3
Fe
OH
OH
т.е. равновесный потенциал зависит от рН раствора. При
дальнейшем увеличении рН ≥ 8 гидролизу подвергаются соли
Fe2+, образуется Fe(OH)2. Концентрация ионов Fe2+ определяется
уравнением:
ПР Fe(OH ) 2
a 2
Fe
a2
OH
ПРFe ( OH )3
RT
RT
0'
E E
ln
E
ln aOH
F
ПРFe ( OH ) 2 aOH
F
0
Таким образом, при подщелачивании сохраняется
зависимость от рН окислительно-восстановительного ферриферро электрода.
4.
В сложных системах происходит не только изменениевалентности, но и состава ионов. Например, для электрода
MnO4-, Mn2+, H+, H2O Pt потенциалопределяющая реакция и
уравнение для электродного потенциала:
MnO4- + 8H+ + 5e Mn2+ + 4H2O
RT
E E
ln
5F
0
a
MnO4
a
a8
H
Mn 2
Органические окислительно-восстановительные электроды,
например, хингидронный электрод: C6H4O2, C6H4(OH)2│Pt
Хингидрон
–
слаборастворимое
эквимолекулярное
соединение хинона C6H4O2 и гидрохинона C6H4(OH)2. Эти
вещества образуют с ионами водорода обратимую
окислительно-восстановительную систему:
C6H4O2 + 2H+ + 2e C6H4(OН)2
5.
Инертный электрод (Au или Pt), помещенный в раствор,содержащий хинон, гидрохинон и ионы водорода, принимает
потенциал, определяемый активностью этих трех веществ:
0
E E хг
RT
ln
2F
a 2 ax
H
aгх
В кислых растворах хингидрон дает равные концентрации
хинона и гидрохинона, поэтому, потенциал хингидронного
электрода зависит только от активности ионов водорода:
2,3RT
E 0,699
pH
F
0,699 В – стандартный потенциал хингидронного электрода.
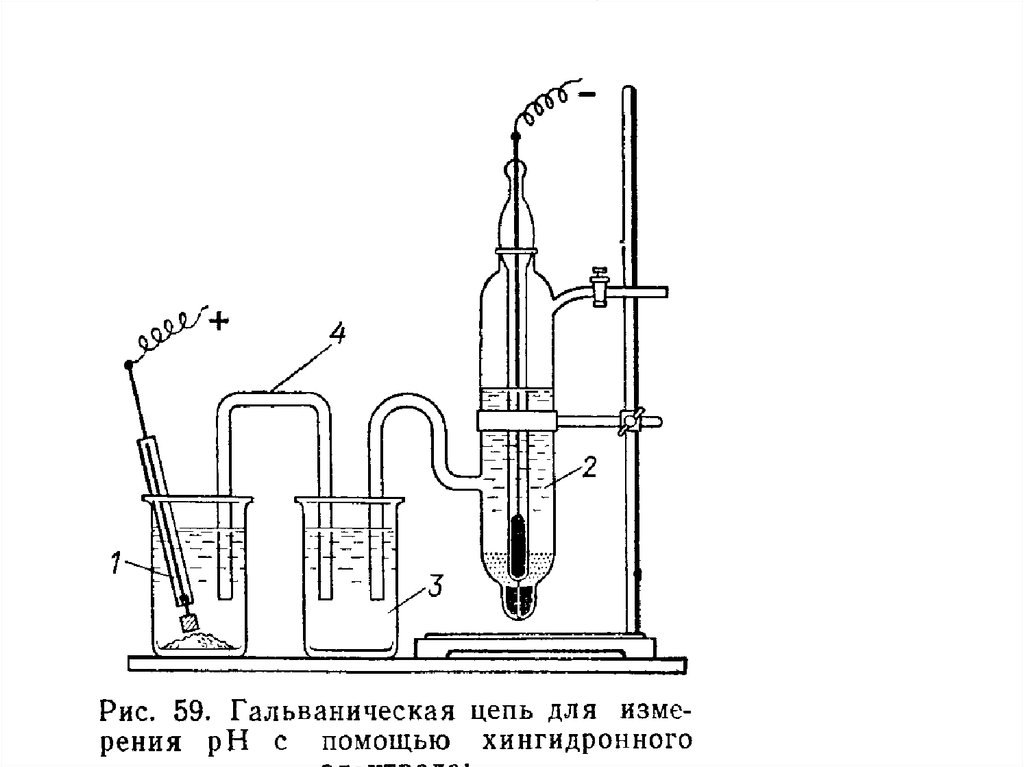
Хингидронный электрод прост по устройству, быстро
приходит в равновесное состояние, устойчив к ядам и
окислительным агентам. Для измерения рН в исследуемый
раствор добавляют небольшое количество хингидрона и
измеряют потенциал платинового электрода в этом растворе.
6.
7.
Правило Лютера. Систему, состоящую из металла М врастворе, содержащем ионы этого металла в двух степенях
окисления M z и М z можно представить как совокупность трех
z1
z2
систем: M / M ; M / M - электроды I рода и M z , M z / Pt окислительно-восстановительный электрод. Для электродов I
рода справедливы следующие соотношения:
1
2
2
M
z1
z1e M
M z2 z 2 e M
RT
E1 E
ln a z
M 1
z1 F
RT
E2 E20
ln a z
M 2
z2 F
0
1
1
G1 z1 FE1
G2 z 2 FE2
Для окислительно-восстановительного электрода:
M
z 2
( z 2 z1 )e M
z1
a z
RT
2
E 2 1 E 20 1
ln M
z 2 z1 F a z
G2 1 z 2 z1 FE2 1
M
1
8.
z2Ионизация М до М
может проходить либо ступенчато –
через
промежуточную
степень
окисления,
либо
непосредственно – до крайней степени окисления, причем
изменение свободной энергии процесса не зависит от его пути
(закон Гесса):
-z2e
G2 G1 G2 1
или
G G G
0
2
0
1
0
2 1
z 2 F E20 ( z 2 z1 )FE20 1 z1 FE10
0
z 2 E2
0
( z 2 z1 )E2 1
0
z1 E1 .
Эта зависимость получила название правило Лютера. Она
показывает, что стандартные потенциалы электродов I рода и
окислительно-восстановительных систем связаны между собой
строгой зависимостью.
9.
Правило Лютера используют, когда экспериментальноеопределение одного из стандартных потенциалов затруднено
или невозможно. Если известны значения двух стандартных
потенциалов, то третий может быть рассчитан. Например,
Fe3+,Fe2+│Fe
Fe3+ + e
0
0
0
3EFe
E
2
E
3
3
2
/ Fe
Fe , Fe / Pt
Fe 2 / Fe
0
EFe
3
/ Fe
+ 3e
0
EFe
2
Fe
Fe2+ +2e
0
0,44 B; EFe
0,77 B,
3
/ Fe 2
0,77 2 ( 0,44)
0,036 B.
3
Для системы Cu2+,Cu+│Сu известны:
0
ECu
2
Cu
0,34 B;
Fe
0
ECu
0,52 B,
/ Cu
0
ECu
:
2
,Cu / Pt
Необходимо найти:
0
0
0
2ECu
E
E
,
2
2
/ Cu
Cu ,Cu / Pt
Cu / Cu
0
ECu
2 0,34 0,52 0,16 B.
2
,Cu / Pt
10.
Ионселективныеэлектроды
отличаются
от
рассмотренных выше электродов тем, что на них идет обмен не
электронами, а ионами. Они представляют собой мембрану,
контактирующую с раствором, содержащим ионы, способные
обмениваться с ионами мембраны. Такими ионами могут быть
ионы водорода (стеклянные электроды с водородной функцией),
любые катионы (катионообменные мембраны) или анионы
(анионообменные мембраны).
В качестве мембран в этих электродах используются стекло
определенного сорта, монокристаллы (галогениды и сульфиды
ряда металлов), несмешивающиеся с водой жидкости.
Наиболее распространенным ионселективным электродом с
твердой мембраной является стеклянный электрод. Электрод
изготовлен из специального электродного стекла, способного
обмениваться ионами водорода с раствором:
RT aH
0
+
+
Н Н ст
Eст Eст
ln '
F
a
H
11.
Фактически в реакцию обмена вовлекаются не только ионыводорода, но и ионы щелочного металла стекла:
М+ст. + Н+ М+ + Н+ст.
a
H
К об a
a'
M
K об
a a'
M
H
aH
Выразим отношение '
aH
a
a
H
a'
H
M
H
a
a'
M
a'
H
K об a
H
M
a' a'
H
M
Сумма активностей ионов водорода и металла в стекле
постоянна, обозначим ее через а и подставим в уравнение
потенциала
RT aH
0
Eст Eст
ln '
F
a
H
2,3RT
2,3RT
0'
0'
0
E Eст
lg a K об a
E
E
lg a
ст
ст
H
M
F
F
12.
Kоб aМ аH2,3RT
0'
lg a Eст
b pH
H
F
Таким образом, в сильно щелочных растворах потенциал
электрода зависит от активности ионов металла, стеклянный
электрод приобретает металлическую функцию, в кислых,
нейтральных и слабощелочных растворах стеклянный электрод
обладает водородной функцией. Верхняя граница рН, до которой
сохраняется водородная функция, зависит от сорта стекла.
aH Kоб аМ
0'
Eст Eст
6
1
4
5
2
а
3
б
Рис.2.2 Различные виды стеклянных электродов: а – шариковый;
б – микроэлектрод.
1 – трубка из лабораторного
стекла, 2 – колбочка из электродного стекла, 3 – пленка электродного
стекла, 4- вспомогательный (хлорсеребряный) электрод, 5 – раствор
0,1н соляной кислоты, 6 – пробка.
13.
14.
15.
16.
Для приготовления стеклянных электродов с водороднойфункцией одним из лучших является стекло “Корнинг 015”, его
состав % (мол): SiO2 – 72,7; CaO – 6,4; Na2O – 21,4.
Стеклянная мембрана обладает большим омическим
сопротивлением,
поэтому для измерения потенциала
электрода используют приборы с большим входным
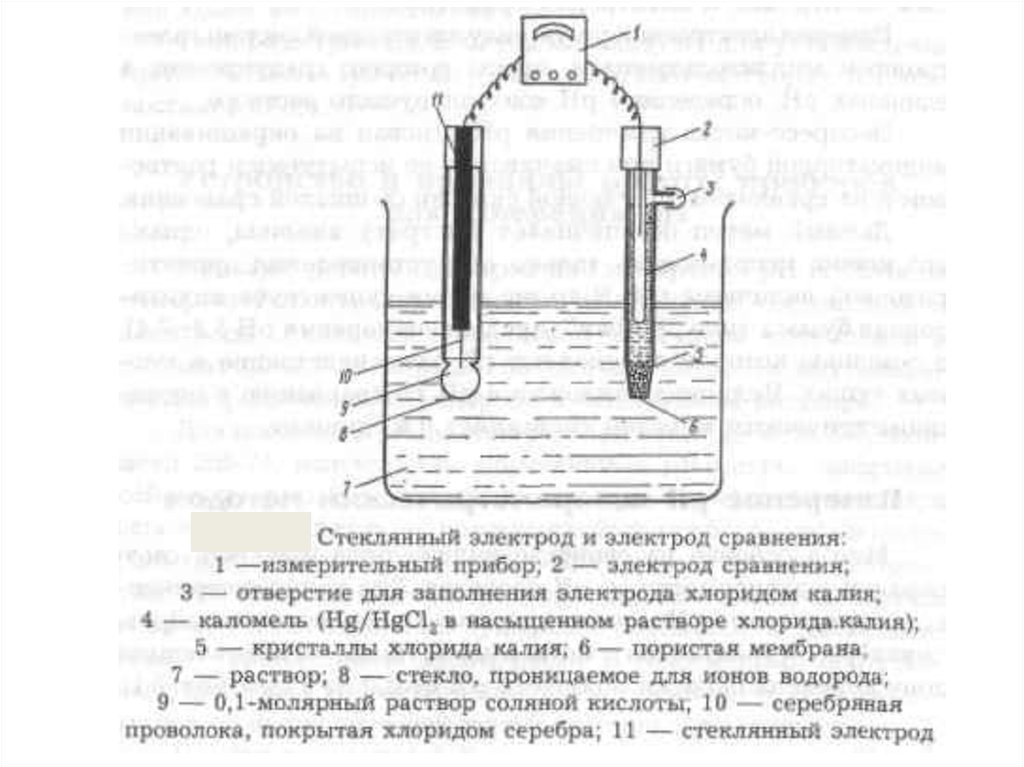
сопротивлением. Собирают следующий элемент:
Ag AgCl│KCl║pHx│стекло│HCl│AgCl Ag
Eэс
E1 E2
Eвсп
ЭДС этого элемента является алгебраической суммой
скачков потенциала: Е = Eэс + E1 + E2 + Eвсп .
Поскольку скачки потенциала Eэс , E2, Eвсп постоянны, то
Е = const + E1 ,
где
Значение стандартного потенциала различно для разных
стеклянных электродов, зависит от обменных свойств стекла.
17.
Стеклянные электроды готовятся из расплавленного стекла,химический состав стекол на внутренней и внешней поверхности
различен, что приводит к появлению потенциала асимметрии.
Его наличие может быть обнаружено при измерении ЭДС
следующей системы:
Ag AgCl│HCl│стекло│HCl│AgCl Ag
E1
E3
E4
E2
Если взять одинаковые хлорсеребряные электроды в
качестве вспомогательного электрода и электрода сравнения, то
E1 = E2. Если бы свойства стекла на внешней и внутренней
поверхности мембраны были бы одинаковыми, то E3 = E4 и
измеренная величина ЭДС элемента равнялась бы нулю. В
действительности ЭДС этой системы не равна нулю, Е = Eас.
По уравнению потенциала можно рассчитать рН раствора,
0'
если известны Eст
и Eас , однако их определение затруднено,
поэтому пользуются методом калибровочного графика.
18. Ионселективные электроды
+ _+ _
а1 + _
+ _
а
_
_
_
_
_
_
+
+
+
+ а2
+
+
а ˃ а 1 ˃ а2
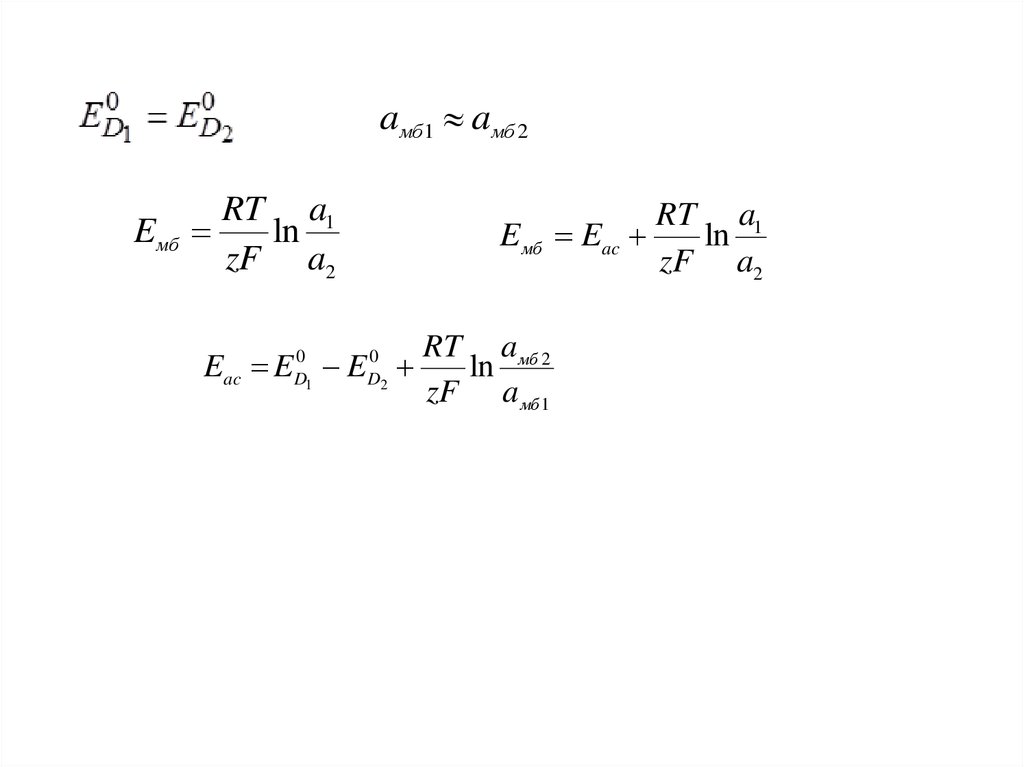
I мб
RT ln a1 zFg1 RT ln a мб zFg мб
0
1
0
мб
ED1 g мб
RT a1
g1 E
ln
zF aмб
Eмб ED1 ED2
0
D1
RT aмб 2 RT a1
E E
ln
ln
zF aмб 1 zF a2
0
D1
0
D2
19.
aмб1 aмб 2Eмб
RT a1
ln
zF a2
E мб
RT a мб 2
Eac E E
ln
zF a мб 1
0
D1
0
D2
RT a1
Eac
ln
zF a2
















 chemistry
chemistry








