Similar presentations:
Электрохимия. Понятие электрохимии. Электроды. Гальванические цепи. Окислительно-восстановительные электроды. (Лекция 6.1)
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 6
Электрохимия. Основные понятия
электрохимии. Электроды. Гальванические
цепи. Окислительно-восстановительные
электроды
1. Электродный потенциал.
2. Строение ДЭС. Термодинамика ДЭС.
3. Уравнение Нернста.
4. Измерение величины электродных потенциалов.
Гальванические цепи.
5.Типы электродов.
Лектор:
Степанова Ирина Петровна, доктор биологических
наук, профессор, зав. кафедрой химии
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания об
основах электрохимии, формировании
электродного потенциала, уравнении
Нернста, классификации электродов,
гальванических цепях
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний,
развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины.
3.
Электрохимия4.
Электрохимия5. Электродный потенциал
6. Медико-биологическое значение темы
Окислительно-восстановительные процессыявляются необходимыми звеньями в сложной
цепи как анаболических, так катаболических
процессов.
Наибольшее значение имеют
процессы биологического
окисления.
7. Медико-биологическое значение темы
В митохондриях окисление происходит врезультате переноса электронов от
органических субстратов на кислород,
который при этом восстанавливается до
воды: 1/2O2 + 2H+ H2O.
Эта реакция реализуется через целый ряд
промежуточных окислительновосстановительных превращений, каждое из
них требует участия определенного фермента.
8. Медико-биологическое значение темы
На трех таких стадияхразность потенциалов больше
0,17 В. В этом случае
количество выделяющейся
энергии примерно
соответствует энергии,
необходимой для синтеза 1
молекулы АТФ.
9.
Медико-биологическое значение темыСхема пути электронов и протонов
через четыре мультиферментных
комплекса дыхательной цепи
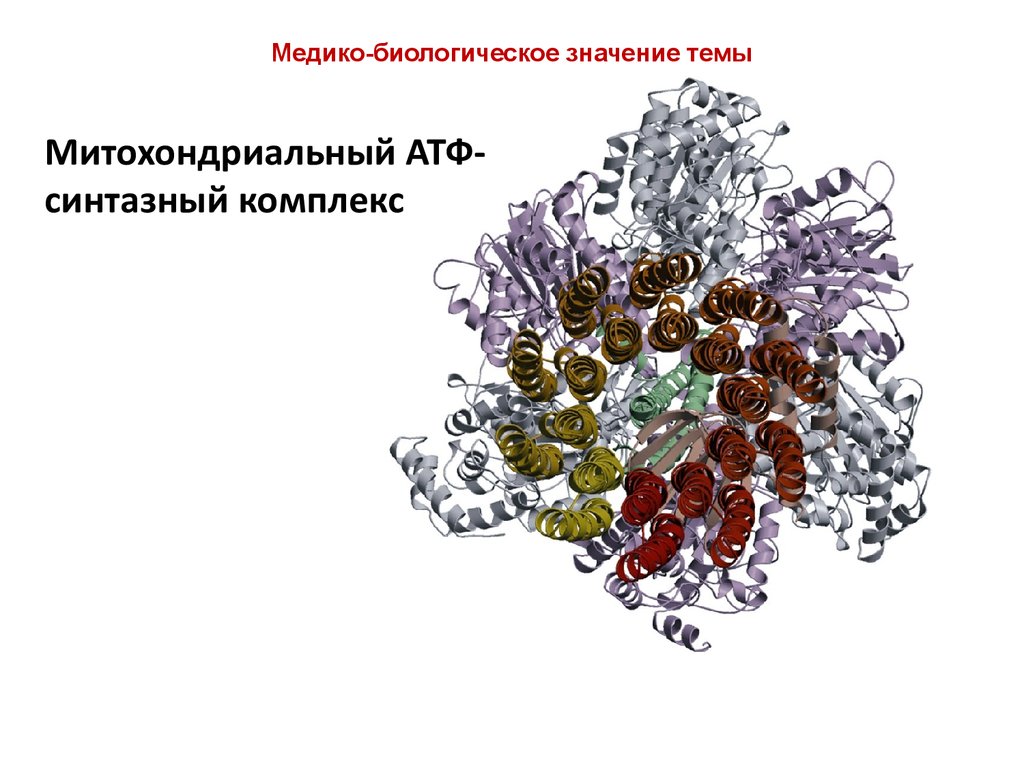
10.
Медико-биологическое значение темыМитохондриальный АТФсинтазный комплекс
11.
Медико-биологическое значение темыМембранный потенциал
клетки формируется за
счет
разности
между
концентрациями
ионов
Na+/K+,
определяемая
перемещением
этих
ионов.
Когда
клетка
работает, она теряет свой
заряд.
12.
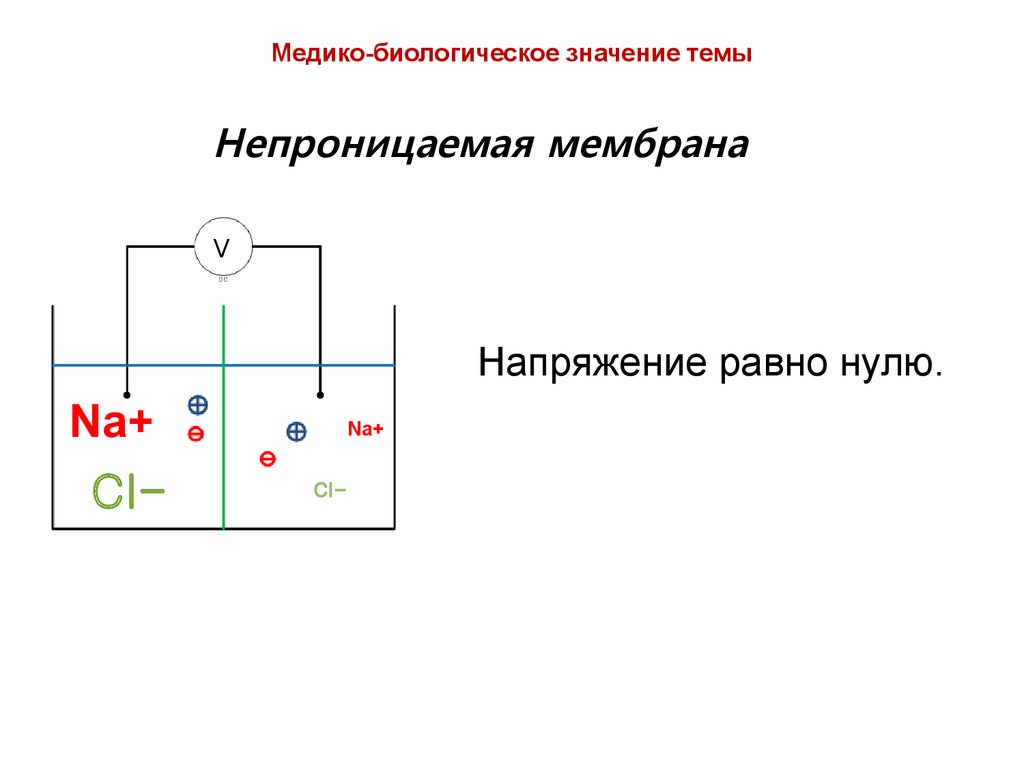
Медико-биологическое значение темыНепроницаемая мембрана
V
Напряжение равно нулю.
Na+
Cl-
Na+
Cl-
13.
Медико-биологическое значение темыПроницаемая мембрана
V
Напряжение равно нулю.
Na+
Cl-
Na+
Cl-
Мембрана проницаема
для обоих ионов.
14.
Медико-биологическое значение темыПолупроницаемая мембрана
V
Na+
Диффузия
Cl-
Na+
Силы
Кулона
Cl-
RT X o
R
ln
zF X i
Мембрана проницаема
только для Na+
15. Фосфолипидная мицелла – синтетический прообраз клетки
_+
А-
К+
К+
16. Мембрана живой клетки полупроницаема.
Медико-биологическое значение темыМембрана живой клетки полупроницаема.
Са++
Cl -
Na+
К+
17. Проницаемость обеспечена ионными каналами мембраны
Медико-биологическое значение темыПроницаемость обеспечена ионными
каналами мембраны
Центральная
водная пора
Устья канала:
селективный
фильтр
Ворота:
проницаемость
может
меняться!
1-1000 каналов на квадратный
микрометр мембраны
18. Нобелевская премия 1991 г. в области физиологии и медицины
Эрвин Нейери
Берт Сакманн
«за открытия в области работы
одиночных ионных каналов»
19.
Медико-биологическое значение темыИонные каналы в клеточных мембранах
Roderick Mac Kinnon
Нобелевская премия
по химии, 2003
Ионный канал для K+ (бактерия Streptomyces lividans)
20.
Медико-биологическое значение темы- Clˉ
-K
+
21.
Медико-биологическое значение темы- Clˉ
-K
+
22.
Медико-биологическое значение темы23. Транспорт ионов через клеточные мембраны
Медико-биологическое значение темыТранспорт ионов через клеточные мембраны
24.
Медико-биологическое значение темыЗахват активными центрами ионов калия и натрия.
Поворот белковой молекулы на 1800
за счёт энергии АТФ.
К+
мембрана
Na+
25.
Медико-биологическое значение темыNa+
мембрана
К+
Выброс захваченных
ионов, причём калий
попадает внутрь клетки,
а натрий выбрасывается
наружу.
26.
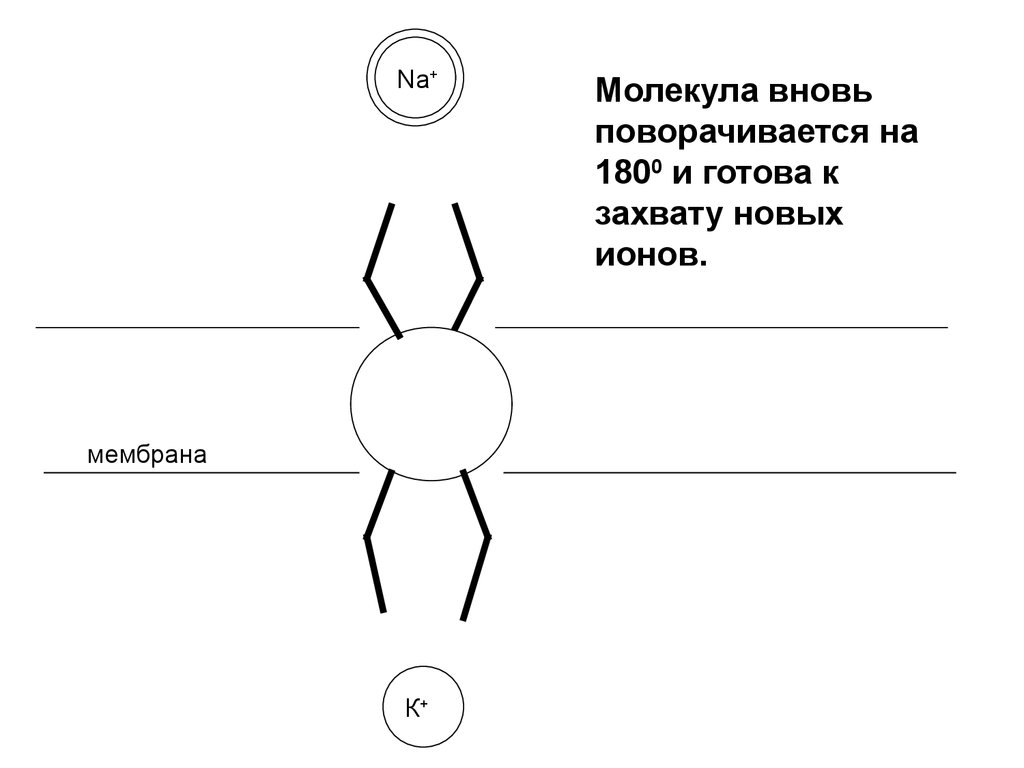
Na+мембрана
К+
Молекула вновь
поворачивается на
1800 и готова к
захвату новых
ионов.
27. Эквивалентная схема клеточной мембраны
RT X oR
ln
zF X i
А
В
28. Медико-биологическое значение темы
Электрохимия является фундаментом такихметодов анализа, как кондуктометрия,
потенциометрия, полярография, вольт- и
амперометрия, широко применяемых в
контроле производств лекарственных
веществ и в анализе готовых фармакопейных
препаратов.
29. Медико-биологическое значение темы
Свойства фармацевтических препаратовнаходятся в непосредственной связи с их
окислительно-восстановительными
свойствами. Так, многие антисептические
и дезинфицирующие средства являются
сильными окислителями.
30. Медико-биологическое значение темы
31. Электродный потенциал
Электрод – физикохимическая система,состоящая из двух
соприкасающихся
материалов
с
различной
электрической
проводимостью.
Zn
32. Электродный потенциал
Схему электрода изображают в видевертикальной
черты,
которая
разделяет
твердую и жидкую фазы.
Например, схема металлического электрода:
Меn+ Me
ж. ф. тв. ф.
Ox
Red
33.
Электродный потенциалСхема электрода:
Ox1 Red1 ;
Ox2
Red2
Zn+2 Zn ;
Cu+2 Cu
34. Электродный потенциал
Электроднымпотенциалом
(φ)
называют максимальную разность
потенциалов,
возникающую
на
границе твердая фаза – раствор в
момент установления равновесия.
35.
Механизмы возникновенияэлектродного потенциала
На границе раздела фаз возможны переходы
поверхностных частиц из одной фазы в другую,
если это сопровождается уменьшением
свободной энергии системы ( G).
В результате обмена заряженными
частицами создается избыток носителей
электричества данного знака по одну сторону и
их недостаток по другую сторону границы
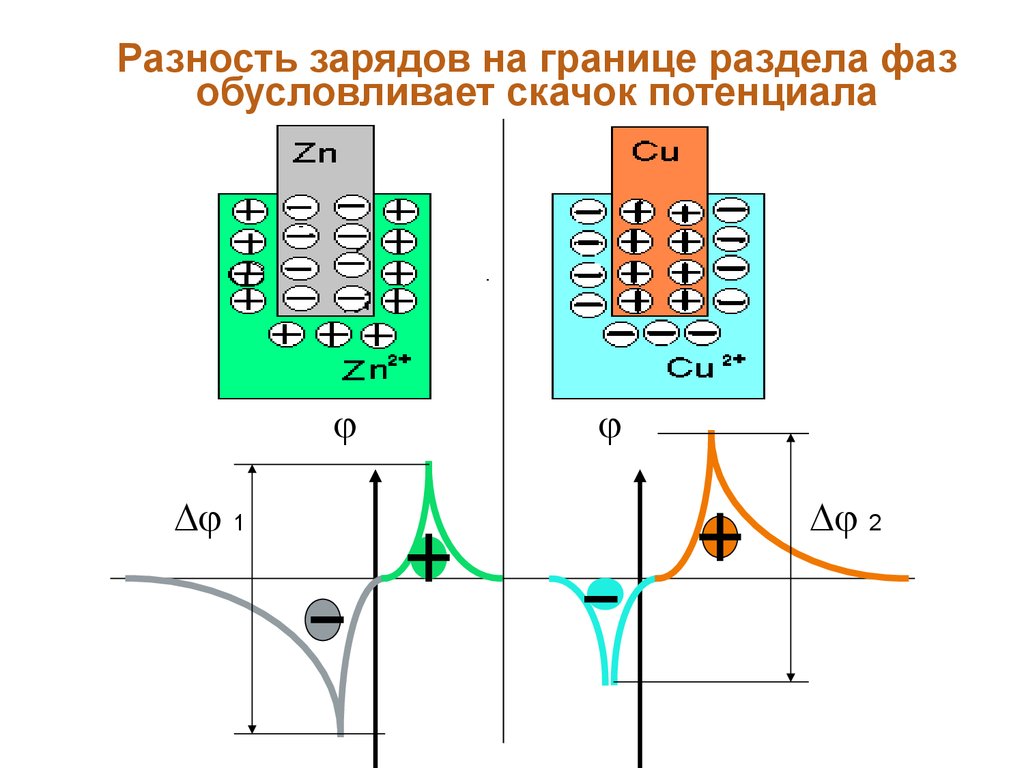
раздела фаз. В результате возникает двойной
электрический слой (ДЭС). Разность зарядов на
границе раздела фаз обусловливает скачок
потенциала.
36.
Механизм возникновения электродного потенциалаПри погружении металла в раствор его
одноименной соли, в системе металл –
раствор устанавливается равновесие:
Меn+ + ne-
Ме0
Данная реакция называется электродной
реакцией.
Ионы Меn+ – потенциалопределяющими
ионами (п. о. и.).
37.
Механизм возникновения электродного потенциалаМе
Zn
2+
Zn2+
Zn2+
Mеn+ + nē → Ме0
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
ДЭС
Ме0 - nē → Mеn+
Раствор
На поверхности раздела
фаз образуется ДЭС и
возникает
скачок
равновесного
потенциала.
38.
Электродный потенциалДЭС образуется:
а) за счет выхода ионов из металла
б) за счет адсорбции ионов на поверхности
металла
SO4
2
Cu2+
39. Возможны 2 случая возникновения электродного потенциала:
Электродный потенциалВозможны 2 случая
электродного потенциала:
возникновения
1) При погружении активного металла (Zn)
в раствор его соли (ZnSO4)
равновесие
электродной
No
current
Электролит
Металл
реакции смещается влево.
Протекает реакция:
Zn0 - 2eZn2+,
т.к. энергия гидратации (Eгидр.)
ионов цинка больше, чем
энергия связи (Eсв.) этих
ионов в кристаллической
решетке, Eгидр. > Eсв.
40. Электродный потенциал
МеталлЭлектролит
При этом часть ионов
цинка
с
поверхности
металла
переходит
в
раствор,
поверхность
No current
металла
заряжается
отрицательно, а раствор
положительно, то есть на
границе твердая фаза –
раствор формируется ДЭС.
41. 2) При погружении неактивного металла (Cu) в раствор его соли (CuSO4)
Электродный потенциал2) При
погружении неактивного металла (Cu) в
раствор его соли (CuSO4)
равновесие
электродной
реакции смещается вправо. На
No current процесс:
электроде протекает
Cu2+ + 2eCu0
В этом случае энергия связи
поверхностных ионов в узлах
кристаллической
решетки
больше
энергии
гидратации
ионов меди: Eсв. > Eгидр.
Металл
Электролит
42. Электродный потенциал
Поэтому часть ионовмеди переходит из
раствора на пластинку,
заряжая ее положительно,
раствор при этом
заряжается отрицательно;
На границе твердая фаза
– раствор формируется
ДЭС.
Металл
Электролит
43. Электродный потенциал
φ < 0Металл
Электролит
φ > 0
Металл
No current
Электролит
44. Электродный потенциал
Ме:Au
Li
Al Fe
Pb
H
Ag/AgCl Cu
Ag
Pt
No current
φ / В -3.0
1.68
Металл
отриц.
0
0.222
φ < 0
Электролит
полож.
φ > 0
Металл
Электролит
45. Разность зарядов на границе раздела фаз обусловливает скачок потенциала
12
46. Электродный потенциал
Существуют и другие механизмывозникновения ДЭС, например, процесс
адсорбции
адсорбата
на
поверхности
адсорбента.
При помещении твердой фазы – хлорида се
ребра AgCl – в раствор нитрата серебра AgNO3
на поверхности твердой фазы из раствора
адсорбируются те ионы, которые входят в
состав кристаллической решетки, а именно
ионы Ag+.
При этом твердая фаза заряжается
положительно, а раствор – отрицательно.
47. Электродный потенциал
Ag+Ag
+
Ag+
Ag+
Ag
+
Ag
+
Ag+
Ag+
Ag+
Ag+ Cl-
Ag+
Ag+Cl-
Ag+Cl-
Ag+Cl-
Ag+Cl-
Ag+ ClAg+
Ag+
Ag+
Ag+
Ag+
Ag+
Ag+
48. Строение ДЭС. Термодинамика ДЭС
Итак, ДЭС может формироваться за счет различныхмеханизмов, в основе которых лежат реакции
осаждения, ионизации, окисления-восстановления,
адсорбции и др.
Электрод
Электролит
+
-
-
+ +
-
+ -
-
49. Строение ДЭС по Штерну
ДЭС можно сравнить с конденсатором,одна обкладка которого – металл, другая –
слой противоположно заряженных ионов.
На поверхности металла за счет
электродных
процессов
возникает
электрический заряд, который определяется
потенциалопределяющими ионами (п.о.и.).
Эта часть ДЭС –
стабильная.
неподвижная или
50. Строение ДЭС. Термодинамика ДЭС
Подвижную часть ДЭС можно разделитьна две части:
1) Адсорбционный слой – состоит из
противоионов,
расположенных
на
расстоянии ионного радиуса от поверхности
металла. На него действуют в основном
электростатические силы притяжения.
2) Диффузный слой – состоит из ионов,
расположенных на расстоянии большем,
чем
ионный
радиус.
Они
свободно
перемещаются в растворе, в основном за
счет теплового движения.
51.
Строение ДЭС. Термодинамика ДЭСMez+(металл)
Mez+(раствор)
Cu
Zn
+φ
+φ
∆ φ = φ+
∆ φ = φ–
электродный потенциал
–φ
–φ
52. Строение ДЭС. Термодинамика ДЭС
Схема ДЭС для пластинки с «-» зарядом:-
Zn
+
+
+
+
+
+
тв. неподв. адс. диффузный
часть
слой слой
ZnSO4
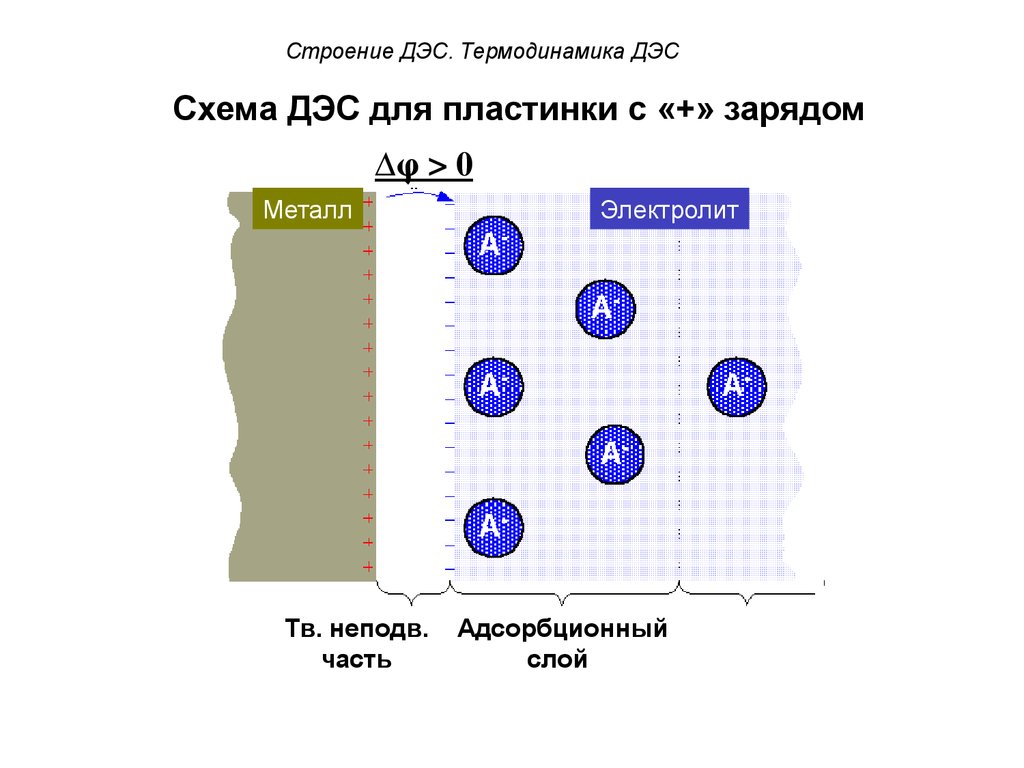
53. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
Металл
Электролит
?
?
?
54. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
Металл
Электролит
Тв. неподв.
часть
?
?
?
55. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
Металл
Электролит
Тв. неподв.
часть
?
Адсорбционный
слой
?
?
56. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
Металл
Электролит
Тв. неподв.
часть
?
Адсорбционный
слой
?
Диффузный
слой
?
57. Строение ДЭС. Термодинамика ДЭС
От величины электродного потенциала (φ) зависитвеличина работы, которая совершается системой при
образовании ДЭС. Величину этой работы можно
выразить уравнением:
A n F
[кДж ·моль-1], где
A – работа, которую надо совершить, чтобы
перенести заряд с одной фазы на другую,
кДж
·моль-1;
n – число электронов, участвующих в электродной
реакции (для металлических электродов совпадает с
зарядом иона);
F – число Фарадея = 96487 Кл · моль-1.
58. Строение ДЭС. Термодинамика ДЭС
В изобарно-изотермических условиях работаравна уменьшению энергии Гиббса:
тогда:
A G,
G n F
G
n F
59. Уравнение Нернста
Вольтер Герман НернстНернст – Эйнштейн – Планк –
Миллиган – фон Лауэ
60.
Уравнение Нернста:RT
ln a КАТ
nF
RT
0
ln a АН
nF
0
φ – электродный потенциал [В],
φ0 – стандартный электродный потенциал - характеризует
природу электрода.
(φ = φ0, если a(п.о.и.) = 1 моль ·дм-3);
R – универсальная газовая постоянная,
n – число электронов в электродной реакции,
F – число Фарадея,
a(п.о.и.) – активная концентрация
потенциалопределяющих ионов [моль · дм-3].
61. Уравнение Нернста
При подстановке констант в выражениеи переводе натурального логарифма в десятичный
(ln= 2,3 ·lg), с учетом определенной температуры,
уравнение Нернста принимает рабочий вид.
Для 298 K уравнение Нернста имеет вид:
0,059
lg a КАТ
n
0
62. Уравнение Нернста
Например, уравнение Нернста для цинкового электродадля 298 K:
0,059
lg a
2
Для 291 K уравнение Нернста имеет вид:
0
zn
2
/ zn
zn 2 / zn
0,058
lg aКАТ
n
0
zn 2
63.
Факторы, влияющие на величину электродногопотенциала
Природа металла: чем большей химической
активностью обладает металл, тем легче он
растворяется, тем отрицательнее
потенциал.
Концентрация ионов металла в растворе: чем
больше концентрация катионов в растворе,
тем положительнее потенциал.
Температура: с повышением температуры
потенциал становится более
положительным.
64.
Измерение величины электродныхпотенциалов. Гальванические цепи
Электродный потенциал нельзя измерить
непосредственно. Можно измерять только
разность потенциалов или
электродвижущую силу (E).
Для этого необходимо собрать
гальваническую цепь из двух электродов.
65.
Измерение величины электродных потенциалов. Гальванические цепиГальванический элемент - это
электрохимическая система, состоящая
из двух электродов любого типа и в
которой самопроизвольно протекает
окислительно-восстановительная
реакция, энергия которой преобразуется
в электрическую энергию.
Гальванические
элементы химические источники
тока!
66.
Измерение величины электродных потенциалов. Гальванические цепиГальванические элементы:
электрохимические - источником
электрической энергии является
химическая реакция.
концентрационные - источником
электрической энергии служат
процессы выравнивания
концентраций растворов.
67. Измерение величины электродных потенциалов. Гальванические цепи
Схема гальванической цепи:тв1 ж1
ж2
тв2
φ1
φ2
Правило «правого плюса»:
справа
записывают
более
положительный электрод (катод), слева
– более
отрицательный (анод).
На
катоде
происходит
процесс
восстановления, на аноде – окисления.
68.
Расчет ЭДС гальванического элементаЭлектродвижущая сила (Е) –
это разность электродных потенциалов
катода и анода в разомкнутом ГЭ.
Е = φ(+) – φ(-)
Е>0[В]
69.
Гальванический элемент Якоби-Даниэля без переносаэлектродные процессы:
_
e
Zn
(-) A: Zn0 – 2e
Cu
(+) K: Cu2+(р-р) + 2e
Zn2+(р-р)
Cu0
Zn + Cu2+ = Zn2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
ZnSO4 CuSO4
Краткая схема Г.Э.:
(-) А: Zn| ZnSO4|| CuSO4|Cu (+)K
70.
Гальванический элемент Якоби-Даниэля с переносомРоль солевого мостика:
- препятствует смешению растворов;
- способствует сообщению растворов.
2ē
_
+
Zn
Zn2+
ZnSO4
KCl
Cu
Cu2+
CuSO4
71.
Гальваническийэлемент
KCl ключ
Наблюдай за
изменениями
электродов!
Cu
1,0 M CuSO4
Zn
1,0 M ZnSO4
72.
-+
Катод:
Cu+2 + 2e- Cu
Cu
1,0 M CuSO4
Анод:
Zn Zn+2 + 2e-
Zn
1,0 M ZnSO4
73.
Измерение величины электродных потенциалов. Гальванические цепи+
-
1,1 В
Катод:
Cu+2 + 2e- Cu
Cu
1,0 M CuSO4
Анод:
Zn Zn+2 + 2e-
Zn
1,0 M ZnSO4
74.
Концентрационные ГЭ- это система из двух одинаковых электродов с
разными активностями вещества в растворах.
( – ) Ag AgNO3 AgNO3 Ag ( + )
a1 < a2
ɑ1
ɑ2
Е зависит от разности активностей вещества в
растворах:
RT a2
E
ln
т.к. Δφ0 = 0
F
a1
75. Измерение величины электродных потенциалов. Гальванические цепи
Для измерения стандартныхэлектродных потенциалов собирают
гальваническую цепь, состоящую из
исследуемого
электрода
и
стандартного водородного электрода,
потенциал которого условно принят
за 0 В.
0
1
H / H
2 2
0,00 В
76. Измерение величины электродных потенциалов. Гальванические цепи
77.
Измерение величины электродных потенциалов. Гальванические цепиH2
Инертный
металл
Pt
78. Измерение величины электродных потенциалов. Гальванические цепи
Уравнение Нернста для нормальноговодородного электрода:
0,059
0
lg a
H
H /1 / 2 H 2
1
H /1 / 2 H 2
Так как
0
H /1 / 2 H
Так как
тогда
2
0 В , тогда
H /1 / 2 H 2
pH lg a
0,059 lg a
H
,
H /1 / 2 H 2
H
0,059 pH
79. Измерение величины электродных потенциалов. Гальванические цепи
80.
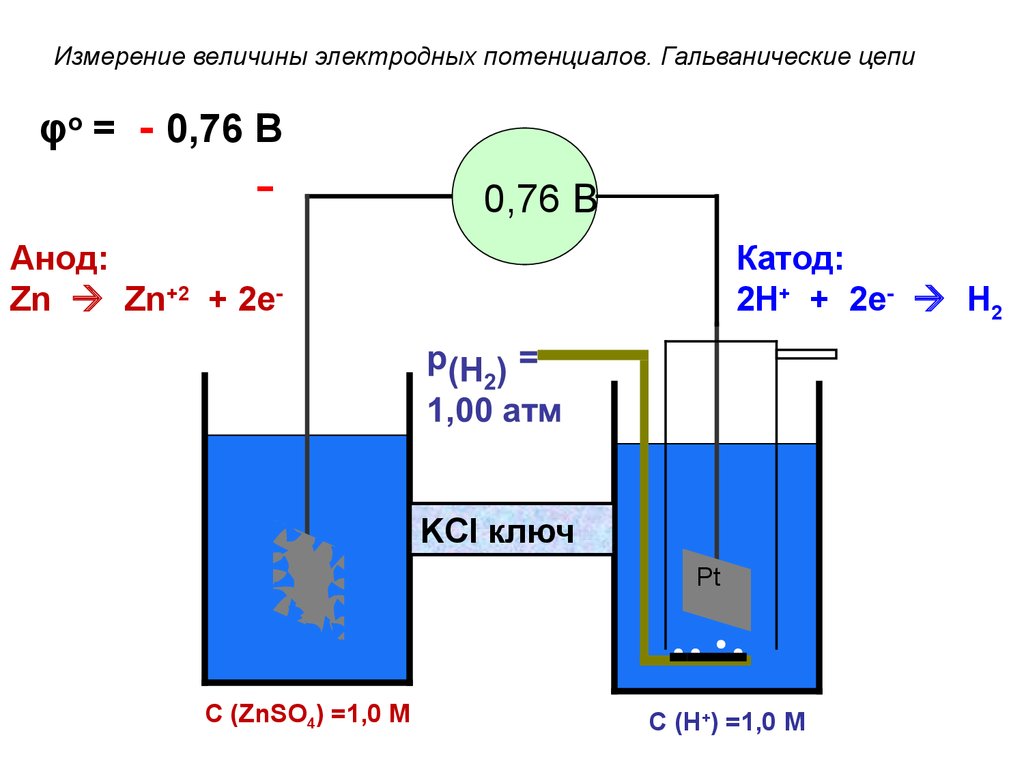
Измерение величины электродных потенциалов. Гальванические цепиφo = - 0,76 В
-
0,76 В
Анод:
Zn Zn+2 + 2e-
Катод:
2H+ + 2e- H2
KCl ключ
Zn
С (ZnSO4) =1,0 M
Pt
С (H+) =1,0 M
81.
Измерение величины электродных потенциалов. Гальванические цепи82.
Измерение величины электродных потенциалов. Гальванические цепиφo = + 0,34 В
+
0,34 В
Катод:
Cu+2 + 2e- Cu
Анод:
H2 2H+ + 2e-
p(H ) =
2
1,00 атм
KCl ключ
Cu
Pt
C (CuSO4)=1,0 M
С (H+) =1,0 M
83. Измерение величины электродных потенциалов
Al+3 + 3e- AlZn+2 + 2e- Zn
φo = - 1,66 В
φo = - 0,76 В
2H+ + 2e- H2
φo = 0,00 В
Cu+2 + 2e- Cu
φo = + 0,34 В
Ag+ + e- Ag
φo = + 0,80 В
Увеличение активности
Металлы располагают в порядке снижения
их активности в электрохимический ряд
напряжений металлов.
84.
АктивныеСредней активности
Уменьшение химической активности
металла
Увеличение электродного потенциала
Усиление окислительных свойств
Мало-активные
85.
Типыэлектродов
Электроды I рода
Электроды II рода
Окислительновосстановительные
электроды
86.
представляет собой металл, погруженный враствор соли, содержащей ионы этого же
металла:
2+
Zn
Схема электрода: Zn │Zn
Электродная реакция:
Zn2++ 2ē
Zno
Уравнение Нернста:
ZnSO4
zn 2 / zn
0
zn
2
0,059
lg a zn 2
/ zn
2
87.
система, в которой металл покрыт слоемтруднорастворимой соли и погружен в раствор,
содержащий анионы этой соли.
Аg
AgCl
KCl
Хлорсеребряный электрод (ХСЭ)
сравнения представляет собой
серебряную проволоку, покрытую
слоем хлорида серебра и опущенную
в насыщенный раствор хлорида калия.
88.
Типы электродовАg
Схема электрода: Ag, AgCl│Cl-
AgCl
Электродная реакция:
AgCl + ē
Ago + ClУравнение Нернста:
KCl
х с
0
х с
0,059 lg a
В насыщенном растворе KCl при
температуре 298 K φx-c = 0,2222 В.
Cl
89.
Раствор, содержащий одновременноокисленную и восстановленную
формы вещества, называют
окислительно-восстановительной
(red-ox) системой.
Инертный токопроводящий
металл (например, платина или
иридий), погруженный в red-ox
систему, образует
red-oxэлектрод.
90. Окислительно-восстановительные электроды
Ptox (окисленная форма)
red (восстановленная форма)
Электродная реакция:
ox + n e-
red
Инертный металл выполняет роль посредника в
осуществлении переноса электронов между
окисленной и восстановленной формами вещества,
являясь донором или акцептором электронов
(донором – по отношению к окисленной форме,
акцептором – по отношению к восстановленной
форме).
91. Окислительно-восстановительные электроды
Red-ox-электроды делятся на простые исложные.
В простых электродах для
осуществления электродной
реакции ox и red формы
обмениваются только электронами.
92. Окислительно-восстановительные электроды
Уравнение Нернста-Петерса:RT aox
ln
nF ared
0
Уравнение Нернста-Петерса для Т 298 К:
0,059 aox
lg
n
ared
0
93.
Окислительно-восстановительные электродыPt
Схема электрода: Pt Fe3+,
Fe2+
Электродная реакция:
Fe3+ + 1ē
Fe2+
Уравнение Нернста-Петерса:
FeSO4 +
Fe2(SO4)3
Если
a
ox
a
red
Fe3 / Fe 2
0
Fe3 / Fe 2
1 , тогда φ = φ0
0,059 a
lg
1
a
Fe3
Fe 2
94. Окислительно-восстановительные электроды
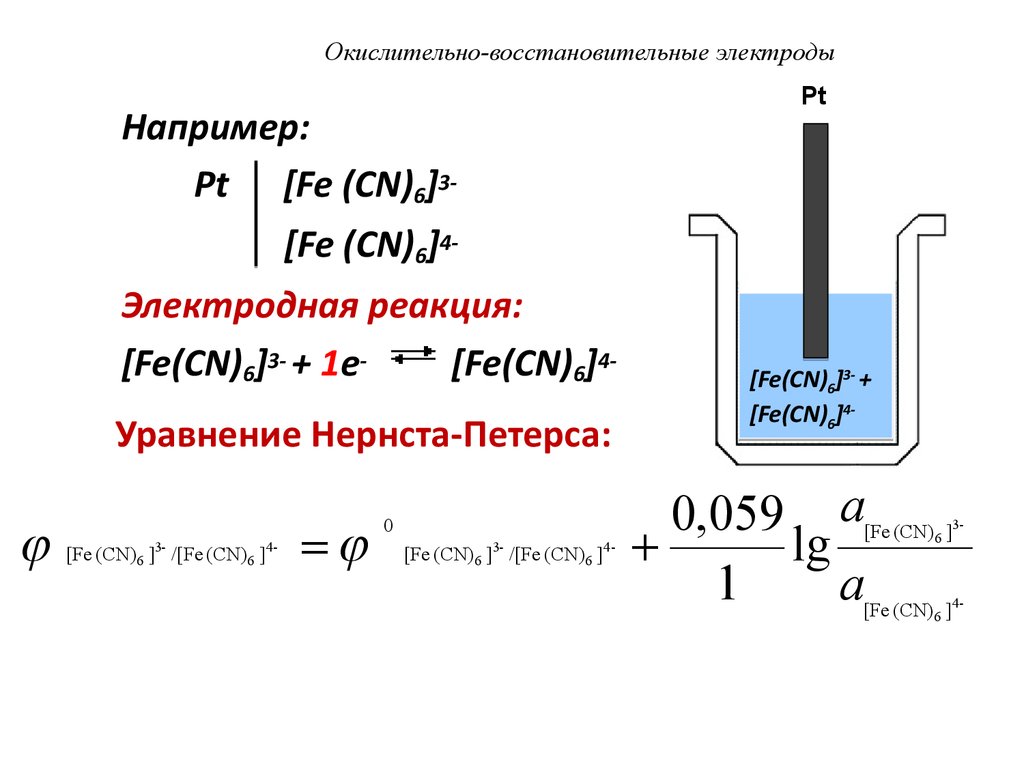
Например:Pt [Fe (CN)6]3-
Pt
[Fe (CN)6]4Электродная реакция:
[Fe(CN)6]3- + 1e[Fe(CN)6]4Уравнение Нернста-Петерса:
[Fe (CN) 6 ]3- /[Fe (CN) 6 ]4-
0
[Fe (CN) 6 ]3- /[Fe (CN) 6 ]4-
[Fe(CN)6]3- +
[Fe(CN)6]4-
0,059 a
lg
1
a
[Fe (CN) 6 ]3-
[Fe (CN) 6 ]4-
95. Окислительно-восстановительные электроды
В сложных электродах восуществлении
электродной
реакции помимо окисленной и
восстановленной форм принимают
участие ионы среды (H+ или OH-).
96. Окислительно-восстановительные электроды
Схема сложного электрода:Pt MnO4-, H+
Mn2+
Электродная реакция:
MnO4– + 8H+ + 5e–
Mn2+ + 4H2O
Уравнение Нернста-Петерса (Т = 298К):
2
(MnO 4 , H /Mn )
0
2
( MnO 4 , H /Mn )
Pt
MnO4– +
H+ + Mn2+
8
( MnO 4 ) ( H )
0,059 a
a
lg
2
5
a ( Mn )
Таким образом, в уравнение Нернста-Петерса
для сложного red-ox электрода, помимо
концентраций окисленной и восстановленной
форм, входит концентрация ионов среды.
97.
Типыэлектродов по
назначению
Электроды сравнения
Электроды
определения
98.
Электроды сравненияВодородный электрод сложен по конструкции и его
потенциал зависит от трудно контролируемых
факторов, поэтому на практике применяют более
простые электроды.
Электроды
сравнения
–
электроды,
потенциалы
которых
известны,
постоянны
и
воспроизводимы.
99. Электроды сравнения
В медико-биологических исследованиях вкачестве электрода сравнения широко
используют хлорсеребряный электрод.
В насыщенном растворе KCl при температуре 298 K
φx-c = 0,2222 В.
100.
Электроды определения(мембранные электроды)
Основные требования к электродам
определения
специфичность,
селективность, высокая чувствительность
к концентрации определенных ионов.
101. Электроды определения
Наиболее распространенным электродомопределения является стеклянный электрод.
Он состоит из стеклянной
трубки, заканчивающейся
шариком из специального
стекла. Внутрь этой
системы наливают
буферный раствор и для
токоотвода помещают
хлорсеребряный
электрод.
Ag
Буферный
раствор
AgCl
Мембрана из
cпециального
стекла
102. Электроды определения
Потенциал, возникающий на х.с. электроде,остается постоянным и не влияет на
потенциал, возникающий между поверхностью
стекла и исследуемым раствором.
Буферный
раствор
Стеклянная
мембрана
Хлорсеребряный
электрод
103. Электроды определения
При помещении стеклянного электрода враствор в поверхностный слой стекла из
раствора интенсивно проникают ионы
водорода, вытесняя ионы Nа+ или Li+ ,
содержащиеся в стекле.
Ионы водорода распределяются между
стеклом и раствором и на границе раздела
фаз возникает разность потенциалов.
Т. к. переход ионов водорода в стекло
зависит от концентрации их в растворе, то
потенциал стеклянного электрода
зависит от рН раствора.
104.
Электроды определенияСтеклянный электрод
перед использованием
вымачивают не менее суток
в дист. воде или слабом
растворе НСI.
Набухшая стеклянная
плёнка представляет собой
твёрдый буферный
раствор кремниевой
кислоты и её солей.
105. Электроды определения
Концентрацию ионов водорода в стеклеможно считать постоянной, а уравнение Нернста
для стеклянного электрода имеет вид:
стeкл
стекл
0
стекл
0
стекл
0,059 lg a
0,059 pH
Н
106. Ионоселективные электроды
Это электроды, проявляющие селективноедействие относительно тех или иных ионов.
C их помощью стало возможным наблюдать
за изменением ионного состава биологических
жидкостей в динамике, а также получать
информацию о внутриклеточном изменении
концентрации ионов Na+, К+, Сa2+, СI- и т.д.
107. Электроды определения
В настоящеевремя число
ионоселективных
электродов с четко
выраженной
селективностью к
определенным
ионам составляет
более 20, например
калиевый электрод,
натриевый электрод
и др.
108. Вопросы для самоконтроля
1. Как формируется ДЭС?2. Охарактеризуйте уравнение Нернста.
3. По каким признакам классифицируются
электроды?
109.
БЛАГОДАРЮ ЗАВАШЕ ВНИМАНИЕ!






































































































 medicine
medicine biology
biology chemistry
chemistry








