Similar presentations:
Кислород и сера
1.
КИСЛОРОДИ СЕРА
2.
VIA группа – халькогены. К ним относятся: кислород, сера, селен и теллур.Халькогены – рождающие руду.
3.
Строение атома кислорода.Давайте опишем кислород как химический элемент.
Находится в VIA группе 2 (малого периода). Неметалл.
8 электронов, 2 электронных слоя: 2e-, 6e-.
Степень окисления – 2.
Положительная степень окисления проявляет лишь в
соединении с фтором: OF2.
Строение и физические свойства.
Кислород
существует
в
двух
модификациях: кислород и озон.
аллотропных
4.
5.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) исвойства восстановителя (только с более электроотрицательным фтором). В качестве
окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций
сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
Кислород реагирует с фтором с образованием фторидов кислорода:
O2 + 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в
специфических очень жестких условиях.
Кислород реагирует с серой и кремнием с образованием оксидов:
S + O2 → SO2
Si + O2 → SiO2
Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P + 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P + 5O2 → 2P2O5
С азотом кислород реагирует при действии электрического разряда, либо при очень
высокой температуре (2000оС), образуя оксид азота (II):
N2 + O2→ 2NO
6.
В реакциях с щелочноземельными металлами, литиеми алюминием
кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид
натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов,
преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней
окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II),
либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
7.
При нагревании с избытком кислородаграфит горит, образуя оксид углерода
(IV):
C + O2 → CO2
При
недостатке
кислорода
образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах.
8.
2. Кислород взаимодействует со сложными веществами:Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды,
карбиды, гидриды. При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
Кислород окисляет бинарные соединения неметаллов:
летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом
также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
прочие бинарные соединения неметаллов — как правило, соединения серы, углерода,
фосфора (сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II),
оксид железа (II) и др.):
2CO + O2→ 2CO2
9.
Кислород окисляет гидроксиды и соли металлов в промежуточныхстепенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
Кислород окисляет большинство органических веществ. При этом
возможно жесткое окисление(горение) до углекислого газа, угарного
газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических
веществ (алкенов, спиртов, альдегидов и др.)
10.
11.
Сера как химический элемент.Находится в VIA группе 3 периода. Неметалл.
16 протонов, 16 электронов, 16 нейтронов.
2е-, 8е-, 6е-.
Максимальная степень окисления +6, минимальная
степень окисления (N группы - 8) – 2.
12.
13.
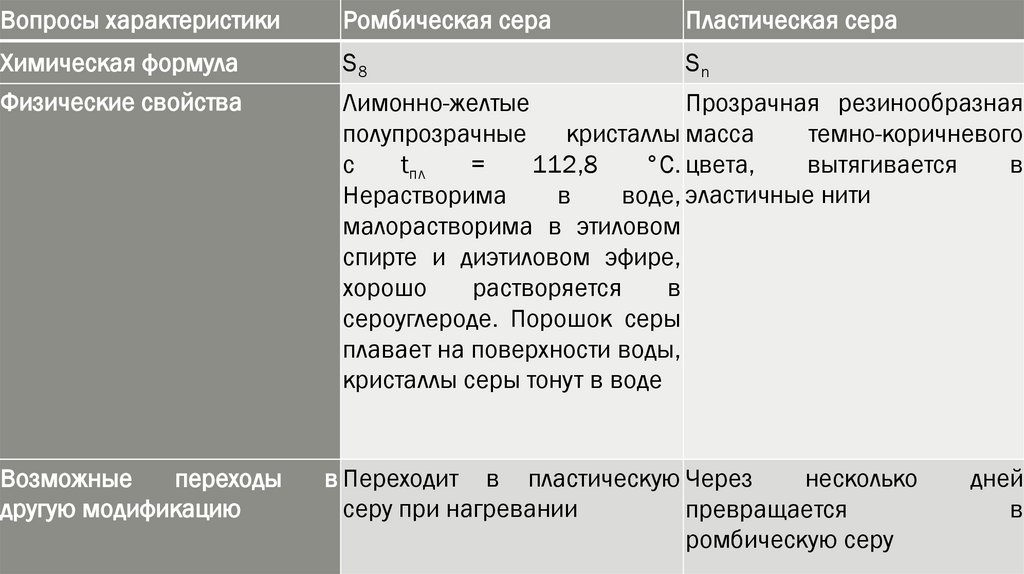
Вопросы характеристикиРомбическая сера
Пластическая сера
Химическая формула
S8
Sn
Физические свойства
Лимонно-желтые
Прозрачная резинообразная
полупрозрачные
кристаллы масса
темно-коричневого
с
tпл
=
112,8
°С. цвета,
вытягивается
в
Нерастворима
в
воде, эластичные нити
малорастворима в этиловом
спирте и диэтиловом эфире,
хорошо
растворяется
в
сероуглероде. Порошок серы
плавает на поверхности воды,
кристаллы серы тонут в воде
Возможные
переходы
другую модификацию
в Переходит в пластическую Через
несколько
серу при нагревании
превращается
ромбическую серу
дней
в
14.
Химические свойства серы.Окислительные свойства серы
(S0 + 2ē → S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2Al + 3S –→ Al2S3
Zn + S –→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6)
3) c кислородом:
S + O2 = SO2
4) c галогенами (кроме йода):
S + Cl2→ SCl2
S + 3F2 → SF6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4+ 6NO2 + 2H2O
15.
Получение серы1. Промышленный метод — выплавление из руды с
помощью водяного пара.
2.Неполное окисление сероводорода (при недостатке
кислорода): 2H2S + O2 → 2S + 2H2O
3. Реакция Вакенродера: 2H2S + SO2 → 3S + 2H2O
16.
Сборник задач: №300,№302(в,г), №319,
№324(а).
17.
Домашнее задание:параграф 32, №320,
№324(б).
















 chemistry
chemistry








