Similar presentations:
Соединения щелочных металлов
1.
Соединения щелочныхметаллов
Бойко Эмиль Ричардович ГБОУ ШКОЛА №1507
2.
3.
4.
Оксиды щелочных металлов обладают всеми свойствами, присущими основнымоксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя
гидроксиды:
5.
6.
LiOH7.
NaOH8.
KOH9.
Гидроксиды•KOH – едкое кали
•NaOH – едкий натр, каустическая сода, каустик
Образование гидроксидов
K2O + H2O= 2KOH
• Гидроксиды щелочных металлов, кроме Li, термостойки и не разрушаются от
температуры.
• Гидроксиды реагируют с
Кислотами
2KOH + H2SO4 = K2SO4 + 2H2O
Кислотными оксидами
2KOH + SO3 = K2SO4 + 2H2O
Солями (если образуется нерастворимое основание).
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
10.
11.
12.
Получение щелочных металлов1) Электролиз расплавов соединений
щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов и гидроксидов
щелочных металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Схема электролизера для получения
натрия
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и
кольцевым железный катодом К, между которыми расположена сетчатая диафрагма.
Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что
позволяет проводить процесс при 610–650°С). Металлический натрий собирается в
верхней части кольцевого катодного пространства, откуда и переходит в сборник. По
мере хода электролиза в ванну добавляют NaCl.
13.
14.
Применениещелочных
металлов
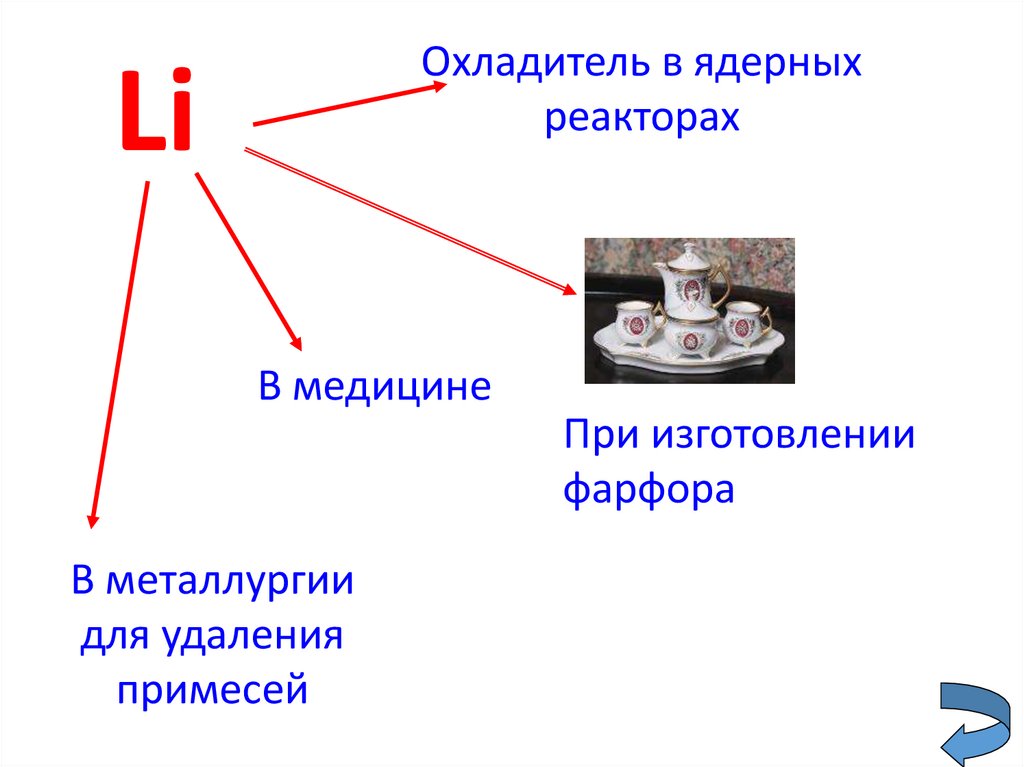
15.
Охладитель в ядерныхреакторах
Li
В медицине
При изготовлении
фарфора
В металлургии
для удаления
примесей
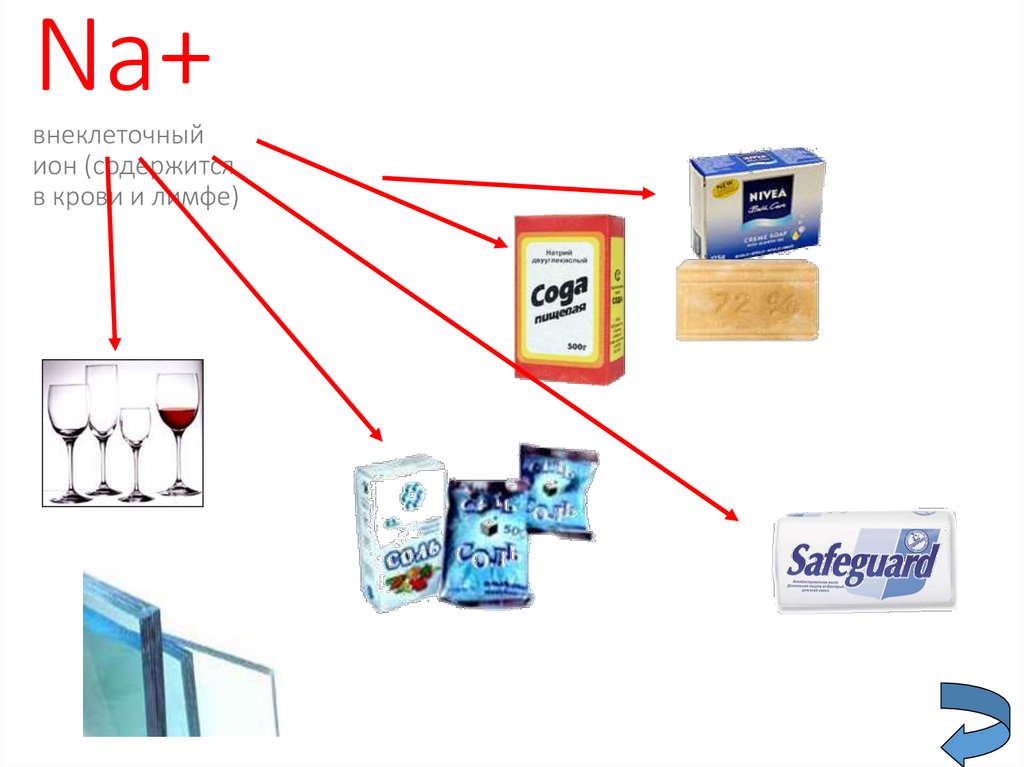
16.
Na+внеклеточный
ион (содержится
в крови и лимфе)
17.
18.
19.
20.
21.
Поваренная соль и географияПоваренная соль известна человеку с незапамятных времен, и
название ее сходно во многих языках. В честь соли названы
многие города, реки и озера: Солигалич, Соликамск,
Сольвычегорск, Соль-Илецк, Сольцы, Усолье и Усолье-Сибирское,
реки Усолка и Соленая и многие другие.
22.
Сколько нужно времени для того,чтобы съесть пуд соли?
Есть поговорка: «Чтобы хорошо узнать человека, надо съесть с
ним пуд соли».
Оказывается это можно сделать всего за год с небольшим. Ведь
потребность соли для нормального питания человека составляет
не менее 7 килограммов в год.
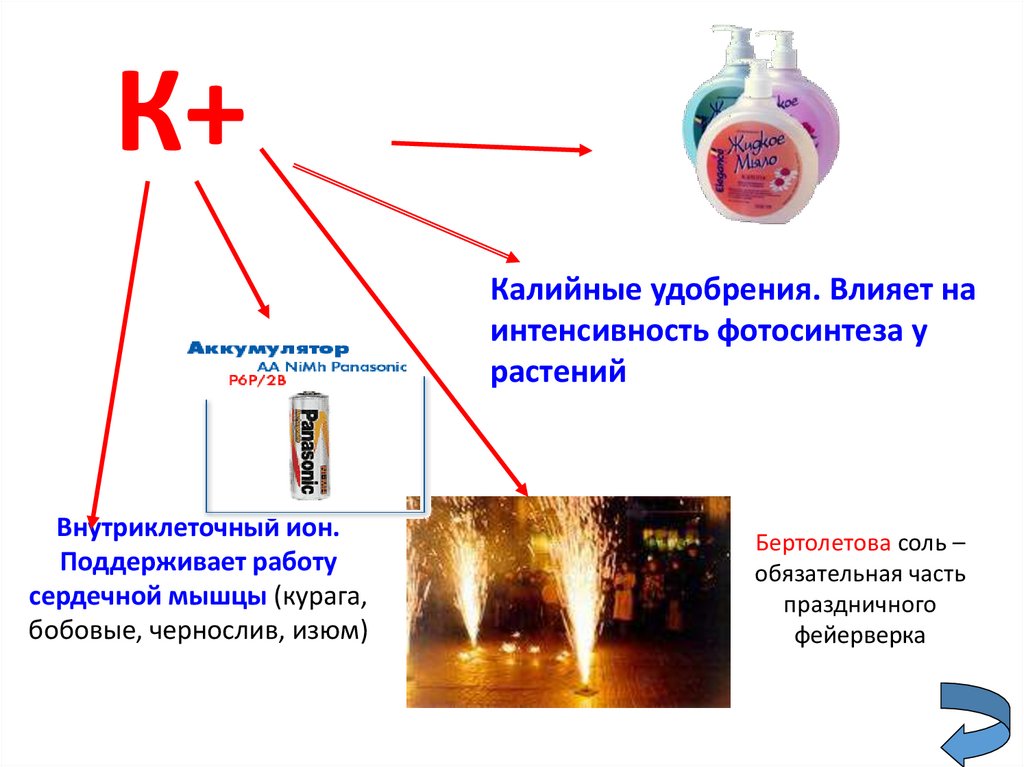
23.
К+Калийные удобрения. Влияет на
интенсивность фотосинтеза у
растений
Внутриклеточный ион.
Поддерживает работу
сердечной мышцы (курага,
бобовые, чернослив, изюм)
Бертолетова соль –
обязательная часть
праздничного
фейерверка
24.
•Поташ, селитру, сильвинит, какойметалл объединит?
• Калий
25.
Раствор хлорида натрия (0,9%)Сколько воды и хлорида натрия нужно взять для
применяется
в медицине.
Такой
раствор
приготовления
физиологического
раствора
называется
физиологическим
массой
0,5 кг?
4,5г соли
495,5 г воды
Питьевая сода применяется в
Смесь
хлорида
и гидрокарбоната
натрия
кулинарии,
для
выпечки кондитерских
массой 15 г обработали
уксусной
изделий.
кислотой,
этом- выделилось
л
Хлоридпри
натрия
как добавка к2,8
пище
(н.у.) газа. Определите массовые доли в
процентах компонентов смеси.
ответ
70% NaHCO3
ответ
30%
NaCl
Хлорид калия - очень ценное минеральное удобрение.
Калийные удобрения играю важную
Рассчитайте массовую долю калия (%) в этом веществе.
Тривиальные названия солей:
роль в жизни растений.
Поваренная соль
52%
NaCl
ответ
Кристаллическая сода
Na2CO3*10H2O
Питьевая сода
NaHCO3
поташ
K2CO3
Калийная
селитра
KNO3
Глауберова соль
Na2SO4*10H2O
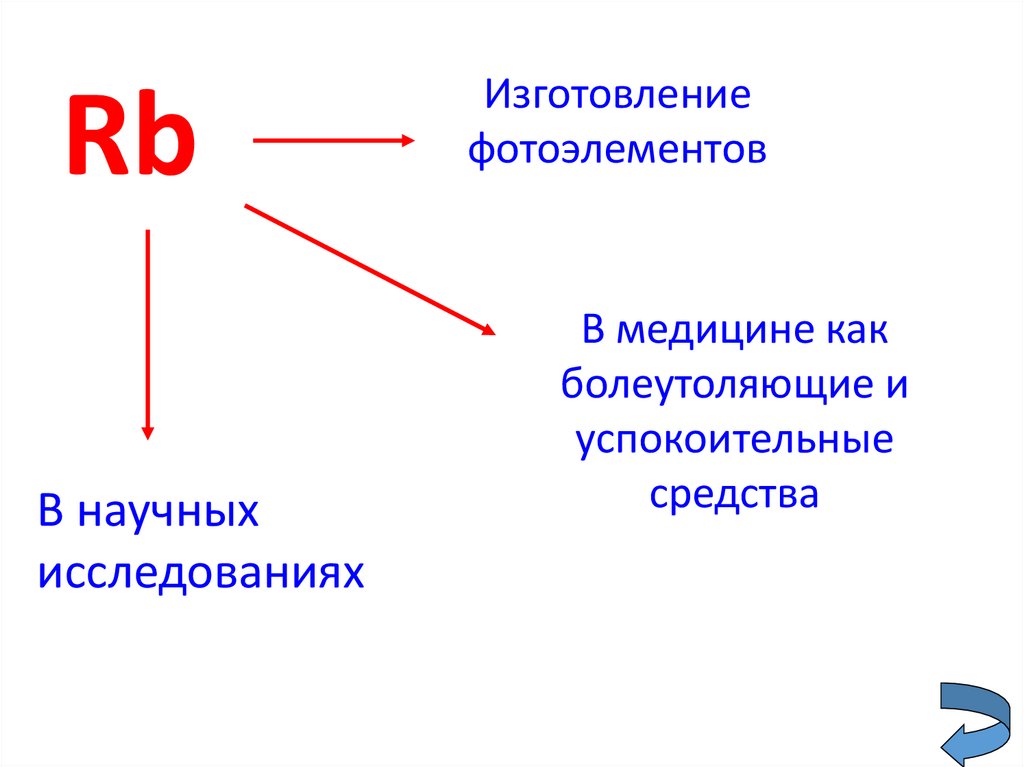
26.
RbВ научных
исследованиях
Изготовление
фотоэлементов
В медицине как
болеутоляющие и
успокоительные
средства
27.
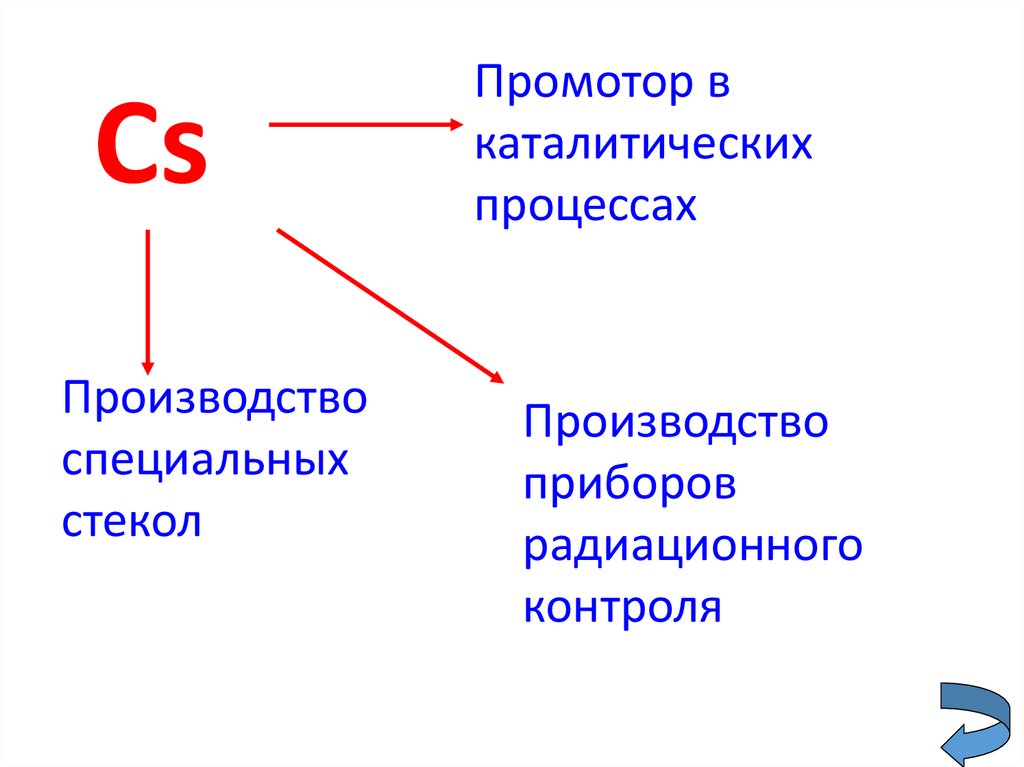
CsПроизводство
специальных
стекол
Промотор в
каталитических
процессах
Производство
приборов
радиационного
контроля
28.
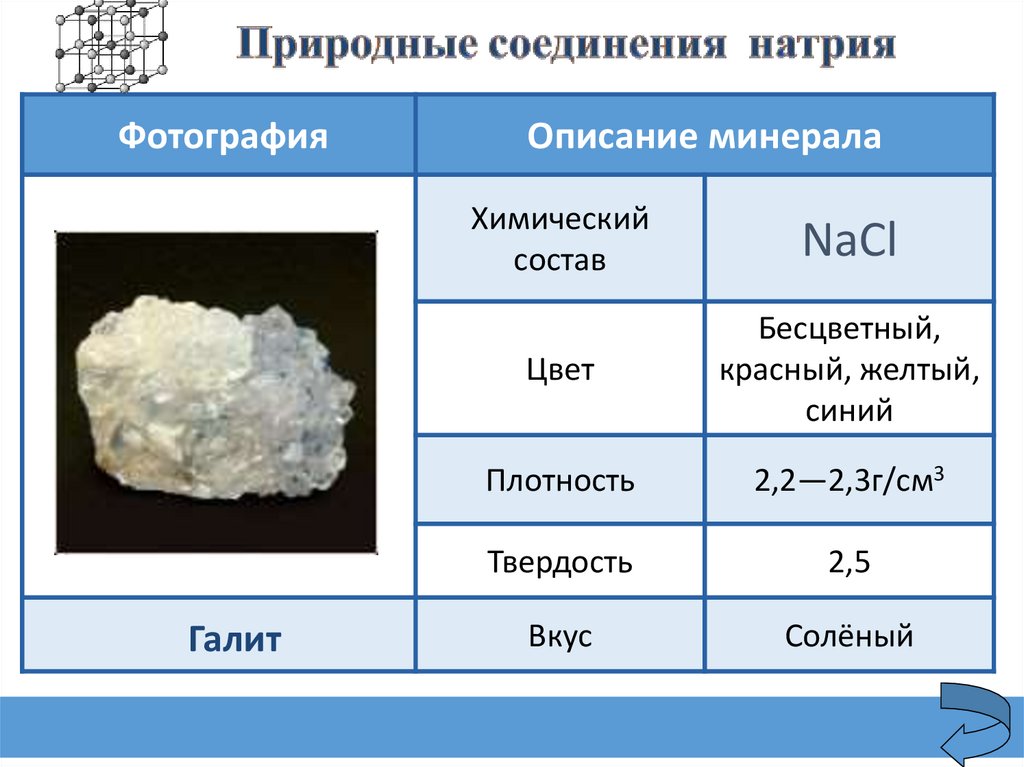
ФотографияГалит
Описание минерала
Химический
состав
NaСl
Цвет
Бесцветный,
красный, желтый,
синий
Плотность
2,2—2,3г/см3
Твердость
2,5
Вкус
Солёный
29.
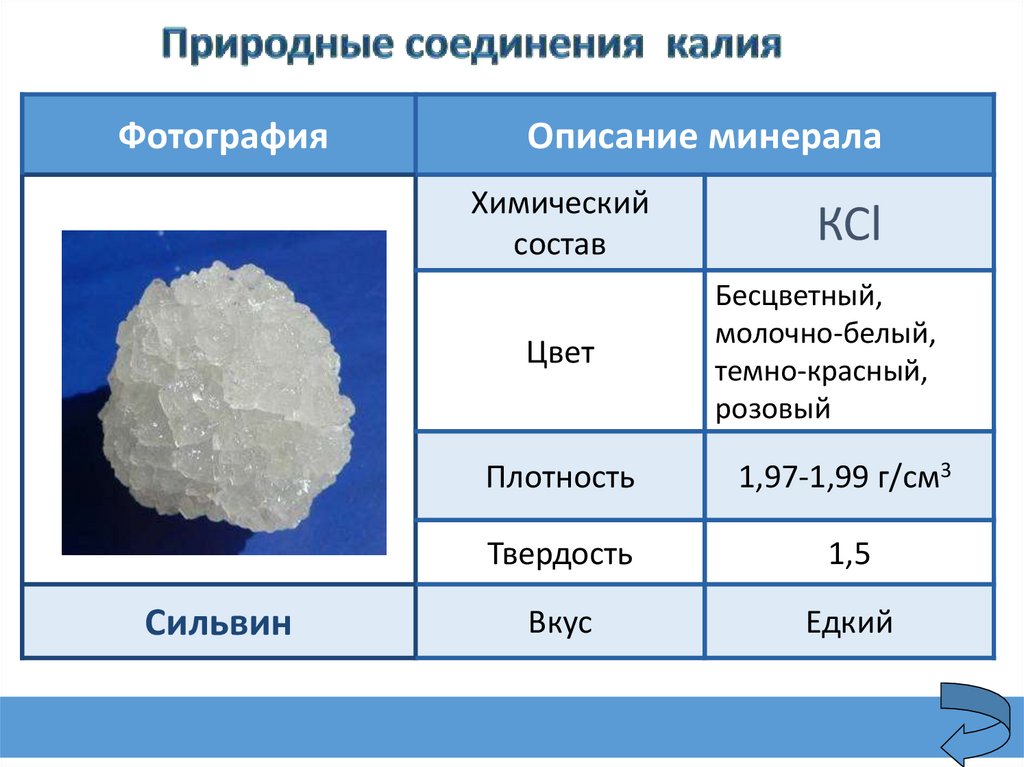
ФотографияОписание минерала
Химический
состав
Сильвин
КСl
Цвет
Бесцветный,
молочно-белый,
темно-красный,
розовый
Плотность
1,97-1,99 г/см3
Твердость
1,5
Вкус
Едкий
30.
ФотографияСподуменн
Описание минерала
Химический
состав
LiAl[Si2O6]
Цвет
Бесцветный,
красный, желтый,
зеленый
Плотность
3,1—3,2 г/см3
Твердость
6,5
31.
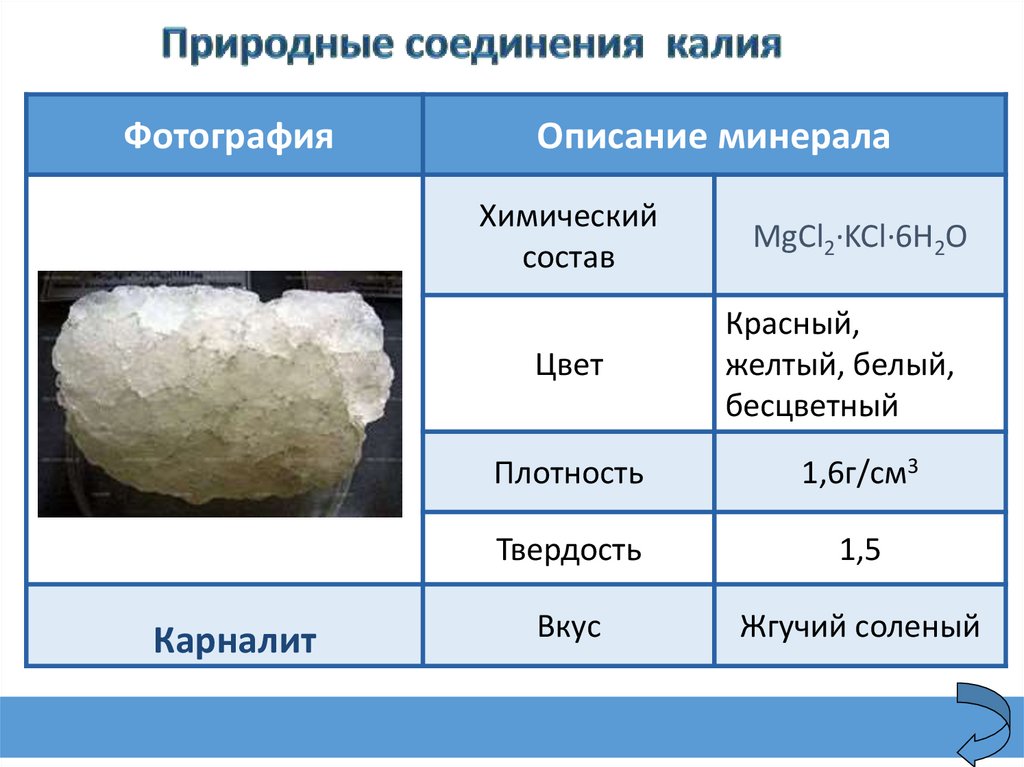
ФотографияКарналит
Описание минерала
Химический
состав
MgCl2·KCl·6H2O
Цвет
Красный,
желтый, белый,
бесцветный
Плотность
1,6г/см3
Твердость
1,5
Вкус
Жгучий соленый
32.
Проверьте• Na2CO3 – кальцинированная сода
• Na2CO3*10Н2О – кристаллическая или стиральная сода
• Na2НCO3 – питьевая сода
33.
1. Хранят обычно в керосине, ибегает он по воде,
В природе, помните, отныне,
Свободным нет его нигде,
В солях открыть его возможно
Желтеет пламя от него
И получить из соли можно
Как Дэви получил его.
О каком элементе идет речь?
Na)
(
34.
Он энергично вытесняетИз влаги - чистый водород,
Его при этом заменяет
И вяжет прочно кислород.
Тот элемент в растеньях скрыт
По фиолетовому цвету
Он может быть в солях открыт.
О каком элементе идет речь?
(К).


























 chemistry
chemistry








