Similar presentations:
Соединения щелочных металлов
1. Соединения щелочных металлов
2. Проверочная работа.
Вариант № 1Вариант№ 2
1) Напишите строение атома 1) Напишите строение атома
Na.
K.
2) Как изменяются
восстановительные свойства
щелочных металлов в
подгруппе? Почему?
2) Как изменяются
металлические свойства
щелочных металлов в
подгруппе? Почему?
3) Напишите реакции
взаимодействия Na с водой и
кислородом . Обязательно
напишите электронный
баланс.
3) Напишите реакции
взаимодействия К с водой и
серой. Обязательно
напишите электронный
баланс.
3. Оксиды ЩМ (Ме2О)
• Получают прокаливанием пероксидов ссоответствующими металлами:
Na2O2 + 2Na
2Na2O
2O-1 + 2e- 2O-2 1 окислитель
Na0 – 1e- Na+ 2 восстановитель
• Оксиды лития и натрия имеют белый цвет,
калия и рубидия – желтый, цезия –
оранжевый, все они – кристаллические
вещества, имеют ионную кристаллическую
решетку.
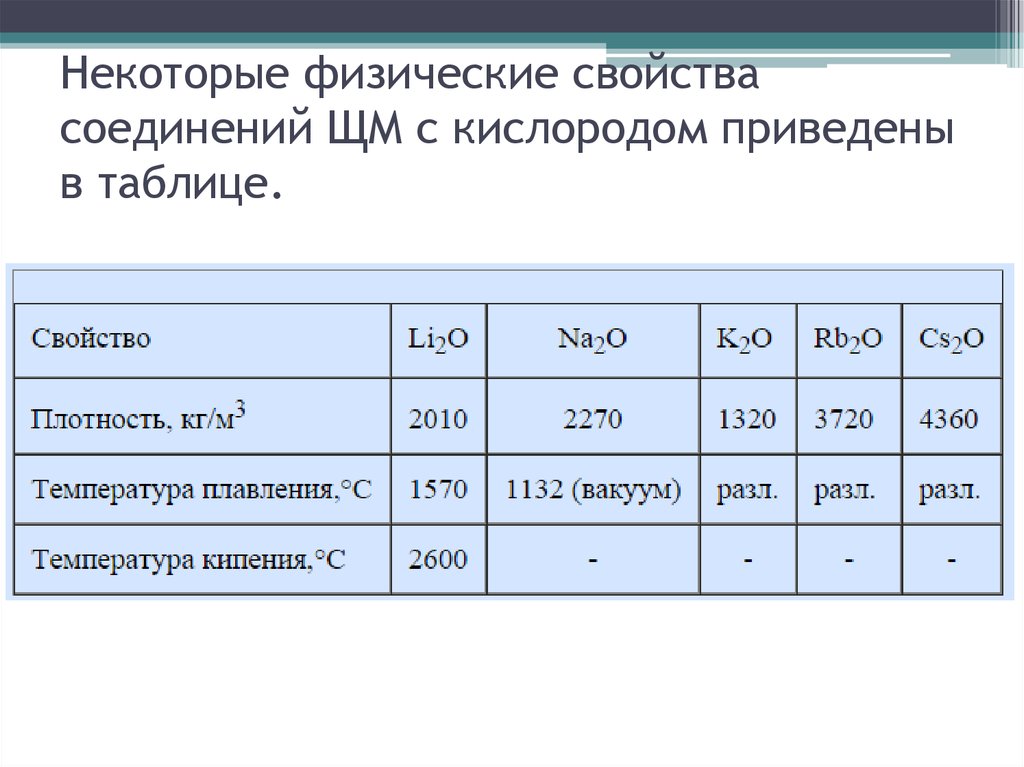
4. Некоторые физические свойства соединений ЩМ с кислородом приведены в таблице.
5. Химические свойства оксидов ЩМ:
• Хорошо растворяются в воде, реагируя с ней:Mе2O + H2O 2MеOH
Na2O + H2O
2NaOH
• Проявляют свойства основных оксидов,
реагируют с кислотными оксидами и
кислотами:
Li2O + SO3 Li2SO4
Li2O + 2HCl 2LiCl + H2O
6. Реагируют с кислородом, водородом, серой и хлором:
2Na2O + O22Na2O2 баланс
Na2O + H2
NaH + NaOН баланс
4Na2O + 4S
2Na2O + Cl2
3Na2S + Na2SO4 баланс
2NaCl + Na2O2 баланс
7. Гидроксиды ЩМ (МеОН):
• Все гидроксиды щелочных металлов –бесцветные гигроскопичные вещества, легко
расплывающиеся на воздухе, очень хорошо
растворимы в воде и этаноле, при переходе от
LiOH к CsOH растворимость увеличивается.
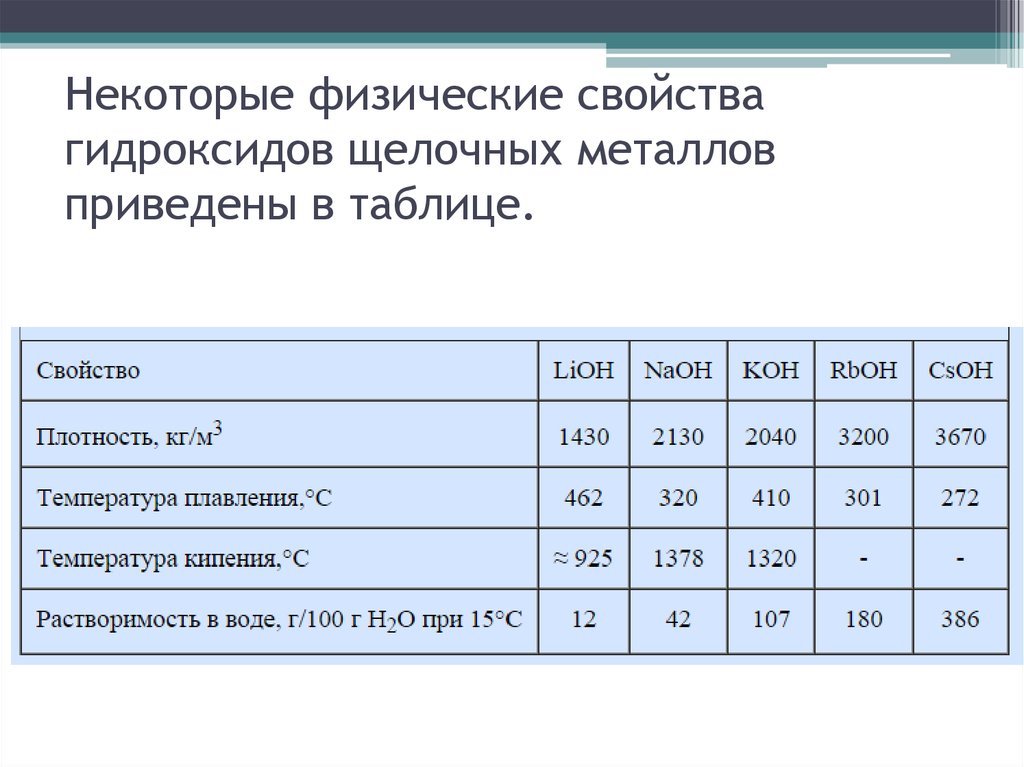
8. Некоторые физические свойства гидроксидов щелочных металлов приведены в таблице.
9. Химические свойства:
• Реагируют с оксидами неметаллов:2NaOH + CO2
Na2CO3 + H2O
2KOH + 2NO2 KNO3 + KNO2 + H2O
• Взаимодействуют с кислотами, вступают в
реакцию нейтрализации:
NaOH + HCl
NaCl + H2O ионное уравнение
KOH + HNO3 KNO3 + H2O ионное уравнение
• Вступают в обменные реакции с солями:
2NaOH + CuCl2
Cu(OH)2 + 2NaCl ионное
уравнение
10.
• Взаимодействуют с амфотерными металлами иих оксидами:
NaOH + Al(OH)3
NaAlO2 + 2H2O
2NaOH + Al2O3
2NaAlO2 + 2H2O
• Гидроксид калия применяется для
получения жидкого мыла и стекла.
• Гидроксид натрия используется для
производства бумаги, искусственных тканей,
мыла, очистки нефтепроводов, в производстве
искусственного волокна и в щелочных
аккумуляторах.
11. Na2CO3 и NaHCO3 карбонат натрия гидрокарбонат натрия
• Карбонат натрия (Na2CO3) используетсядля производства бумаги, мыла и стекла.
• Гидрокарбонат натрия (питьевая
сода) (NaHCO3) применяется в медицине,
кулинарии, в производстве минеральных вод,
используется в огнетушителях.
12.
• Карбонат калия (поташ) (K2CO3)необходим при производстве жидкого мыла и
стекла.
• Глауберова соль (Na2SO4 · 10 H2O) применяют
для производства соды и стекла и в качестве
слабительного средства.
• Поваренная соль (NaCl) хлорид натрия
Пищевая промышленность, медицина, суточная
потребность в соли составляет 5 г, летальная
доза в 100 раз превышает суточную норму
потребления и составляет 3 грамма на 1
килограмм массы тела.
• Нитрат калия (KNO3) калиевая селитра
Основное применение находит в пиротехнике
(дымный порох), комплексное минеральное
удобрение











 chemistry
chemistry








