Similar presentations:
Глоссарий
1.
*Глоссарий
Химическая реакция – процесс превращения исходных веществ в продукты реакций.
Физические явления – явления, приводящие к изменению формы или агрегатного
состояния вещества, но не приводящие к образованию новых веществ.
Химические явления – явления, при которых одни вещества превращаются в другие,
отличающиеся от исходных составом и свойствами.
Горение – физико-химический процесс, при котором превращение вещества
сопровождается интенсивным выделением энергии (тепла).
Коэффициенты – оказывают количество молекул данного вещества.
Индексы – показывают количество атомов элемента в веществе.
Уравнения реакций – условная запись химической реакции
посредством химических формул и математических знаков.
2.
*Тема: Валентность.Определение
валентности по
формулам.
3.
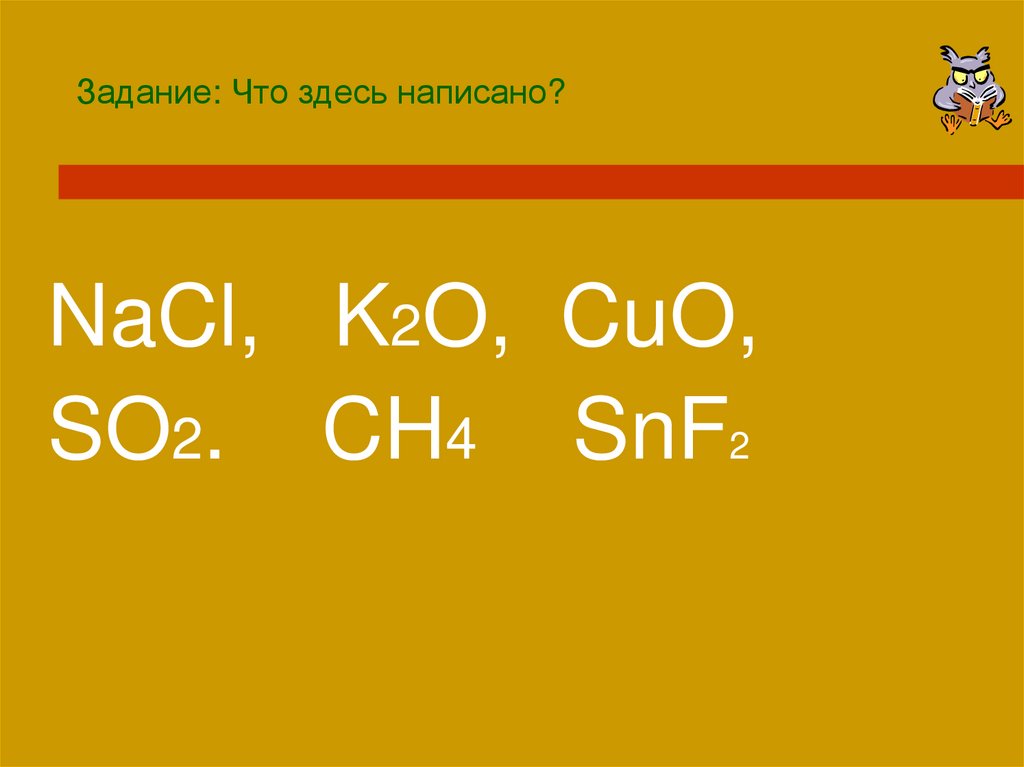
Задание: Что здесь написано?NaCl, K2O, CuO,
SO2. CH4 SnF2
4.
. Рассчитайтеотносительную
молекулярную массу данных
веществ: CuO, SO2.
Справочные данные:
Аr (Cu) = 64
Аr (O) = 16
Аr (S) =3 2
5.
Что общего в составе молекул?Чем они отличаются друг от друга?
Задание: сравните
качественный и
количественный состав в
молекулах:
HCl , H2O, NH3, CH4.
6.
Вывод: У атомов разнаяспособность удерживать
определённое количество других
атомов в соединениях. Это
называется валентностью.
Слово “валентность” происходит от
лат. valentia – сила.
7.
8.
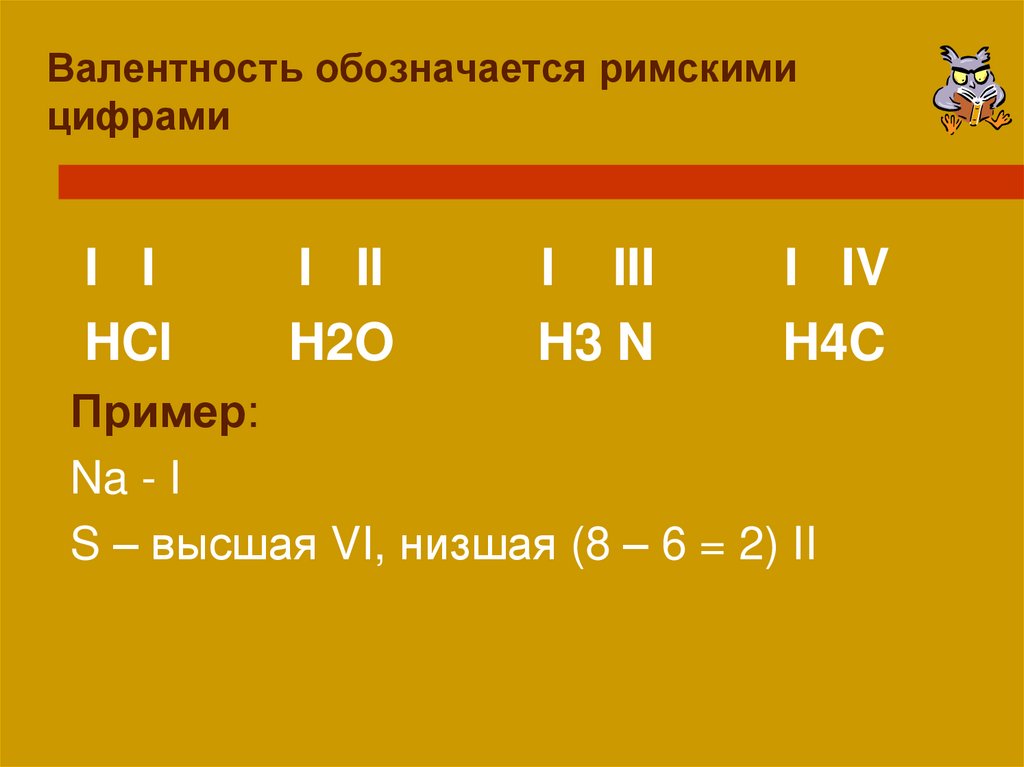
Валентность обозначается римскимицифрами
I I
HCl
I II
H2O
I III
H3 N
I IV
H4C
Пример:
Na - I
S – высшая VI, низшая (8 – 6 = 2) II
9.
Составление химическихформул по валентности
1. Запиши рядом знаки химических элементов, которые входят в состав
вещества.
BO
B
Пример: Составить химическую
формулу оксида бора.
10.
6III
II
BO
Н.О.К. (наименьшее общее кратное) –
это число, которое делится на
исходные числа без остатка.
11.
Раздели Н.О.К. на валентность каждого элемента.Запиши полученный индекс.
6
III
II
BO
2
6 : III = 2
3
6 : II = 3
Пример: Составить химическую формулу
оксида бора.
12.
Типы химических реакций.13.
Классификация реакций• по числу и составу исходных веществ и продуктов реакции
реакция соединения
реакция разложения
реакция замещения
реакция обмена
• по тепловому эффекту
экзотермическая реакция
эндотермическая реакция
14.
По числу и составу исходныхвеществ и продуктов реакции
• Реакция соединения – реакция, в ходе, которой из
нескольких простых и сложных веществ образуется одно
более сложное вещество.
Взаимодействие оксида кальция с водой
CaO + H2O = Ca(OH)2
Взаимодействие оксида серы (IV) с водой
SO2 + H2O = H2SO3
Горение оксида серы (IV)
2SO2 + O2 = 2SO3
15.
Реакция разложения• Реакция разложения – реакция, в которой из одного
исходного вещества образуется несколько новых веществ.
Электролиз воды
2H2O = 2H2 + O2
Разложение нитрата калия
2KNO3 = 2KNO2 + O2
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2
16.
Реакция замещения• Реакция замещения – реакция между простым и
сложным веществами, в результате которой атомы
простого вещества замещают атомы одного из
элементов сложного вещества.
Взаимодействие цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2
Взаимодействие натрия с водой
2Na + 2H2O = 2NaOH + H2
Взаимодействие железа с раствором сульфата меди (II)
Fe + CuSO4 = FeSO4 + Cu↓
17.
Реакция обмена• Реакция обмена – реакция, в результате которой два
вещества обмениваются своими составными частями,
образуя два новых вещества.
Взаимодействие растворов сульфата меди (II) и гидроксида калия
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Взаимодействие раствора гидроксида натрия с азотной кислотой
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие хлорида аммония с гидроксидом кальция
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
18.
По тепловому эффектухимической реакции
• Экзотермические реакции – реакции, протекающие с
выделением энергии (тепла).
Горение фосфора в кислороде
4P + 5O2 = 2P2O5 + Q кДж
Горение этилового спирта
C2H5OH + 3O2 = 2CO2 + 3H2O + Q кДж
19.
Эндотермическая реакция• Эндотермические реакции – реакции, протекающие с
поглощением энергии (тепла).
Горение азота в атмосфере кислорода
N2 + O2 = 2NO – Q кДж
Разложение оксида ртути
2HgO = 2Hg↓ + O2↑ – Q кДж
Горение аммиака в кислороде
4NH3 + 5O2 = 4NO + 6H2O – Q кДж
20.
Проверьте свои знанияОпределите тип химической реакции.
Распределите предложенные вам уравнения, расставьте
коэффициенты в уравнениях реакций.
H2 + O2 = H2O
NaOH + H3PO4 = Na3PO4 + H2O
Fe(OH)3 = Fe2O3 + H2O
P2O5 + H2O = H3PO4
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
Ca + H2O = Ca(OH)2 + H2
CaCO3 = CaO + CO2
Fe + HCl = FeCl2 + H2
Реакция соединения
Реакция обмена
Реакция разложения
Реакция замещения
21.
Сравни и оцениРеакция соединения
Реакция обмена
Реакция разложения
Реакция замещения
2H2 + O2 = 2H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O
2Fe(OH)3 = Fe2O3 +3H2O
P2O5 + 3H2O = 2H3PO4
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
Ca + 2H2O = Ca(OH)2 + H2
CaCO3 = CaO + CO2
Fe +2HCl = FeCl2 + H2
0 ошибок - «5»
1-2 ошибки – «4»
3-4 ошибки – «3»
5 и более – «2»



















 chemistry
chemistry








