Similar presentations:
Типы химических реакций
1. Типы химических реакций
• Межакова НА МАОУ «СОШ№5 г.Челябинска»2. Химическая реакция – это превращение одних веществ в другие.
!Сущность химической реакции
Что
происходит
с веществами в процессе
химической
состоит
в перегруппировке
атомов
.
реакции?
ВИДЕО
3.
1Образование осадка
2
Растворение осадка
3
Выделение газа
4
Появление запаха
5
Изменение окраски
6
Выделение теплоты или света
4. Классификация реакций
• по числу и составу исходных веществ и продуктов реакцииреакция соединения
реакция разложения
реакция замещения
реакция обмена
• по тепловому эффекту
экзотермическая реакция
эндотермическая реакция
5. Запишите формулы веществ в соответствующие столбцы таблицы: H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH)2, O3, FeBr3
Запишите формулы веществ всоответствующие столбцы таблицы:
H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH)2, O3, FeBr3
Простые
Простые вещества
вещества
Сложные
Сложные вещества
вещества
…………………..
H2
…………………..
…………………..
Al
…………………..
…………………..
Mg
…………………..
…………………..
…………………..
S
…………………..
O3
Na2S
CuCl2
KI
Ca(OH)2
…………………..
FeBr3
6. По числу и составу исходных веществ и продуктов реакции
Реакция соединения – реакция, в ходе, которой изнескольких простых и сложных веществ образуется
одно более сложное вещество.
Взаимодействие оксида кальция с водой
CaO + H2O = Ca(OH)2
Взаимодействие оксида серы (IV) с водой
SO2 + H2O = H2SO3
Горение оксида серы (IV)
2SO2 + O2 = 2SO3
7. Реакция разложения
Реакция разложения – реакция, в которой из одного исходного веществаобразуется несколько новых веществ.
Электролиз воды
2H2O = 2H2 + O2
Разложение нитрата калия
2KNO3 = 2KNO2 + O2
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2
8. Реакция замещения
• Реакция замещения – реакция между простым и сложным веществами, врезультате которой атомы простого вещества замещают атомы одного
из элементов сложного вещества.
Взаимодействие цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2
Взаимодействие натрия с водой
2Na + 2H2O = 2NaOH + H2
Взаимодействие железа с раствором сульфата меди (II)
Fe + CuSO4 = FeSO4 + Cu↓
9.
Реакции обмена – это такие реакции, при которых двасложных вещества обмениваются своими составными
частями
10. Реакция обмена
Реакция обмена – реакция, в результате которой два веществаобмениваются своими составными частями, образуя два новых вещества.
Взаимодействие растворов сульфата меди (II) и гидроксида калия
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Взаимодействие раствора гидроксида натрия с азотной кислотой
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие хлорида аммония с гидроксидом кальция
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
11.
2P + 5Cl2 → 2PCl5CH4 →C + H2
Na + S → Na2S
HCl + Mg → MgCl2 + H2
ZnSO4+2KOH→K2SO4 + Zn(OH)2
12.
BaCl2 + Na2SO4 →BaSO4 + NaClAlCl3 + NaOH → NaCl + Al(OH)3
Fe(OH)3→ Fe2O3 + H2O
H2SO4 + Al→ Al2(SO4)3 + H2
P2O5 + Na2O → Na3PO4
Al2(SO4)3+Ba(NO3)2 →Al(NO3)3 + BaSO4
13.
В каких химических уравнениях неправильнорасставлены коэффициенты?
1) ZnS + 4 HCl = ZnCl2 + H2S
2) 2 Fe2O3 + H2 = 2 Fe + 3 H2O
3) 2 CuS + 3 O2 = 2 CuO + 2 SO2
14.
По изменению степеней окисления химических элементов:1. Окислительно-восстановительные реакции – реакции,
идущие с изменением степеней окисления элементов (все
реакции замещения, а также реакции соединения и
разложения, в которых участвует хотя бы одно простое
вещество).
CuSO4 + Fe = FeSO4 + Cu↓
Zn + 2HCl = ZnCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
15. По тепловому эффекту
Экзотермические идут с выделениетеплоты
S + O2 = SO2 + Q
Эндотермические Идут с
поглощением
теплоты
N2 + O2 = 2NO -Q
16.
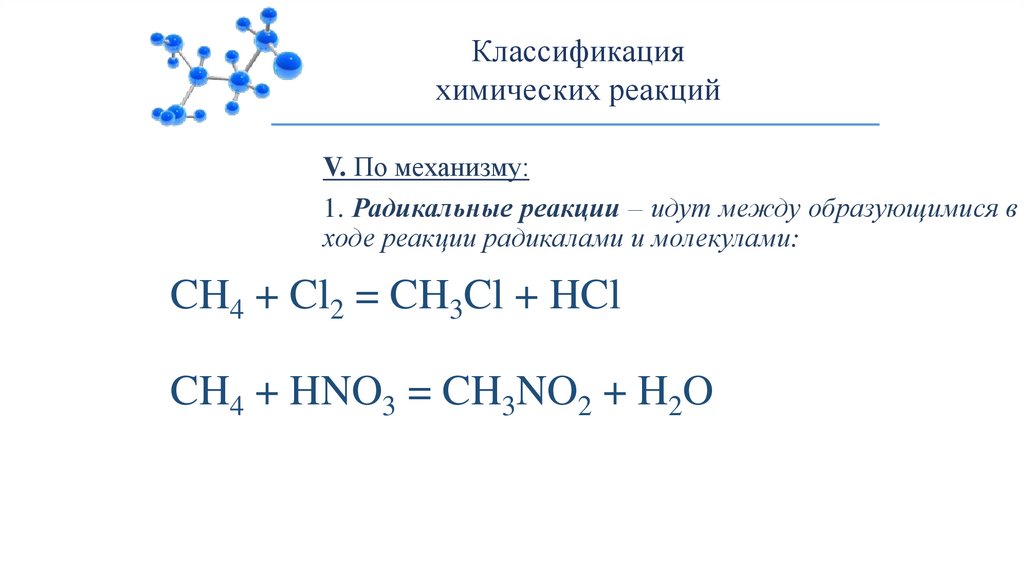
Классификацияхимических реакций
V. По механизму:
1. Радикальные реакции – идут между образующимися в
ходе реакции радикалами и молекулами:
CH4 + Cl2 = CH3Cl + HCl
CH4 + HNO3 = CH3NO2 + H2O
17.
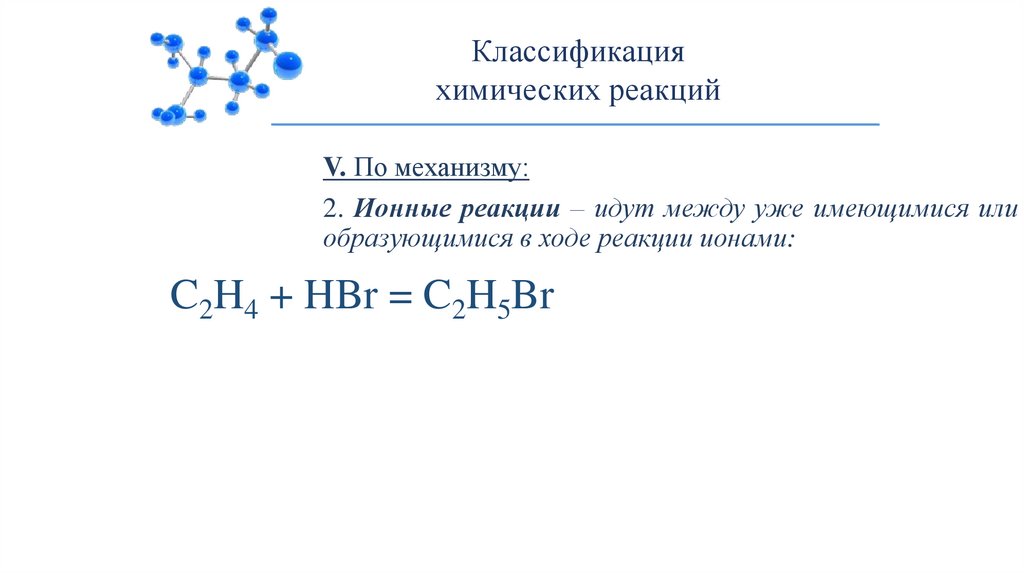
Классификацияхимических реакций
V. По механизму:
2. Ионные реакции – идут между уже имеющимися или
образующимися в ходе реакции ионами:
C2H4 + HBr = C2H5Br
18. Реакции присоединения
Реакции, в которых в состав органическоговещества включаются атомы или группы атомов
в результате соединения двух или нескольких
молекул исходных веществ. Реакции происходят
за счет разрыва -связей
СH2 CH2 + Br2 CH2Br - CH2Br
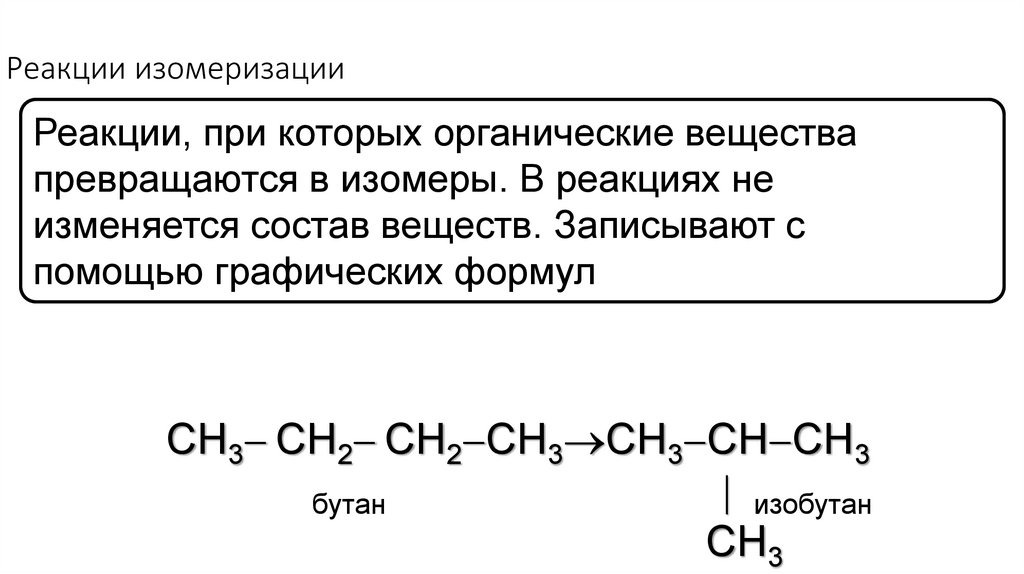
19. Реакции изомеризации
Реакции, при которых органические веществапревращаются в изомеры. В реакциях не
изменяется состав веществ. Записывают с
помощью графических формул
СH3 CH2 СH2 CH3 CH3 CH CH3
изобутан
бутан
CH3
20. Реакция полимеризации
• Реакцию образования полимера из мономера называютполимеризацией. В процессе полимеризации вещество может
переходить из газообразного или жидкого состояния в состояние
весьма густой жидкости или твердое. Реакция полимеризации не
сопровождается отщеплением каких-либо низкомолекулярных
побочных продуктов. При полимеризации полимер и мономер
характеризуются одинаковым элементным составом.
21. Получение полипропилена
• n СН2 = СН → (- СН2 – СН-)n|
|
СН3
СН3
пропилен
полипропилен
Выражение в скобках называют Структурным звеном, а число n в
формуле полимера – степенью полимеризации.
22. Реакция поликонденсации
• Помимо реакции полимеризации полимерыможно получить поликонденсацией —
реакцией, при которой происходит
перегруппировка атомов полимеров и
выделение из сферы реакции воды или других
низкомолекулярных веществ.
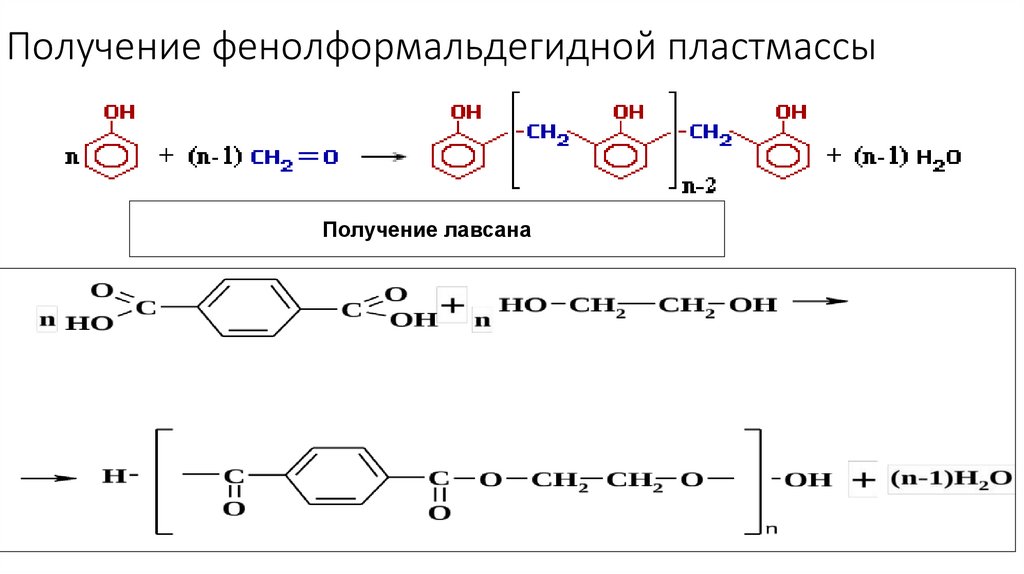
23. Получение фенолформальдегидной пластмассы
Получение лавсана24.
ЭкспериментИсходные
вещества
сульфат меди (||) и
алюминий
Гидроксид натрия
и серная кислота
Хлорид бария и
сульфат натрия
Медь и хлор
Видео
Признаки
Выпадение
осадка и
изменение цвета
Выделение
тепла
Выпадение
осадка и
изменение цвета
Выделение
энергии
Дигидроксокарбо- Выделение
нат меди (||)
углекислого газа и
Видео
выпадение осадка
Схема/Уравнение
АВ + С = СА + В
Типы химических
реакций
Замещения
3CuSO4+2Al=Al2(SO4)3 + 3Cu↓
AB + CD = AD + CB
NaOH + H2SO4 = Na2SO4 + H2O + Q
AB + CD = AD + CB
Обмена,
экзотермическая
Обмена
Na2SO4 + ВаCl2 = BaSO4↓ + 2NaCl
A + C = AC
Соединения
Cu + Cl2 = CuCl2
ABС = А + В + С
(CuOH)2CO3 =2CuO↓ +H2O+CO2↑
Разложения
25.
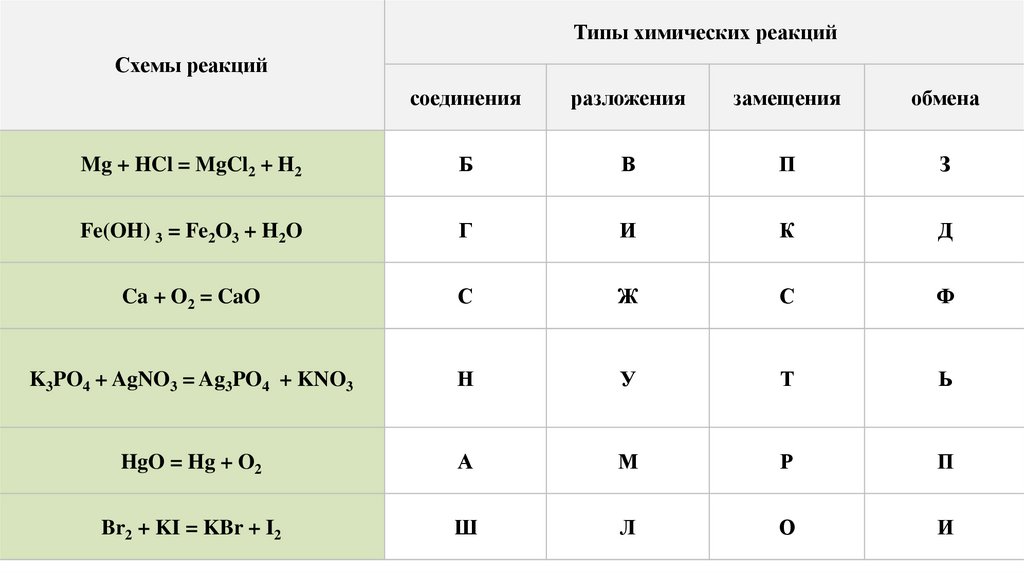
Типы химических реакцийСхемы реакций
соединения
разложения
замещения
обмена
Mg + HCl = MgCl2 + H2
Б
В
П
З
Fe(OH) 3 = Fe2O3 + H2O
Г
И
К
Д
Ca + O2 = CaO
С
Ж
С
Ф
K3PO4 + AgNO3 = Ag3PO4 + KNO3
Н
У
Т
Ь
HgO = Hg + O2
А
М
Р
П
Br2 + KI = KBr + I2
Ш
Л
О
И
26.
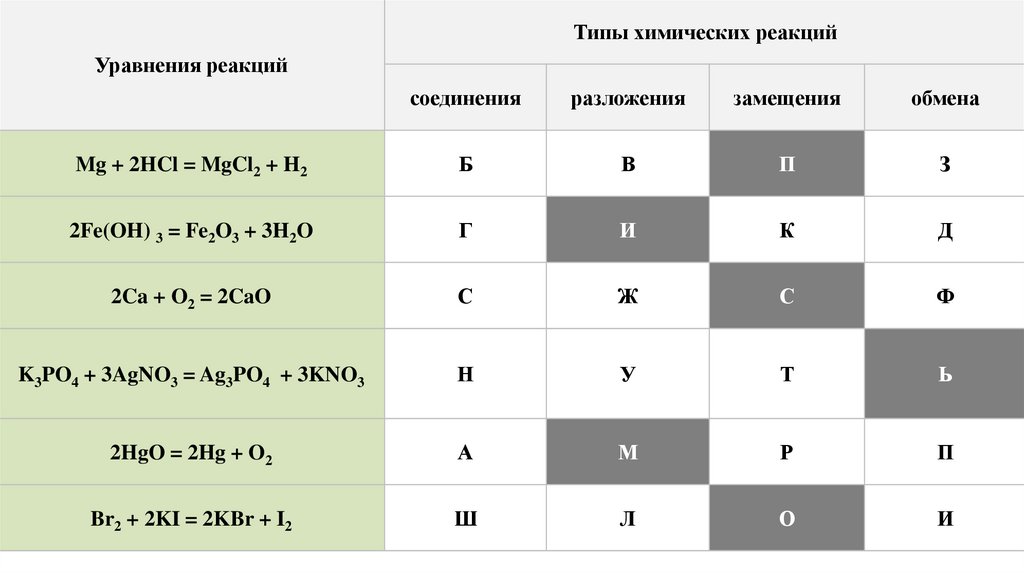
Типы химических реакцийУравнения реакций
соединения
разложения
замещения
обмена
Mg + 2HCl = MgCl2 + H2
Б
В
П
З
2Fe(OH) 3 = Fe2O3 + 3H2O
Г
И
К
Д
2Ca + O2 = 2CaO
С
Ж
С
Ф
K3PO4 + 3AgNO3 = Ag3PO4 + 3KNO3
Н
У
Т
Ь
2HgO = 2Hg + O2
А
М
Р
П
Br2 + 2KI = 2KBr + I2
Ш
Л
О
И
27. Составьте уравнение синтеза аммиака и расставьте коэффициенты. К какому типу химических реакций относиться синтез аммиака?
Для того чтобы произошла реакция, в результате которой образуется аммиак,исходную газовую смесь азота и водорода нагревают до 300˚С и сжимают до
давления в 200-300 Мпа. Затем зжатую газовую смесь пропускают через
стальную трубку диаметром около 1 м и высотой около 10-15 м – так
называемую колонну синтеза аммиака. Внутри колонны находится около 3т
пористого железа, на поверхности которого молекулы азота и водорода
становятся более активными и вступают во взаимодействие между собой.
Образование аммиака сопровождается выделением теплоты, которую
используют для нагревания исходной сжатой смеси азота и водорода. За один
проход через колонну около 15-20% исходных газов превращается в аммиак.
•N2+3H2 = 2NH3 + Q
•Это реакция соединения, экзотермическая
видео
28. Домашнее задание
• §20• 1. Репродуктивный уровень (оценка «3»), упр.
• 2. Прикладной уровень (оценка «4») РТ: определить типы
химических реакций
• 3. Творческий уровень (оценка «5»). Напишите 5-7 примеров
химических реакции в моей жизни.











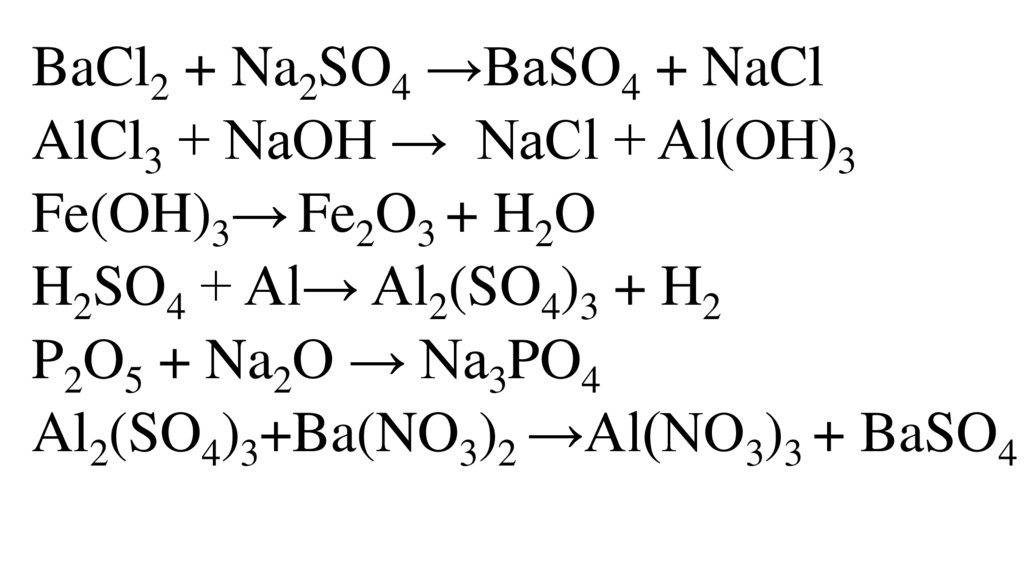










 chemistry
chemistry








