Similar presentations:
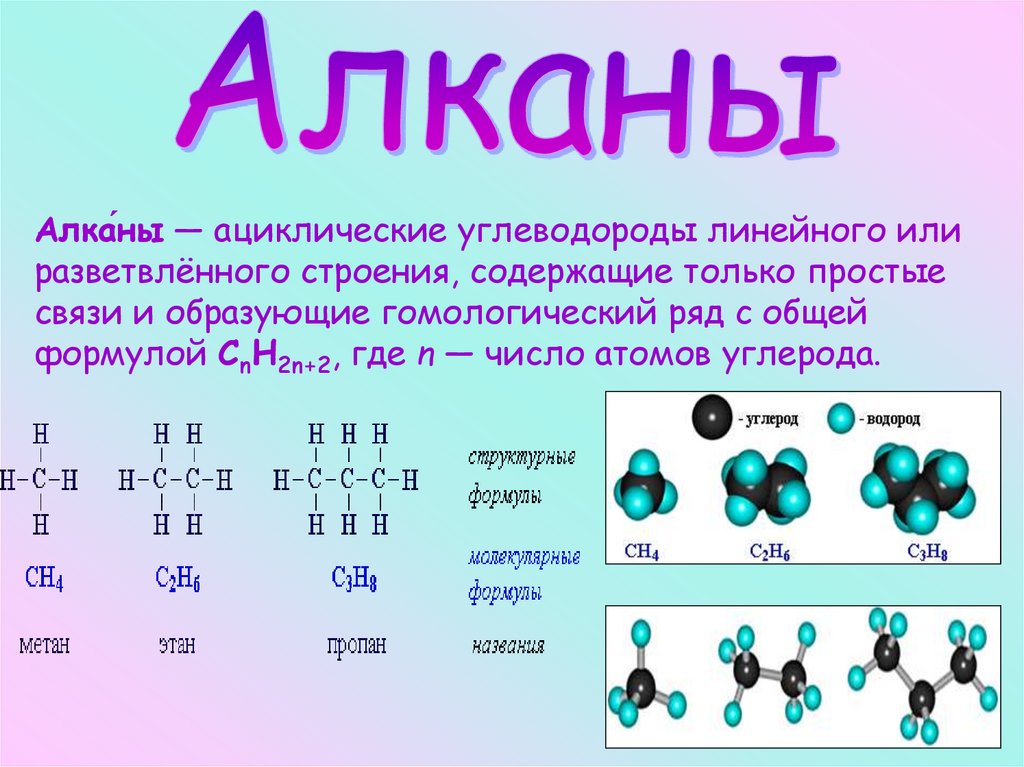
Алка́ны
1.
Алка́ны — ациклические углеводороды линейного илиразветвлённого строения, содержащие только простые
связи и образующие гомологический ряд с общей
формулой CnH2n+2, где n — число атомов углерода.
2.
Слово «алкан» того же происхождения, что и«алкоголь» Устаревший термин «парафин» произошел
от латинских parum — мало, незначительно и affinis родственный; парафины обладают малой реакционной
способностью по отношению к большинству химических
реагентов. Многие парафины являются гомологами;
в гомологическом ряду алканов каждый последующий
член отличается от предыдущего на одну метиленовую
группу СН2. Термин происходит от греческого homologos
— соответственный, подобный.
3.
Номенклатурные (от лат. nomenclatura — роспись имен)названия алканов строятся по определенным
правилам:
1. Выбор главной цепи (самой длинной цепочки атомов углерода в
молекуле, которая является основой)
2. Нумерация ат омов главной цепи (нумерация начинается с того
конца, к которому ближе стоит заместитель или функциональная
группа; если же заместители равноудалены от концов цепи, то
нумерация начинается с того конца, где их больше)
3. Формирование названия (в начале названия указываются цифры –
номера атомов углерода, при которых находится заместитель
(если заместителей несколько, то цифры пишутся через запятую)
после номера ставится дефис указывается количество
заместителей и их названия, затем без пробелов название
главной цепи)
4.
Формула Название ЧислоФормула Название
изомеров
Число изомеров
СН4
Метан
1
С11Н24
Ундекан
159
С2Н6
Этан
1
С12Н26
Додекан
355
С3Н8
Пропан
1
С13Н28
Тридекан
802
С4Н10
Бутан
2
С14Н30
Тетрадекан
1858
С5Н12
Пентан
3
С15Н32
Пентадекан
4347
С6Н14
Гексан
5
С20Н42
Эйкозан
366319
С7Н16
Гептан
9
С25Н52
Пентакозан
36797588
С8Н18
Октан
18
С30Н62
Триаконтан
4111846763
С9Н20
Нонан
35
С40Н82
Тетраконтан
62481801147341
С10Н22
Декан
75
С100Н202
Гектан
около 5,92111039
5.
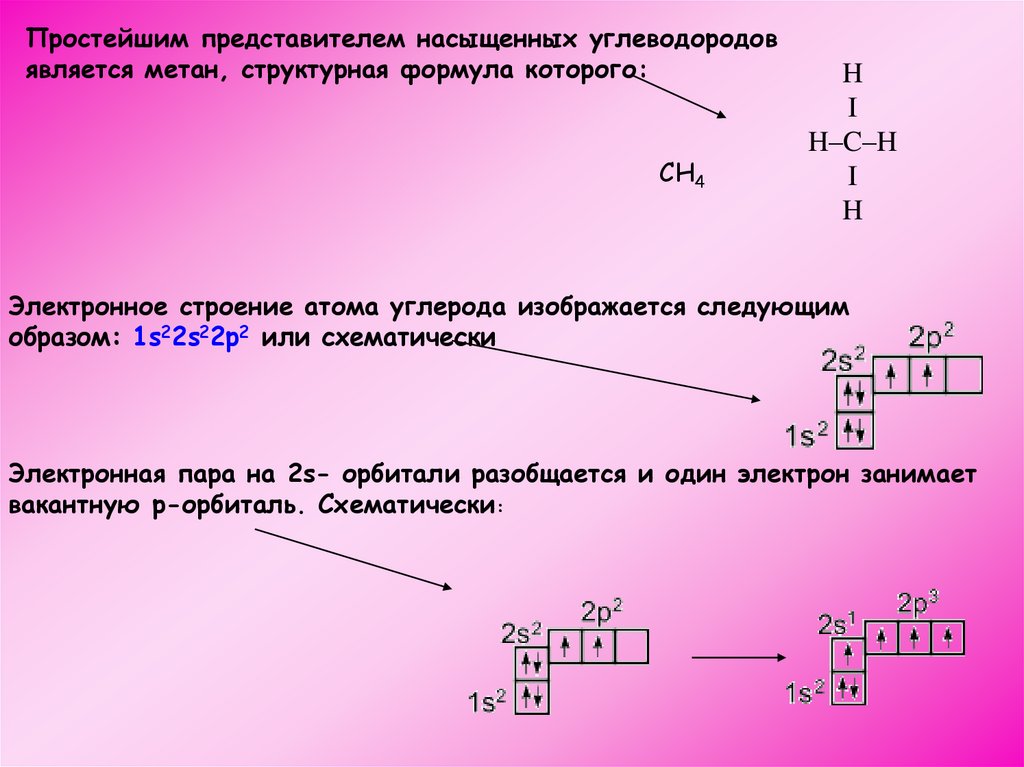
Простейшим представителем насыщенных углеводородовявляется метан, структурная формула которого:
СН4
H
I
H–C–H
I
H
Электронное строение атома углерода изображается следующим
образом: 1s22s22p2 или схематически
Электронная пара на 2s- орбитали разобщается и один электрон занимает
вакантную p-орбиталь. Схематически:
6.
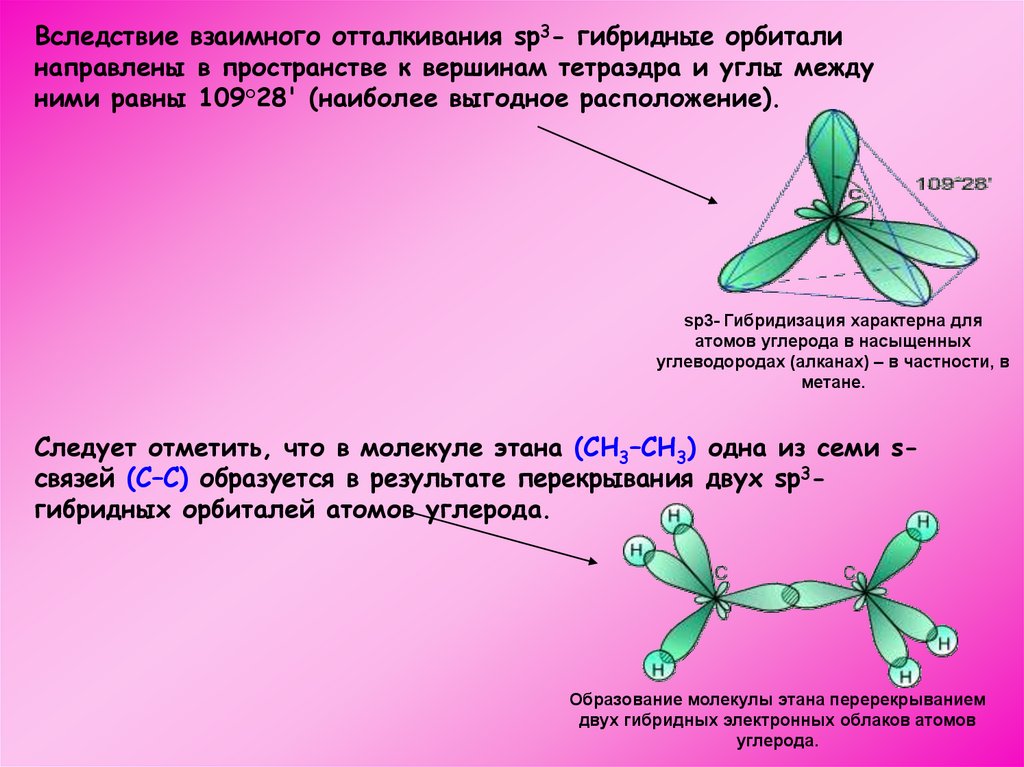
Вследствие взаимного отталкивания sp3- гибридные орбиталинаправлены в пространстве к вершинам тетраэдра и углы между
ними равны 109°28' (наиболее выгодное расположение).
sp3- Гибридизация характерна для
атомов углерода в насыщенных
углеводородах (алканах) – в частности, в
метане.
Следует отметить, что в молекуле этана (CH3–CH3) одна из семи sсвязей (С–С) образуется в результате перекрывания двух sp3гибридных орбиталей атомов углерода.
Образование молекулы этана перерекрыванием
двух гибридных электронных облаков атомов
углерода.
7.
1. В обычных условиях первые четыре члена гомологического рядаалканов (С1 — С4) — газы. Нормальные алканы от пентана до
гептадекана (C5 — C17) — жидкости, начиная с С18 и выше —
твердые вещества.
2. По мере увеличения числа атомов углерода в цепи, т.е. с ростом
относительной молекулярной массы, возрастают температуры
кипения и плавления алканов. При одинаковом числе атомов
углерода в молекуле алканы с разветвленным строением имеют
более низкие температуры кипения, чем нормальные алканы.
3. Алканы практически нерастворимы в воде, так как их молекулы
малополярны и не взаимодействуют с молекулами воды, но они
хорошо растворяются в неполярных органических растворителях,
таких как бензол, тетрахлорметан и др.
4. Жидкие алканы легко смешиваются друг с другом.
8.
1.Реакции замещения (галогенирование)СН4 + Cl2
CH3Cl + Cl2
CH3Cl + HCl (хлорметан)
HCl + CH2Cl2 (дихлорметан)
CH2Cl2 + Cl2
HCl + CHCl3 (трихлорметан)
CHCl3 + Cl2
HCl + CCl4 (тетрахлорметан)
2.Дегидрирование (отщепление водорода) при
катализаторах (Pt, Ni, Al2O3, Cr2O3) и при
высокой температуре (400о-600о)
CH3-CH3
CH2=CH2 + H2
9.
3.Реакции горения (при этом образуется углекислый гази вода)
CH4 + 2O2
CO2 + 2H2O
CnH2n+2 + (3n+1/2)O2
nCO2 + (n+1)H2O (в общем виде)
4.Крекинг (происходит под действием высокой
температуры 470о-550о)
C16H34
гексадекан
CnH2n+2
C8H18 + C8H16
октан
октен
Сn-kH2(n-k)+2 + CkH2k (в общем виде)
10.
5.Изомеризация (происходит при нагревании скатализатором AlCl3)
6. Ароматизация (образуются циклоалканы)
11.
1. Получение из ненасыщенныхуглеводородов. Взаимодействие алкенов или алкинов с
водородом ("гидрирование") происходит в присутствии
металлических катализаторов (Ni, Pd) при
нагревании:
СН3-СН=СН2 + Н2
СН3-СН2-СН3
СНз-C≡СН + 2Н2
СН3-СН2-СН3
.
2. Получение из галогенпротводных. При нагревании
моногалогензамещенных алканов с металлическим натрием получают
алканы с удвоенным числом атомов углерода (реакция Вюрца):
2CH3CH2Br + 2Na
CH3CH2CH2CH3 + 2NaBr
Подобную реакцию не проводят с двумя разными галогензамещенными
алканами, поскольку при этом получается смесь трех различных алканов
12.
3. В лабораторных условиях метан часто получают из карбидаалюминия:
Аl4С3 + 12Н2О
ЗСН4↑ + 4Аl(ОН)3.
4. Получение из солей карбоновых кислот. При сплавлении
безводных солей карбоновых кислот с щелочами получаются
алканы, содержащие на один атом углерода меньше по
сравнению с углеродной цепью исходных карбоновых кислот:
CH3COONa + NaOH
5. Изомеризация.
CH4 + Na2CO3
13.
Первый в ряду алканов – метан – является основнымкомпонентом природных и попутных газов и широко
используется в качестве промышленного и бытового газа.
Перерабатывается в промышленности в ацетилен, газовую
сажу, фторо- и хлоропроизводные.
Низшие члены гомологического ряда используются для
получения соответствующих непредельных соединений
реакцией дегидрирования. Смесь пропана и бутана
используется в качестве бытового топлива. Средние члены
гомологического ряда применяются как растворители и
моторные топлива. Высшие алканы используются для
производства высших жирных кислот, синтетических
жиров, смазочных масел и т.д.










 chemistry
chemistry








