Similar presentations:
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
1.
Урок №2Характеристика
химического элемента по
кислотно-основным
свойствам образуемых им
соединений. Амфотерные
оксиды и гидроксиды
2.
Основные свойства• Чем большим радиусом атома обладает
химический элемент, тем он проявляет более
сильные металлические свойства, и тем
более сильными основными свойствами
обладают его соединения.
• Основные свойства веществ проявляются во
взаимодействии их с кислотами, кислотными
оксидами,
амфотерными
оксидами
и
основаниями,
а
также
некоторыми
неметаллами (в определённых условиях).
3.
• Li Li2O LiOH• Na Na2O NaOH
• K K2O KOH
• Mg MgO Mg(OH)2
• Ca CaO Ca(OH)2
• Cr CrO Cr(OH)2
Основные свойства проявляют оксиды
(М2О и МО) и гидроксиды металлов
(МОН и М(ОН)2)в степени окисления
+1 и +2 (за исключением Be и Zn)
4.
Кислотные свойства• Чем меньше радиус атома химического
элемента, тем он проявляет более
сильные неметаллические свойства, и
тем более сильными кислотными
свойствами обладают его соединения.
• Кислотные свойства обратны основным
5.
• P P2O5 H3PO4• S SO3 H2SO4
• Cl2 Cl2O7 HClO4
• V V2O5 HVO3
• Cr CrO3 H2CrO4
Кислотные свойства проявляют оксиды и
гидроксиды неметаллов в степени
окисления ≥+3, а также оксиды и
гидроксиды металлов в степени
окисления ≥+5
6.
Амфотерные свойства• Проявляют химические элементы, которые
занимают промежуточное (граничное)
положение между типичными металлами и
типичными неметаллами, амфотерны и их
соединения.
• Амфотерность заключается во
взаимодействии данных веществ (оксидов,
гидроксидов) как с сильными основаниями
(основными оксидами) так и кислотами
(кислотными оксидами).
7.
• Be BeO Be(OH)2• Zn ZnO Zn(OH)2
• Al Al2O3 Al(OH)3
• Fe Fe2O3 Fe(OH)3
• Cr Cr2O3 Cr(OH)3
• Mn MnO2 Mn(OH)4
Амфотерные свойства проявляют
оксиды и гидроксиды металлов в
степени окисления +3, +4, а также
соединения Be и Zn.
8.
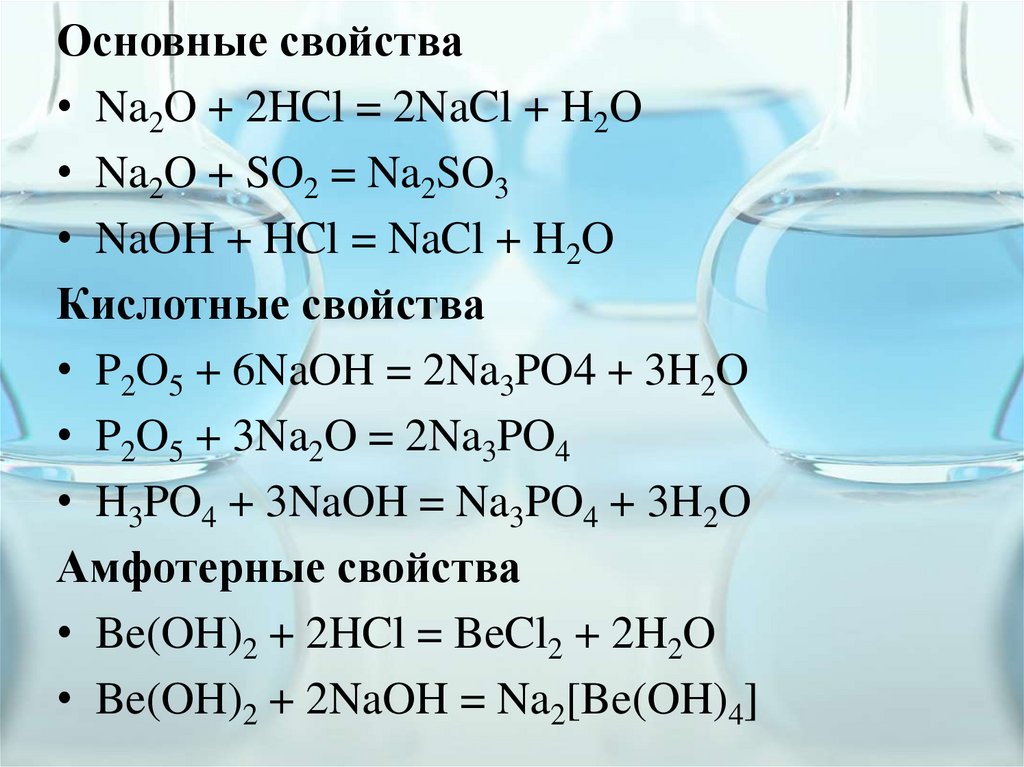
Основные свойства• Na2O + 2HCl = 2NaCl + H2O
• Na2O + SO2 = Na2SO3
• NaOH + HCl = NaCl + H2O
Кислотные свойства
• P2O5 + 6NaOH = 2Na3PO4 + 3H2O
• P2O5 + 3Na2O = 2Na3PO4
• H3PO4 + 3NaOH = Na3PO4 + 3H2O
Амфотерные свойства
• Be(OH)2 + 2HCl = BeCl2 + 2H2O
• Be(OH)2 + 2NaOH = Na2[Be(OH)4]
9.
У химических элементов, которые проявляютмножество степеней окисления для нижних
характерны основные свойства, для
промежуточных – амфотерные, для высоких –
кислотные. Например, Cr:
Cr+2O основный оксид Cr+2(OH)2 основание
Cr+32O3 амфотерный
оксид
Cr+3(OH)3 амфотерное
основание
Cr+6O3 кислотный
оксид
H2Cr+6O4 кислота
10.
Амфотерность Zn(OH)2• Используя, выданные реактивы,
получите гидроксид цинка и докажите
его амфотерность путём проведения
соответствующих химических реакций.
• Запишите в тетрадь уравнения
проведённых химических реакций в
молекулярном виде, а дома допишите
их в полном и сокращённом ионном
виде.
11.
Домашнее задание• §2, ответить на вопросы 1- 4 письменно.
• Дописать уравнения проведённых
реакций в полном и сокращённом
ионном виде.










 chemistry
chemistry








