Similar presentations:
Алкены
1.
2.
ЗАДАНИЕ 1 (выполнить в тетрадях)Дайте названия следующим углеводородам по
международной номенклатуре.
СН3
СН3 – СН2 – С – СН3
СН3
СН3 – СН – СН – СН – СН3
СН3
С2Н5
СН3
3.
НоменклатураСтроение
молекулы
Изомерия
Физические
свойства
CnH2n
Химические
свойства
Получение
Проверка
знаний
Применение
3
4. Это интересно
• Всем известный полиэтиленбыл получен был получен в
1933 году Э. Фосеттом и Р.
Гибсоном
• В 1943 году из полиэтилена
стали изготавливать посуду,
ящики, бутылки, упаковку,
предметы домашнего обихода
• Благодаря Его Величеству Случаю в 1938 году
американский учёный Р. Планкетт получил тефлон,
обладающий исключительной химической устойчивостью.
5.
Алкены – это углеводороды, вмолекуле которых кроме
одинарных связей содержится
одна двойная связь между
атомами углерода.
CnH2n
Общая формула: СnH2n
5
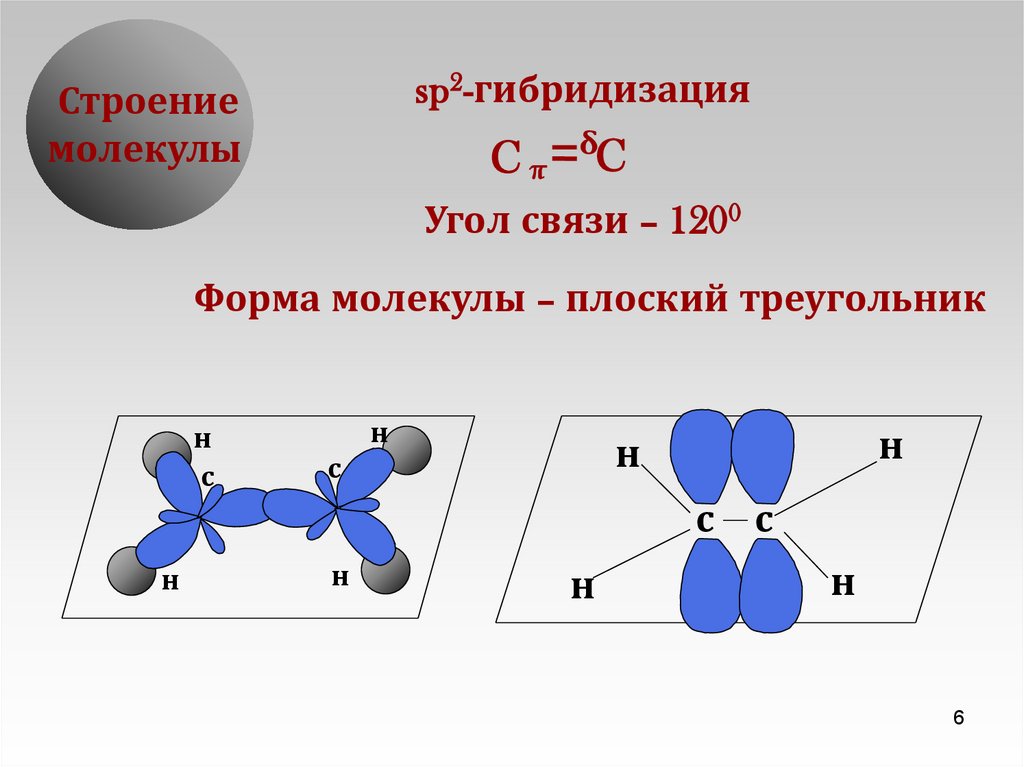
6.
sp2-гибридизацияСтроение
молекулы
Cπ
δC
Угол связи – 1200
Форма молекулы – плоский треугольник
н
с
н
н
н
с
с
н
н
н
с
н
6
7. Изомерия
Углеродного скелетаПоложения кратной связи
Межклассовая
Пространственная
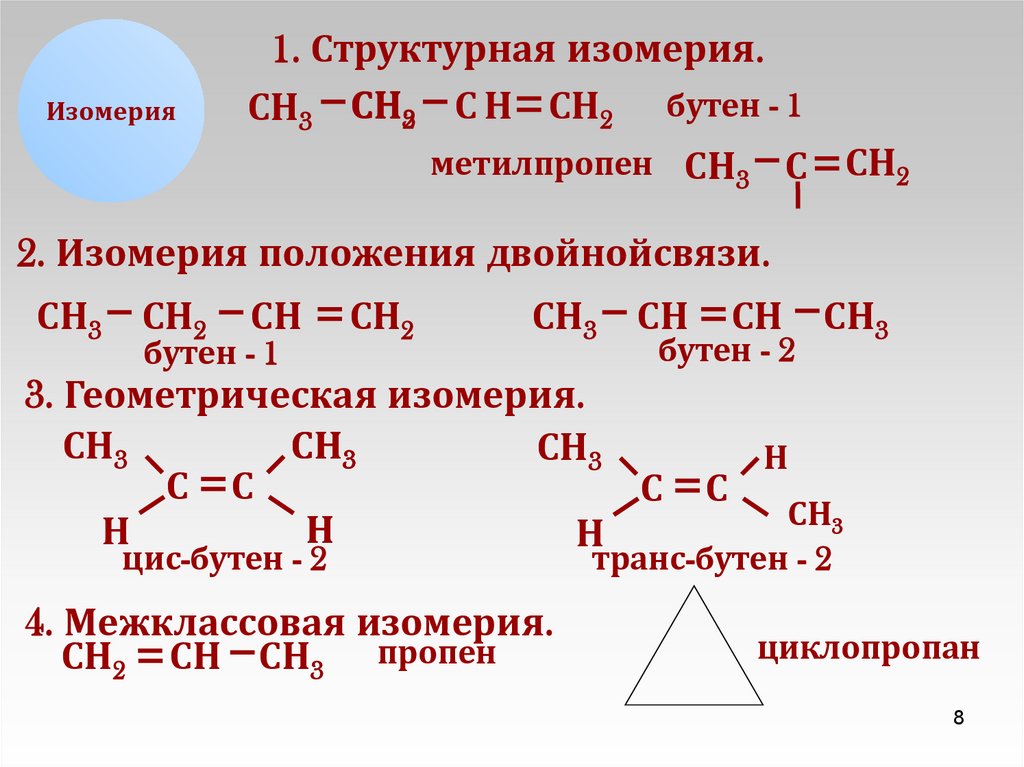
8.
Изомерия1. Структурная изомерия.
СН3 СН32 С Н СН2 бутен - 1
метилпропен СН3 С СН2
2. Изомерия положения двойнойсвязи.
СН3
СН2
СН
бутен - 1
СН2
СН3
СН
бутен - 2
3. Геометрическая изомерия.
СН3
СН3
СН3
С С
С
Н
Н
Н
цис-бутен - 2
4. Межклассовая изомерия.
СН2 СН СН3 пропен
СН
С
СН3
Н
СН3
транс-бутен - 2
циклопропан
8
9.
Агрегатное состояние:С2Н4 – С4Н8
газообразные вещества;
С5Н10 – С18Н36
с С19Н38
Физические
свойства
жидкости;
твердые вещества
С увеличением молекулярной массы соединений
температуры кипения и плавления закономерно
повышаются.
Г, З нефтяной, Ц
Этилен С2Н4
Tпл = - 169,20С
Tкип = - 103,70С
Плохо в
Н2О
9
10.
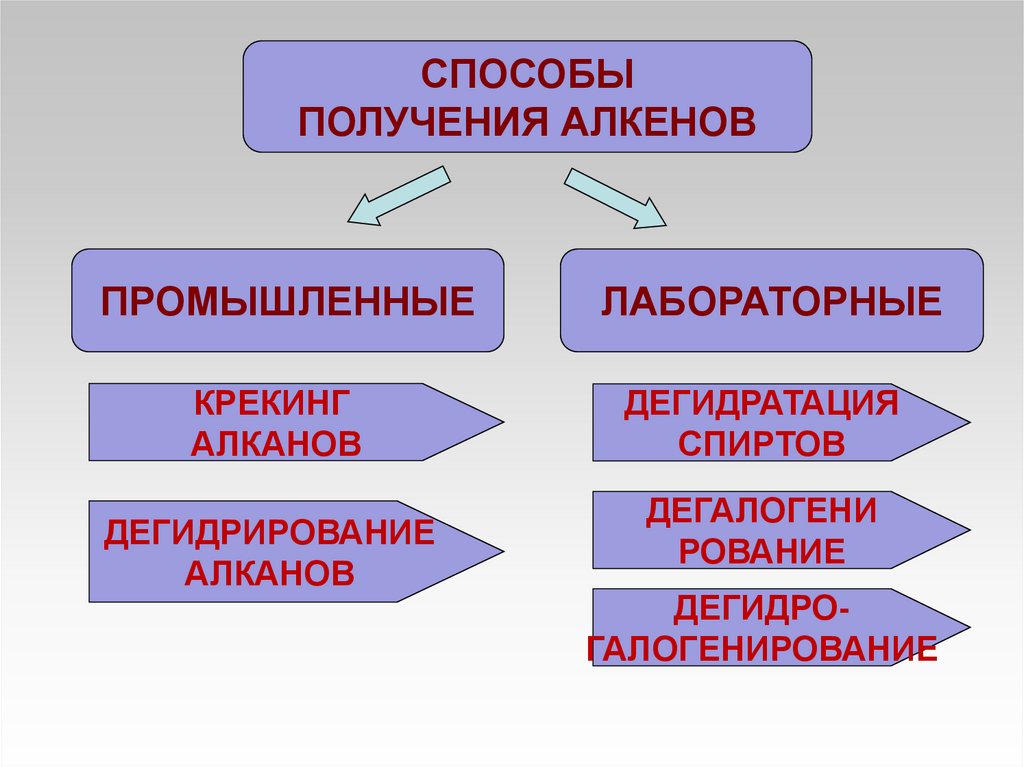
СПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВ
ПРОМЫШЛЕННЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ЛАБОРАТОРНЫЕ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИ
РОВАНИЕ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
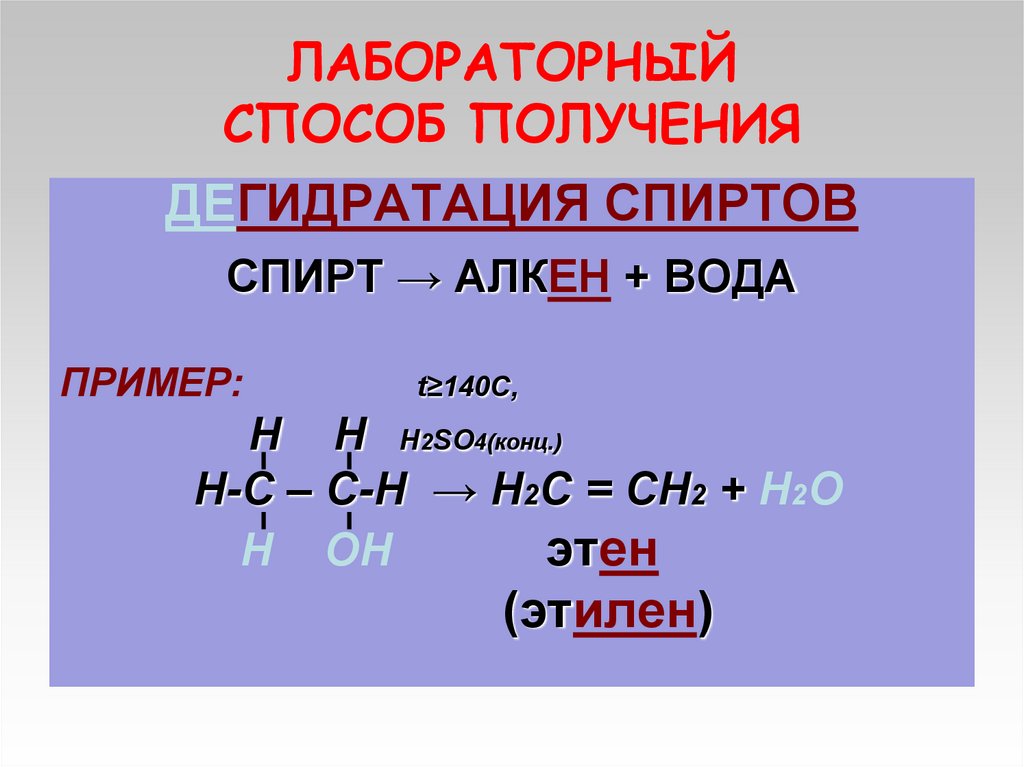
11. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВСПИРТ → АЛКЕН + ВОДА
ПРИМЕР:
t≥140C,
Н Н Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН
этен
(этилен)
12. Получение алкенов
КРЕКИНГ АЛКАНОВАЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ
С МЕНЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
ЦЕПЬЮ
ПРИМЕР:
С 10
t=400-700C
Н 22→ С5Н 12+ С5Н10
декан
пентан
пентен
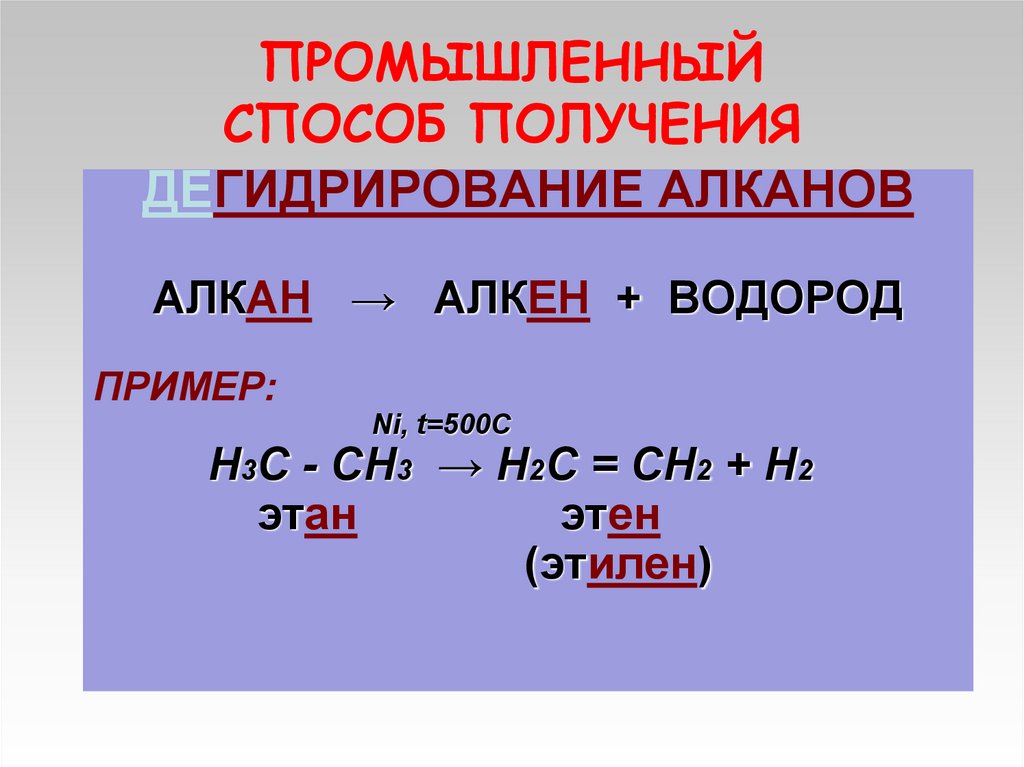
13. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВАЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Ni, t=500C
Н3С - СН3 → Н2С = СН2 + Н2
этан
этен
(этилен)
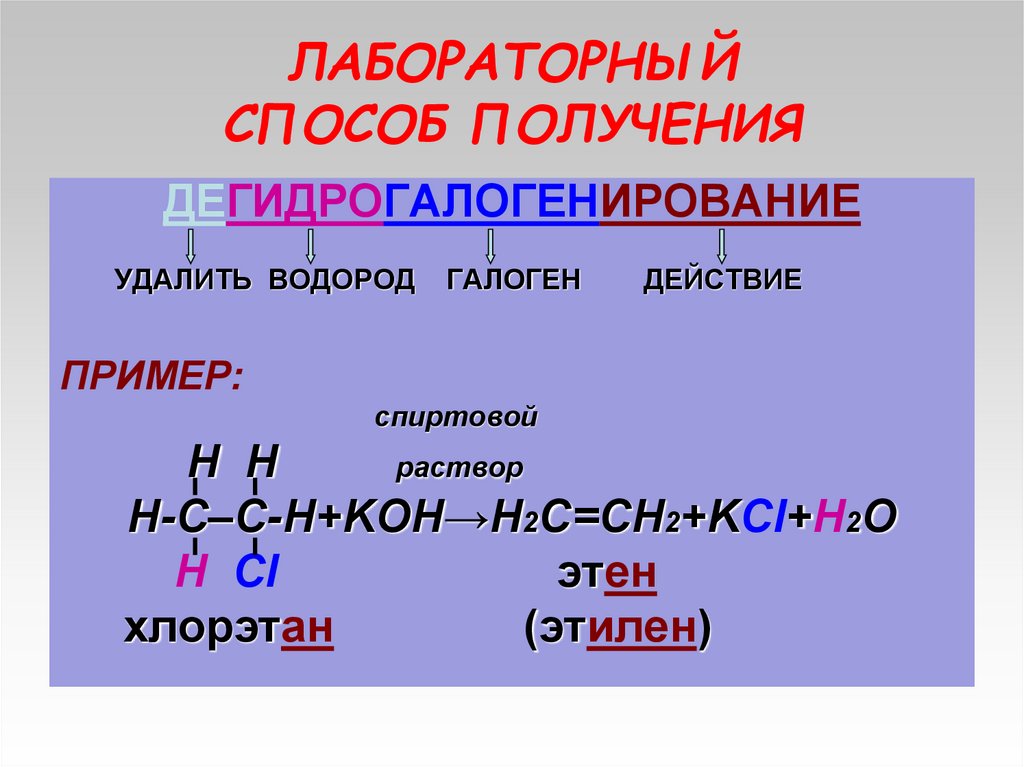
14. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕУДАЛИТЬ ВОДОРОД
ГАЛОГЕН
ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H
раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н Cl
этен
хлорэтан
(этилен)
15.
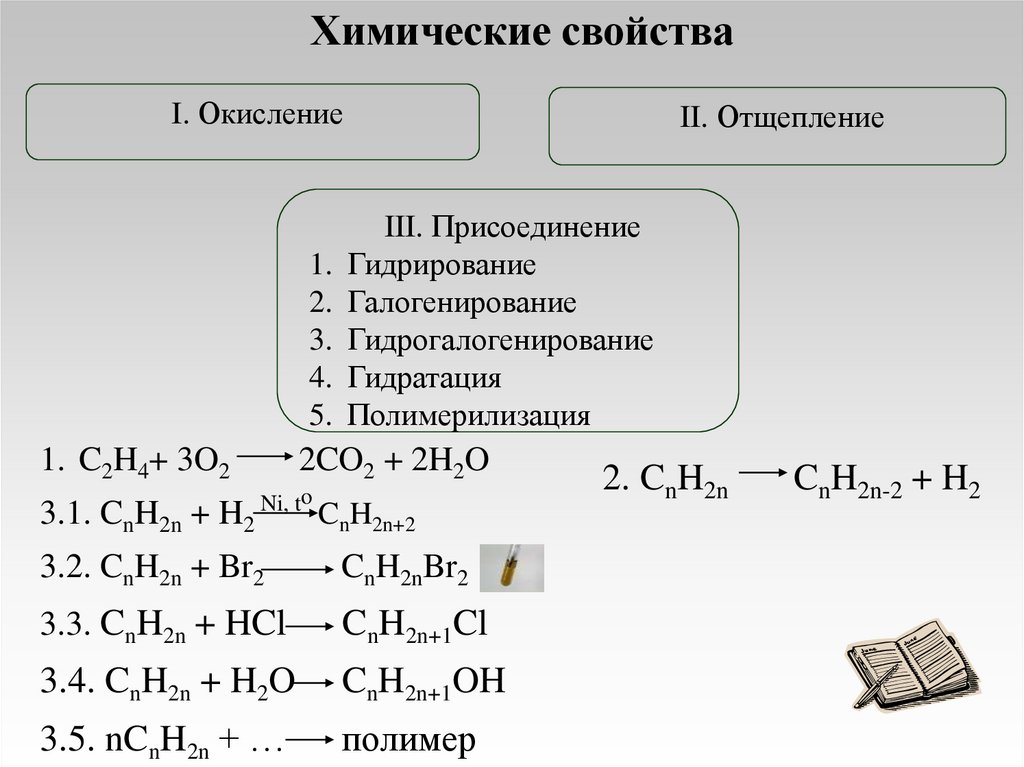
Химические свойстваI. Окисление
1.
2.
3.
4.
5.
1. C2H4+ 3O2
3.1. CnH2n + H2
II. Отщепление
III. Присоединение
Гидрирование
Галогенирование
Гидрогалогенирование
Гидратация
Полимерилизация
2CO2 + 2H2O
Ni, to
CnH2n+2
3.2. CnH2n + Br2
CnH2nBr2
3.3. CnH2n + HCl
CnH2n+1Cl
3.4. CnH2n + H2O
CnH2n+1OH
3.5. nCnH2n + …
полимер
2. CnH2n
CnH2n-2 + H2
16.
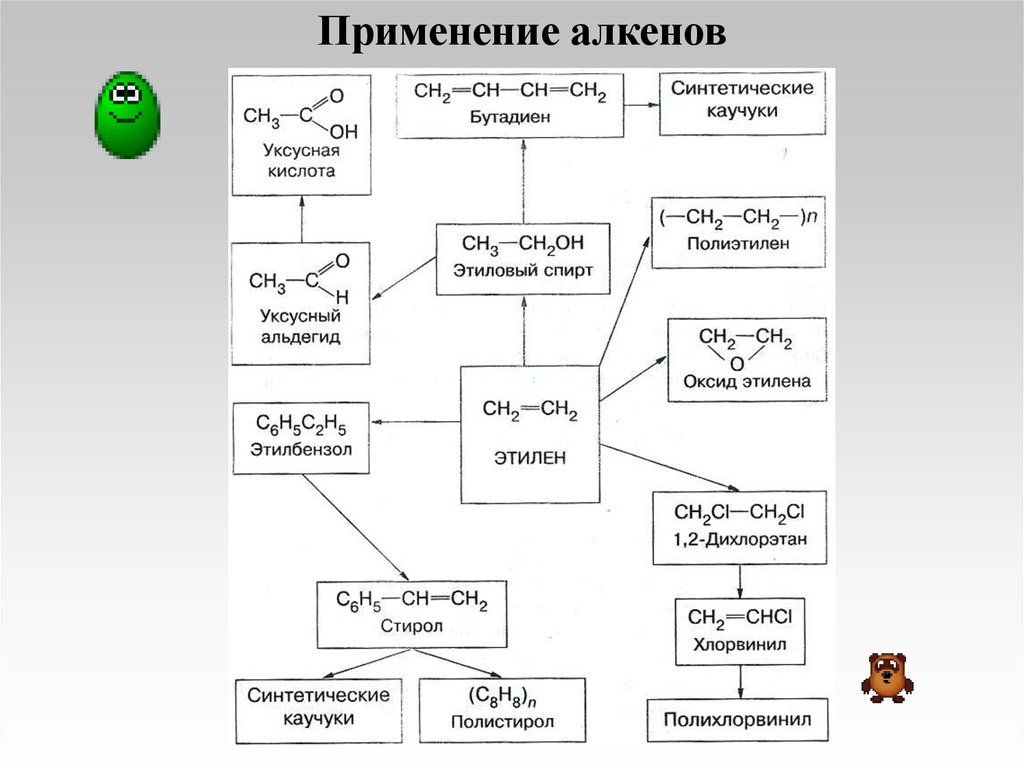
Применение алкенов17.
ЗАДАНИЕ 2. Тест (выполнить в тетрадях)1. Алкены можно также назвать:
а) этиленовыми углеводородами,
б) олефиновыми углеводородами,
в) непредельными углеводородами,
г) все предыдущие ответы верны.
2. Состав этена отражает общая формула:
а) CnH2n+2,
б) CnH2n,
в) CnH2n-2,
г) CnH2n-6
3. Соотнесите:
тип углеводорода:
формула:
1) алканы,
2) алкены;
а) C2 H4,
б) CH4,
в) C7H16,
г) C12H24,
д) C6H12,
е) C3H8.
18.
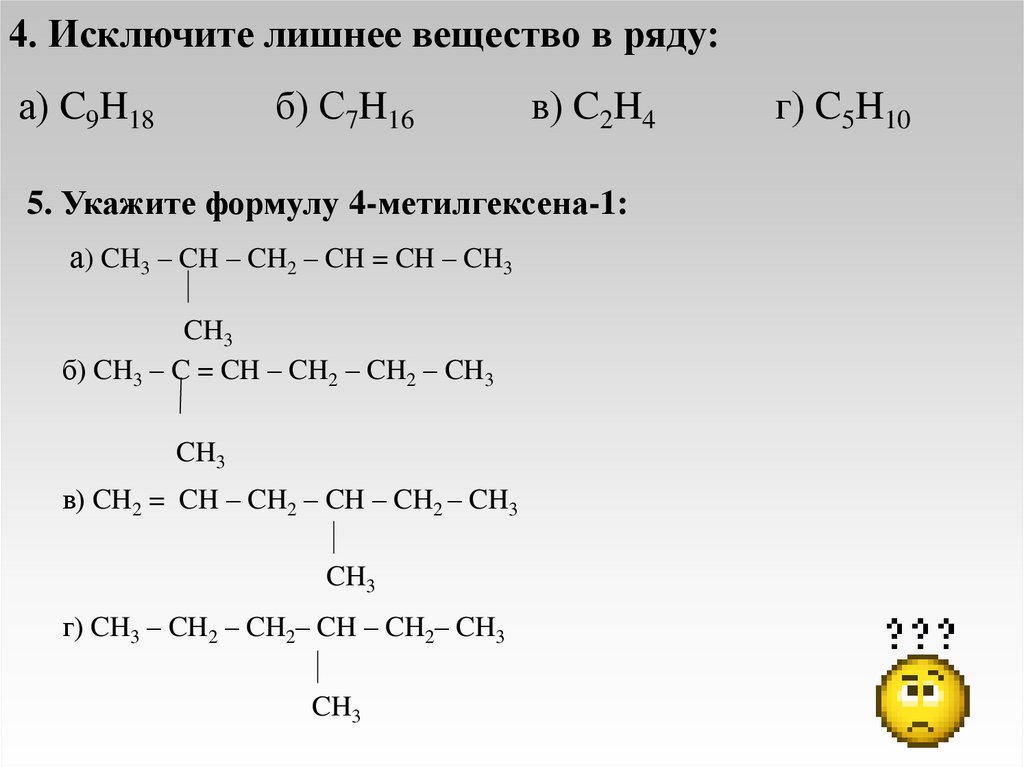
4. Исключите лишнее вещество в ряду:а) C9H18
б) С7H16
в) C2H4
5. Укажите формулу 4-метилгексена-1:
а) CH3 – CH – CH2 – CH = CH – CH3
CH3
б) CH3 – C = CH – CH2 – CH2 – CH3
CH3
в) CH2 = CH – CH2 – CH – CH2 – CH3
CH3
г) CH3 – CH2 – CH2– CH – CH2– CH3
CH3
г) C5H10
19.
6. Какой тип реакции не характерен для алкенов?а) замещение
б) присоединение
в) окисление
г) полимеризации
7. Реакция присоединения водорода называется:
а) гидрированием
б) гидрогалогенированием
в) гидратацией
г) дегидрированием








 chemistry
chemistry








