Similar presentations:
Валентность
1.
2.
Мы знаем, что вещества состоят измолекул , а молекулы из атомов.
Чтобы атомы оставались вместе,
образуя молекулу, их должна
удерживать сила. Эту силу назвали
химической связью.
которая
Химическая
связь
- это сила,
А способность
элемента
образовывать
удерживает
атомы
в молекуле.
ллллллллллллллллллллллллллллллллл
определенное
количество
связей назвали
ллллллллллллллллллллллллллллллллл
валентностью.
3.
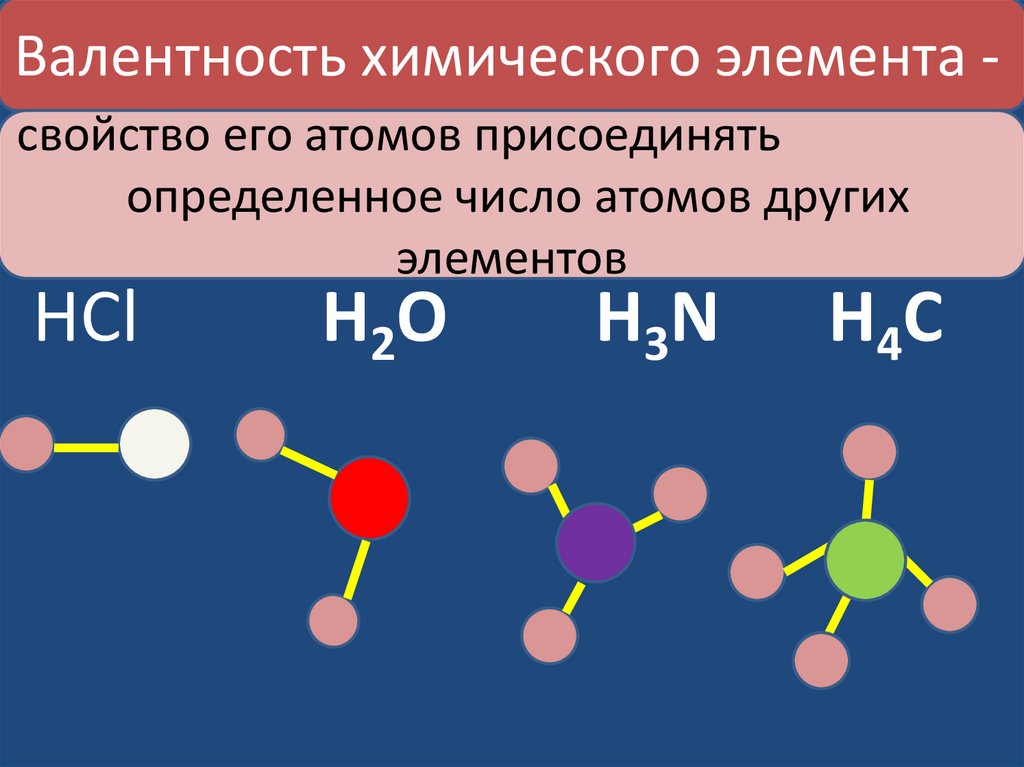
Валентность химического элемента свойство его атомов присоединятьопределенное число атомов других
элементов
HCl
H2 O
H3 N
H4 C
4.
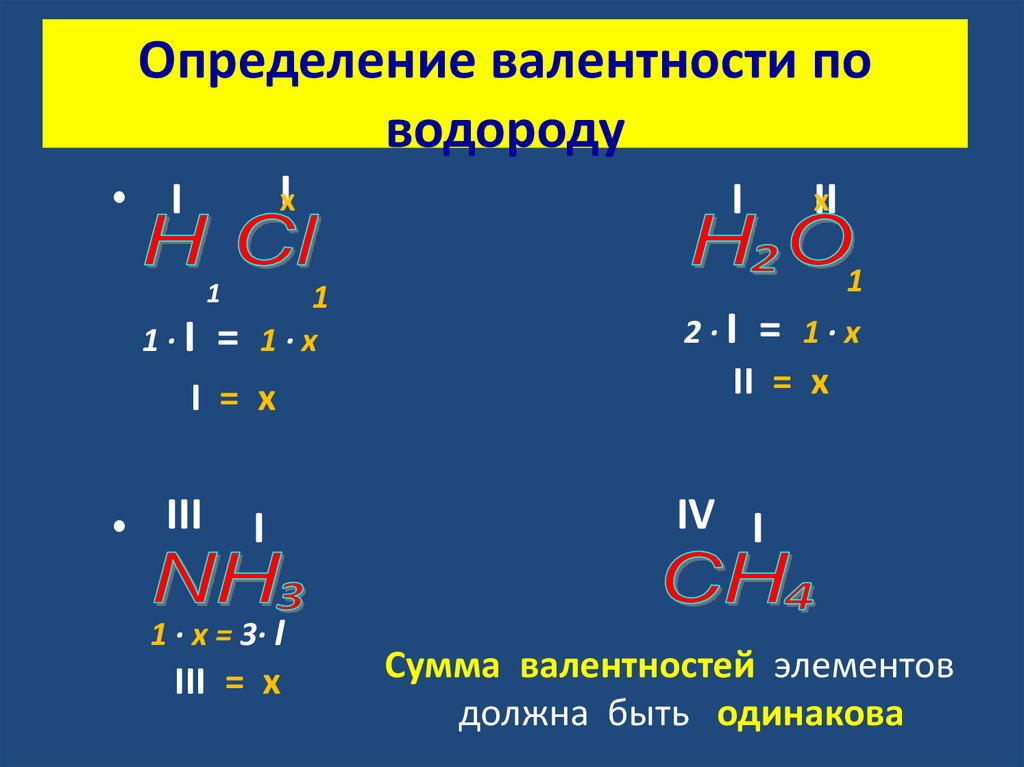
Определение валентности поводороду
Iх
• I
1
1·I
=
1
1·х
I = х
• III
I
1 · х = 3· I
III = х
I
2·I
хII
=
1
1·х
II = х
IV I
Сумма валентностей элементов
должна быть одинакова
5.
З а п о м н и т е!I
6.
Чтоб валентность элемента в даннойформуле узнать, надо рядом с элементом
водород пересчитать, римской цифрою
представить и над формулой поставить
II
I
III
7.
Определение валентности покислороду
Если рядом с элементом кислород,
двухвалентен он, не то что водород, сумму
всех его валентностей найди и на индекс
элемента раздели
III
6:2=3
II
II · 3= 6
8.
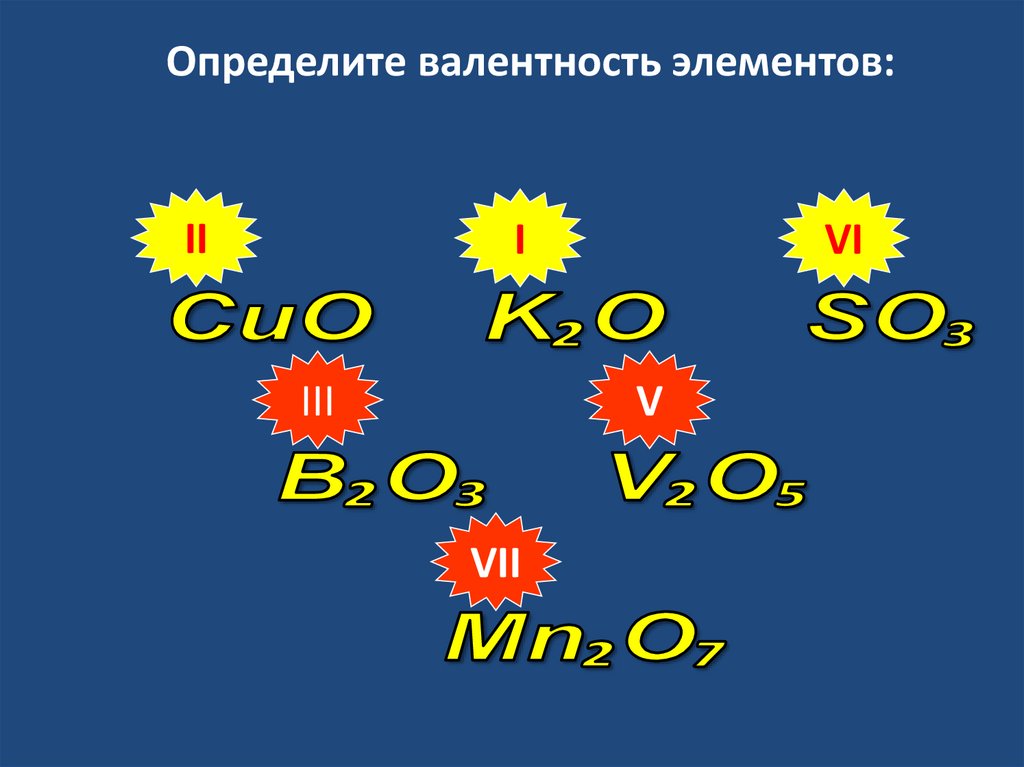
Определите валентность элементов:II
I
III
VI
V
VII
9.
З а п о м н и т е!II
10.
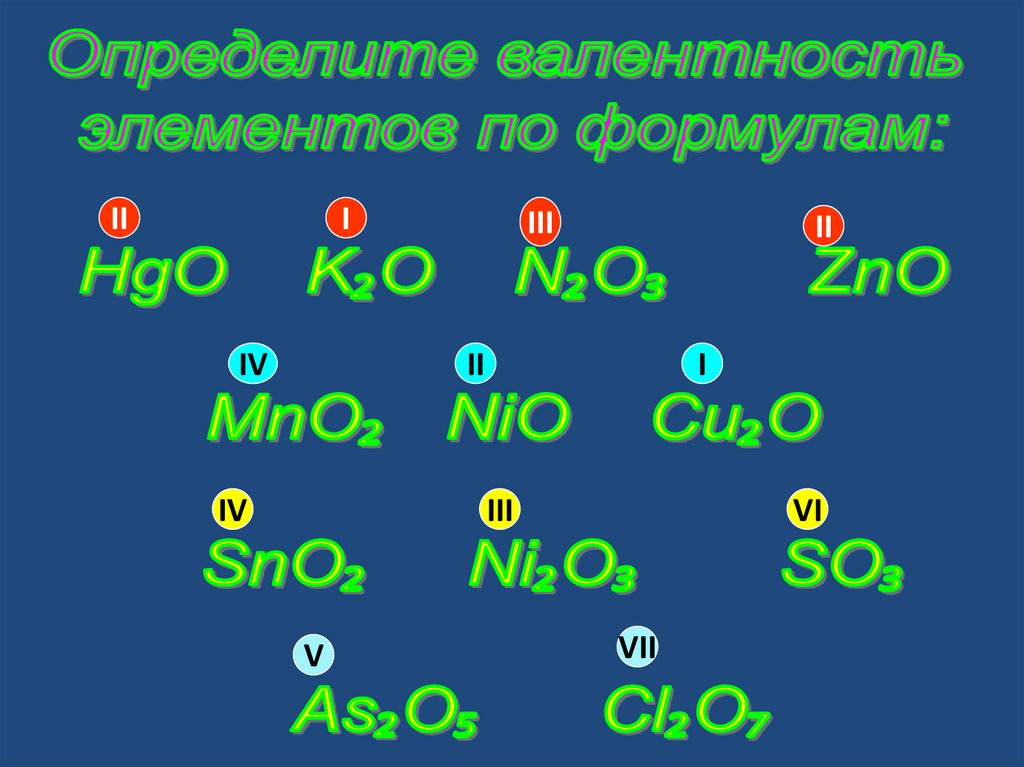
III
III
II
II
IV
IV
I
III
V
VI
VII
11.
Определитевалентность
натрия, бора,
Как
же можно
узнать валентность
элемента?
углерода, кислорода, хлора, кальция, НО
алюминия,
серы,
фосфора,Менделеева!
магния и азота
Очень
просто!
Из таблицы
Валентность элемента совпадает с номером группы
12.
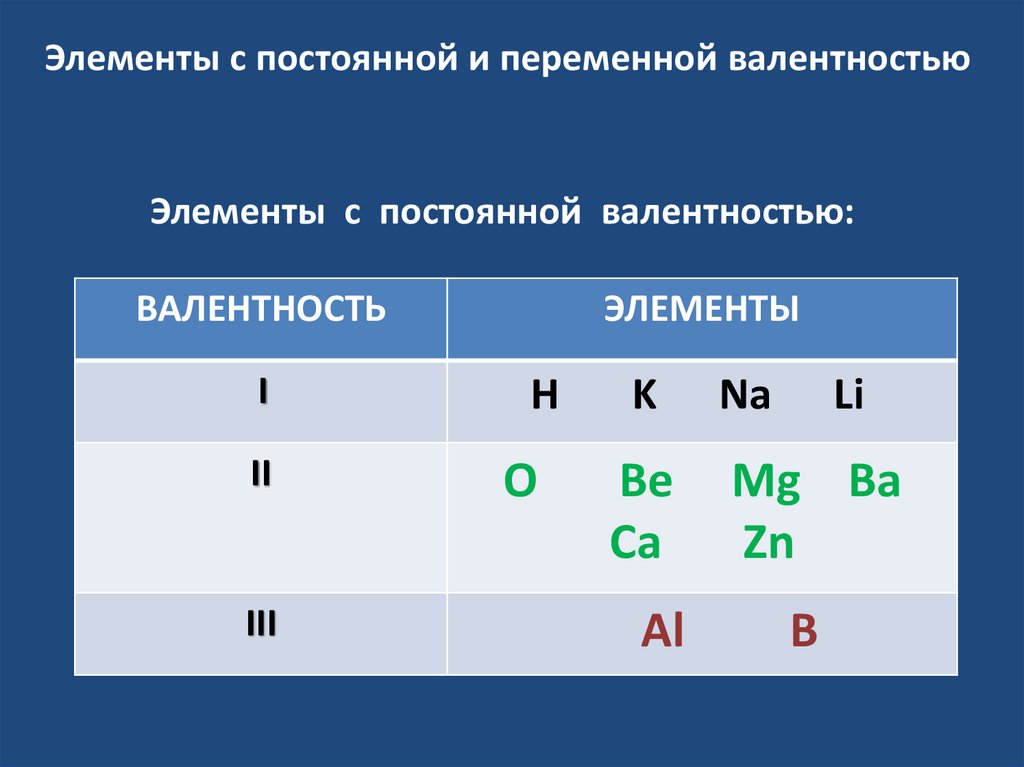
Элементы с постоянной и переменной валентностьюЭлементы с постоянной валентностью:
ВАЛЕНТНОСТЬ
I
II
III
ЭЛЕМЕНТЫ
H
O
K
Be
Ca
Al
Na
Li
Mg Ba
Zn
B
13.
14.
15.
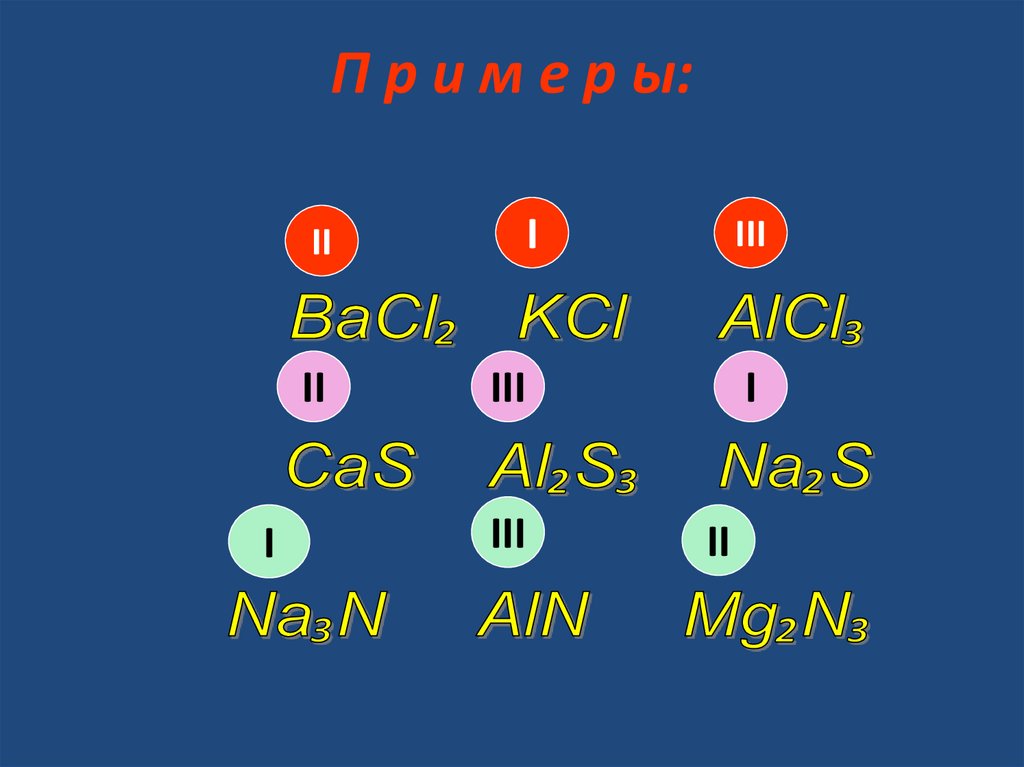
П р и м е р ы:I
II
I
III
II
III
I
III
II
16.
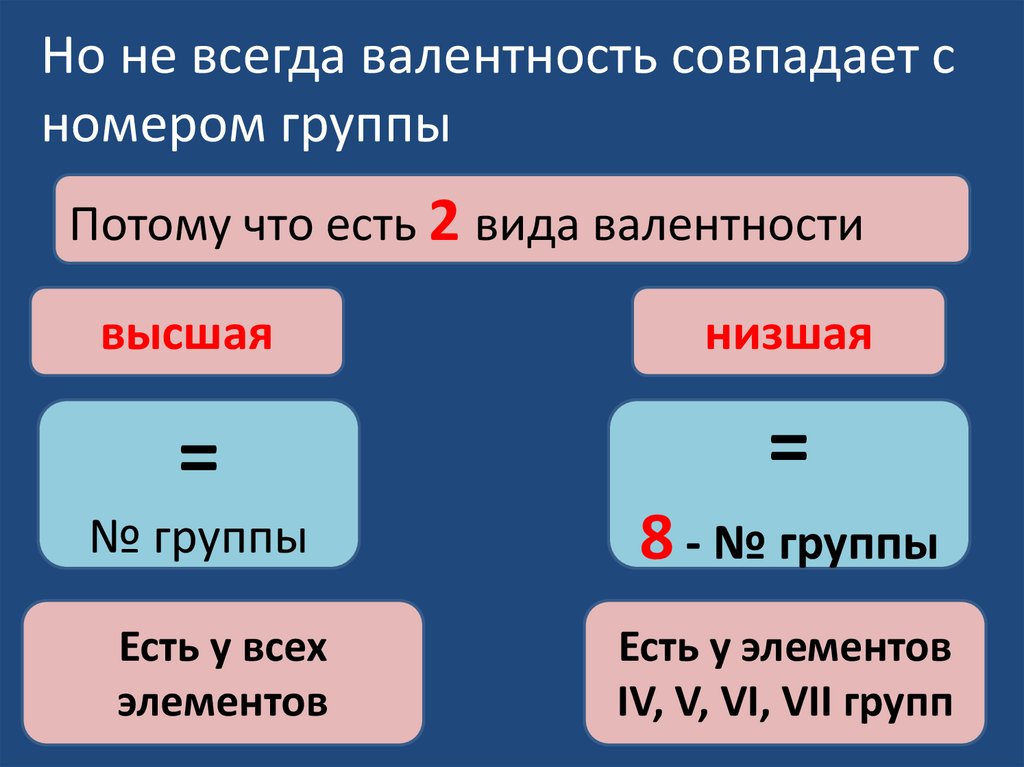
Но не всегда валентность совпадает сномером группы
Потому что есть 2 вида валентности
высшая
низшая
=
=
№ группы
8 - № группы
Есть у всех
элементов
Есть у элементов
IV, V, VI, VII групп
17.
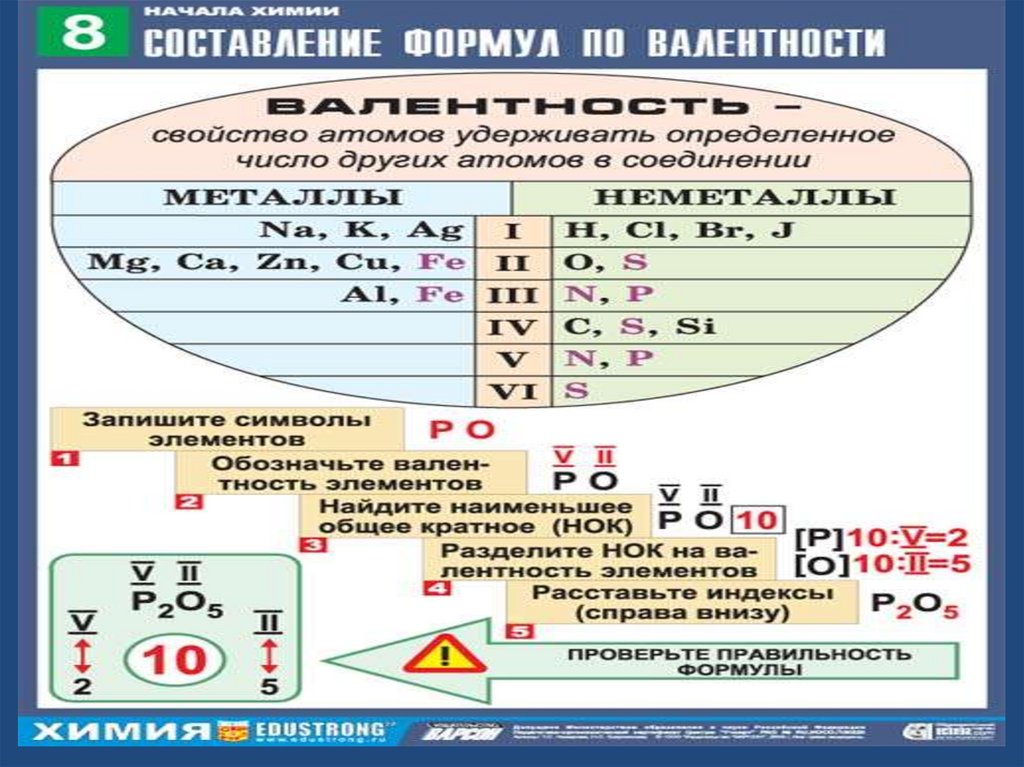
1.Рядом записываем знакихимических элементов.
2.Определяем валентность элементов:
У элемента,
который
записан
слева – она
высшая и
=№ группы
4. Считаем индексы:
У элемента,
который
записан справа
– она низшая и
=8 - № группы
18.
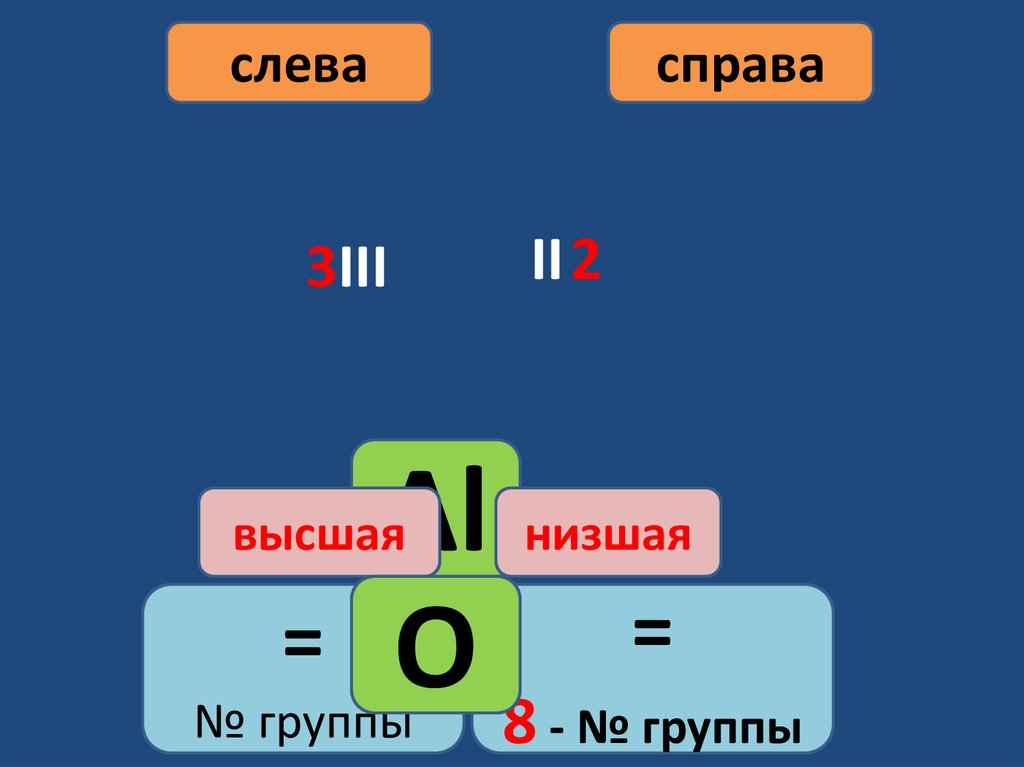
слева3III
справа
II 2
Аl низшая
=
= O
№ группы
8 - № группы
высшая
19.
IVII
2
4
2
20.
IIIII
2
3
21.
22.
Как определить валентность по готовой формуле рассмотримна данных примерах:
Пример1:
V₂O₅
II
1). Обозначим валентность известного элемента: V₂O₅
2). Определяем общее число единиц валентности атомов:
2 * 5 = 10
3). Разделим это число на число атомов элемента,
валентность которого нам известна:
10 / 2 = 5
(в нашем примере)
4). Поставить частное (5) римской цифрой над искомым
элементом как его валентность:
V II
V₂ O₅
(10)
23.
RxOyСоставить формулы
соединений с
кислородом
Na2O
1. Натрия
следующих элементов
MgO
2. Магния
3. Алюминия
Al2O3
SiO2
4. Кремния (IV)
P2O5
5. Фосфора (V)
SO3
6. Серы (VI)
Cl2O7
7. Хлора (VII)
24.
IСоставить
формулы
R xCly
соединений с хлором
следующих элементов
1. Натрия
2. Магния
3. Алюминия
4. Кремния (IV)
5. Фосфора (V)
6. Серы (VI)
NaCl
MgCl2
AlCl3
SiCl4
PCl5
SCl6
25.
Составить формулысоединений с
азотом следующих
элементов
1. Натрия
2. Магния
3. Алюминия
Na3N
Mg3N2
Al N
26.
Составить формулысоединений с
углеродом
следующих элементов
1. Натрия
2. Магния
3. Алюминия
Na4С
Mg2С
Al4С3
27.
Составить формулысоединений с
кислородом
Оксид кальция
СaO
Кальция
следующих элементов
Оксид бора
В2 O 3
Бора
К2O
Калия
ZnO
Цинка
CO2
Углерода(IV)
Железа (II) FeO
Железа (III) Fe2O3
Оксид калия
Оксид цинка
Оксид углерода (IV)
Оксид железа (II)
Оксид железа (III)
28.
Составить формулысоединений, образованных:
Н 2O
кислородом и водородом
1.
2. водородом и магнием
3. Алюминием и фосфором
4. Фосфором и водородом
5. Цинком и азотом
6. Азотом и калием
7. Кислородом и бором
MgН2
Al Р
Н3Р
Zn3N2
К3N
B2O3
29.
Составить формулысоединений, образованных:
Н 2S
Серой и водородом
1.
2. Серой и кислородом
3. Серой и кальцием
4. Серой и натрием
5. Железом (II) и серой
6. Железом (III) и серой
7. Водородом и азотом
SO3
CaS
Na2S
FeS
Fe2S3
H 3N




















 chemistry
chemistry








