Similar presentations:
Окислительно-восстановительные реакции (ОВР)
1.
Окислительно-восстановительныереакции(ОВР)
Определение: ОВР- это реакции, при которых
меняется степень окисления элементов до и
после реакции.
Восстановитель повышает степень
окисления(отдает электроны)
Окислитель понижает степень
окисления(принимает электроны)
Электронный баланс –число отданных
электронов должно быть равно числу принятых
электронов
2.
Степень окисления• - это условный заряд, который бы
приобрел атом, если бы все связи в
веществе были ионными
• - это условный заряд, равный числу
частично или полностью, «отданных»
или «присоединенных» электронов от
одного атома к другому
3.
4.
5.
6.
Степень окисления элемента• Степень окисления- это условный заряд элемента
• Валентность – число ковалентных связей
• Степень окисления часто численно совпадает с
валентностью
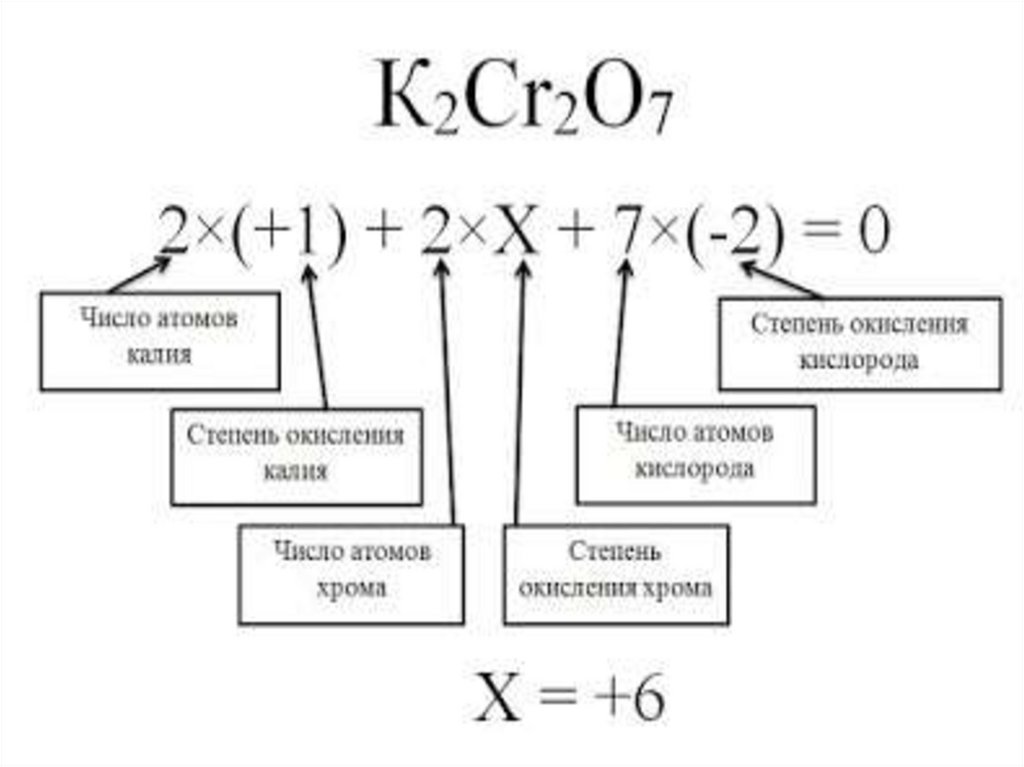
• Правила определения степени окисления:
1. В простых веществах ст. окисления равна нулю
2.В молекуле сложного вещества сумма
положительных степеней окисления равна сумме
отрицательных степеней окисления. Знак «минус»
получает более электроотрицательный
элемент(более сильный неметалл)
7.
Степень окисления• 1)Численно С.О. совпадает с
валентностью, если в веществе нет:
• а) Неполярных связей
• б)Донорно-акцепторных связей
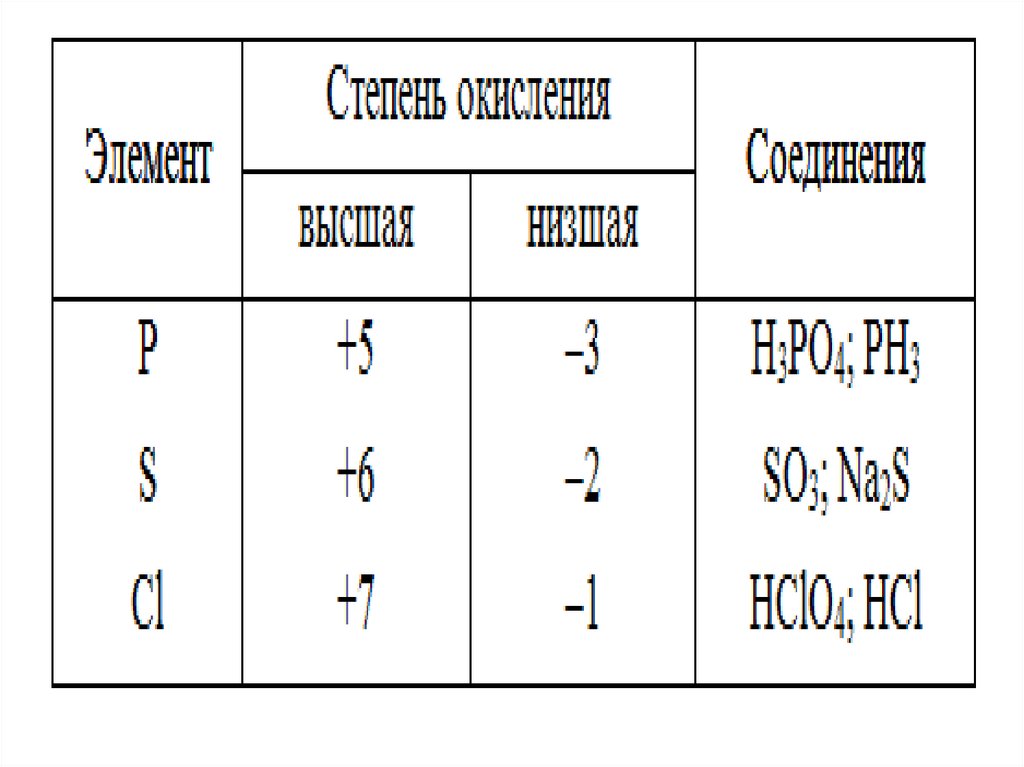
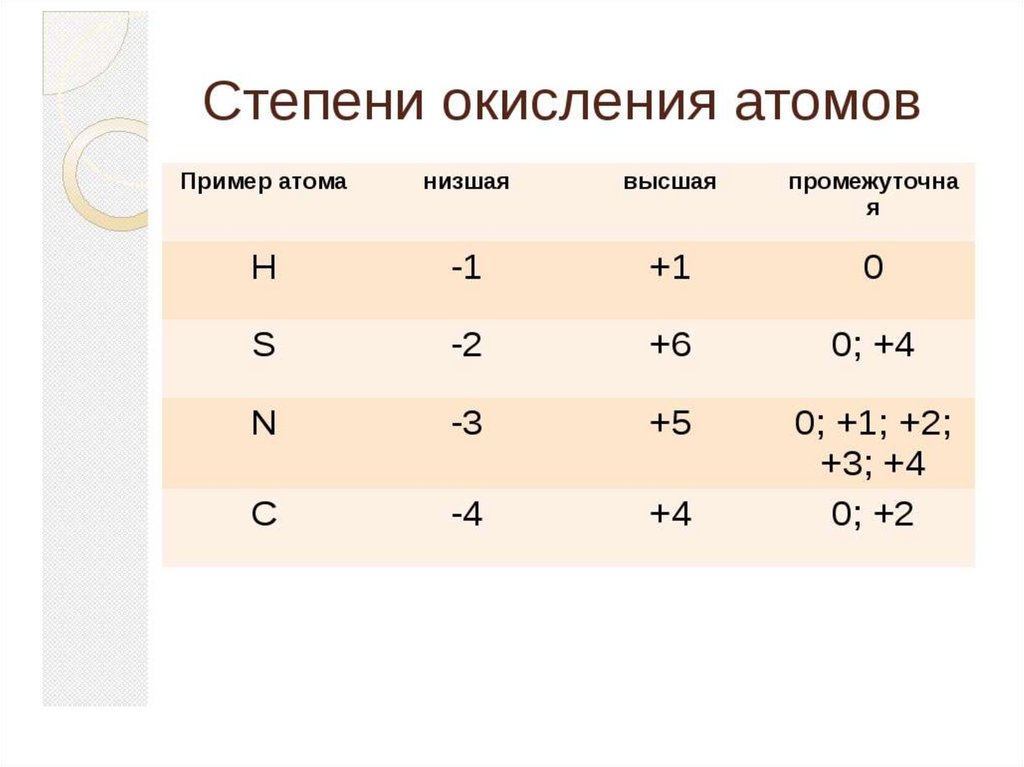
• 2) Низшая С.О. не Ме определяется :
8-№ группы
• 3)Высшая С.О. определяется:
по № группы
• 4) Сумма всех С.О. х.э. = 0
• 5) С.О. х.э. в простых в-вах = 0
8.
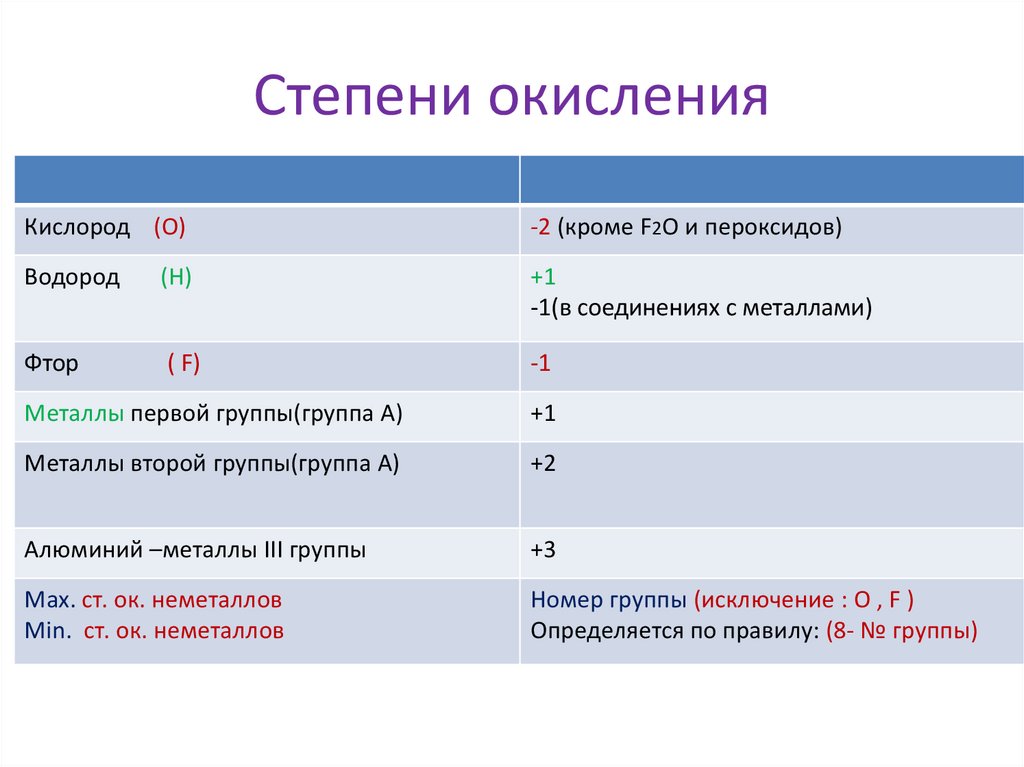
Степени окисленияЗначения ст. окисления некоторых
элементов
-2 (кроме F2O и пероксидов)
Кислород (О)
Водород
(Н)
+1
-1(в соединениях с металлами)
Фтор
( F)
-1
Металлы первой группы(группа А)
+1
Металлы второй группы(группа А)
+2
Алюминий –металлы III группы
+3
Мах. ст. ок. неметаллов
Мin. ст. ок. неметаллов
Номер группы (исключение : О , F )
Определяется по правилу: (8- № группы)









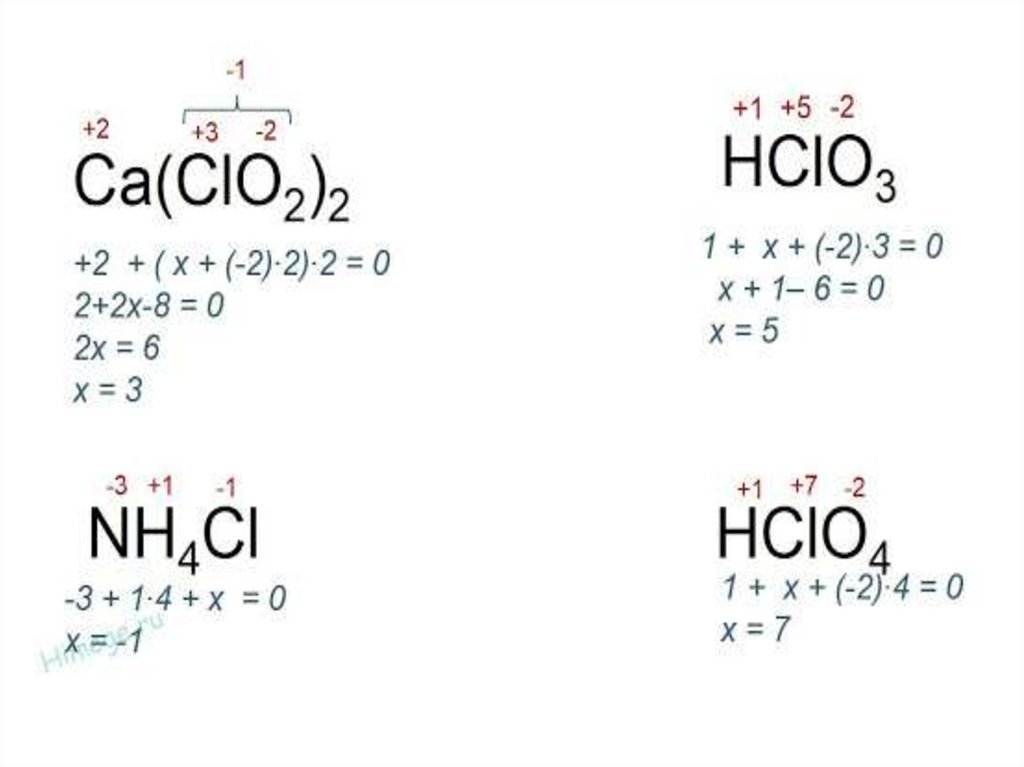
 chemistry
chemistry








