Similar presentations:
Строение вещества
1. СТРОЕНИЕ ВЕЩЕСТВА
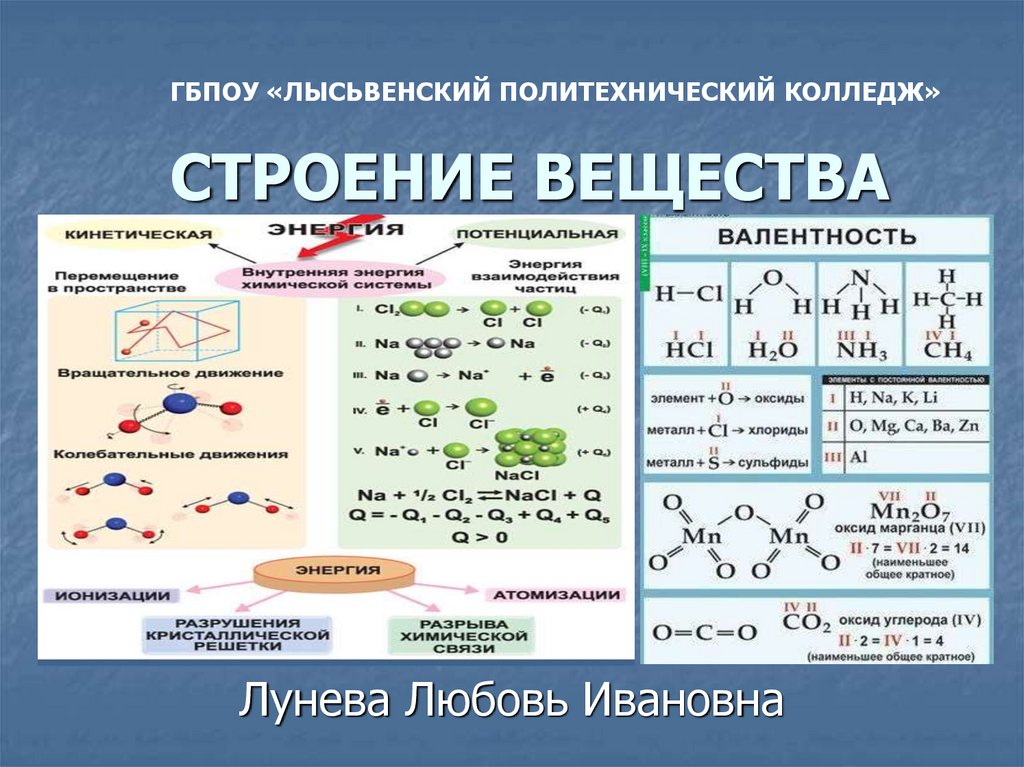
ГБПОУ «ЛЫСЬВЕНСКИЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ»СТРОЕНИЕ ВЕЩЕСТВА
Лунева Любовь Ивановна
2. Способность атомов образовывать молекулы
К основной причине образования химической связиможно отнести то, что взаимодействующие атомы
стремятся перераспределить электроны таким образом,
чтобы приобрести устойчивые электронные
конфигурации, как у инертных газов.
Атомы стремятся приобрести устойчивую внешнюю
электронную оболочку (дублет или октет).
Длина связи - расстояние между взаимодействующими
атомами,
Энергия ионизации - энергия, которую необходимо
затратить для отрыва электрона от атома,
Электроотрицательность (ЭО)– способность атомов
притягивать к себе электроны от других атомов
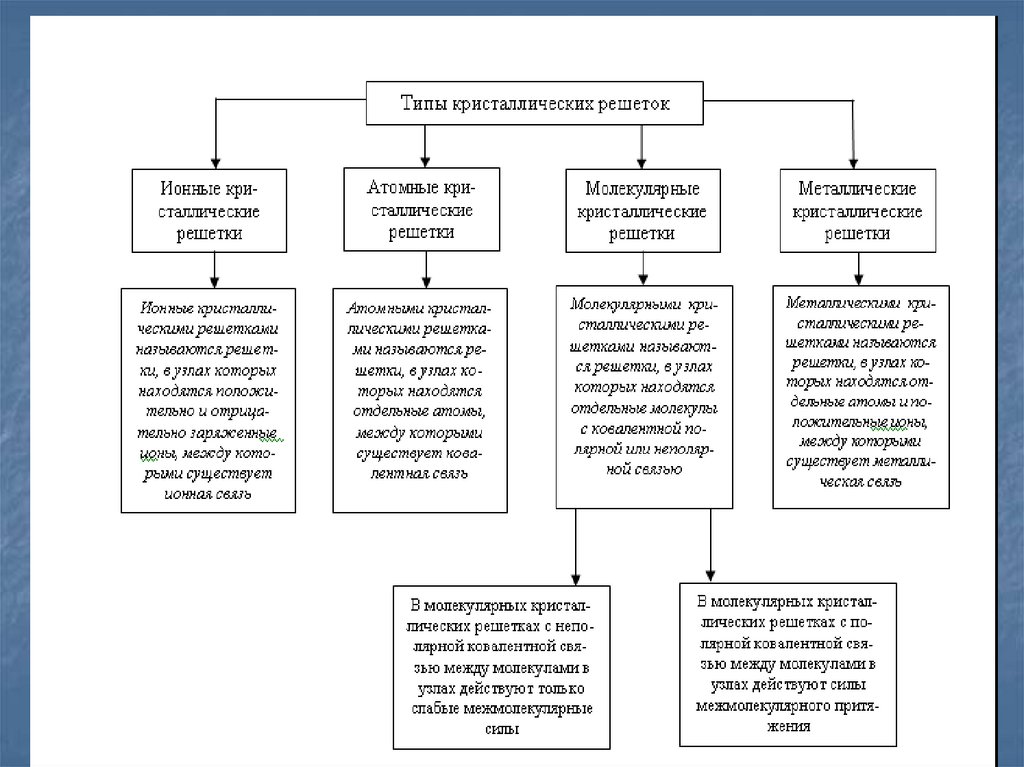
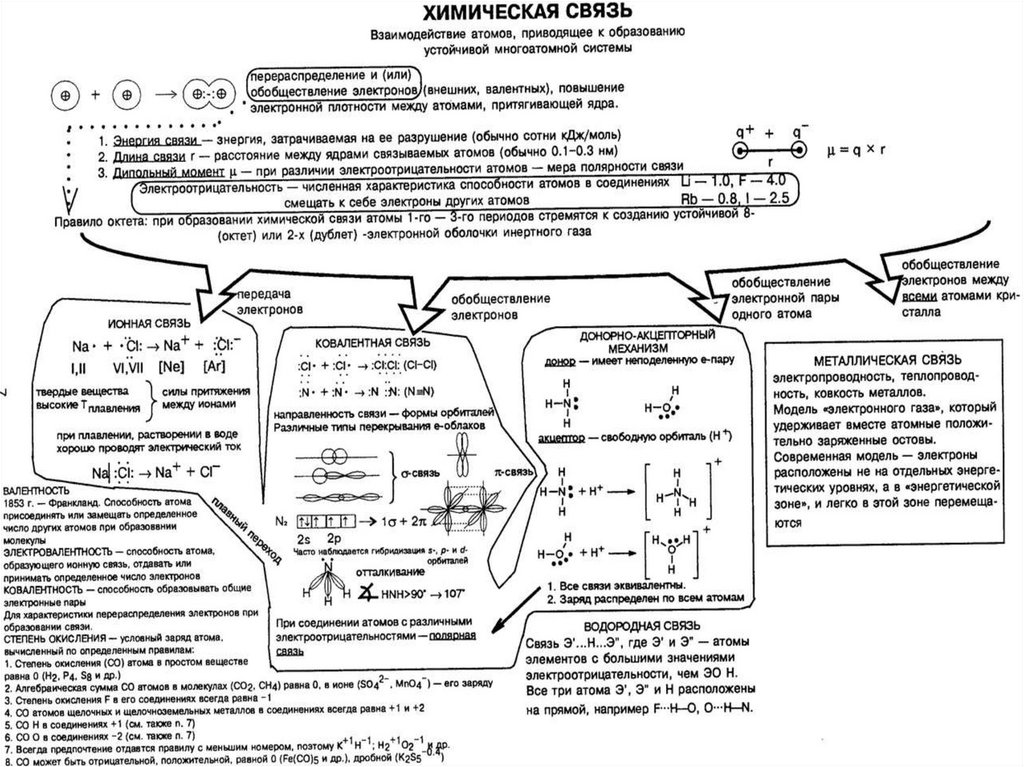
3. Виды химической связи
Химическая связь – взаимодействиеатомов, которое связывает их в
молекулы, ионы, радикалы, кристаллы.
Химическая связь может быть:
Ковалентной,
Ионной,
Металлической,
Водородной.
4. Ковалентная химическая связь
Ковалентная связь (1916 г., Льюис)– связь, образующаяся между
атомами неМе за счет общих
электронных пар,
это двухэлектронная связь,
принадлежащая одновременно
ядрам двух атомов.
5.
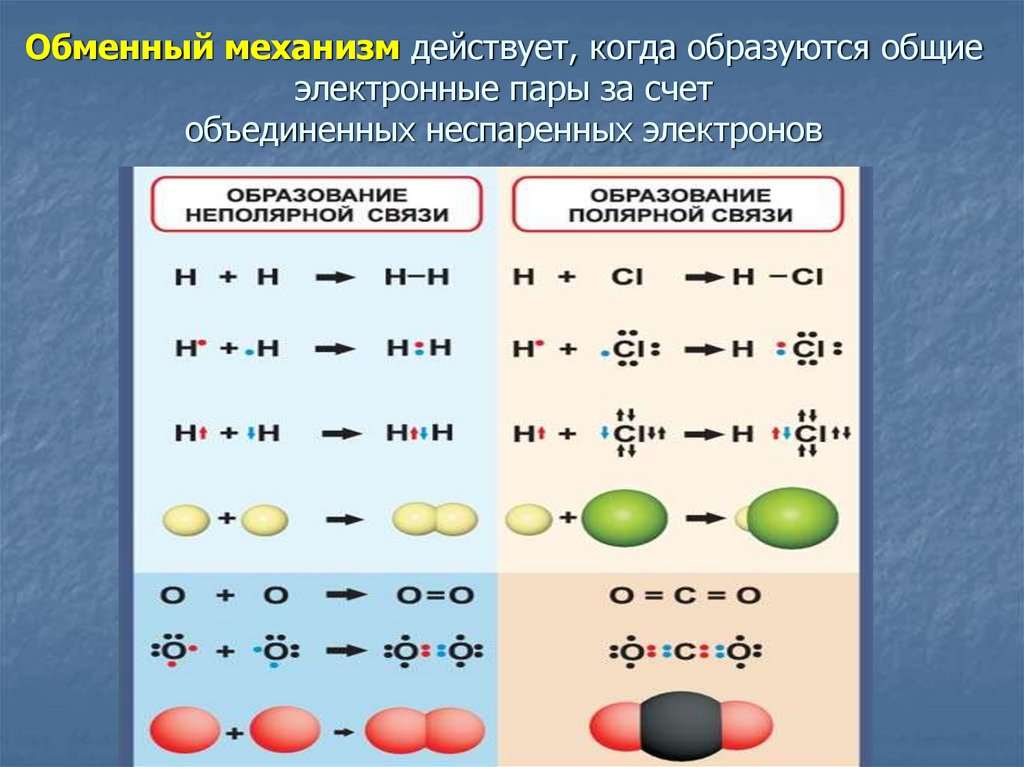
Неполярная ковалентная связь – связь, образующаясямежду атомами с одинаковой электроотрицательностью
(в молекулах простых веществ).
Полярная ковалентная связь – связь между атомами,
электроотрицательность которых не сильно различается,
при этом происходит смещение общей электронной пары к
наиболее электроотрицательному атому (между атомами
разных неМе).
6. Обменный механизм действует, когда образуются общие электронные пары за счет объединенных неспаренных электронов
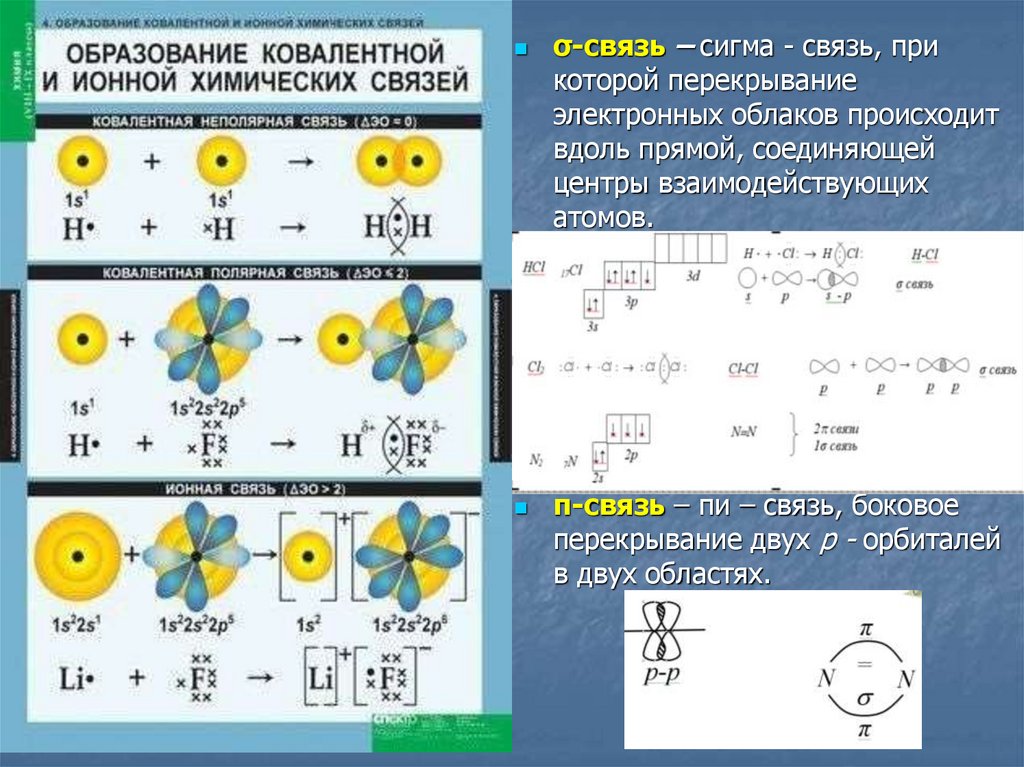
7.
σ-связь – сигма - связь, прикоторой перекрывание
электронных облаков происходит
вдоль прямой, соединяющей
центры взаимодействующих
атомов.
π-связь – пи – связь, боковое
перекрывание двух р - орбиталей
в двух областях.
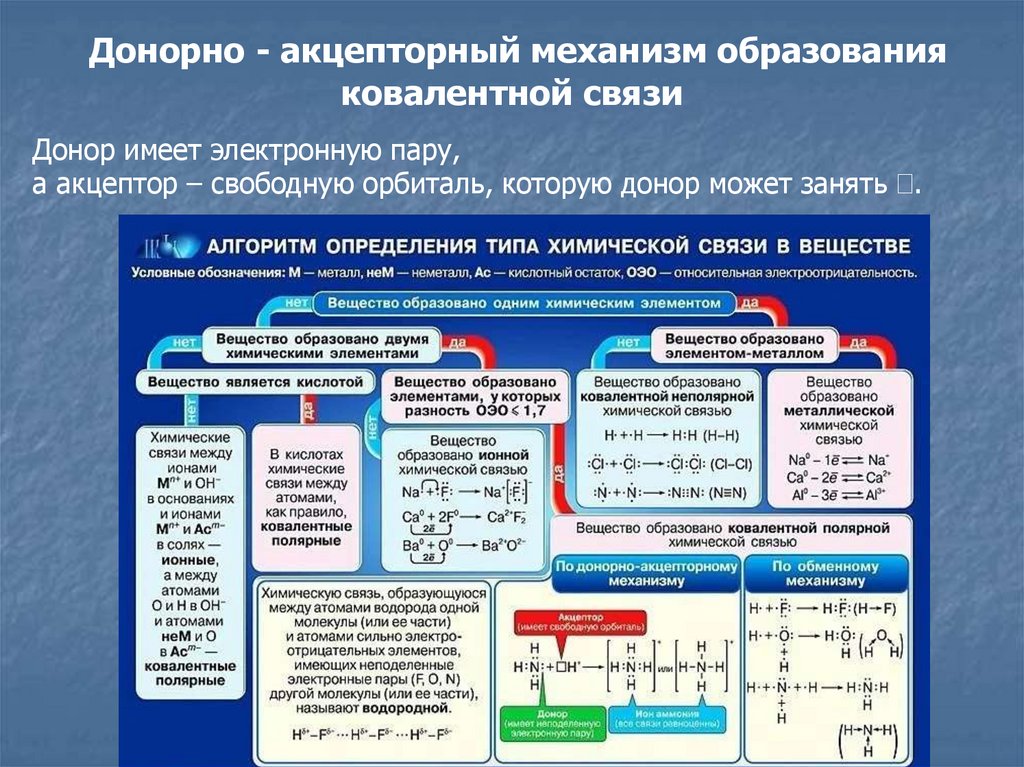
8. Донорно - акцепторный механизм образования ковалентной связи
Донор имеет электронную пару,а акцептор – свободную орбиталь, которую донор может занять .
9.
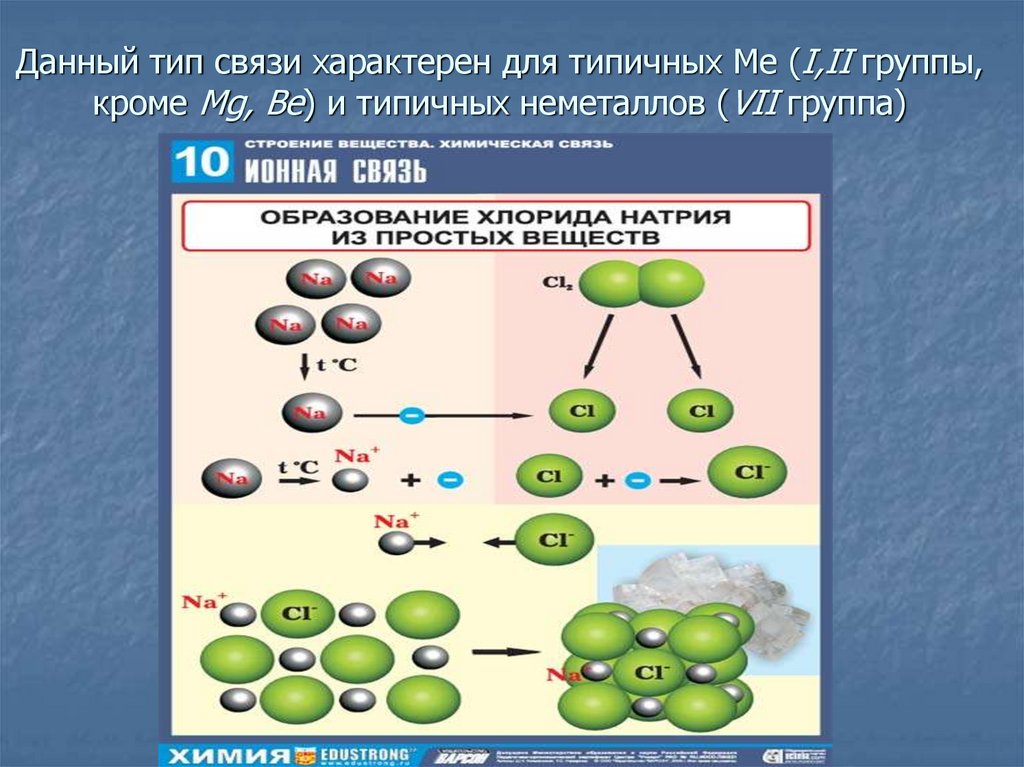
10. Ионная химическая связь
Ионная связь – связь, образовавшаяся за счетэлектростатического притяжения катионов к анионам.
Она образуется между ионами, электроотрицательность
которых сильно отличается друг от друга.
Ионы – заряженные частицы, в которые превращаются
атомы в результате отдачи или присоединения электронов.
Катионы – положительно заряженные ионы (атомы Ме),
Анионы – отрицательно заряженные ионы (атомы неМе)
11.
12. Данный тип связи характерен для типичных Ме (I,II группы, кроме Mg, Be) и типичных неметаллов (VII группа)
13.
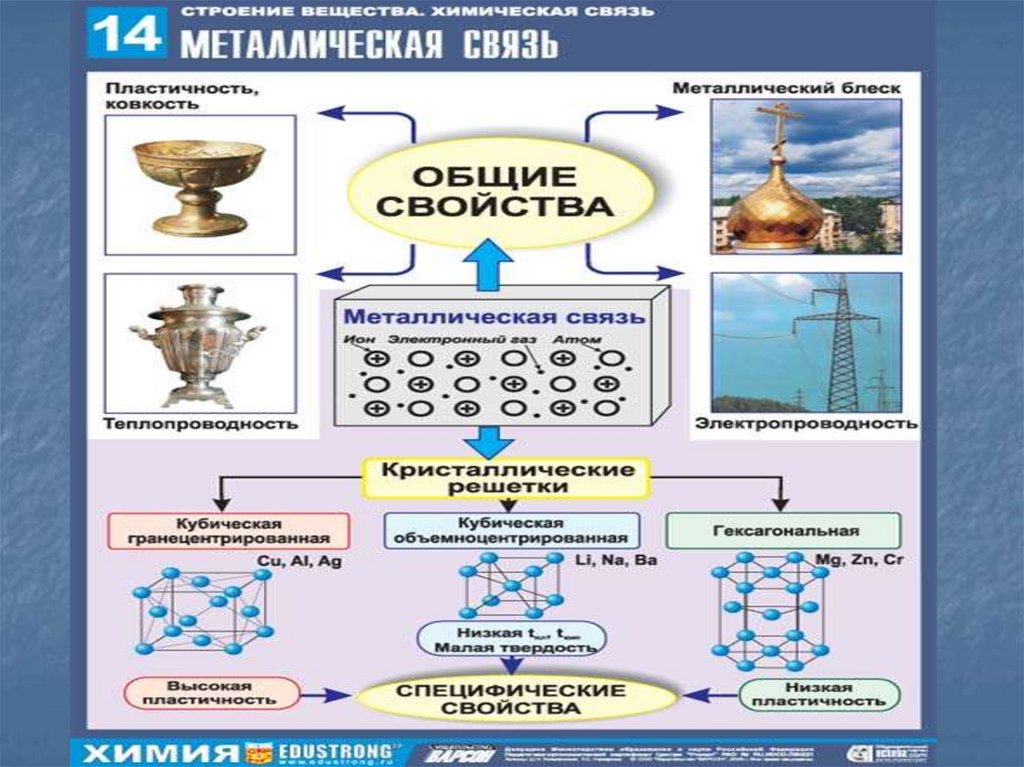
14. Металлическая связь
Металлическая связь – связь вметаллах, которую выполняют
относительно свободные электроны между
ионами Ме в металлической
кристаллической решетке.
Она основана на обобществлении
валентных электронов, принадлежащих
всем атомам в кристалле.
Эта связь характеризуется небольшим
числом валентных электронов (1 – 3) и
большим количеством свободных
орбиталей.
Металлическая связь прочная, чем
объясняются высокие температуры
плавления и кипения металлов.
15.
16. Водородная связь
Водородной связью называютхимическую связь, образованную атомом
водорода, связанным с атомом другого
более электроотрицательного элемента
(О, F, N, Сl).
Водородная связь может быть
межмолекулярной и внутримолекулярной.
Она гораздо более слабая, чем ионная
или ковалентная, но более сильная, чем
межмолекулярное взаимодействие.
17.
18. Составьте электронные и структурные формулы веществ
BeCl2AlF3
SO3
H2S
J2
CaF2
PCl3
19. Степень окисления элементов в сложных веществах
Степень окисления – это условный заряд атома вмолекуле, вычисленный согласно предположению о том,
что молекула состоит только из ионов.
20. Правила нахождения степени окисления
Алгебраическая сумма СО атомов в молекуле равнанулю,
СО элемента в простом веществе равна нулю,
СО атомов в молекуле сложного вещества может
быть выражена + или - числом,
Алгебраическая сумма СО атомов в сложном ионе
равна его заряду,
Элементы с постоянной СО:
Н +1(кроме гидридов),
О –2 (кроме пероксидов) и ОF 2
элементы главной подгруппы 1 группы +1,
все элементы 2 группы, кроме Hg +2,
алюминий АI +3,
фтор F – 1.
21. Определите степень окисления
Al2O3, H2SO4, Al2(SO4)3, H2O, NaOH, Na[Al(OH)4]H2SO3, H3PO4, HNO3, H2SiO3, HNO2, H2CO3 ,
НМnО4 , Са(NO3)2 Na 2 CO3
СаCl2, K2CO3, CaCO3, KCl, Pb(NO3)2, KOH,
Pb(OH)2, KNO3, CaSO3, HCl, CO2














 chemistry
chemistry








