Similar presentations:
Основным показателем энергетических возможностей пороха является количество тепла, выделяющееся при его сгорании в стволе оружия
1. ВВЕДЕНИЕ Основным показателем энергетических возможностей пороха является количество тепла, выделяющееся при его сгорании в
стволеоружия. При этом одновременно образуются газообразные и
конденсированные продукты сгорания, нагретые до высоких
температур и сжатые до больших давлений. Расширяясь в объеме
зарядной каморы и стволе оружия, пороховые газы совершают
определенную работу, которая зависит от энергетических
характеристик пороха и термодинамических параметров продуктов
сгорания. Основными характеристиками работоспособности пороховых
газов являются так называемая сила пороха ( f1 ) и показатель процесса
расширения пороховых газов при выстреле . Эти параметры
определяются путем термодинамического расчета. При
термодинамическом расчете используется либо информация о
химическом составе продуктов сгорания, либо информация о
зависимости баллистических характеристик порохов от теплоты
сгорания пороха при воде жидкой qv( ж ) В свою очередь, qv( ж )связана с
внутренней энергией (энтальпией) продуктов сгорания. Баллистические
параметры выстрела зависят не только от силы пороха и показателя ,
но и от других баллистических характеристик пороха, таких как,
скорость горения пороха.
2.
Кроме скорости горения на процесс газообразования влияют форма иразмеры пороховых элементов.
Как известно, теоретические методы дают приблизительную
оценку основных параметров быстропротекающих процессов (горения и
расширения). Это связано, в частности с тем, что не учитываются
влиянии молекулярных постоянных компонентов смесей (атомов,
молекул), используемых при вычислении термодинамических свойств
индивидуальных веществ.
3.
I. ПОНЯТИЯ И ТЕРМОДИНАМИЧЕСКИЕ ОСНОВЫРАСЧЕТА БАЛЛИСТИЧЕСКИХ
ХАРАКТЕРИСТИК ПОРОХА
Во внутренней баллистике силой пороха называют величину,
выраженную произведением удельной газовой постоянной R на
температуру горения T1 . Физический смысл этого произведения – силы
пороха – работа расширения 1 кг пороховых газов под давлением
101325 Па при нагревании их от абсолютного нуля до температуры
горения T1 . Для расчета силы пороха ( RT1 f1 ) нам надо знать
удельную газовую постоянную для пороховых газов и температуру
горения пороха. Величину R можно вычислить, используя уравнение,
которое устанавливает связь между универсальной (молярной) газовой
постоянной ( R0 = 8314 Дж/кмоль К – это значение газовой постоянной
одинаково для всех газов) и удельной газовой постоянной:
(1)
R0 RM
где М – молярная масса газа, кг/кмоль.
4.
Для газообразных продуктов сгорания пороха, представляющих собойсмесь нескольких газов, применяется средняя молярная масса:
(2)
М (М v / v )
ср
i i
i
где М i – молярная масса; vi – число молей i го компонента
продуктов сгорания пороха; vi – суммарное число киломолей всех
газообразных продуктов сгорания пороха, кмоль/кг.
Также определить удельную газовую постоянную пороховых
газов можно, зная удельный объем пороховых газов при нормальных
условиях V уд ( p0=101325 Па и Т = 273,15 К):
,R p V / T 101325 V / 273,15 371V
(3)
уд
уд
0 уд
где
(4)
Vуд 22,4 vi
Кроме удельной газовой постоянной пороховых газов для определения
силы пороха необходимо знать температуру горения пороха. Под
температурой горения пороха обычно понимают температуру
пороховых газов в момент их образования при горении пороха в
постоянном объеме, когда вся выделившаяся энергия идет на их
нагрев, т.е. в изохорном процессе (V=const). В соответствии с этим
определением температура горения пороха рассчитывается на
основании закона сохранения энергии, согласно которому внутренняя
энергия пороха равна внутренней энергии продуктов его сгорания при
температуре горения: (U )T (U
П
0
П .С . )T1
(5)
5.
Используя это равенство, можно путем графического или аналитическогоинтерполирования из зависимости U
(T ) найти значение T1.
П .С .
Внутренняя энергия сложных составных систем, к которым относятся
порох и продукты его сгорания, рассчитывается по значениям этого параметра
для отдельных компонентов систем. Следовательно, значения внутренней
энергии пороха и пороховых газов могут быть определены по закону
аддитивности, т.к. внутренняя энергия обладает свойством аддитивности:
(6)
(U П )T0
(U j )T0 gi
где (U j )T0– внутренняя энергия j го компонента пороха при начальной
(исходной, стандартной) температуре T0 ; g i – массовая доля j го
компонента пороха: (U
(7)
)T
(U ) v
П .С
1
i T1 i
где (U i )T1 – внутренняя энергия; vi – число молей i гокомпонента продуктов
сгорания пороха при температуре сгорания T1 .
Во внутренней баллистике для описания поведения пороховых газов
применяется уравнение состояния Абеля, в котором влиянием внутренних сил в
связи с высокой температурой горения пренебрегают:
(8)
p(V b) RT1
Поправку b к объему газов в уравнении состояния пороховых газов во
внутренней баллистике принято называть коволюмом пороховых газов и
обозначать . Коволюм имеет размерность удельного объема (м3/кг), а его
значение определяется соотношением:
(9)
0,001V уд
6.
Работа расширения газов в адиабатическом процессе определяется нетолько величиной RT1 , но и разностью К-1, где К – показатель
адиабаты, равный K C p / Cv.Во внутренней баллистике разность К-1
обозначается .
Показатель процесса расширения пороховых газов можно
вычислить исходя из известного из термодинамики уравнения Майера
C p Cv R по формуле:
K 1 C p / Cv 1 (C p Cv ) / Cv R / Cv
(10)
Если расчет проводить при среднем значении изохорной теплоемкости,
то формула для принимает вид:
(11)
R / Cv R(T1 T2 ) /[(U П .С . )T1 (U П .С . )T2 ]
Таким образом, из приведенных формул видно, что для расчета
силы пороха, коволюма и показателя необходимо знать химические
составы пороха и продуктов его сгорания, значение внутренней
энергии компонентов пороха, а также значение внутренней энергии
продуктов сгорания пороха при температурах, близких к температуре
горения и их плотность. Химический состав пороха выбирается, исходя
из требований к пороху или задается. Химический состав продуктов
сгорания пороха и их термодинамические параметры определяются
путем термодинамического расчета.
7.
II.ТЕОРЕТИЧЕСКИЙ РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХПАРАМЕТРОВ ПРОДУКТОВ СГОРАНИЯ И
ЭНЕРГЕТИЧЕСКИХ ХАРАКТЕРИСТИК ПОРОХА
2.I.Задачи термодинамического расчета.
Методы. Допущения
Возможный состав продуктов сгорания порохов определяется
исходным составом пороха, а также условиями горения и представляет
собой смесь разнообразных газов: CO, CO2 , H , H 2O, N2 , NO, CH4 , OH , O.
Их можно рассматривать как физически однородную систему. В смеси
продуктов сгорания пороха, неподвергающихся диссоциации,
химические реакции с изменением общего числа молей газов не
протекают. Поэтому они подчиняются основным газовым законам: их
термодинамическое состояние определяется двумя параметрами,
например температурой и давлением (температурой и плотностью) или
температурой и объемом.
При выстреле пороховые газы переходят из начального
состояния (состояние в момент образования) в конечное,
соответствующее моменту прохождения снарядом дульного среза в
процессе политропного расширения, завершая определенную работу.
Работоспособность пороховых газов при данных условиях заряжания и
конструкции ствола зависит от энергетических характеристик пороха и
термодинамических параметров продуктов сгорания в момент их
образования. Эти характеристики определяются как опытным, так и
расчетным путем.
8.
В задачи расчета входят определение:• элементного состава пороха;
• состава продуктов сгорания;
• запаса потенциальной энергии пороха, выражаемого величиной
внутренней энергии;
• силы пороха, выражающей работоспособность пороховых газов;
• термодинамических параметров продуктов сгорания пороха
(равновесной температуры, удельных теплоемкостей, удельной газовой
постоянной, показателя процесса расширения пороховых газов при
выстреле, средней молярной массы, удельного объема пороховых
газов).
В настоящее время для расчета энергетических характеристик
порохов и термодинамических параметров продуктов сгорания
применяются две группы методов:
1.Методы, основанные на полном расчете химического состава
продуктов сгорания пороха при допущении мгновенного установления
химического равновесия между компонентами пороховых газов. Такие
методы сравнительно сложны, но их достоинство состоит в том, что они
позволяют определять характеристики продуктов сгорания с
наибольшей точностью.
2.Упрощенные методы расчета характеристик порохов и
пороховых газов. Достоинством этих методов является простота и
доступность при минимальной информации о порохе.
9.
Упрощенные методы расчета находят применение для приближенных(предварительных) оценок энергосодержания проектируемых порохов и
работоспособности пороховых газов при выборе состава и содержания
компонентов, а также при их корректировке или случайном изменении.
Термодинамические расчеты порохов можно проводить с
большей или меньшей точностью в зависимости от числа учитываемых
при этом веществ в продуктах сгорания. В разных случаях при горении
порохов может образоваться в результате протекания основных,
побочных и второстепенных реакций от 5 до 50 веществ. Число
химических реакций при горении порохов, а следовательно, и число
компонентов продуктов сгорания определяются элементным
химическим составом пороха, давлением пороховых газов и
температурой горения. При этом низкие давления и высокие
температуры способствуют протеканию реакций диссоциации, а
высокие давления препятствуют ей. В первом случае число продуктов
сгорания будет увеличиваться за счет продуктов диссоциации, во
втором – число различных компонентов в продуктах сгорания будет
меньше.
Для нитратцеллюлозных порохов с отрицательным
кислородным балансом химический состав продуктов сгорания при
температурах горения определяется равновесием реакции водяного
газа и реакций диссоциации и взаимодействия основных компонентов
продуктов сгорания. В [1] приведены уравнения, который определяют
качественный состав продуктов сгорания.
10.
Эти уравнения содержат 15 газообразных компонентов:CO2 , CO, H 2O, H 2 , N2 , O2 , OH , N , H , O, CN , HCN , HCO, NH.
Расчет количественного состава продуктов сгорания может быть
проведен с учетом влияния на равновесие реакций только температуры
(по схеме идеального газа) или температуры и давления (по схеме
реального газа). При этом в зависимости от требуемой точности
определения состава продуктов сгорания и их характеристик
рассчитываются все возможные компоненты или только основные по
содержанию. В продуктах сгорания нитратцеллюлозных порохов
основными компонентами являются CO , CO, H O, H , N .
2
2
2
2
Количественное соотношение первых четырех компонентов
определяется равновесием реакции водяного газа, а содержание
молекулярного азота – количеством атомарного азота в компонентах
пороха.
Таким образом, состав продуктов сгорания порохов можно
рассчитывать в зависимости от желательной или необходимой степени
точности по следующим методам:
1.По схеме идеального газа с учетом компонентов продуктов только
по равновесию реакции водяного газа.
2.По схеме идеального газа с учетом компонентов продуктов всех
возможных реакций.
3.По схеме реального газа с учетом компонентов продуктов только
по равновесию реакции водяного газа.
11.
4.По схеме реального газа с учетом компонентов продуктов всехвозможных реакций.
Расчет состава продуктов сгорания и их характеристик в любом
методе проводится путем решения системы термодинамических
уравнений, число которых должно быть равным числу определяемых
величин: числу различных компонентов продуктов и их параметров.
Независимо от числа определяемых величин методы
термодинамического расчета порохов базируются на законах физики и
химии.
Поскольку состояние пороховых газов при выстреле
соответствует состоянию реальных газов, то при расчете необходимо
учитывать влияние на их состав, внутреннюю энергию и коволюм, не
только температуры, но и давления (или плотности) газов. При этом
влияние плотности на внутреннюю энергию газов сравнительно
невелико. Считается допустимым определение температуры горения по
внутренней энергии при фиксированном значении плотности. В то же
время коволюм пороховых газов весьма чувствителен к
термодинамическим параметрам состояния р, Т или , Т, которые в
процессе выстрела заметно изменяются. Учет переменности коволюма
при баллистических расчетах существенно усложняет решение задач.
Поэтому для упрощения целесообразно принять еще одно допущение –
постоянство коволюма и определять его при некоторых средних
значениях температуры и давления газов в канале ствола за весь
период выстрела.
12.
2.2.Принципы расчета элементнойхимической формулы пороха
Для расчета термодинамических свойств продуктов сгорания
пороха в первую очередь необходимо определить элементную
химическую формулу пороха. Это задача сводится к определению
суммарного числа молей каждого химического элемента, содержащихся
во всех компонентах пороха массой 1кг. Следовательно, для расчета
элементной химической формулы пороха нужно знать состав каждого
компонента. Компонентный состав пороха может быть выражен в
процентах или массовых долях. Для сложных веществ, таких как порох,
понятие моль неприменимо. Поэтому принято в расчетах таких веществ
использовать не количество их в молях, а массу в килограммах. При
этом элементный химический состав представляют в виде условной
химической формулы 1 кг вещества. Так, для нитратцеллюлозных
порохов, компоненты которых состоят из четырех элементов, формула
записывается как Ca , H b , Oc , N d , где a, b, c, d – количество молей
углерода, водорода, кислорода и азота в 1 кг пороха соответственно.
Количественный состав 1 кг пороха в молях химических элементов
рассчитывается следующим образом:
13.
m 1m
a a j g j (1000a j g j ) / M j aнц g нц
1
1
m
m 1
b b j g j (1000 b j g j ) / M j bнц g нц
1
1
Mj
m
1
m
(12)
;
1
m 1
d d j g j (1000 d j g j ) / M j d нц g нц
1
;
m 1
c c j g j (1000 c j g j ) / M j cнц g нц
;
;
;
;
1
M j – относительная молекулярная масса j - го компонента пороха;
a j , b j , c j , d j – количество молей углерода, водорода, кислорода и
азота в 1 кг j - го компонента пороха, моль/кг; g j – массовая доля j-го
компонента пороха; aнц , bнц , cнц , d нц – количество молей углерода,
водорода, кислорода и азота в 1 кг нитрата целлюлозы, моль/кг; g нц –
где
массовая доля нитрата целлюлозы в порохе.
14.
Элементный состав 1 кг нитрата целлюлозы вычисляется по формулам:а нц = 37,037 – 1,1904N,
bнц = 61,75 – 2,6984N,
(13)
cнц = 30,864 + 0,436N,
d нц = 0,717N,
где N – содержание азота в нитрате целлюлозы, выраженное в
массовых процентах.
Для проверки правильности расчета следует суммировать
произведения атомных масс элементов на количества их молей в 1 кг
пороха. Точность расчета считается удовлетворительной
при
m
A m
1
j
j
1000 5 г.
15.
2.3.Принципы расчета равновесного состава,полной внутренней энергии и коволюма
продуктов сгорания без учета их диссоциации
для реальных газов и уточнение их значений
При больших давлениях, соответствующих давлениям газов при
выстреле, поведение реальных газов существенно отличается от
поведения идеальных. Известны значительной число уравнений
состояния реальных газов, например уравнения Ван-дер Ваалеса или
уравнение состояния Абеля. Эти уравнения сравнительно просты,
удобны и достаточно точны для качественной оценки поведения газов.
Однако для количественной оценки более точным, применимым для
большего диапазона температур и давлений, считается уравнение
состояния с вириальными коэффициентами, впервые предложенное
Р.Клазиусом: pV R T (1 B(T ) / V C (T ) / V 2 D(T ) / V 3 ...) (14)
m
0
m
m
m
или
(15)
pVm R0T (1 B ' (T ) p C ' (T ) p D' (T ) p ...)
2
2
Функции В(Т), С(Т), … или В`(Т), С`(Т), … называются вторым, третьим
и т.д. вириальными коэффициентами. Они зависят от температуры и
физических свойств газов. Второй вириальный коэффициент учитывает
бинарные столкновения молекул, третий – тройные и т.д.
16.
На основе уравнения состояния с вириальными коэффициентамиА.Е.Арутюняном была разработана методика расчета состава и
характеристик продуктов сгорания пороха, учитывающая их
реальность. Суть методики состоит в определении поправок к
параметрам газа, учитывающих отличие реального газа от идеального.
Указанные поправки рассчитываются по вириальным коэффициентам и
их производным по времени. Расчет состава пороховых газов и
зависящих от него величин проводится по следующим формулам:
константа реакции водяного газа
K реал К идe
(16)
где К – константа реакции водяного газа, принимаемого как
идеального; - безразмерная величина, зависящая от плотности
пороховых газов и вириальных коэффициентов.
Число А в формуле для числа молей CO2 в продуктах сгорания
пороха:
А К реал (b / 2 с а) с
(17)
ид
Число молей
CO2 в продуктах сгорания пороха:
vCO2 А [ A2 4a(a c)( К реал 1)] 1/ 2 / 2( К реал 1)
Остальные компоненты рассчитываются аналогично:
(18)
17.
vCO a vCO2vH2O c a vCO2
vH2 b / 2 c a vCO2
(19)
Поправки на реальность пороховых газов к внутренней энергии
U R0T ( п.с vi X п2.с. ( vi )2 Y ) (20)
где п.с – плотность пороховых газов; vi – суммарное число молей
пороховых газов; Х, Y – суммарные величины, вычисляемые по
производным вириальных коэффициентов для компонентов продуктов
сгорания пороха по температуре и имеющих размерность удельного
объема.
Внутренняя энергия продуктов сгорания пороха:
(21)
реал
ид
U п.с. U n.c. U
x
x
Коволюм пороховых газов:
п.с vi y [1 п.с ( x п.с. vi y )
,y
(22)
где - суммарные величины, вычисляемые по вириальным
коэффициентам для компонентов продуктов сгорания пороха и
имеющие размерность удельного объема. Расчет температуры горения
пороха основан на применении к термодинамической системе порох –
пороховые газы закона сохранения энергии и закона Кирхгоффа о
зависимости тепловых эффектов в термодинамических процессах от
температуры.
18.
В соответствии с этим методика расчета сводится к нахождению такойтемпературы, при которой внутренняя энергия или энтальпия
продуктов сгорания оказывается равной внутренней энергии или
энтальпии исходного пороха. Следовательно, зависимость внутренней
энергии (энтальпии) от температуры в любом интервале выражается
уравнением вида:
UТ A BT CT 2;
HТ A` B`T C`T 2. (23)
Необходимо подчеркнуть, что коэффициенты А, В, С (А`, В`, С`)
имеют определенные численные значения только для конкретного
состава пороха. Поэтому они должны определяться при расчете
равновесной температуры горения каждого вида пороха. При
установлении зависимости U= (T) или Н= (T) для искомых продуктов
сгорания необходимо рассчитать значения внутренней энергии
(энтальпии) по крайней мере при трех температурах. Предварительно
определяются составы продуктов сгорания при этих температурах и
находят значения nU или Н по формулам:
n
n
(24)
U Т U T i 1000 U T VT / M iVT
1
i
1
n
i
i
1
n
i
n
H Т H T i 1000 H T T / M i T
1
i
1
i
i
1
i
(25)
19.
По закону сохранения внутренняя энергия пороха при стандартнойтемпературе равняется внутренней энергии продуктов сгорания при
температуре горения, т.е. U п.298 U п.с.Тv .
Используя это равенство и установленную зависимость U= (Т), находят
значение равновесной температуры горения пороха.
Аналитическое решение задачи определения температуры
горения пороха является трудоемким. Поэтому ее лучше решать
графически или на ЭВМ по соответствующей программе. Необходимые
для определения температуры горения пороха значения внутренней
энергии компонентов пороховых газов при предварительно задаваемых
температурах (близких к Т1 ) рассчитывают по значениям энтальпий
газов при тех же температурах, используя известную из термодинамики
связь между ними:
(26)
U H v RT
Т
T
i
Значения энтальпий для различных веществ приводятся в специальных
справочниках термодинамических параметров газов [2-5].
Таким образом, задача определения температуры продуктов
сгорания пороха, рассчитанных без учета диссоциации, сводится к
нахождению числа молей двуокиси углерода в продуктах при
нескольких значениях температуры, вычислению внутренней энергии
продуктов и графическому или машинному решению уравнения
энергетического баланса.
20.
2.3.1.Определение внутренней энергии порохаВнутренняя энергия пороха является его основной
энергетической характеристикой. Поскольку объем пороха, как
твердого вещества, остается постоянным при изменении температуры,
то его внутренняя энергия равна его энтальпии, т.е.
U П hП
(27)
В теплотехнических расчетах широко используют таблицы
полных энтальпий веществ. Эти таблицы составлены, исходя из того,
что за начало отсчета энтальпий элементов принято их стандартное
состояние, наиболее распространенное в природе ( O2 , H 2 , N 2 , Cl2 , F2
и т.д. в газообразном состоянии; C в форме графита; металлы) при
температуре T0 и давлении p0 =101325 Па, т.е. hT =0. Энтальпия
химических соединений (компонентов пороха) при0стандартных
параметрах считается равной тепловому эффекту образования их из
элементов при этих параметрах, т.е. для химических соединений
0
hпT0 hTO
. В соответствии с принятым началом отсчета полная
энтальпия химических соединений (hT ) при температуре Т равна:
h h0 (h0 h0 ) (28)
T
T0
T
T0
где hT0 – тепловой эффект образования веществ из элементов при T0
и p0 (определяется с учетом фазовых превращений);
0
0
,
h
hT T – энтальпии веществ при температурах T и T0 .
0
0
21.
В таблицах полных энтальпий веществ за температуру начала отсчетапринята температура T0 293,15K . Полная энтальпия веществ при
заданной температуре Т в этом случае определяется по формуле:
0
0
0
(29)
h
h
(
h
h
)
T
293
T
293
0
где h293 – стандартная теплота образования 1 кг вещества в
изобарно-изотермической реакции образования из стандартных
веществ в стандартных условиях.
Полная энтальпия m – компонентов пороха определяется по
m
формуле:
hп h j g j hсм
(30)
1
где h j– полная энталпия 1 кг j-го компонента пороха; g i – массовая
доля j-го компонента; hсм– теплота смешения компонентов пороха
(теплота растворения одного компонента в другом). Теплота смешения
мала по сравнению с энтальпией образования компонентов пороха и
ею без заметного изменения hп можно пренебречь. Тогда расчетная
формула упрощается и получает вид:
m
hп h j g j
1
(31)
22.
III. УПРОЩЕННЫЙ МЕТОД РАСЧЕТА СИЛЫ ПОРОХА,КОВОЛЮМА И ПОКАЗАТЕЛЯ ПРОЦЕССА
РАСШИРЕНИЯ
ПОРОХОВЫХ ГАЗОВ ПРИ ВЫСТРЕЛЕ
3.1.Термодинамические основы метода.
Зависимости для расчета удельной теплоты сгорания пороха
Рассмотренный ранее метод, определения характеристик
пороха, требует знания о составе и свойствах продуктов сгорания. В
случае, когда не ставится задача о нахождении продуктов сгорания,
определение силы пороха, коволюма и показателя процесса
расширения пороховых газов при выстреле, необходимых для расчета
максимального давления pmax и дульной скорости снаряда U g ,
рекомендуется простой метод расчета по удельной теплоте сгорания
пороха qv ( ж ) .
Между термодинамическими параметрами любой системы
существует взаимосвязь. Термодинамика дает различные выражения
этой взаимосвязи, например:
23.
А1 2 RT1 /( K 1)[1 (V2 / V1 ) K 1 ]А1 2 RT1 /( K 1)[1 ( p2 / p1 ) ( K 1) / K ] ]
А1 2 RT1 /( K 1)[1 (T2 / T1 )]
(32)
(33)
(34)
Представленные уравнения можно рассматривать не только как
выражения для работы, но и для внутренней энергии, поскольку в
адиабатическом процессе согласно первому закону термодинамики
работа равняется изменению внутренней энергии.
Применительно к явлению выстрела уравнения (31-33) можно
трактовать как выражения работы, совершаемой за счет внутренней
энергии пороховых газов, образовавшихся при сгорании 1 кг пороха с
силой f1 RT1. Потому уравнение (33) примет другой вид:
А1 2 U T1 U T2 U RT1 (1 T ) /( K 1)] (35)
Если температуру пороховых газов в конечном состоянии принять
равной нулю, т.е. T2 0, тоU2 0 . Тогда получим выражение для
полной внутренней энергии 1 кг пороховых газов:
(36)
АT1 0 U T1 U п.с. RT1 /( K 1)]
По закону сохранения энергии полная внутренняя энергия пороховых
газов U п.с. равна полной внутренней энергии такого же количества
пороха, т.е. для 1 кг пороха и пороховых газов можно записать:
(37)
U U
п
п.с.
24.
Из уравнений (35), (36) следует, чтоf1 RT1 ( K 1)U п.с. ( K 1)U п
(38)
Основным показателем энергетических возможностей пороха
является количество тепла, которое выделяется при его сгорании в
зарядной каморе и стволе оружия, т.е. в условиях замкнутого объема
при V=const. В продуктах сгорания порохов содержатся пары воды.
Поэтому, теплота сгорания пороха меньше его внутренней энергии (и
внутренней энергии продуктов сгорания) на теплоту испарения воды
(конденсацию паров воды), образовавшейся при горении,
следовательно,
(39)
qv ( п ) U п.с. vH 2O qH 2O
где qv (п ) – удельная теплота сгорания пороха при воде парообразной;
продуктов сгорания при
U п.с. – удельная внутренняя энергия
температуре горения пороха; v H 2O – число молей воды в продуктах
сгорания 1 кг пороха; q H O – скрытая теплота испарения одного моля
воды, равная 44,1 кДж. 2
Из уравнения (39) следует, что внутренней энергии пороха при данной
температуре соответствует теплота сгорания с учетом скрытой теплоты
фазового превращения воды в продуктах сгорания, т.е. теплота
сгорания пороха при воде жидкой qv (ж ) .
25.
Таким образом, равенствоqv ( п ) vH 2O qH 2O U п. U п.с
(40)
выражает процесс превращения энергии пороха при его изохорическом
сгорании. Численные значения qv (п ) и qv (ж ) зависят от принятой
системы отсчета, нуля энергии, т.е. температуры, к которой отнесены
эти величины.
В общем случае выражение для qv (ж ) в связи с внутренней
энергией продуктов сгорания имеет вид:
qv ( ж ) U T1 U T2
(41)
Сопоставив равенства (37) и (40) получим:
f1 RT1 ( K 1)( qv ( ж ) U T2 ) ( K 1)U T2 ( K 1)qv ( ж ) (42)
где U T и показатель адиабаты К зависят от состава пороховых газов
2
и их температуры.
Если предположить, что состав пороховых газов и температура
горения для разных порохов незначительно отличаются друг от друга,
то можно принять величины U T и К для всех порохов одинаковыми и
2
формула для расчета силы пороха примет вид:
f1 a bqv ( ж )
(43)
Коэффициенты a и b могут быть рассчитаны по принятым
значениям К и U T или найдены опытным путем при сравнении силы
2
пороха и qv ( ж )для ряда порохов.
26.
При применении упрощенного метода расчета рекомендуетсяиспользовать формулу внутренней баллистики:
(44)
f1 (6817 0,846 qv ( ж ) )102
где qv ( ж ) измеряется в кДж/кг и f1 – в Дж/кг (процесс расширения
пороховых газов принят политропическим с показателем политропы
n=1,0846).
Связь между коволюмом пороховых газов и удельной
теплотой сгорания qv ( ж ) устанавливается, исходя из уравнения
состояния Абеля при полном сгорании пороха в постоянном объеме:
(45)
p(Vуд ) RT f1
После всех преобразования получаем формулу для расчета:
(46)
(1381 0,12qv( ж) )10 6
где qv (ж )- кДж/кг, - м3/кг.
Характеристика = n – 1 отражает как первоначальную
потенциальную энергию пороха, так и закон использования ее в
процессе выстрела. В литературе приводится анализ зависимости
характеристики от условий заряжания и температуры пороховых
газов. В результате этого анализа получены следующие формулы для
расчета этой величины:
ср 0,329 0 /(7,1410 5 T1 0,329)
(47)
(48)
0 0,458 0,3910 4 T1
5
(49)
ср 0,1176 /(7,1410 T1 0,329)
27.
При расчета для баллиститных порохов используются формулы (47),(48), а для пироксилиновых – (49).
Теперь рассмотрим зависимости для определения удельной
теплоты сгорания пороха. Известно, что теплота сгорания пороха как
удельный тепловой эффект химических реакций, происходящих при
горении пороха, может быть выражена через теплоты образования
компонентов пороха и продуктов сгорания (согласно
термодинамическому закону Гесса). При расчете удельной теплоты
сгорания пороха по теплотам сгорания и образования компонентов,
необходимо знать состав продуктов сгорания, выраженный в молях или
массовых долях (для компонентов пороха). Это усложняет расчет qv ( ж ) ,
а вместе с тем и расчет характеристик пороха.
Поэтому для определения необходимой нам величины qv ( ж )
рекомендуется использовать метод, предложенный в 1937 г.
голландским ученым Де-Поу, по так называемым термическим
коэффициентам . Теплота сгорания пороха qv ( ж ) является
термохимическим аналогом термодинамического параметра системы внутренней энергии. Из термодинамики известно, что внутренняя
энергия как один из калорических параметров обладает свойством
аддитивности. Это свойство относится и к теплоте сгорания пороха, как
идентичной величине. Оно позволяет определять значения этой
величины путем сложения теплот сгорания отдельных компонентов
пропорционально их содержанию в порохе:
(50)
q n
v ( ж)
j j
28.
где j – термохимический коэффициент, равный теплоте сгорания 10гj-го компонента пороха и показывает изменение величины qv (ж ) при
изменении содержания компонента на 1%; n j – процентное содержание
каждого компонента в порохе.
Приведенная формула проста и удобна. Однако при ее
использовании необходимо учитывать особенности тепловой
характеристики влаги, некоторое количество которой всегда
содержится в порохе. Для воды коэффициент H O равен нулю.
2
Изменение воды в порохе формально не изменяет удельную теплоту
сгорания. Поэтому, если рассчитывать величину qv (ж ) на сухую массу,
т.е. оставлять процентное содержание компонентов неизменным после
изменения содержания воды, то результат будет получаться
ошибочным. Для его исправления нужно разделить на относительную
массу водосодержащего пороха, принимая сухую массу за единицу.
Например, если qv (ж ) при расчете на сухую массу пороха равняется
3900 кДж/кг, а содержание влаги в нем 0,5%, то исправленное
значение удельной теплоты сгорания будет равно:
q'v ( ж ) (qv ( ж ) ) сух / 1,005 3900 / 1,005 3881кДж / кг
(50)
Правильное значение величины qv (ж ) будет получаться при расчете и
после изменения содержания влаги проводить с учетом изменившегося
соотношения компонентов пороха. Точность вычисления удельной
теплоты сгорания qv (ж ) зависит так же от точности значений j для
отдельных компонентов пороха. Для точных вычислений qv (ж )
необходимо пользоваться эмпирически найденными значениями
j
а не вычисленными по теплотам образования веществ.
29.
Пользоваться расчетными значениями j рекомендуется в том случае,когда отсутствуют эмпирические данные, в частности, при
предварительных расчетах qv (ж ) порохов, содержащих какой-либо
новый компонент.
30.
3.2. Зависимости для расчета баллистическиххарактеристик порохов, определяющих интенсивность
газообразования
3.2.1. Эмпирические формулы для расчета скорости горения
пороха
Во внутренней баллистике ствольных систем принят
следующий закон скорости горения пороха U U1 p . Влияние природы
и состава пороха на эту важнейшую баллистическую характеристику (U )
оценивается по влиянию на коэффициент скорости горения U .
1
Зависимость величины U1 от природы и состава пороха определяется
опытным путем. Коэффициент скорости горения для пироксилиновых
порохов в значительной зависит от содержания летучих веществ в
порохе и азота в исходном пироксилине. Увеличение содержания
летучих веществ в порохе на 1% понижает коэффициент скорости
горения U приблизительно на 10%. Чем больше содержание азота в
1
пироксилине, тем больше величина U . Изменение содержания азота
1
на 1% изменяет величину U на 28,5%.
1
31.
Для расчета U пироксилиновых порохов предложена формула,1
выражающая его зависимость от удельной теплоты сгорания qv (ж ) ,
которая имеет вид:
U1 [143*10 6 (0,24)qv( ж) 530)] /[0,25(1220 t0 ) 30h 52,5h' ] (51)
где t 0 –температура пороха, 0С; h – содержание летучих веществ в
порохе, удаляемых 6-ти часовой сушкой (вода), %; h - содержание
летучих веществ в порохе, не удаляемых 6-ти часовой сушкой (спирт,
эфир), %; коэффициенты подобраны для получения величины U
1
в мм/(с Па).
При расчете величины U1 для нитроглицериновых порохов
можно применять следующую формулу:
U1 (0,1qv( ж) 20) *10 7
(52)
где qv (ж ) - удельная теплота сгорания пороха, ккал/кг; результат 4
получается в (дм/с)/(кгс/дм2) и требует перевода в м/сПа (U1 / 10 )
или в мм/сПа (U1105 ).
Ни одна из приведенных эмпирических формул не учитывает
влияние на величину U плотности пороха. Экспериментальным путем
1
установлено, что при уменьшении
плотности пороха на (1…2)%
коэффициент U1 увеличивается на (10…15)% и наоборот. Поэтому,
если известно отклонение плотности пороха от принятого за
нормальное значение, равное 1,65 г/см3, то полученное расчетом по
формулам (51), (52) значение U необходимо пересчитать, учитывая
1
указанную степень влияния на него
плотности пороха.
32.
3.2.2. Формулы для расчета коэффициента формы иотносительной горящей поверхности порохов
Процесс газообразования характеризуется величиной интенсивности
газообразования Г и ее зависимостью от сгоревшей части пороха:
(53)
mСГ / тП
Величина Г определяется следующим образом:
Г=(ǽ/e1 ) U1
(54)
где ǽ - коэффициент формы пороховых элементов, который для пороха
дегрессивной формы изменяется от 1 до 3 и равен 0,72 для порохов
цилиндрической формы с семью каналами; e1 – толщина горящего свода
пороха; - относительная текущая горящая поверхность пороха,
изменяется при горении пороха в зависимости от формы. Формула (54)
отражает влияние на процесс газообразования формы, размеров и
состава пороховых элементов.
При расчете характеристик выстрела p max и U g влияние на них
формы, размеров и скорости горения пороха, учитывается через
величину Г ср , которая входит в параметр заряжания К,
рассчитываемый по формуле:
К [ mС mП f ( Гср / S )2 ] / (55)
где Г ср – средняя интенсивность газообразования за время горения
пороха, рассчитываемая по формуле:
(56)
Г ср= ǽ срU1 / e1
33.
Величины, входящие в выражение дляследующим формулам:
для трубчатого пороха:
ǽ = (c - e1 )/с ;
ср (3 к ) / 4 ;
к (с е1 ) /(с е1 ) ,
откуда ср (2с е1 ) / 2(с e1 ) ;
Г ср рассчитываются по
для 7-канального порохового заряда:
ǽ 0,72; ср (3 расч ) / 4; расч 1,37,
откуда ср
4,37 / 4 1,09.
34.
IV. РАСЧЕТ ОСНОВНЫХ БАЛЛИСТИЧЕСКИХ ПАРАМЕТРОВВЫСТРЕЛА pmax И Ug В ЗАВИСИМОСТИ ОТ
ХАРАКТЕРИСТИК ПОРОХА
4.1.Теоретические основы расчет баллистических
параметров выстрела
К важнейшим баллистическим характеристикам явления
выстрела относятся максимальное давление пороховых газов (p max ) и
дульная скорость снаряда ( U ) – скорость движения снаряда при
g
вылете из ствола. Эти две баллистические
характеристики
определяются при оценке качества порохов и пороховых зарядов
(оценка производится стрельбой из ствольного оружия на полигонах
пороховых заводов и НИИ). Максимальное давление пороховых газов в
стволе ограничено прочностью ствола. Также оно косвенно влияет на
дульную скорость снаряда, являющуюся основной величиной,
определяющей дальность полета, способность поражать
быстродвижущиеся и бронезащищенные цели.
Теоретической основой расчета баллистических параметров
выстрела являются зависимости, которые связывают параметры
выстрела с конструктивными характеристиками ствола и
характеристиками пороха. Эти зависимости позволяют установить
основные закономерности и анализировать влияние различных
факторов (например, характеристик пороха) на баллистические
параметры выстрела.
35.
Получение баллистических зависимостей для давленияпороховых газов - в первом основном периоде выстрела и для скорости
снаряда - во втором периоде – основывается на использовании
уравнения внутренней баллистики ствольных систем, которое выражает
баланс энергии при выстреле:
f1mП / mсU 2 / 2 pS (1 1) / (57)
где f1 – сила пороха; n -1 – показатель процесса расширения
пороховых газов при выстреле; mП– масса пороха в заряде; коэффициент фиктивности массы снаряда, зависящей от
второстепенных работ пороховых газов, пропорциональных главной
работе, равной кинетической энергии снаряда; m c – масса снаряда; S –
площадь поперечного сечения канала ствола; U – скорость движения
снаряда в стволе; p – давление пороховых газов в стволе; 1 V / S –
приведенная длина свободного объема зарядной камеры V ;1 – путь
снаряда в стволе в текущей момент.
Левая часть уравнения f1mП / выражает полный запас
энергии (полную внутреннюю энергию) пороховых газов,
2
образовавшихся при сгорании mП кг пороха. В правой части mсU / 2
– работа, совершаемая пороховыми газами в процессе расширения при
выстреле; pS (1 1) / - полная внутренняя энергия mП кг
пороховых газов после совершения ими работы.
Уравнение (57) представляет собой основную упрощенную
математическую модель выстрела, полученную при допущении
отсутствия потерь тепла в стенки камеры и ствола. Кратковременность
выстрела в некоторой степени оправдывает это допущение и
36.
обеспечивает сравнительно небольшое расхождение действительныхзначений величин с расчетными. Также принимается допущение о
протекании процесса горения пороха при V=const. В действительности
лишь предварительный период выстрела совершается при этих
условиях. В первом основном периоде в связи с движением снаряда по
каналу ствола объем, в котором сгорает порох, изменяется. Однако
скорость изменения заснарядного объема вначале невелика. В начале
периода движение снаряда происходит сравнительно медленно и объем
заснарядного пространства изменяется незначительно. К моменту
достижения максимального давления заснарядный объем
увеличивается по сравнению с объемом камеры всего 1,5-2 раза. Но
поскольку давление пороховых газов растет значительно быстрее, то
условия горения пороха остаются идентичными условиям при V=const.
К моменту достижения p max успевает сгореть большая часть пороха
( max 0,6 0,8) . Аналогично обосновывается допущение об условиях
горения пороха при V=const до конца первого периода.
При расчете энергетических характеристик предполагается, что
продукты сгорания являются идеальными газами. Образующиеся
твердые вещества занимают малый объем, так как даже при комнатной
температуре объем любого газа более, чем в 1000 раз превышает
объем такой же массы твердого вещества. Также считается, что при
горении пороха в камере и канале ствола химическое и
термодинамическое равновесие в продуктах сгорания устанавливается
мгновенно. Мы будем рассматривать модель пороховых газов,
компоненты которого находятся в полном равновесии.
37.
Для пути снаряда 1 в текущий момент в первом периоде выстрела былаполучена формула для текущего давления пороховых газов в первом
периоде:
p [p 0 (1 )9 ] / 0
(58)
где p 0 – давление форсирования (задается по соотношению p/f1 0,038
0 – относительная2сгоревшая масса пороха в предварительном
периоде; mcU / f1mП 2 – технический к.п.д. выстрела в текущий
момент первого периода.
Максимальное давление пороховых газов рассчитывается при
m и m .Тогда формула для расчета m примет вид:
2
m 0,1( K 0 ) {[ 0,1( K 0 )] 0,8K, 0 }1/ 2 (59)
где K U пр 2 / 2U12 – параметр заряжания. Величина U1 имеет размерность
скорости и представляет собой условную скорость снаряда. Эта
величина рассчитывается по формуле:
U1 S /( mc ср )
(60)
Расчетная формула для дульной скорости по методу А.С.Рябова
имеет вид:
U g U пр{1 [(l1 lK ) /(l1 lg )] (l K )}1/ 2
(61)
1/ 2
где U пр [( f1mП 2) /( mc )] - предельная скорость снаряда;
V1 зарядной
объема
l1 (V0 mП ) / S - приведенная длина свободного
камеры к концу горения пороха; l K [l0 (l K )8 ] l1 – путь снаряда к
концу горения пороха; U 2 / U 2– технический к.п.д. выстрела к
К
пр
концу горения пороха. K
38.
Вследствие разнородности компонентов многоступенчатостипроизводственного цикла, разнообразия технологических операций и
режимов партии пороха одной марки и даже части одной партии
характеризуются некоторым различием по составу, геометрическим
данным и, следовательно, по баллистическим параметрам.
Приведенные выше формулы для p max и U g позволяет оценивать
расчетным путем изменение этих величин при изменении
характеристик пороха.
Для определения указанных выше энергетических и
баллистических характеристик пороха в литературе предложен ряд
методов. В данном пособии рассматриваются относительно простые
методы, применяемые студентами на занятиях – это метод Рябова А.С.,
метод Де-Поу и Особого бюро, метод Ле-Шателье и Малляра, метод
Бринкли и Уилсона.
Метод Рябова А.С. описан выше, поэтому далее мы знакомимся
с другими перечисленными методами.
39.
4.2. Метод Де-Поу и Особого бюроОпределение удельной теплоты сгорания порохов по методу
Де-Поу и Особого бюро (ОБ) базируется на экспериментальных данных,
полученных в калориметрической бомбе. На основе экспериментальных
данных предложена формула (49) определения удельной теплоты
сгорания пороха. Значения определяются не только экспериментом,
но и расчетом. Для некоторых компонентов, применяемых в порохах и
взрывчатых веществах, численные значения , заимствованные из
работы [8], приведены в таблице 1.
40.
Нитраты целлюлозы4.184(1.3N-6.7)
Нитроглицерин
+73.27
Нитродигликоль
+73.10
Динитротолуол
+4.18
Дибутилфталат
-77.40
Централит №1
-99.16
Централит №2
-95.18
Вазелин
-133.47
Графит
-125.50
Камфора
-117.00
Спирт этиловый
-73.20
Углерод
-140.00
Дифениламин
-121.34
Вода
0
Этиловый эфир
-93.70
Диамилфталат
-81.50
Нитрогуанидин
+27.61
ТЭН
+65.27
Таблица 1
Значения термохимического
коэффициента
41.
Примечание: N-% содержание азота; знаки «плюс» и «минус»означают увеличение и уменьшение соответственно теплоты сгорания
от введения того или иного компонента.
Расчет элементного состава пороха сводится к вычислению суммарного
количества молей атомов углерода а, водорода b, кислорода с и азота d
в 1 кг пороха. Элементная формула 1 кг пороха представляется
формулой Ca H bOc N d . Рассмотрим методику определения числа молей
атомов химических элементов на примере компонентов, которые
широко применяются в различных порохах. Процентное содержание
компонентов в порохе обозначим через n i .
1. В качестве первого компонента рассмотрим нитрат
целлюлозы (НЦ). Элементный состав 1 кг НЦ выражается условной
химической формулой вида Ca H bOc N d , где a, b, c, d вычисляются по
формуле (12). В 1 кг пороха содержится 10 n i граммов НЦ, элементный
состав которого выражается формулой Ca1 H b1Oc1 N d 1. Значения
a1, b1 , c1, d1 определяются по зависимостям:
a1= (37,037 – 1,1904N)10 n1/1000,
b1= (61,75 – 2,6984N) 10 n1/1000,
c1= (30,864 + 0,436N) 10 n /1000,
1
d1= 0,717N10n1/1000.
42.
2.Нитроглицерин (НГЛ) имеет химическую формулу C3 H 5O9 N 3и молекулярную массу 227 г. В порохе содержится 10n 2 граммов НГЛ,
который имеет элементную формулу Ca2 H b 2Oc 2 N d 2 , где
a 2 3n210 / 227,
b2 5n210 / 227,
c2 9n210 / 227,
d 2 3n210 / 227.
3.Динитротолуол (ДНТ) имеет химическую формулу C7 H 6O2 N и
молекулярную массу 182 г. В порохе содержится 10n 3 граммов ДНТ,
который имеет элементную формулу Ca3 H b3Oc 3 N d 3 , где
a 3 7n310 / 182,
b 3 6n310 / 182,
c3 2n310 / 182,
d 3 n310 / 182.
4.Дибутилфталат (ДБФ) имеет химическую формулу C16 H 22O4
и молекулярную массу 278 г. В порохе содержится 10n 4 граммов ДБФ,
который имеет элементную формулу Ca4 H b 4Oc 4 N d 4 , где
a 4 16n410 / 278,
b 4 22n410 / 278,
c 4 4n410 / 278,
d 4 0.
43.
5. Централит №1 (Ц1) имеет химическую формулу C17 H 20ON 2и молекулярную массу 268 г. В порохе содержится 10n 5граммов Ц1,
который имеет элементную формулу Ca5 H b5Oc 5 N d 5, где
a 5 17n510 / 268,
b 5 20n510 / 268,
c5 n510 / 268,
d 5 2n510 / 268.
6. Вазелин (В) имеет химическую формулу C15 H 32 и
молекулярную массу 212 г. В порохе содержится 10n 6граммов В,
который имеет элементную формулу Ca6 H b 6 , где
a 6 15n610 / 212,
b 6 32n610 / 212,
c 6 0,
d 6 0.
44.
Если порох состоит из указанных компонентов, суммарное числомолей атомов углерода а, водорода b, кислорода с и азота d в 1 кг
пороха определяется следующим образом:
a a1 a 2 a 3 a 4 a 5 a 6 ,
b b1 b 2 b 3 b 4 b 5 b 6 ,
c c1 c 2 c3 c 4 c5 c 6 ,
d d1 d 2 d 3 d 4 d 5 d 6 .
Тогда элементная формула 1 кг пороха имеет вид Ca H bOc N d.
Таким образом, в 1 кг пороха 12а г углерода, 1b г водорода, 16с г
кислорода и 14d г азота. Если расчеты выполнены корректно, то
значение m 12a 1b 16c 14d незначительно будет отличаться от
1000. Относительная ошибка результатов расчетов составляет
=(1000 - m)/10, приемлемой считается не более 0,5%.
Расчет состава продуктов сгорания и температуры горения
пороха. Рассмотрим метод расчета состава и температуры продуктов
сгорания, в основе которого лежит известное значение qv. Ознакомимся
с математической моделью исследуемых процессов. Предполагается,
что продукты сгорания пороха состоят из газообразных веществ, таких
CO
O, H 2иN2 реакции
как
.Тогда
уравнение
2 , CO, H 2химической
горения пороха можно представить в виде:
(62)
Ca H bOc N d xCO2 yCO uH 2O zH 2 d / 2 N 2 .
45.
Продукты горения реагируют между собой по уравнениюреакции водяного газа:
CO2 H 2O CO2 H 2 .
Эту обратимую реакцию можно записать в символьной форме:
y u x z
где x,z – мольные концентрации исходных продуктов; y, u – мольные
концентрации продуктов реакции.
Согласно закону Гульдберга и Вааге, в состоянии равновесия
частное от деления произведения концентраций продуктов реакции на
произведение концентраций исходных продуктов является величиной
постоянной. Эту величину называют константой равновесия, и
обозначим ее как Кv. Индекс указывает, что реакции протекают в
постоянном объеме. Для реакции водяного газа:
(63)
K v yu / xz.
Значения K v для реакции водяного газа в зависимости от температуры
приведены в таблице 2.
46.
Таблица 2.Зависимость константы равновесия K v от температуры
Т, К
К
Т, К
К
Т, К
К
1100
1.019
2100
4.989
3100
7.690
1200
1,381
2200
5,333
3200
7,881
1300
1,774
2300
5,657
3300
8,063
1400
2,187
2400
5,967
3400
8,228
1500
2,600
2500
6,259
3500
8,387
1600
3,030
2600
6,554
3600
8,535
1700
3,450
2700
6,860
3700
8,676
1800
3,851
2800
7,041
3800
8,804
1900
4,245
2900
7,271
3900
8,925
2000
4,624
3000
7,489
4000
9,042
47.
Предлагается следующая аппроксимирующая функция, полученнаяобработкой данных табл.2, для определения K v :
(64)
K v ln( 929,65 *10 6 T 2 3,165T 2720)
Относительная ошибка определения K v по этой функции не превышает
1%. Для вычисления значений мольных концентраций продуктов
горения составляем систему уравнений материального баланса исходя
из равенства (62):
x y a,
(65)
2 x y a c,
u z b / 2.
Имеем три уравнения с четырьмя неизвестными: x, y, u, z. В
качестве четвертого уравнения применяют уравнение (63). Для
решения системы из четырех уравнений в качестве независимой
переменной принимают х, тогда из системы уравнений (65) получается:
(66)
y a x, u c a x, z b / 2 c x a
Подставив значения y, u, z из (66) в (63), получим зависимость:
(67)
(a x)(c x a) K v x(b / 2 c x a)
Раскрыв скобки (67) и выполнив преобразования, получим квадратное
уравнение относительно х:
x 2 x y 0
(68)
где K v 1, K v (c a b / 2) с, y a(a c) (69)
48.
Действительное значение корня в квадратном уравнении (68)определяется зависимостью:
x ( ( 2 4 )0,5 ) /( 2 )
(70)
Система уравнений (66) и (69) может быть решена, если
известно значение температуры горения, необходимое для вычисление
Kv, из формулы (64). Температура горения определяется методом
последовательных приближений, исходя из уравнения внутренней
энергии. Суть метода: задается некоторое произвольное значение
температуры горения и вычисляется изменение внутренней энергии
продуктов сгорания. Если вычисленное значение внутренней энергии
U c совпадает со значением удельной теплоты горения qv , то
заданная температура принимается за температуру горения. В
противном случае задается новое значение температуры горения и
расчет повторяется.
Изменение внутренней энергии продуктов сгорания пороха
(смеси газов) представляется равенством:
U c x u x y u y u uu z u z d / 2 ud
(71)
где u с соответствующими индексами означают изменение внутренней
энергии одного моля CO2 , CO, H 2O, H 2иN2 .
Изменение внутренней энергии продуктов сгорания пороха
(каждого в отдельности) представляется в виде аппроксимирующих
функций:
49.
u x (0,013848T 2.6748 ln T 11,255) * 4,184, кДж / моль,uu (7,4802 *10 7 T 2 0.38318 ln T 0,0069056T ) * 4,184, кДж / моль,
u y (2,1855 *10 7 T 2 0.31338 ln T 0,0058501T ) * 4,184, кДж / моль,(72)
u z (3,8704 *10 7 T 2 0.0045571T 1,35) * 4,184, кДж / моль,
ud (2,3372 *10 7 T 2 0.3054 ln T 0,0057187T ) * 4,184, кДж / моль,
здесь индексы x, u, y, z, d соответственно относится к углекислому газу,
воде, окиси углерода, водороду и азоту.
Расчет работоспособности и потенциала пороховых газов. Зная
состав продуктов и температуру горения, можно вычислить
работоспособность и потенциала П пороховых газов. Для этого
предварительно определяются значения удельных объемов
газообразования пороха при воде жидкой v1 и газообразной v2 на основе
закона Авогадро:
(73)
v1 ( x y z d / 2) * 22,41 / 1000, м3 / кг
(74)
v2 ( x y z d / 2) * 22,41 / 1000, м3 / кг
где 1000 – переводной коэффициент одного литра, м 3.
Работоспособность и потенциал пороховых газов выражаются
зависимостями f RT и П f / .
Величина газовой постоянной в нормальных условиях
определяется из уравнения состояния идеальных газов:
R p0v / T0 101325v / 273, где p0 – атмосферное давление (101325
Па), T0 273,15K и v – удельный объем газов.
50.
Следовательно, работоспособность при воде жидкой f1 и парообразнойf выражаются зависимостями:
2
f1 101325v1T / 273,
f 2 101325v2T / 273, Hм / кг.
(75)
Для определения потенциала П предварительно необходимо вычислить
величину с p / сv 1. Здесь с p и сv мольные значения теплоемкостей
пороховых газов при постоянном давлении и объеме, которые зависят
от температуры. Зависимости мольных теплоемкостей от температуры
определяются из уравнений:
с px (14.19 0.0004 T - 1500) 4.184, кДж/моль,
с py (8.564 0.000286 T - 1500) 4.184, кДж/моль,
с pu (11.856 0.001319 T - 1500) 4.184, кДж/моль,
с px (7.976 0.000698 T - 1500) 4.184, кДж/моль,
с pd (8.49 0.000316 T - 1500) 4.184, кДж/моль,
сvx (12.204 0.0004 T - 1500) 4.184, кДж/моль,
сvy (6.578 0.000286 T - 1500) 4.184, кДж/моль,
сvu (9.87 0.001319 T - 1500) 4.184, кДж/моль,
сvx (5.99 0.000698 T - 1500) 4.184, кДж/моль,
сvd (6.504 0.000316 T - 1500) 4.184, кДж/моль,
(76)
51.
Теплоемкость смеси газов равна сумме произведений теплоемкостей еекомпонентов на их мольные доли:
C p xсpx yс py uс pu zс pz dс pd / 2, кДж / кг ,
(77)
Cv xсvx yсvy uсvu zсvz dсvd / 2, кДж / кг ,
где сvi и с pi – мольные теплоемкости при постоянных давлении и
объеме.
52.
4.3. Метод Ле-Шателье и МалляраСогласно этому методу предполагается, что кислород,
содержащийся в ВВ или порохе, сначала расходуется на окислениеCдоCO
, а оставшийся делится пополам и идет на окисление COдоCO2иH 2доH 2O
Для пороховых систем, имеющих элементный состав Ca H bOc N d , этот
принцип математически представляется зависимостями:
x (c a ) / 2
y a x,
z (b x) / 2.
В результате уравнение горения пороха имеет вид уравнения (62).
Вычисление элементного состава пороха через моли атомов a, b, c, d
осуществляется также как и в пп. 4.1 (метод Де-Поу и ОБ). Имея
элементный состав пороха и конечные продукты горения, удельную
теплоту сгорания пороха можно рассчитать на основе закона Гесса,
согласно которому тепловой эффект реакции равен разности между
суммой теплот образования продуктов реакции и суммой теплот
образования исходных веществ. Под теплотой образования понимают
то количество теплоты, которое выделяется или поглощается при
образовании определенного количества вещества из простых
элементов. Тепловой эффект при постоянном давлении называют
изменением энтальпии при реакции или просто энтальпией реакции и
обозначают через H. Иногда энтальпию называют полной энергией
системы, равной сумме внутренней энергии u и объемной энергии pv .
Разность энтальпий в двух состояниях системы равна тепловому
эффекту изобарного процесса. Энтальпия образования многих веществ
известны и они приведены в справочниках. Энтальпии образования
компонентов ВВ и продуктов сгорания в литературе приводятся при
53.
Т=291 К. Энтальпия образования экзотермической реакцииобозначается положительным знаком + H, а эндотермической - H. В
табл.3 приведены стандартные энтальпии образования некоторых
веществ.
H, кДж/кг
Вещество
Таблица 3.
Стандартные
энтальпии
образования
Нитратцеллюлозы
(1418-62.8 N)4.184
НГЛ
+372
ДНТ
+78.24
ДБФ
+867
Ц1
+133.5
Ц2
+90.0
В
+477
Вода (парообразная)
+241.5
Вода (жидкость)
+286
Углекислый газ
+400
Окись углерода
+110.52
Диамилфталат
+918
54.
Используя данные табл.3 для исследуемых компонентов были полученызависимости для определения энтальпии образования компонентов:
Н НЦ (1418 - 62,8 N)4.184n1/100,
Н НГЛ 372 n 2 / 22,7,
Н ДНТ 78,4 n 3 / 18,2,
Н ДБФ 867 n 4 / 27,8,
Н Ц1 133,5 n 5 / 26,8,
Н Ваз 477 n 6 / 21,2,
где n1 , n 2 , n 3, n 4 , n 5 , n 6– процентное содержание НЦ, НГЛ, ДНТ, ДБФ, Ц1 и
вазелина соответственно.
Энтальпия образования 1 кг пороха:
Н обр Н НЦ Н НГЛ Н ДНТ Н ДБФ Н Ц1 Н В , кДж / кг.
Энтальпии образования продуктов сгорания пороха CO2 , H 2иСO
соответственно определяются из уравнений:
Н1 x395 / 44, Н 2 u 231,5 / 18, Н3 y122 / 28, кДж / кг. , где 395, 231.5, 122
энтальпия образования перечисленных выше продуктов сгорания в кДж/кг.
Энтальпия образования водорода и азота равны нулю. Суммарная энтальпия
образования продуктов сгорания пороха:
Н гор Н1 Н 2 Н 3 , кДж / кг.
Определение удельной теплоты сгорания пороха при постоянном
давлении:
q p Н гор - Н обр , кДж / кг.
55.
Определим удельную теплоту сгорания пороха при постоянномобъеме. При эксперименте теплота химической реакции выделяется
при постоянном объеме и qv q p ,так как при изобарическом процессе
часть энергии химической реакции расходуется на работу расширения
газов от одного объема v1 до другого v2 . Работа расширения газов
определяется равенством pv2= 8.31441 291 / 1000, где =x+y+z+d/2 –
суммарное число молей продуктов сгорания; R=8.31441 Дж/(моль К) –
универсальная газовая постоянная; T2 291K– температура до которой
продолжается процесс расширения; 1000 – переводной коэффициент
Дж в кДж. Следовательно, qv q p pv2 .
Температура горения в этом методе определяется также как и в
методе Де-Поу и ОБ, т.е. методом последовательных приближений,
задавая различные значения Т с целью удовлетворения условию:
q p U c ,
где U c– определяется по уравнениям (71) и (72).
56.
4.4. Метод Бринкли и УилсонаВ основе метода Бринкли и Уилсона лежит допущение, согласно
которому вначале кислород окисляет водород до воды, затем
оставшийся кислород последовательно окисляет углерод до окиси
углерода и углекислого газа. При этом реакция горения записывается в
форме:
Ca H bOc N d xCO2 yCO uH 2O zC d / 2 N 2
где x c - a - b/2, y 2a - c b/2, u b/2, z 0 при c a b/2.
Если c a b/2, то x 0, y c b/2, u b/2, z a - c b/2.
Вычисление энергетических и баллистических характеристик
пороха проводится, как и в методе Ле-Шателье и Малляра, за
исключением определения значений x, y, z, u. Изменение внутренней
энергии углерода вычисляется по формуле du z = 6.4 T 4.184 / 1000
кДж/моль.
Следует отметить внимание на то, что по этому методу в
продуктах сгорания содержится свободный углерод.
57.
V. ПОГРЕШНОСТИ ЭНЕРГЕТИЧЕСКИХ ИБАЛЛИСТИЧЕСКИХ ХАРАКТЕРИСТИК ПРОДУКТОВ
СГОРАНИЯ ПОРОХОВ И
ТОПЛИВ. МЕТОД ОПРЕДЕЛЕНИЯ ПОГРЕШНОСТЕЙ
ХАРАКТЕРИСТИК ПОРОХОВ ОТ ПОГРЕШНОСТИ
МОЛЕКУЛЯРНЫХ ПОСТОЯННЫХ
Как было сказано ранее, пороха являются источником энергии,
приводящей в движение снаряд в ствольном огнестрельном оружии.
Основным показателем энергетических возможностей пороха является
количество тепла, выделяющееся при его сгорании в стволе оружия.
При этом одновременно образуются газообразные и конденсированные
продукты сгорания, нагретые до высоких температур и сжатые до
больших давлений. Расширяясь в объеме зарядной каморы и стволе
оружия, пороховые газы совершают определенную работу, которая
зависит от энергетических характеристик пороха и термодинамических
параметров продуктов сгорания. Основными характеристиками
работоспособности пороховых газов являются так называемая сила
пороха (f1 )и показатель процесса расширения пороховых газов при
выстреле . Эти параметры определяются путем термодинамического
расчета. При термодинамическом расчете используется либо
информация о химическом составе продуктов сгорания, либо
информация о зависимости баллистических характеристик порохов от
теплоты сгорания пороха при воде жидкой q v ( ж ). В свою очередь,q v ( ж )
связана с внутренней энергией (энтальпией) продуктов сгорания.
58.
Следует отметить, что баллистические параметры выстрела зависят нетолько от силы пороха и показателя , но и от других баллистических
характеристик пороха, таких как, скорость горения пороха. Кроме
скорости горения на процесс газообразования влияют форма и размеры
пороховых элементов.
С развитием методов расчета параметров продуктов сгорания
периодически внимание специалистов обращалось на то, как влияют
погрешности при определении термодинамических свойств веществ на
точность вычисления параметров процесса. В литературе достаточно
подробно описан общий метод оценки погрешностей расчетных
параметров, возникающих из-за погрешностей в данных по
термодинамическим свойствам и термическим константам
индивидуальных веществ. Однако, вопрос о влиянии молекулярных
постоянных компонентов смесей (атомов, молекул), используемых при
вычислении термодинамических свойств индивидуальных веществ, на
точность расчетов параметров процессов в известной авторам
литературе не рассматривался.
Поэтому было проведено исследование влияния погрешностей
молекулярных постоянных компонентов смеси на параметры
быстропротекающих процессов в камере ракетного двигателя и
процессов в ствольном оружии.
59.
При исследовании были сформулированы и решены ряд задач:был обоснован выбор величин ( qk – условная величина), погрешности
которых необходимо учитывать при расчете характеристик; обоснован
выбор наиболее значимых при проектировании двигателей и
ствольного оружия параметров продуктов сгорания и перечня
исследуемых объектов (топлив, порохов). Разработан алгоритм и
программная реализация предлагаемого метода оценки влияния
погрешностей молекулярных постоянных на параметры процессов в
ракетных двигателях и характеристики выстрела. Провести
моделирование процессов при термодинамическом расчете.
При решении сформулированных задач используются
термодинамические методы расчета параметров процесса, методы
статистической термодинамики, общий метод расчета равновесного
состава, методы расчета параметров выстрела, методика
термодинамического расчета продуктов сгорания без учета их
диссоциации по схеме для реального газа; расчет параметров выстрела
по методу Рябова А.С..
Известно, что при использовании идеального рабочего тела и
достижения идеальных условий организации и протекания процессов
погрешность рассчитанных величин свойств продуктов сгорания
определяется:
1)Математической погрешностью метода расчета;
2)Погрешностью в исходных данных о топливе, порохе (энтальпия и
элементный состав топлива, пороха);
60.
3)Погрешностью справочных данных по свойствам индивидуальныхвеществ.
Первые два случая рассматривались в литературе. Для
определения погрешностей, возникающих вследствие погрешностей
термодинамических свойств индивидуальных веществ (третий случай) в
известной автору литературе (публикации
немногочисленны)
принято
0
0
оценивать через погрешности I q (энтальпии), Sq (энтропии) и теплоту
образования HfTO 0 для каждого индивидуального вещества.
Погрешности энтальпии и энтропии приводят к соответствующим
погрешностям в равновесном составе и свойствах продуктов сгорания.
В свою очередь, погрешности равновесного состава и свойств
продуктов сгорания при расчете горения и расширения приводят к
погрешностям таких параметров ЖРД как температура торможения на
входе в сопло Tос , удельный импульс в пустоте Iу.п, расходный
комплекс и другие, а также баллистических характеристик выстрела,
таких как сила пороха, показатель процесса расширения пороховых
газов при выстреле, температура горения, скорость горения и т.д. При
этом принято, что погрешности I q 0, Sq 0 могут быть назначены
независимо друг от друга.
Как известно, величины термодинамических свойств газов энтальпия, энтропия взаимосвязаны через так называемые
0
молекулярные постоянные. Поэтому погрешности I q , Sq 0 не могут
назначаться независимо.
61.
Продукты сгорания топлив, порохов - газовые смеси, которыесостоят из атомов и молекул. Атомы обладают энергетическим
состоянием только одного типа, которое обусловлено движением
электронов в электрическом поле ядра атома. Энергетические
состояния двухатомных молекул связаны с движением электронов в
электрическом поле молекулы, с колебаниями ядер ее атомов друг
относительно друга и с вращением ядер относительно центра тяжести
молекулы.
В отличие от двухатомных молекул многоатомные молекулы, в
том числе наиболее простые, обладают значительно более сложными
системами энергетических состояний. Так же как у двухатомных
молекул, эти состояния обусловлены движением электронов молекулы,
колебаниями ядер ее атомов и вращением молекулы как целого
относительно центра тяжести молекулы. Кроме того, в нелинейных
многоатомных молекулах, состоящих из групп атомов, имеет место
внутреннее вращение.
В уравнения для определения электронной, колебательной и
вращательной энергий входят постоянные, называемые
молекулярными. Молекулярные постоянные вычисляются (особенно
для двух- и многоатомных молекул) часто по недостаточно точным
экспериментальным данным. Следовательно, при расчете
термодинамических свойств индивидуальных веществ в идеальном
состоянии (энтальпии, энтропии) с использованием статистических
сумм по энергетическим состояниям молекул (или атомов) возникают
определенные погрешности, которые потом сказываются на
дальнейших расчетах.
62.
Вопросы точности расчетных параметров рассматривались влитературе, но определение влияния погрешностей молекулярных
постоянных и теплоты образования на расчетные параметры не были
рассмотрены. В справочной литературе точность величин определяется
7 классами точности величин теплоты образования ( HfTO 0) и
0
приведенного термодинамического потенциала Ф T.Однако,
определить влияние погрешностей молекулярных постоянных на
характеристики продуктов сгорания в настоящее время достаточно
сложно, а в некоторых случаях практически невозможно. Поэтому
авторами предлагается оригинальная методика определения влияния
погрешностей молекулярных постоянных.
Была установлена взаимосвязь между погрешностями величин,
определяющих состав и свойства продуктов сгорания, в том числе и
молекулярные постоянные с выбранными параметрами процессов. При
постоянном элементном химическом составе
(78)
biт const , i 1, m
любой параметр (термодинамический) продуктов сгорания в камере
можно представить функцией энтальпии i и энтропии S смеси.
Последние, в свою очередь, определяются элементным химическим
составом, энтальпией топлива (пороха) i T , давлением. Поэтому,
погрешности в молекулярных постоянных индивидуальных веществ
приведут к изменениям термодинамических свойств веществ и, в
конечном итоге, к погрешностям параметров .
63.
Из зависимостей:I q H fT 0 ( H T H 0 ) ( HT 0 H 0 ),
0
Sq R0 ln( Q / N A ) R0T ( ln Qq / T ) p ,
0
0
H T H 0 R0T 2 ( ln Qq / T ) p ,
0
0
ln K j aij S A( i ) S j R0 aij I A( i ) I j R0T ,
i
0 0i
видно, что погрешности I q и Sq q-го вещества определяются
0
0
0
0
0
0
(79)
(80)
(81)
(82)
погрешностями ряда других величин-аргументов, условно
обозначаемых далее qk(k=1,2,…,n). В приведенных формулах: a ij число атомов химического элемента; S0 ( i ) , I A (i) - энтропия и энтальпия
атомарного вещества; S0j , I j - энтропияAи энтальпия молекулярного
вещества.
Определить параметр процесса при заданных значениях biT, iT , р
можно, представив его в виде функции:
[biT , iT , p,{Iq 0 , S q 0 }].
(83)
При заданных biT , iT , р погрешность параметра будет определяться
погрешностями термодинамических функций:
(84)
0
0
[{ Iq , S q }].
64.
Анализ выражений (79-82) показывает, что погрешностиэнтальпии и энтропии индивидуальных веществ взаимосвязаны и
зависят от погрешностей величин, определяющих теплоты образования
0
HfTO (термохимическая величина); логарифма статистической суммы
ln(Q/N A ) ; универсальной газовой постоянной R 0 ; числа Авогадро NA .
Из выше сказанного следует, что необходимо было разработать
метод, позволяющий оценивать погрешности в зависимости от
погрешности молекулярных постоянных, которые входят в расчетные
формулы для вычисления статистических сумм индивидуальных 0
веществ Q q, а также от погрешности теплоты образования HfTO .
Известно, что статистическая сумма по состояниям молекул
(атомов) газа выражается формулой:
Q(T) pi exp(( i 0 ) / kT ),
(85)
где i и 0 - энергия i-го состояния молекулы и ее нижнего (основного)
состояния ; p i - статистический вес i-го состояния ; k–постоянная
Больцмана.
Следовательно, молекулярными постоянными будут
параметры, определяющие значения энергий i , 0 и pi . Погрешность
постоянной Больцмана - несущественна. Небольшое влияние
оказывают и погрешности числа Авогадро NA и универсальной газовой
постоянной R 0 . Таким образом, задача сводится к нахождению0
взаимосвязи величин и погрешностей i , 0 , piи HfTO
параметров qk , определяющих величины:
0
(86)
[{ i , 0 , pi , H fT 0 }] ( qk )
65.
Из данного краткого рассмотрения видно, что определениепогрешностей параметров представляется сложной задачей
На основе выше изложенного и в рамках принятых моделей
свойств и процессов сформулируем постановку задачи: при небольших
значениях погрешностей qkпогрешность любого параметра процесса
представляет линейный функционал относительно qk:
(87)
qk
qk
q k
По выражению (87) можно оценить максимальную абсолютную
погрешность:
max
qk
q k
qk
max
(88)
Относительная погрешность (в процентах) определяется:
max
max
100
(89)
66.
Следующим этапом исследования является определениепроизводных( / qco ). Как видно, задача определения производных
( / qco ) в конечном итоге сводится к расчету производных
( / q ) p ,T ( =i или S). Производные ( / q ) p ,T определяются
из дифференцирования известных выражений для удельных энтальпий
I q0
i и энтропии S:
ln n
0
n
nq
nn I n
q
n
q
p,T ln M (90)
i
p,T
T
i
q
q
M
T
T
p,T
p,T
s
q
p,T
ln M
T
s
q
S q0
ln n
n
nq
nn
S n0 R0 1 ln nn
q
n
q
p,T
p,T
p,T
T M T
(91)
67.
где =1 - для индивидуальных веществ в газообразном состоянии; =0- для индивидуальных веществ в конденсированном состоянии; n индекс любого компонента (индивидуального вещества) продуктов
сгорания.
Для определения производных ( ln nn / q ) p ,Tи ( ln M T / q ) p ,T
была продифференцирована система уравнений химического
равновесия по q . В результате получилась замкнутая система
уравнений для расчета производных:
ln n j
ln n i
a ij
jq R j iq R i
q
q
p, T i
p, T
(92)
ln n j
ln ni
ln MT
aij n j ni Bi 0
q p,T
j,i
q p, T q p, T
(93)
68.
ln ni0
nn
n i j
q p ,T
где
ln K j
Ri
q (i)
p,T
ln K j
Ri
q ( j)
p, T
(94)
(95)
(96)
для молекулярных (i) и атомарных (j) индивидуальных продуктов
сгорания; iq , jq - символы Кренекера.
Таким образом, показано что, существенным этапом расчета
погрешностей и наиболее сложной задачей является установление
зависимостей величин R от «молекулярных» постоянных и теплоты
образования. Допустим, нам необходимо вычислить зависимость
величины R от «молекулярных» постоянных для атомарного
индивидуального вещества.
69.
Для этого воспользуемся формулами (79)-(82) и формулой определениявнутренней составляющей статистической суммы для одноатомных
газов:
hc (i)
Qвн pi exp
Te ,
(97)
kT
i
p
где i -статистический вес i-го состояния атома (молекулы); -энергия iго электронного состояния атома (молекулы), отсчитанная от его
основного состояния; hc / k c2 - радиационная постоянная; Ттемпература. Если в качестве qk взять статистический вес i-го
состояния (pi ) атома (молекулы), то можно получить следующие
зависимости:
ln K j
i 0
Ri
aij exp
p
kT
i (i )
i 0
i pi exp kT (98)
Для атомарного кислорода в справочнике приводятся такие уровни
энергии электронных состояний и p :
i
70.
pipi
pi
pi
pi
5
3
1
5
1
Te(i)=0 см-1
Te(i)=158.265 см-1
Te(i)=226.977 см-1
Te(i)=15867.862 см-1
Te(i)=33792.583 см-1
и, следовательно, для каждого i-го уровня необходимо вычислить:
ln K j
Ri
p i
(i)
т.е. 5 раз определяются величины производных
аналогичным образом вычисляются:
ln K
j
Ri
(i )
Te(i )
и
Ri . Затем,
ln K j
Ri
(hc k ) (i)
для каждого i-го уровня. Как видно из выше изложенного, процесс
определения Ri для атомов (в данном случае для О), длителен, сложен
и трудоемок.
71.
При вычисленииln K
ln K j
j
Rj
, Rj
(i )
pi
Te(i)
(i)
и
ln K j
Rj
(hc k ) (i)
для двух и многоатомных молекул этот процесс становится еще более
сложным и не эффективным. Поэтому целесообразно в качестве qk
взять либо логарифм статистической суммы по состояниям молекулы
(атома), либо теплоемкость, так как в выражения для определения этих
параметров входят молекулярные постоянные, указанные выше.
Например, если в качестве qk выбрать логарифм статистической
суммы ln( Q / N ),то значения величин для Ri , R j в правой части
уравнения (92) можно определить по формулам (94), (95) и в
результате получим Ri aij , R j 1.
В качестве объекта исследования пороховых зарядов были выбраны
пороха баллиститного типа НДТ – штатные и модифицированные.
Определены основные баллистические и энергетические
характеристики порохов по методу Рябова А.С., методу Де-Поу и ОБ,
методу Ле-Шателье и Малляра, методу Бринкли и Уилсона.
Сравнительные результаты расчетов энергетических и
баллистических характеристик пороха приведены в табл.4.
72.
Таблица 4Сравнительные результаты расчетов энергетических и баллистических
характеристик пороха, полученные разными методами
Характеристики
Де-Поу и
ОБ
ЛеШателье и
Малляра
Бринкли и
Уилсона
Рябов А.С. Без учета
диссоциации
qv ,
3233.12
2928.30
3738.14
2972.63
U c ,
3237.99
2934.67
3740.30
2185.51
2162.81
T, К
2780.00
2485.00
2925.00
2456.31
2528.84
, Нм/кг
941776.98
912942.81
730443
П, Нм/кг
3721830.33 3532820.65 3183861.05
кДж/кг
кДж/кг
0.253
0.258
0.229
x, моль/кг
2.95
4.26
0
y, моль/кг
22.00
20.68
17.18
933184.33 979486.23
0.362
0.359
73.
ХарактеристикиДе-Поу и
ОБ
ЛеШателье и
Малляра
Бринкли и
Уилсона
Рябов А.С.
u,
моль/кг
5.57
4.26
16.27
z, моль/кг
10.70
14.15
7.76
v, м 3/кг
0.91
0.99
0.67
0.021
a
24.94
24.94
24.94
24.91
b
32.55
32.55
32.55
32.08
c
33.46
33.46
33.46
33.46
d
10.16
10.16
10.16
9.51
0.099
0.103
0.093
0.102
Без учета
диссоциации
0.003
74.
Погрешности характеристик пороха и параметров выстрела(максимального давления и др.) от погрешности молекулярных
постоянных:
производная удельной теплоты сгорания:
где = ln(Q/N);
qv ( ж )
U
i
qv ( ж )
84.8
производная силы пороха: f1
(99)
производная температуры горения:
qv ( ж )
Т
0.5
(100)
(101)
производная показателя состояния пороховых газов:
Т
- 0,00001283 1
0,3290714
(102)
75.
производная коволюма:qv ( ж )
0.000012
(103)
Затем по формулам (88), (89) определяем величину максимальной
абсолютной и относительной погрешности параметров выстрела.
Независимо от метода определения параметров выстрела и
характеристик пороха их погрешности будут одни и те же, т.к. при
горении пороха образуются одни и те же продукты сгорания.
Для пороха марки НДТ в таблицах приведены максимальные
абсолютные погрешности баллиститных характеристик от погрешности
молекулярных постоянных для каждого компонента продуктов
сгорания:
76.
Таблица 5Величина погрешности удельной теплоты сгорания
(q v ( ж) 2972,628кДж / кг )
N, %
11,5
12
12,5
13
13,5
1
2
3
4
5
6
H2
0,198237
0,194978
0,191719
0,188435
0,185176
O2
0,5068
0,504244
0,501682
0,4991
0,496538
N2
1,0371
1,04309
1,048998
1,054951
1,060859
OH
0,282
0,282697
0,283047
0,283399
0,283749
CO
0,329
0,3207
0,311822
0,302876
CN
0,6228
0,63009
0,637313
0,64459
NH
0,5905
0,589221
0,587908
0,586586
H2O
0,52337
0,531576
0,539769
0,548024
CO2
2,51
2,506735
2,515437
2,524207
CO
0,329
0,3207
0,311822
0,302876
0,293998
CN
0,6228
0,63009
0,637313
0,64459
0,651813
NH
0,5905
0,589221
0,587908
0,586586
0,585273
77.
Продолжение табл.5N, %
11,5
12
12,5
13
13,5
1
2
3
4
5
6
H2 O
0,52337
0,531576
0,539769
0,548024
0,556217
CO2
2,51
2,506735
2,515437
2,524207
2,53291
HCN
0,0465
0,050944
0,0554
0,059891
0,064348
HCO
6,3463
6,358077
6,369867
6,381748
6,393538
H
0,39635
0,408164
0,419963
0,431853
0,443652
O
0,8473
0,856186
0,865076
0,874034
0,882924
N
0,8747
0,88194
0,889165
0,896445
0,90367
Сумма
15,11095
15,15864
15,21717
15,27614
15,33467
78.
Таблица 6Величина погрешности силы пороха (f1 933184,927217 Дж / кг )
N, %
11,5
12
12,5
13
13,5
H2
16,81054
16,53417
16,2578
15,9793
15,70293
O2
42,976
42,75988
42,54261
42,32366
42,10639
N2
87,9505
88,45401
88,95502
89,45988
89,96088
OH
23,9424
23,97271
24,00237
24,03226
24,06191
CO
27,9474
27,19538
26,44253
25,68389
24,93104
CN
52,8177
53,43166
54,04411
54,66126
55,27371
NH
50,0758
49,96592
49,85463
49,74248
49,63119
H2 O
44,38165
45,07763
45,77237
46,47245
47,16718
CO2
212,715
212,5711
213,3091
214,0527
214,7907
HCN
3,9421
4,32002
4,69794
5,078766
5,456686
HCO
538,1651
539,1649
540,1647
541,1722
542,172
H
33,61074
34,61228
35,61286
36,62114
37,62173
79.
Продолжение табл.6N, %
11,5
12
12,5
13
13,5
O
71,8487
72,60458
73,35843
74,11807
74,87192
N
74,174
74,78849
75,40115
76,01852
76,63118
Сумма
1281,357
1285,453
1290,416
1219,398
1300,38
80.
Представим результаты уточненных значенийтермодинамических функций компонентов продуктов сгорания, а
именно энтальпии от погрешности молекулярных постоянных. Для
этого продифференцируем выражение (63) по первой производной
статистической суммы ( ln Qq / T ) pи воспользуемся формулой (72)
для определения максимальной абсолютной погрешности энтальпии.
Таблица 7
Уточненные значения энтальпий при Т = 2456,314 К
Компонент
I 0 q(кДж/кг)
I 0 q(кДж/кг)
H2
69130,392
40,0014
O2
76872,164
40,0014
N2
17414,346
40,0014
OH
109088,985
40,0014
CO
-37016,974
40,0014
CN
446936,068
40,0014
NH
411491,808
40,0014
81.
Продолжение табл.7Компонент
I 0 q(кДж/кг)
I 0 q(кДж/кг)
H 2O
-144295,3214
40,0014
CO2
-274197,5673
40,0014
HCN
241206,2404
40,0014
HCO
82431,6999
40,002
H
263019,3901
40,0014
O
294621,95
40,0014
N
5179058,58
40,0014
82.
Как видно, влияние молекулярных постоянных набаллистические и энергетические характеристики (удельную теплоту
сгорания, силу пороха, коволюм и т.д.) баллиститных порохов – НДТ
существует. Было установлено, что погрешность энергии
поступательного движения молекул (атомов) в основном зависит от
погрешности физических постоянных, которые составляют сотые доли
процентов от этой составляющей и показано, что основной вклад в
суммарную погрешность вносит внутреннее движение атомов (молекул)
( Be , e xeи т.д.). Для пороха марки НДТ были вычислены значения
энергетических и баллистических параметров и их абсолютные
f1= 933184,927217
погрешности: q v ( ж )=2972,628 15,33467 кДж/кг;
3
1300,38 Дж/кг; = 0,102428 0,000174 м /кг; Т =2456,314 7,667332
К. Также было установлено, что: с увеличением процентного
содержания азота в коллоксилине наблюдается рост погрешности
характеристик пороха и основных параметров выстрела; наибольшую
погрешность вносят многоатомные компоненты (HCO, HCN), т.е.
малоизученные компоненты; с повышением температуры наблюдается
рост погрешности внутренней составляющей статистической суммы.
В заключении можно сказать, что влияние молекулярных
постоянных довольно существенно и его необходимо учитывать при
разработке новых высокоэнергетических составов, вновь
синтезируемых взрывчатых веществ и при проектировании РД.
83.
ЛИТЕРАТУРА1.Термодинамические свойства индивидуальных веществ:
Справочник/ Под ред.В.П.Глушко. 3-е изд. – М.: Наука, 1985.
2.Справочник физико-химических величин компонентов и
основных продуктов сгорания порохов и твердых ракетных топлив/ Под
ред.С.Н.Данилова. – М.: Машиностроение, 1970. – 295 с.
3.Лебедева Ю.А., Стесик А.И. и др. Термодинамические свойства
ВВ и компонентов топлив. – М.: ИХФ АН СССР, 1981. – 73 с.
4.Термодинамические и теплофизические свойства продуктов
сгорания: Справочник в 10-ти томах. Т.1/Под ред. В.П.Глушко. - М.:
Изд-во ВИНИТИ АН СССР, 1971. - 266 с.
5.Термодинамические свойства индивидуальных веществ:
Справочник в 2-х томах. Изд.2-е./Под ред. акад. В.П.Глушко. - М.: Издво АН СССР, 1962.
6. Термодинамические свойства индивидуальных веществ:
Справочные издания в 4-х томах. Т1. Кн.1. Методы расчета. Вычисления
термодинамических свойств. - М.: Наука, 1978. - 496 с.
7.Липанов А.М. Теоретические основы обработки твердых
ракетных топлив – Ижевск: Изд-во инст.прикл.хим.-физики УРО РАН,
2003. – 100 с.
8.Расчет энергетических и баллистических характеристик
порохов: Учебно-методическое пособие/Р.Ш.Гайнутдинов, Б.М.Казбан,
А.В.Косточко:КГТУ, Казань, 2000. 52 с.







































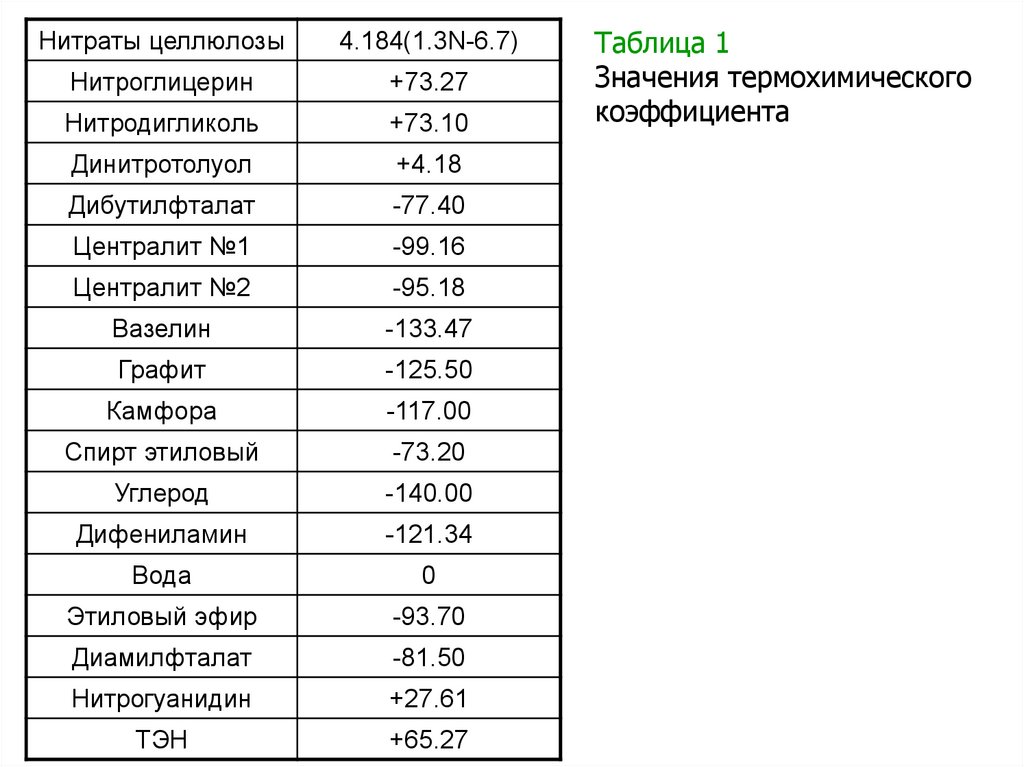












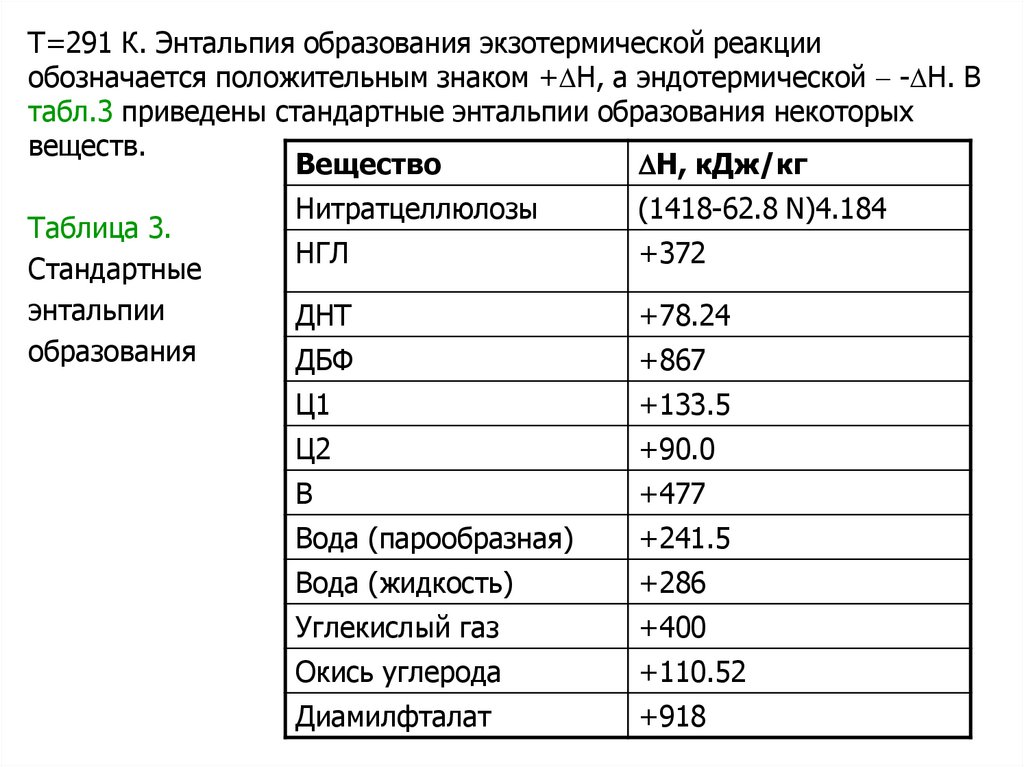












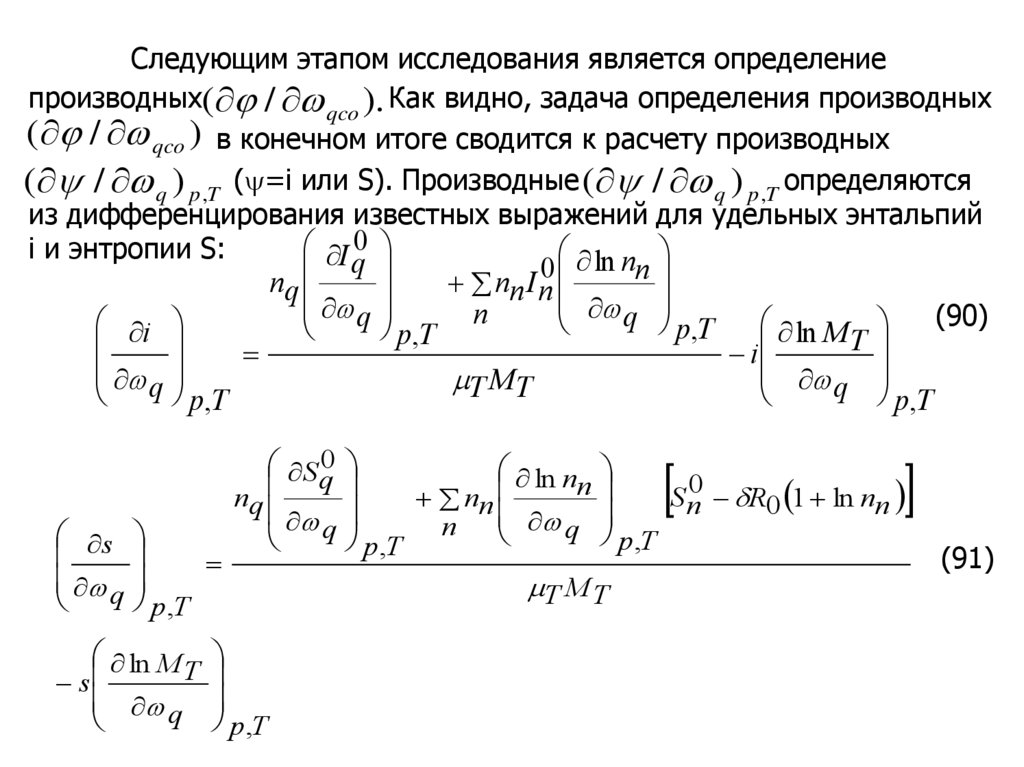





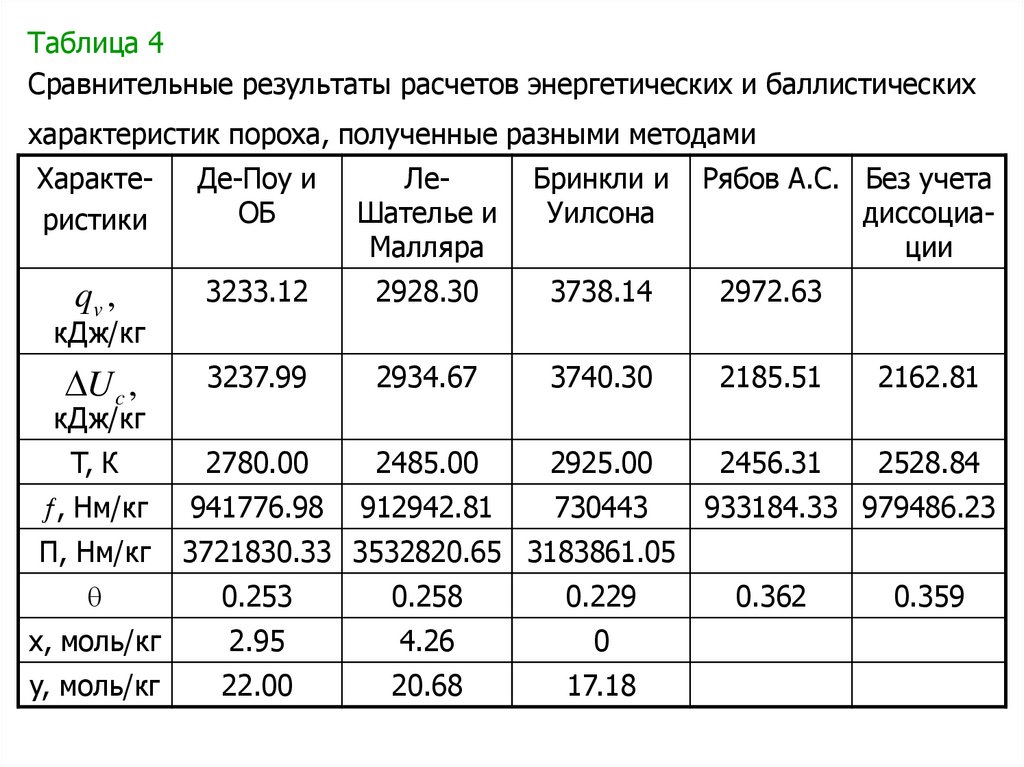
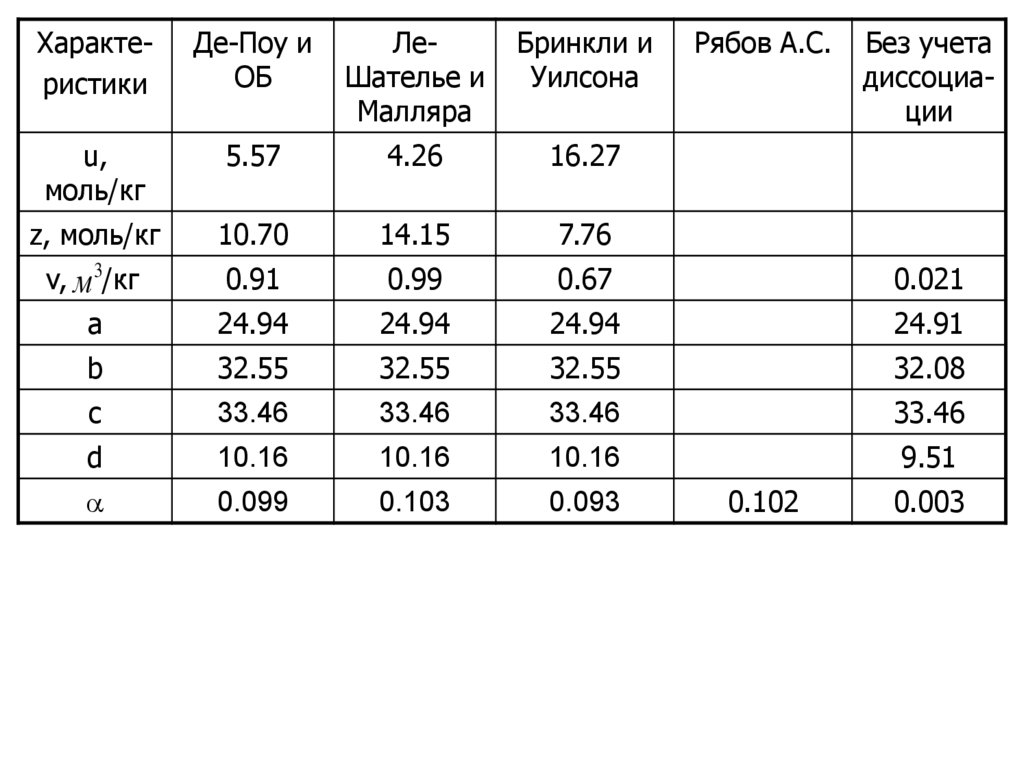


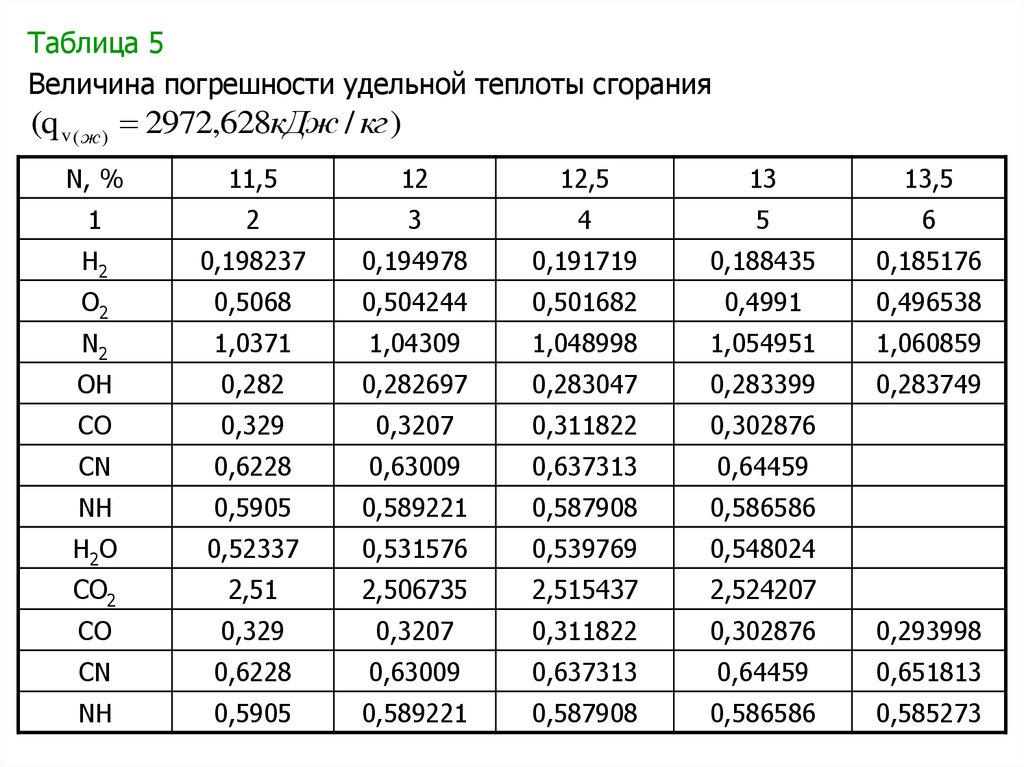
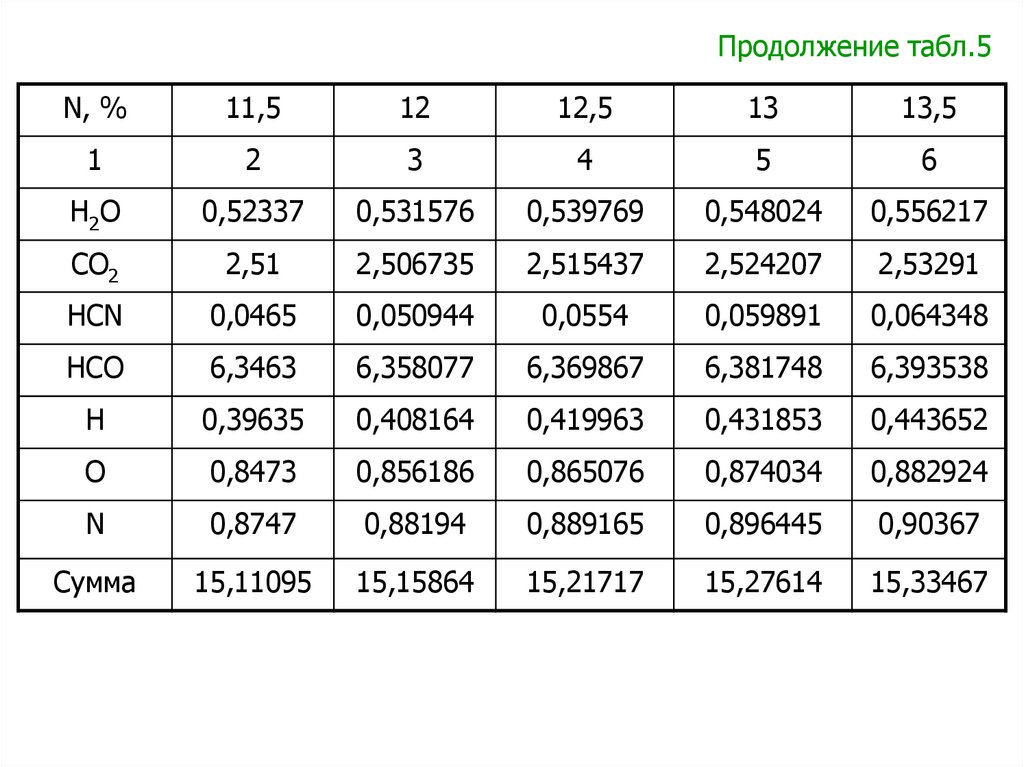

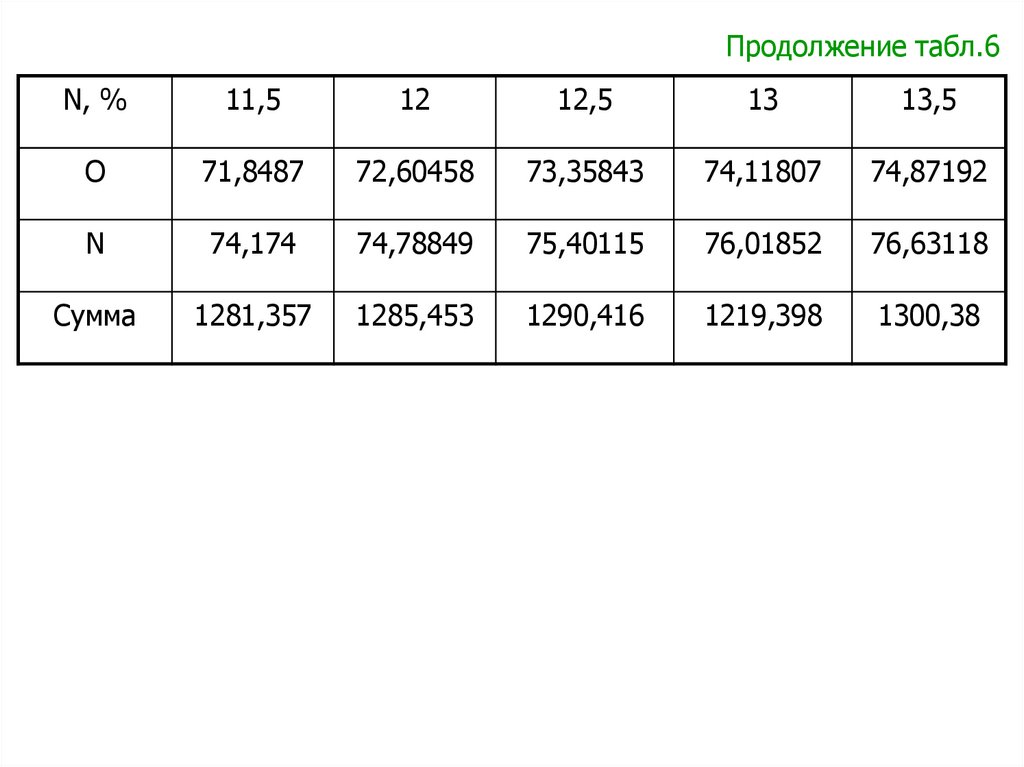
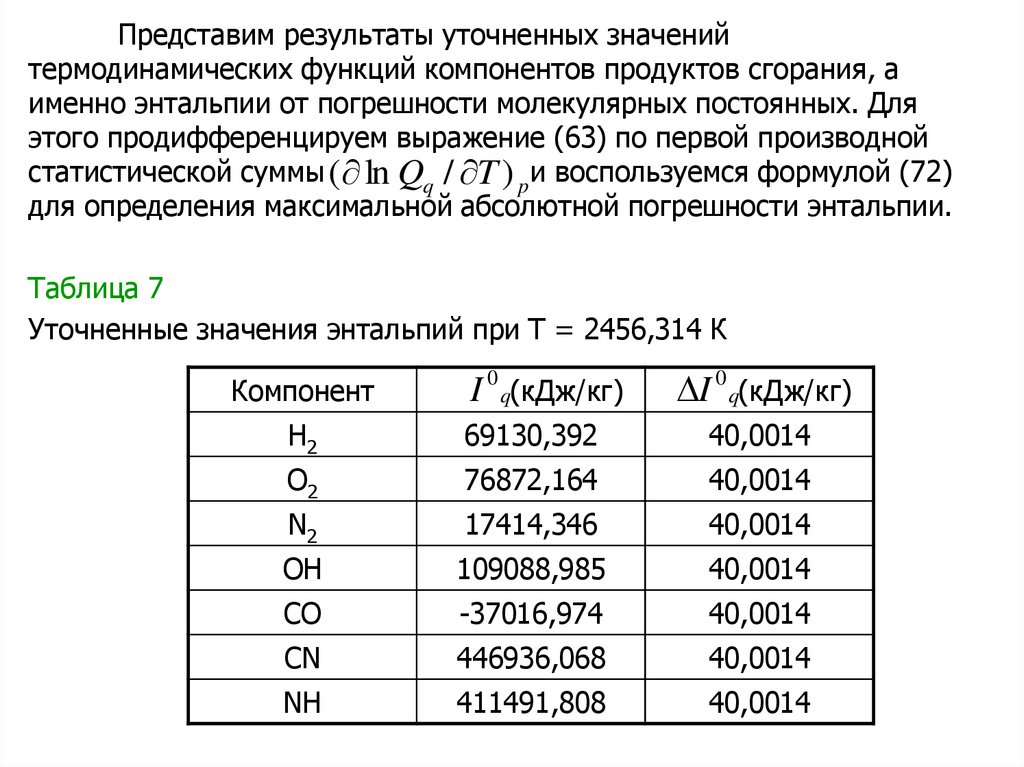
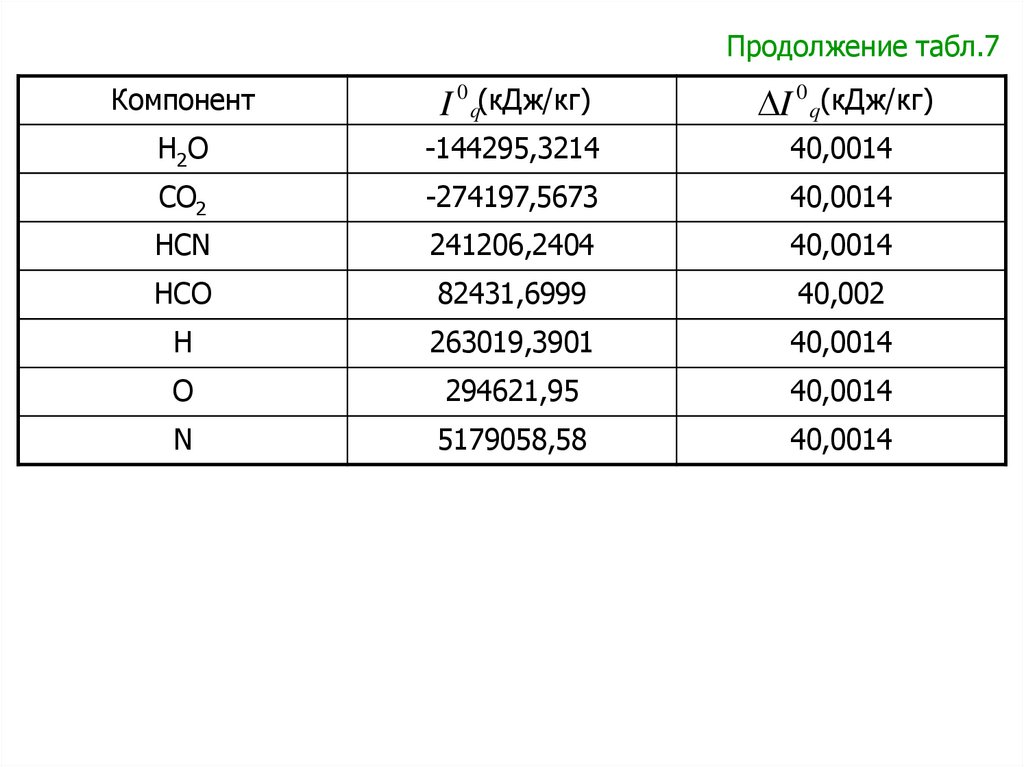


 warfare
warfare








