Similar presentations:
Кислоты. Оксиды
1.
2.
Крапиващавель
3.
оксидыоснования
кислоты
HCl, HNO3, H2SO4,
Ca(OH)2, K2O, Na2O,
Al2O3, Zn(OH)2, Fe(OH)3
4.
оксидыK2O,
Na2O,
Al2O3
основания
кислоты
Ca(OH)2 H2SO4,
Zn(OH)2 HCl,
Fe(OH)3 HNO3
5.
HF – фтороводороднаяHCl - хлороводородная(соляная)
HBr – бромоводородная
HI - йодоводородная
H2S - сероводородная
HNO3 - азотная
HNO2 - азотистая
H2SO4 - серная
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3 - кремниевая
H3PO4 - фосфорная
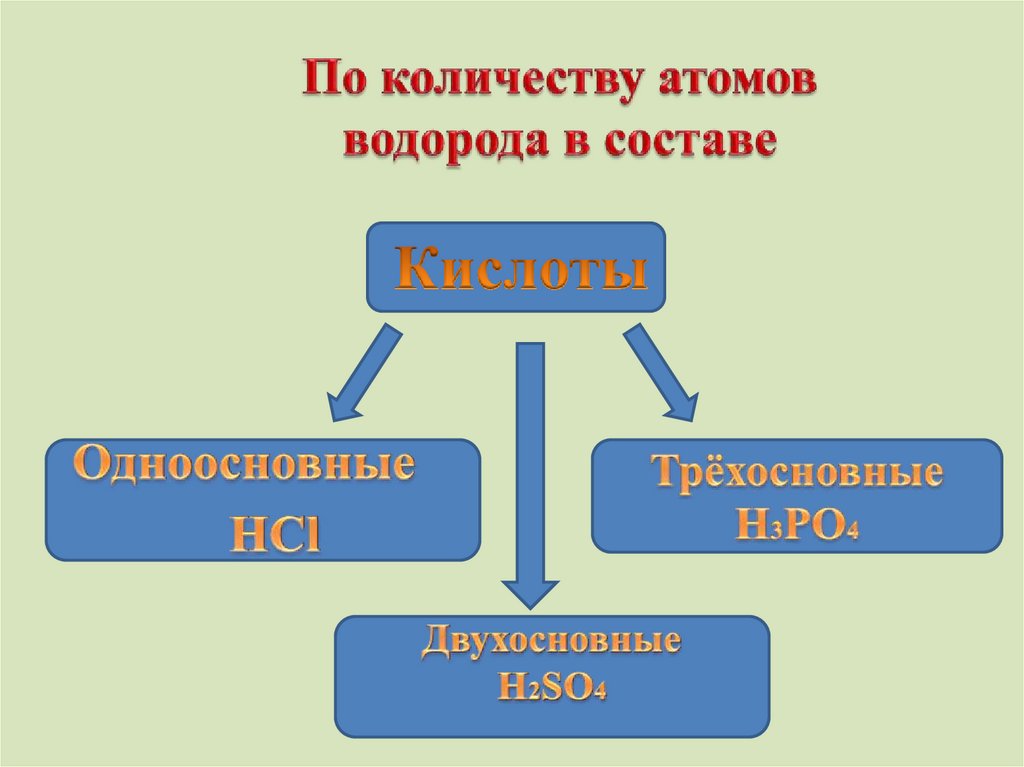
Кислоты – это сложные вещества, молекулы которых
состоят из атомов водорода и кислотного остатка.
6.
H2SO47.
По какому признакукислоты разделены на группы
HF - фтороводородная
HCl - хлороводородная
HBr - бромоводородная
HI - йодоводородная
H2S - сероводородная
HNO3 - азотная
HNO2 - азотистая
HClO4 - хлорная
H2SO4 - серная
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3- кремниевая
H3PO4 - фосфорная
H3BO3 - борная
8.
9.
По какому признакукислоты разделены на группы
H3PO4 - фосфорная
HF - фтороводородная
H3BO3 - борная
HCl - хлороводородная
HBr - бромоводородная
HI - йодоводородная
HNO3 - азотная
HNO2 - азотистая
H2S - сероводородная
HClO4 - хлорная
H SO - серная
2
4
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3 - кремниевая
10.
11.
12.
Угольная и сернистая кислоты - H2CO3 и H2SO3 всвободном виде не существуют, т.к. они разлагаются
на воду и соответствующий оксид.
H2CO3
H2SO3
H2SiO3
CO2 + H2O
SO2 + H2O
SiO2 + H2O
13.
14.
15.
16.
• По агрегатномусостоянию:
- Жидкие
- Твердые (H3PO4, H2SiO3)
17.
Серная кислотаБесцветная жидкость, вязкая как масло, тяжелее
воды. Растворять кислоту в воде необходимо
очень осторожно, вливать кислоту в воду тонкой
струйкой, а не наоборот, т.к. при смешивании
кислоты и воды выделяется большое количество
теплоты и вода может просто вскипеть и
выплеснуться на руки, лицо, одежду. Серная
кислота обугливает древесину, бумагу, кожу,
ткани.
18.
Правила техники безопасности приработе с кислотами
Не нюхать!
Не пробовать!
Не разливать!
О любых
проблемах
сообщать
учителю!
19.
НазваниеОкраска
Окраска
индикатора индикатора в индикатора в
нейтральной
щелочной
среде
среде
Лакмус
Метиловый
оранжевый
фиолетовый синий
оранжевый Желтый
Окраска
индикато
ра в
кислой
среде
красный
Краснорозовый
Фенолфтале бесцветный малиновый бесцвет
ин
ный
20.
21.
Взаимодействие с основаниями с образованием
соли и воды (реакция нейтрализации)
НСI + NaOH = NaCI + H2O
HNO3 + Fe(OH)2 = Fe(NO3)2 + 2H2O
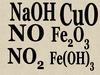
Взаимодействие с оксидами металлов:
CuO + H2SO4 = CuSO4 + H2O
Взаимодействие с металлами, стоящими до Н
(смотрим ряд напряжения металлов)
Zn + 2HCI = ZnCI2 + H2
Взаимодействие с солями:
H2SO4 + BaCI2 = BaSO4 +2НСI (должен выпасть осадок или
поучиться газ)
22.
Найти степень окисления всех элементов исоставить формулы соответствующих
оксидов
HNO3 HNO2 H2SO4 H2SO3 H2CO3 H2SiO3H3PO4 -
23.
Домашнее задание§ 39 (уч.8 класса) ,упр 4,6
Выучить информацию
по данной презентации
Поработать с тренажерами





















 chemistry
chemistry