Similar presentations:
Возбудители ОРВИ
1.
Возбудители ОРВИЗав.кафедрой
д.м.н., профессор
Г.И.Чубенко
2.
ОРВИОколо 40 млн. человек ежегодно болеют
острыми респираторными вирусными
инфекциями. Каждый третий житель
планеты.
Вирус гриппа и возбудители ОРЗ
сокращают среднюю продолжительность
жизни приблизительно на 10 лет.
3.
Среди возбудителей ОРВИнасчитывается более 200 вирусов.
5 семейств РНК-содержащих
вирусов:
Orthomyxoviridae,
Paramyxoviridae,
Coronaviridae,
Reoviridae,
Picornaviridae
и 1 семейство ДНК-содержащихAdenoviridae.
4.
Этиологическая структура ОРВИ сезон2016-2017 гг.
5.
Миксовирусы2 семейства:
Orthomyxoviridae:
род Influenzavirus А
род Influenzavirus В
род: Influenzavirus С
Paramyxoviridae:
род Paramyxovirus (парагриппа 1,3 типов)
Род Rubulavirus (парагриппа 2,4 типов,
эпидемического паротита)
Morbillivirus ( кори)
Pneumovirus ( РСВ)
6.
Общая характеристикамиксовирусов
геном представлен одноцепочечной РНК;
имеют спиральный нуклеокапсид;
вирионную транскриптазу;
содержат поверхностные гликопротеины;
могут обладать гемагглютинирующей
активностью;
обладают нейраминидазной активностью;
характерно слияние вирусной оболочки с
клеточной мембраной
7.
Вирусы гриппаГрипп (от франц. gripper схватывать) название предложено
врачом Сабажем в 19 веке).
Синоним итальянское - инфлуенца
8.
Известно 3 типа вируса гриппаобозначаемых А,В,С.
Крупные пандемии: 1907, 1918, 1929,
1957, 1958, 1977 годы.
Из них самой значительной стала в 1918
год - грипп “испанка” с очень высокой
летальностью. Во время нее от гриппа
умерло 20 млн. человек.
9.
Морфология вируса гриппа АВирион сферической формы, диаметром 80-120 нм.
Капсид имеет спиральный тип симметрии.
Содержит РНК, снаружи покрыт белковой
оболочкой
РНК состоит из 8 фрагментов содержащих 10 генов.
Вирус гриппа кодирует 3 белка оболочки
Суперкапсид содержит липопротеиновую мембрану
клетки хозяина. На поверхности находятся
гликопротеины – 2 белка - фермента. Они встроены
в виде шипов:
10.
Гемагглютинин (НА)Этот фермент имеет сродство к
мукопротеидным рецепторам клеток,
обеспечивает адсорбцию вируса на
чувствительных клетках и агглютинацию
эритроцитов.
Различают 15 антигенных типов
гемагглютинина. У человека встречаются
антигенные варианты:
НА0, НА1,
НА2, НА3
11.
12.
Нейраминидаза (NA)Фермент расщепляющий нейраминовую
кислоту. Способствует проникновению
вируса и участвует в созревании вируса.
Известно 10 типов нейраминидаз, у вирусов
гриппа А человека - 2 антигенных типа
нейраминидазы N1 и N2.
Определяет эпидемические и
пандемические свойства
вирусов.
13.
Антигенные свойства вирусагриппа А.
S-антиген, внутренний антиген связан с нуклеопротеидом (NP –белок
и М-белки). По S-антигену вирусы
гриппа разделяются на три типа А, В,
С.
V-антиген - поверхностный антиген
определяется гемагглютинином и
нейраминидазой.
14.
Изменчивость вируса гриппа АСегментарным геномом
Разновидностями поверхностных
гликопротеинов
Вариабельностью фенотипов
гемагглютинина и нейраминидазы
15.
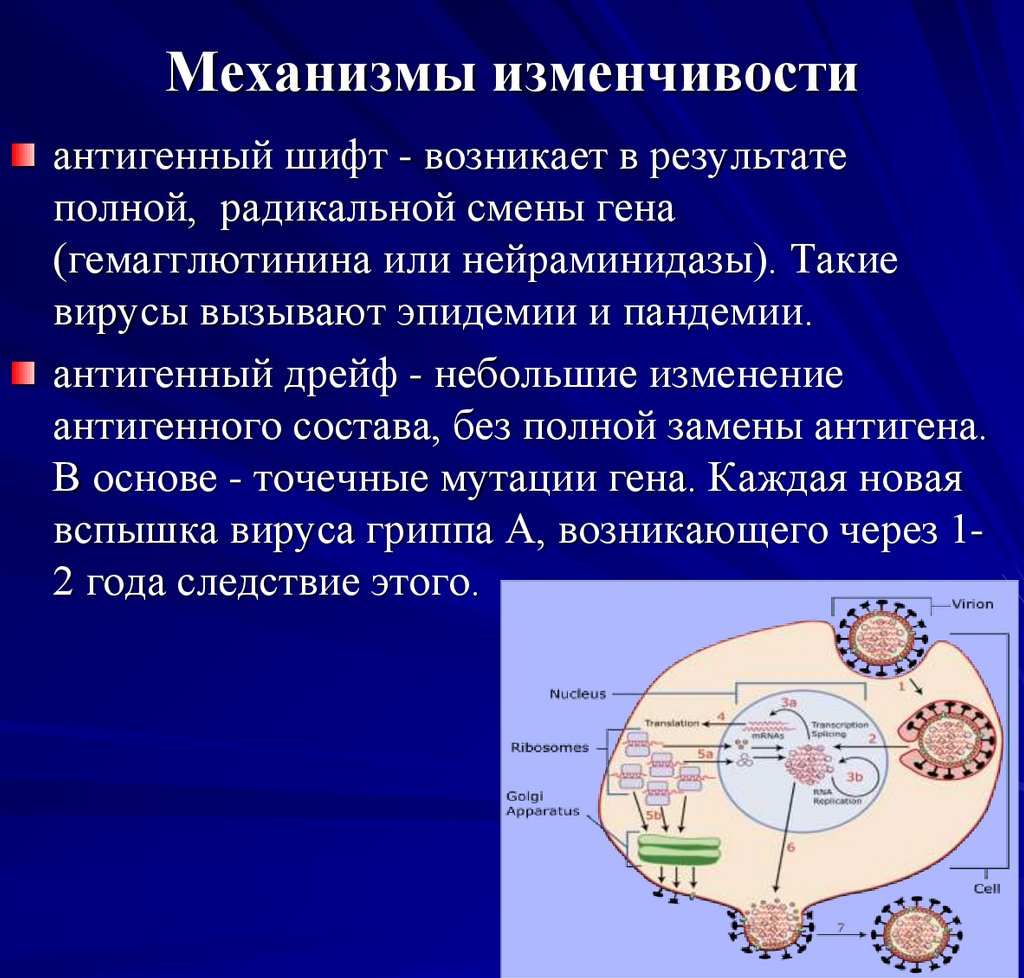
Механизмы изменчивостиантигенный шифт - возникает в результате
полной, радикальной смены гена
(гемагглютинина или нейраминидазы). Такие
вирусы вызывают эпидемии и пандемии.
антигенный дрейф - небольшие изменение
антигенного состава, без полной замены антигена.
В основе - точечные мутации гена. Каждая новая
вспышка вируса гриппа А, возникающего через 12 года следствие этого.
16.
Вирусы гриппа В и С имеют болеестабильные антигены
17.
Согласно рекомендации ВОЗ вирусыгриппа обозначают следующим
образом:
А /Хабаровск /90 /77 (Н1N1)
Серотип вируса, вид хозяина, место
выделения, номер штамма, год его
выделения и фенотип гемаггютинина
и нейраминидазы
18.
Культивированиев куриных эмбрионах, инфицирование
производят в амниотическую и
алантоисную полости. В них вирус
репродуцируется в течение 36-48 часов.
в культуре клеток первично
трипсинизированных. В клеточных
культурах вирус оказывает слабое
цитопатическое действие.
19.
Транскрипция и репликациявирусного генома
осуществляется в ядре клетки. Транскриптаза
вируса гриппа использует м-РНК клетки.
Каждый из фрагментов генома вируса
транскрибируется и реплицируется
самостоятельно.
Синтез вирусоспецифических белков
осуществляется на рибосомах. Капсидные
белки, поступают в ядро из цитозоля.
20.
В ядре клетки синтезируется 3 типавирусоспецифических РНК
позитивные комплементарные РНК
(м-РНК) используемые для синтеза
вирусных белков
полноразмерная комплементарная РНК
(к-РНК), которая служит матрицей для
синтеза вирионных РНК
негативная вирионная РНК (в-РНК),
которая является геномом для вновь
синтезированных вирионов.
В состав вириона включается только
негативная РНК.
21.
РезистентностьВирус не устойчив во внешней среде:
быстро разрушается при температуре
60оС, Уф-излучении, действии
дезинфицирующих веществ, эфира,
детергентов.
При комнатной температуре вирус
жизнеспособен в течение суток, на
металлических предметах- до 2-х суток.
Длительно сохраняется при низких
температурах. При температуре - 60оС.
сохраняет устойчивость 2-3 года.
22.
ПатогенезПуть заражения - воздушно-капельный.
Ворота инфекции - верхние дыхательные
пути.
Инкубационный период короткий (1-3дня).
Вирусы гриппа человека вызывают
заболевания только у человека
23.
Резервуаром инфекции могутслужить животные (кошки, собаки,
птицы). Вирус может проникать в
организм животных и менять там
свою антигенную структуру.
24.
Вирус птичьего (куриного) гриппаH5N1
Птичий грипп – вызываемая подтипом
вируса А. Природный резервуар –
водоплавающие птицы.
Подтипы A/H5N1, A/H7N7, A/H9N2.
Первый случай выделения вируса H5N1 у
людей зарегистрирован в 1997 году в
г.Гонконге.
В 2004 году вирус птичьего гриппа (H5N1)
получил более широкое распространение.
25.
Доказано, что вирус (H5N1) претерпел 2мутации.
Первая в виде мутации - делеции 5
аминокислот (с 80 по 84-ю) в
поверхностном белке, в грибовидной
части гемагглютинина;
Вторая мутация выявлена в ножке
нейраминидазы и тоже по типу
делеции (20 аминокислот).
Данные мутации позволили вирусу не
только адаптироваться к организму
кур, но и приобрести выраженные
инфекциозные свойства в отношение
человека.
26.
Вирус свиного гриппаА(Н1N1)sw
Впервые выделен в марте-апреле
2009 г. Калифорния
А(Н1N1) /Калифорния/04/09
12.6.2009 г. ВОЗ объявлено о
пандемии
27.
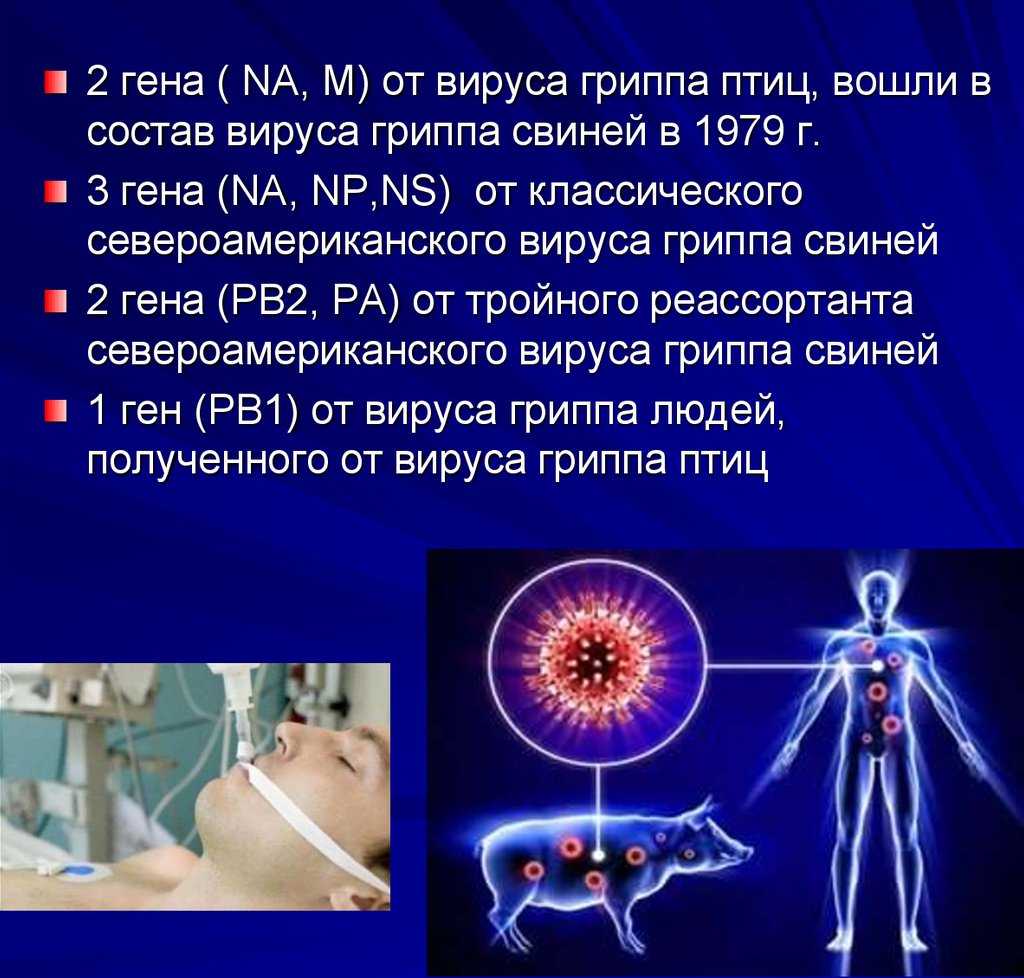
2 гена ( NA, M) от вируса гриппа птиц, вошли всостав вируса гриппа свиней в 1979 г.
3 гена (NA, NP,NS) от классического
североамериканского вируса гриппа свиней
2 гена (РВ2, РА) от тройного реассортанта
североамериканского вируса гриппа свиней
1 ген (РВ1) от вируса гриппа людей,
полученного от вируса гриппа птиц
28.
Этиопатогенез гриппаВирусы гриппа имеют сродство к цилиндрическому
эпителию верхних дыхательных путей, где и
происходит его репродукция.
Скорость репродукции вируса очень высокая и за 2-3
часа популяция вирусов на несколько порядков
возрастает.
Дегенеративно-дистрофические изменения
(разрушение ворсинок, пикноз и фрагментация ядер,
набухание и вакуолизация цитоплазмы), что
проявляется отеком и некрозом клеток.
29.
При распространенном процессе нарушаетсямикроциркуляция вследствие повышенной
проницаемости и ломкости сосудов, нарастает отек и
кровоизлияния.
Развивающаяся вирусемия и токсинемия
обусловливают развитие лихорадки.
Токсинемию усиливают соединения, выделяющиеся
при распаде клеток (гистамин, ацетилхолин).
Поражается сердечно-сосудистая система и нервная
система. Частым осложнением является острая
сердечно-сосудистая недостаточность обусловленная
инфекционно-токсическим шоком.
30.
31.
Инфекция опасна своимиосложнениями:
Вирусной пневмонией,
Поражением почек, кишечника
Печени, кроветворных органов и др.
32.
Важное значение принадлежит местнойзащите (интерферону). Интерферон
начинает вырабатываться клеткой, когда
она поражается вирусом. Способность
продуцировать интерферон, стимулирует
высокая температура тела и накопление
недоокисленных метаболитов.
Главная роль в выздоровлении от гриппа
принадлежит антителам против антигенов
и ферментов вируса.
33.
ИммунитетНапряженный, типо- и штаммо- специфический,
связанный с выработкой противовирусных АТ к
гемагглютинину и нейраминидазе.
С 9-10 дня заболевания в крови и носовом секрете
идет накопление вируснейтрализующих АТ
SIgA.
Наблюдается выработка гуморального
иммунитета, накопление вирулицидных и
вируснейтрализующих АТ IgМ и IgG.
Клеточный иммунитет обеспечивается
макрофагами и Т-цитотоксическими клетками.
34.
Продолжительностьпостинфекционного иммунитета:
грипп А до 2-3 лет,
грипп В – 3-5 лет,
грипп С- пожизненный.
Новорожденные обладают пассивным
иммунитетом в течение 6-8 месяцев,
обусловленным IgG.
35.
Лабораторная диагностикаУчитывает связь с эпидемией,
высокую контагиозность, короткий
инкубационный период с внезапным началом
заболевания и максимумом клинических
проявлений через 1-2 суток.
Материал для исследования- смывы из
носоглотки, мазки с конъюнктивы, отделяемое
носа, доставляют в вирусологическую
лабораторию в охлажденном виде, в термосе
со льдом или переносном холодильнике.
36.
Условияхранения
материала
При температуре от 2 до 8 °С — в течение
трех суток. При температуре минус 70 °С или
в жидком азоте - длительно. Допускается
только однократное замораживаниеоттаивание материала. Температура хранения
минус 20 °С не допускается
Условия
В термоконтейнере с охлаждающими
транспортиров элементами или в термосе со льдом при
ания
температуре: 0—4 °С - не более трех суток;
материала
минус 70 °С или в жидком азоте - длительно.
Температура транспортирования минус 20 °С
допускается только с учетом однократного
замораживания и транспортирования - без
размораживания не более 4 дней
37.
Методы диагностикиВирусологический
серологический
экспресс диагностика:
иммунофлюресцентный метод,
ИФА, ИХА, ПЦР.
38.
ВирусологическийЗаражение куриного эмбриона
материалом от больного, после
инкубации проверяют наличие вируса по
реакции гемагглютинации, титр вируса и
его идентификацию проводят в реакции
торможения гемагглютинации
39.
40.
Серологический методИспользуют парные сыворотки, взятые от
больного в первые дни болезни и через
10-14 дней. Диагностическим критерием
является нарастание титра антител.
Используют реакции РНГА, РСК, РН,
ИФА, радиального гемолиза.
Регистрируется нарастание титра антител в 4
раза и более.
41.
42.
Специфическое лечениепротивогриппозный гамма-глобулин.
Интерферон лейкоцитарный человеческий
Защищает слизистую оболочку от
проникновения вируса. Интерферон подавляет
внутриклеточные этапы репродукции вируса
Этиотропное противовирусное лечение
Химиопрепараты :
Ремантадин эффективен при гриппе А.
Адапрамин эффективен против вирусов гриппа
типов А и В.
Дейтиформин (против типов А и В).
Ингибиторы РНК вируса:
Рибавин - эффективен при тяжелом течении,
подавляет репликацию вируса.
43.
44.
45.
ПрофилактикаВключает:
вакцинацию,
использование химиопрепаратов
и иммуномодуляторов и
адаптогенов
46.
Химиопрофилактикаиндукторы интерферона: циклоферон
и амиксин.
в качестве противовирусных
препаратов: Тамифлю, Альгирем
Ремантадин, Арбидол.
47.
48.
49.
ВакцинопрофилактикаЦельновирионные вакцины– живые или
инактивированные
Применялись для лиц старше 16 лет. Присутствие
липидной оболочки обусловливает возникновение
прививочных осложнений.
живая гриппозная вакцина,
вакцина гриппозная инактивированная элюатно
центрифужная жидкая;
вакцина гриппозная инактивированная
центрифужная жидкая;
вакцина гриппозная хроматографическая
инактивированная жидкая
50.
Расщепленные–«сплит»- вакцины изинактивированных, расщепленных вирусов при
помощи органических растворителей или
детергентов, лишенные липидов.
Эффективные вакцины, хорошо переносятся.
Рекомендованы как детям, так и пожилым
ослабленным людям.
ВАКСИГРИП (Франция),
Бегривак (Германия),
Флюарикс (Бельгия).
Вакцинация проводится ежегодно.
51.
Субъединичная – содержит поверхностныеантигены, выделенный из вирусных частиц
гемагглютинин и нейраминидазу. Обладают
хорошей переносимостью, нереактогенна.
Могут применяться у детей начиная с 6месячного возраста.
В России разрешены к применению
субъединичные вакцины:
Агриппал (Германия), Гриппол (Россия),
Инфлювак (Нидерланды).
52.
53.
54.
Отличие парамиксовирусов отортомиксомирусов
У парамиксовирусов несегментирован
геном, у ортомиксовирусов сегментирован
РНК синтезируется в цитоплазме, а не в
ядре
Нуклеокапсид содержит 2 белка
Низкая скорость эволюции вирусов
Диффузный характер ЦПД (симпласт,
синцитий)
55.
Респираторно-синцитиальныйвирус (РСВ)
РСВ распространен, главным образом среди
детей первых лет жизни. У каждого 4-5
ребенка развивается бронхиолит или
пневмония, бронхит с астмоидным
компонентом.
В России ежегодно погибает до 160 тыс.
детей в результате развития вызванных им
тяжелых пневмоний.
56.
Морфология РСВВирион сферической формы, диаметром 120-200 нм.
Геном представлен однонитевой ,
нефрагментированной РНК, несет 10 генов,
определяющих 11 вирусоспецифических белков
(N,P,L, М и К).
В состав суперкапсида входят гликопротеины F и G.
Белок G обеспечивает фиксацию вируса на
чувствительных клетках,
белок F- слияние мембраны вируса с мембраной
клетки и ее лизосом; слияние инфицированной
клетки с неинфицированной с образованием
синцития.
57.
Антигенные свойстваобладают единым комплементсвязывающим
антигеном.
Гетерогенность
популяции PC-вирусов
заключается в наличии
подтипов (А, В),
58.
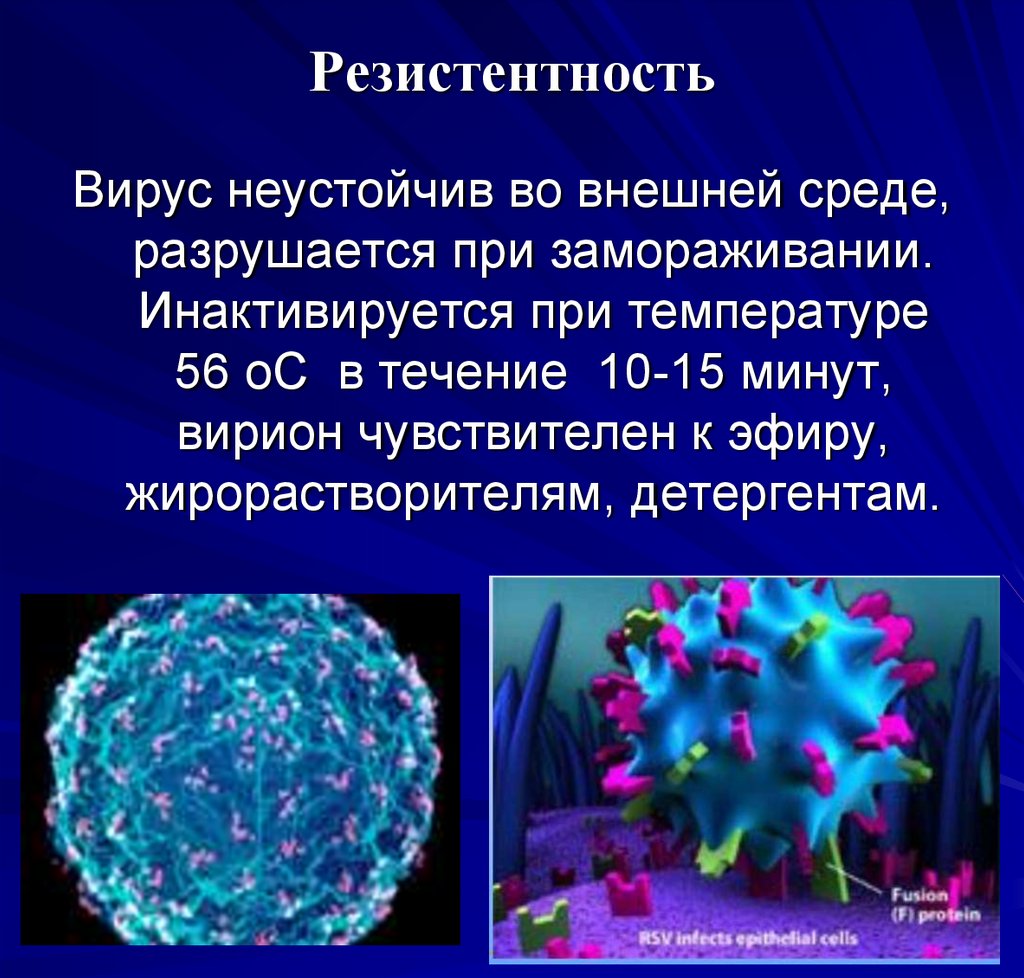
РезистентностьВирус неустойчив во внешней среде,
разрушается при замораживании.
Инактивируется при температуре
56 оС в течение 10-15 минут,
вирион чувствителен к эфиру,
жирорастворителям, детергентам.
59.
КультивированиеНе патогенен для лабораторных животных.
Не размножается в куриных эмбрионах.
Хорошо репродуцируется в клеточных
культурах как перевиваемых, так и
первичных (НЕLA, HEP-2). В качестве
биологической модели используют обезьян.
Обладает выраженным цитопатическим
действием.
60.
ПатогенезИнкубационный период 3-7 дней.
Вызывает нарушение дренажной функции
бронхиального дерева. Наблюдается
сосочкообразное разрастание эпителия средних
и мелких бронхов, группирование
эпителиальных клеток в многоядерные
конгломераты (синцитий), утолщение
межальвеолярных перегородок.
61.
ИммунитетУ детей до 6 месяцев проявляется
защитная роль плацентарного
иммунитета.
Постинфекционный иммунитет
продолжительный, стойкий. Обусловлен
появлением вирус нейтрализующих АТ,
клеток памяти и секреторных Ig A.
62.
Лабораторная диагностикаЦитоскопическое исследование, РИФ
Иммунологическая диагностика:
обнаружение вирусных антигенов (РН в
культурах клеток, реакции торможения
гемадсорбции) или антител к возбудителю
при постановке реакций РСК, ИФА с
парными сыворотками.
63.
ЛечениеИммуномодуляторы
Рибавирин
64.
ПрофилактикаСпецифическая - вакцина для защиты от
респираторно-синцитиального вируса
апробирована в 2016 г. (США) Обеспечивает
высокий уровень выработки специфических
антител.
Отечественных вакцин нет.
Иммунопрофилактика - препараты
интерферона или его индукторов.
65.
66.
67.
68.
Большинство респираторных заболеваний,ассоциированных с HMPV, встречается у
детей первых 2 лет жизни. Данная
возрастная категория представляет группу
риска по развитию тяжелой инфекции,
ассоциированной с этим вирусом.
69.
Морфология HMPVОписан в 2001 г
РНК-содержащий вирус.
Вирионы HMPV имеют сферическую и
нитевидную формы.
Сферические частицы имеют средний диаметр
150- 300 нм.
Вирионная РНК кодирует 9 структурных и
неструктурных белков.
Поверхностные
гликопротеины
F и G.
70.
Сходство аминокислотныхпоследовательностей между HMPV и HRSV
составляет от 23 до 43%.
В настоящее время идентифицированы две
эволюционные линии (генотипы А и В) и два
генетических кластера (субтипа) в пределах
каждой линии. Генотип А более патогенный
чем В.
71.
КультивированиеВирус слабо реплицируется в обычных
клеточных культурах, используемых для
диагностики респираторных вирусов.
Цитопатический эффект очевиден лишь в
третичных клетках почек обезьян и некоторых
клеточных линиях: Vero, А-549 LLC-MK2, QT35,. Установлена экспериментальная инфекция
у хомяков, мышей, хлопковых крыс, морских
свинок, макак-резусов, африканских зеленых
мартышек и шимпанзе.
72.
Гистологически выявило дегенеративныеизменения эпителиоцитов, внутри которых
определялись эозинофильные
цитоплазматические включения,
а также обнаружило многоядерные гигантские
клетки и гистиоциты.
73.
Резистентность74.
ЭпидемиологияHMPV циркулирует на протяжении всех
календарных месяцев и имеет выраженное
сезонное распределение, перекрывающее
циркуляцию RSV. Пики активности зависят от
климатических условий географических регионов.
Чаще вызывает моноинфекцию.
75.
Трансмиссия осуществляетсяпреимущественно воздушно-капельным и,
вероятно, контактно-бытовым путем.
76.
77.
Реже – ринорея, миалгия. При этом лихорадкаболее 39 0С, сильный кашель и осиплость голоса
у детей с HMPV-инфекцией наблюдаются чаще
Зарегстрированы случаи тяжелой HMPVинфекции у взрослых и реинфекции у
иммунокомпромитированных лиц.
Новые инфекции - результат несовершенного
протективного иммунного ответа и/или
заражения новыми генетическими подтипами.
78.
79.
Течение инфекции и характер иммунногоответа на нее во многом определяется типом
цитокиновой регуляции.
Вирус способен ускользать от иммунного
ответа и реплицироваться в клетках иммунной
системы, проявляя иммуносупрессивные и
иммуномодулирующие свойства, что приводит как
к повторным инфекциям, так и к развитию
иммунопатологических процессов в организме.
80.
Лабораторная диагностика.Клинические образцы- назальные или
назофарингеальные смывы.
Идентификация HMPV в ПЦР :
количественные методы ПЦР и детекция
патогена (в режиме реального времени).
Можно определить вирусную нагрузку, что
определяет тяжесть течения заболевания.
Серологическое тестирование позволяет
установить ретроспективный диагноз:
4-кратное и более повышение титров антител.
В последнее время разрабатываются варианты
ИФА для детекции специфических антител
против HMPV.
81.
в непрямом МФА (НМФА) сиспользованием инфицированных клеток.
82.
ЛечениеВ качестве этиотропного средства
рассматривают рибавирин,
сульфатид-сиалила липида (NMSO3) и
специфические ингибиторы слияния вирусa.
Самый инновационный подход –
использование siRNAs-наномолекул, обладающих
специфической анти-HMPV активностью.
83.
Пассивная иммунопрофилактика-Паливизумаб - гуманизированные
моноклональные антитела IgG1, воздействующие на
эпитопы антигена белка слияния F оболочки вируса.
Молекула паливизумаба состоит
из человеческих (95%) и мышиных (5%)
аминокислотных последовательностей. Он
обладает выраженной нейтрализующей и
ингибирующей слияние клеток активностью
против РСВ штаммов, как подтипа А, так и подтипа
В.
84.
Специфическая профилактикаведутся исследования по созданию
живых аттенуированных вакцин с
использованием арсенала молекулярнобиологических методов, включая
обратную генетику.

















































































 medicine
medicine








