Similar presentations:
Формирование химического состава подземных вод
1. Формирование химического состава подземных вод
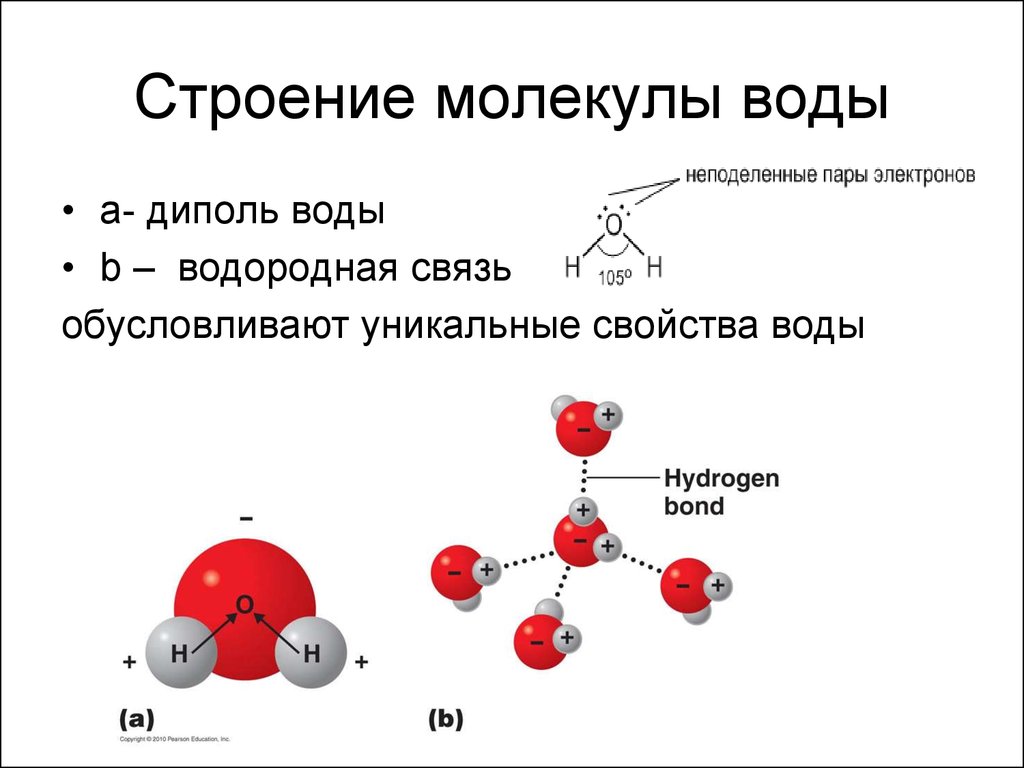
2. Cтроение молекулы воды
• а- диполь воды• b – водородная связь
обусловливают уникальные свойства воды
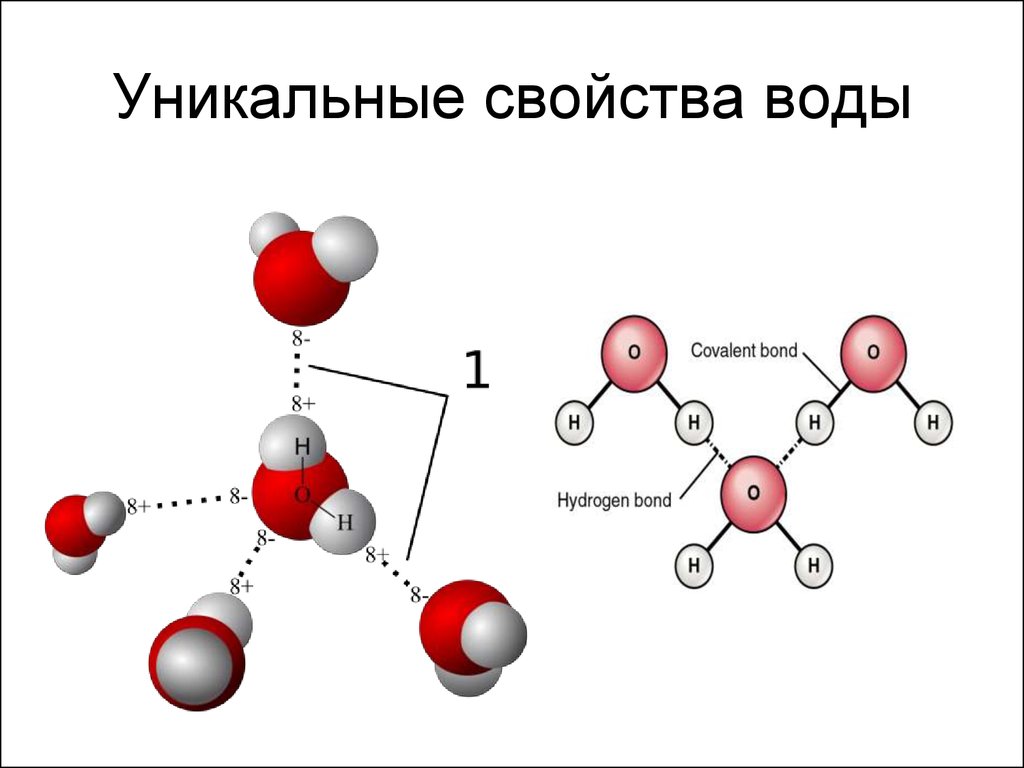
3. Уникальные свойства воды
4. Водородная связь
• Две поделенные электронные пары участвуют в образованиидвух полярных ковалентных связей, а оставшиеся две
неподеленные пары электронов тоже играют важную роль в
свойствах воды.
• Все заместители у атома кислорода, включая неподеленные
пары, стремятся расположиться как можно дальше друг от
друга. Это приводит к тому, что молекула приобретает форму
искаженного тетраэдра с атомом кислорода в центре.
• В четырех вершинах этого "тетраэдра" находятся два атома
водорода и две неподеленные пары электронов.
• Но если смотреть только по центрам атомов, то получается, что
молекула воды имеет угловое строение, причем угол Н–О–Н
составляет примерно 105 градусов.
5. Водородная связь
Энергия водородной связи Н---О воды (H2O)2 составляет 21,5
кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные
и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но
именно они заставляют воду быть жидкостью или льдом (а не газом) в
обычных условиях. Водородные связи разрушаются только тогда,
когда жидкая вода переходит в пар.
В жидкой воде молекулы связаны между собой лишь в отдельные
агрегаты из нескольких молекул. Эти агрегаты могут свободно
двигаться рядом друг с другом, образуя подвижную жидкость. Но при
понижении температуры упорядоченность становится все больше и
больше, а агрегаты – все крупнее. Наконец, образуется лед.
В кристалле льда между молекулами остаются пустоты. Объем пустот
чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед
имеет меньшую плотность, чем жидкая вода и плавает на поверхности.
Большинство же других веществ при замерзании увеличивает свою
плотность.
6. Возникновение водородных связей
Для возникновения водородных
связей важно, чтобы в молекулах
вещества были атомы водорода,
связанные с небольшими, но
электроотрицательными атомами,
например: O, N, F.
Это создает заметный частичный
положительный заряд на атомах
водорода. С другой стороны, важно,
чтобы у электроотрицательных
атомов были неподеленные
электронные пары. Когда
обедненный электронами атом
водорода одной молекулы (акцептор)
взаимодействует с неподеленной
электронной парой на атоме N, O или
F другой молекулы (донор), то
возникает связь, похожая на
полярную ковалентную.
7. Факторы формирования
Факторы формирования - это естественные или искусственныепричины, определяющие возникновение и протекание
гидрогеохимических процессов в земной коре.
Физико-химические факторы:
свойства воды и водных растворов, химических элементов и их
соединений;
Физические:
температура, давление, гравитация, радиоактивность;
Физико-географичекие:
климат (осадки и испарение, температура), рельеф, поверхностные воды,
почвенно-растительный покров;
Геолого-гидрогеологические:
тектоника, магматизм и метаморфизм, состав пород, фильтрационные
свойства пород;
Микробиологические: микрофлора и микрофауна;
Антропогенные (техногенные):
промышленные и с/х предприятия, коммунально-бытовые отходы и др.
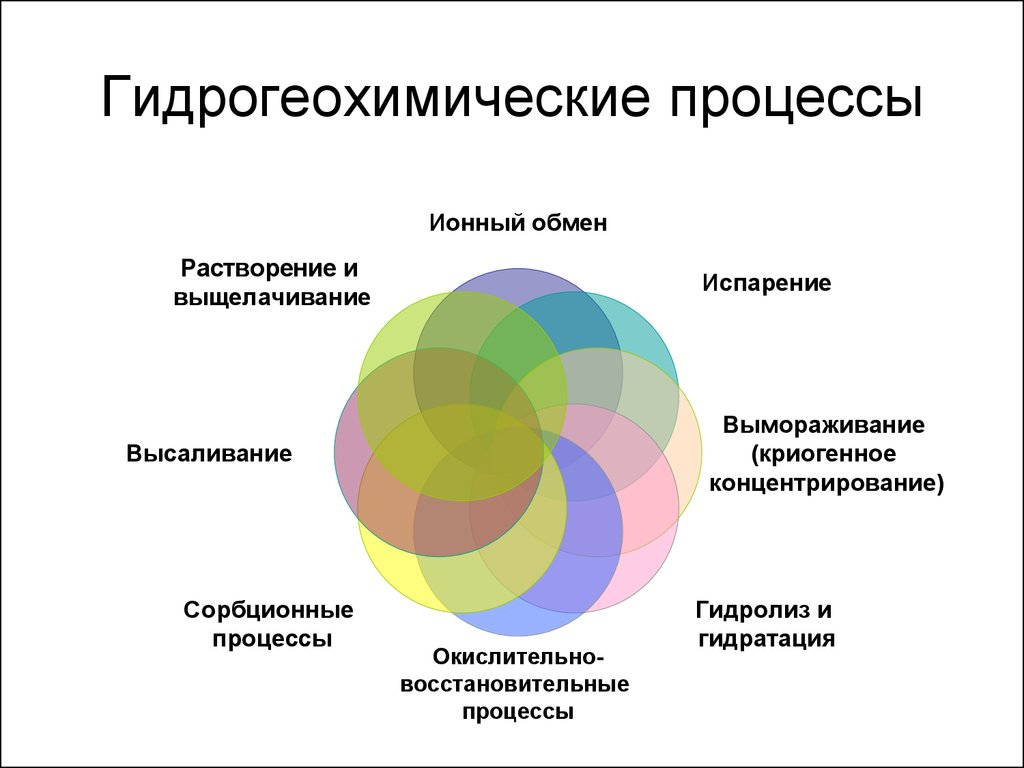
8. Гидрогеохимические процессы
Ионный обменРастворение и
выщелачивание
Испарение
Вымораживание
(криогенное
концентрирование)
Высаливание
Сорбционные
процессы
Окислительновосстановительные
процессы
Гидролиз и
гидратация
9. Окислительно-восстановительные процессы
ОКИСЛЕНИЕ – переход элементов с низкойвалентностью в высоковалентные
FeS2 + nH2O + mO2 FeSO4 Fe2(SO4)3 Fe(OH)3 + H2SO4
ВОССТАНОВЛЕНИЕ – элементы с высокой
валентностью переходят в соединения с более
низкой валентностью
MeSO4 + 2C = MeS + 2CO3
Na2SO4 + 2C + H2O = Na2CO3 + H2S + CO2
переходит в р-р,
повышает щелочность
подземных вод
CaSO4 + 2C + H2O = CaCO3 + H2S + CO2
кальцит не растворим, ухудшает проницаемость пород
10. Гидратация
ГИДРАТАЦИЯ – химическое присоединениеводы к минералам горных пород с
образованием новых минералов
(гидроокислов и гидросиликатов)
Fe2O3 + n H2O Fe2O3 ×nH2O
гематит
лимонит
CаSO4 + 2H2O CaSO4 × 2H2O
ангидрит
гипс
11. Гидролиз
ГИДРОЛИЗ алюмосиликатов – обменное разложение веществапод влиянием гидролитической диссоциации воды,
сопровождающееся разрушением одних и образованием
других минералов
K[AlSi3O8] + n H2O + CO2 K2CO3 + Al4 [Si4O10](OH)8 +
в р-р
каолинит
SiO2×nH2O
опал
Дальнейший гидролиз каолинита приводит к его полному
разложению и образованию латерита
Al4 [Si4O10](OH)8 H2Al2O4 + SiO2 + nH2O
каолинит
латерит
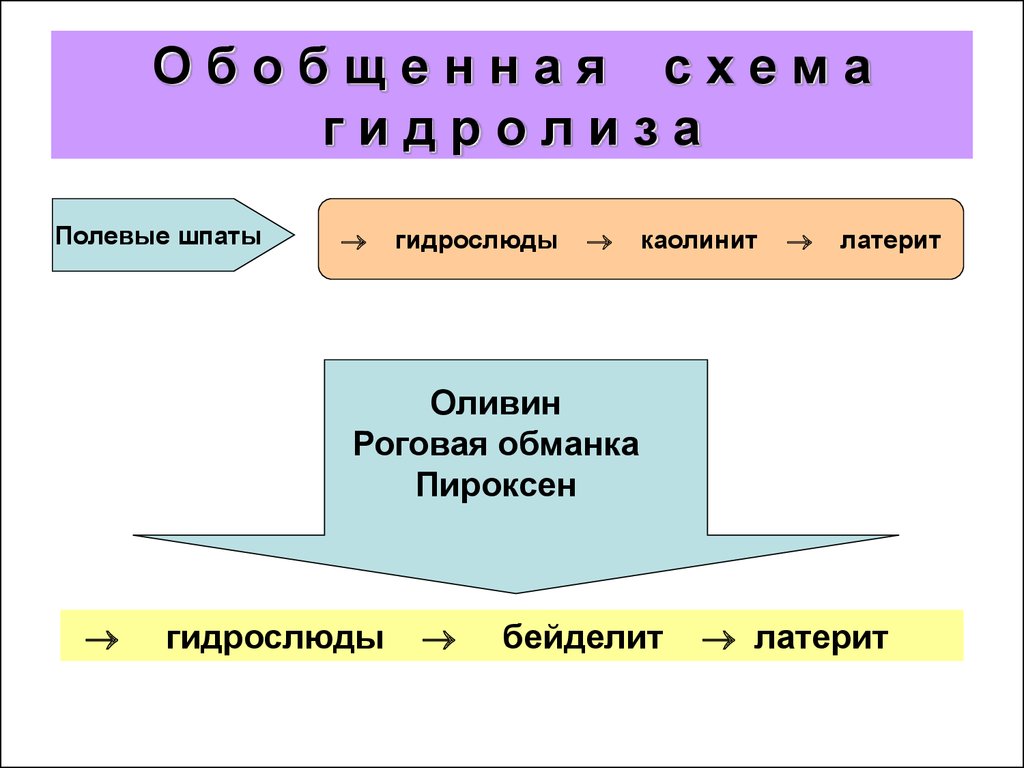
12. О б о б щ е н н а я с х е м а г и д р о л и з а
Обобщенная схемагидролиза
Полевые шпаты
гидрослюды
каолинит
латерит
Оливин
Роговая обманка
Пироксен
гидрослюды
бейделит
латерит
13. Гидрогеохимические процессы
14. Гидробиохимические процессы
Сульфофикация(аэробные условия)
Сульфатредукция
(анаэробные условия)










 chemistry
chemistry ecology
ecology








