Similar presentations:
Сульфатна кислота і сульфати
1.
Сульфатна кислота і сульфати.Найважливіші природні
сульфати, якісна реакція на
сульфат-іон.
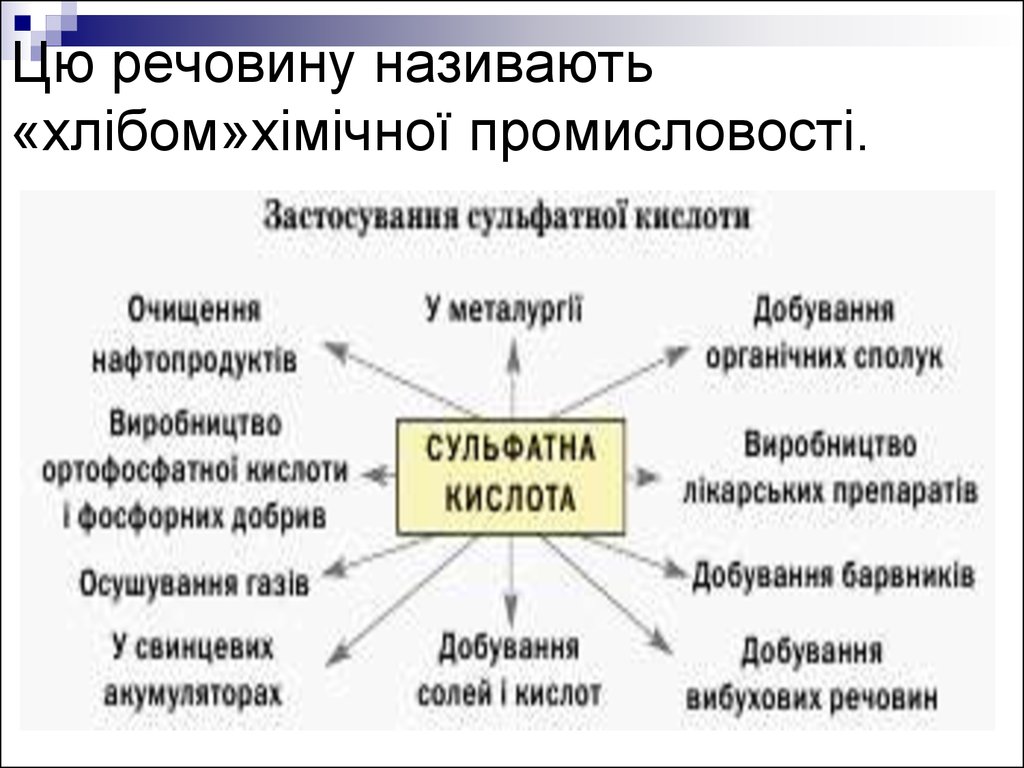
Застосування сульфатної кислоти
і сульфатів
Охорона навколишнього
середовища від забруднення
викидами сульфуровмісних
речовин.
2. Мета:
Відновити знання про склад, фізичні властивості і відношення до водисульфатної кислоти.
Ознайомити з сульфатами та їхніми властивостями, практичним
застосуванням.
Розкрити значення для хімічної промисловості і народного господарства.
Розвинути вміння встановлювати причинно-наслідковий зв’язок між
властивостями сульфатної кислоти та її застосуванням.
Загострити увагу на правилах (Т/Б) при роботі з сульфатною кислотою та
при приготуванні її водних розчинів.
Пояснити окиснювальну здатність концентрованої сульфатної кислоти.
Удосконалити вміння складати рівняння реакцій з металами, оксидами,
основами і солями в молекулярній, повній і скороченій йонних формах.
Дати поняття про якісну реакцію на сульфат-іон.
Ознайомити із сировиною та хімічними реакціями, що покладені в основу
виробництва сульфатної кислоти, з умовами їх здійснення.
Розкрити значення цих знань для управління процесом виробництва.
Формувати вміння складати рівняння реакцій, що лежать в основі
виробництва сульфатної кислоти (випалювання піриту та сульфідів,
окиснення сульфур(IV) оксиду, гідратація сульфур(VI) оксиду).
Розвивати поняття про каталіз, формувати поняття “вихід продукту реакцій”.
Висвітлити проблему охорони праці і довкілля від забруднення.
3. Демонстрації:
5. Спалювання сірки і доведення кислотногохарактеру утвореного оксиду.
6. Виділення теплоти під час розчинення у воді
концентрованої сульфатної кислоти.
7. Водовідбірні властивості концентрованої
сульфатної кислоти (дія на цукор і папір).
8. Якісна реакція на сульфат-іон.
Лабораторні досліди:
4. Ознайомлення зі зразками природних сполук
Сульфуру.
5. Виявлення сульфат-іонів у розчині.
4. Сульфатна кислота.
Сульфатна, або сірчана, кислотаїїформула — H2SO4.
Будова молекули. Графічна формула молекули:
Сульфатна кислота,як і всі інші кислоти, —
молекулярна сполука
Кулестержневамодель молекули сульфатної кислоти
5.
Укажіть значення валентності таступеня окиснення Сульфуру в
сульфатній кислоті.
6. Фізичні властивості.
За звичайних умовчиста сульфатна кислота — безбарвна
оліїста рідина
без запаху,
майже удвічі важча за воду (ρ = 1,83
г/см3).
Температура плавлення споолуки
становить +10,3 °С, а кипіння +280 °С.
Під час кипіння кислота починає
розкладатиися на сульфур(VI) оксид і
воду.
7.
Переконатися в тому, що розчиненнясульфатної кислоти — процес
екзотермічний, допоможе такий
демонстраційний дослід. Зберемо
прилад
помістимо в стакан закріплену в лапці
штатива пробірку, у яку налито
легкокиплячу (t кип. 40 °С)органічну
речовину — діетиловий етер.
У хімічний стакан наллємо 50 мл води
кімнатної температури. Після цього
повільно, по скляній паличці, час від
часу помішуючи, увіллємо в стакан
50 мл концентрованої сульфатної
кислоти. Спостерігатимемо, як рідина
в пробірці закипає і випаровується.
Причина цього явища —підвищення
температури розчину. Якщо відкрити
пробку й піднести до отвору пробірки
запалену скіпку, пари етеру
спалахнуть
8. Потрібно знати
Розчинення кислоти у водісупроводжується виділенням великої
кількості теплоти.
Для того щоб із концентрованої
сульфатної кислоти виготовити її
розбавлений розчин, кислоту доливають у
воду, а не навпаки.
Тоді температура рідини зростає
повільніше, і вдається запобігти її
закипанню й розбризкуванню.
9.
Вона взаємодіє з:1)металами, розміщеними в ряді
активності до водню;
2) основними й амфотерними оксидами;
3) основами;
4) амфотерними гідроксидами;
5) солями
10. Хімічні властивості.
Сульфатна кислота завдяки наявності вмолекулі двох ковалентт них полярних
зв’язків О–Н є двохосновною.
Її дисоціація за першою стадією в
розбавленому розчині відбувається майже
повністю (це сильна кислота), а за другою —
частково:H2SO4→H + HSO4;HSO4→H + SO4²ˉ.
Проте у йонноомолекулярних рівняннях сульфатну
кислоту записують такою сукупністю йонів:
2H+ SO4²ˉ.
11. Реакції з металами.
взаємодіє майже з усіма металами. Можливість цихреакцій, а також склад їх продуктів залежать від
концентрації кислоти і хімічної активності металу. Метал
завжди є відновником. Тому сульфатна кислота,
реагуючи з ним, буде окисником і відновлюватиметься.
+1 +6 –2
У молекулі 2
4 можуть відновлюватися
(зменшувати ступінь окиснення) два елементи —
Гідроген і Сульфур.
Якщо з металом взаємодіє розбавлена сульфатна
кислота, то відновлюється Гідроген.
Продукти реакції — сульфат металічного елемента і
водень:
2Al + 3H2SO4 (розб.) = Al2(SO4)3+ 3H2↑.
H SO
12. Схема взаємодії концентрованої сульфатної кислоти з металами
Нагадуємо, що «витісняти» водень здатніметали, розміщені в ряду активності
перед ним.
13.
Із розбавленою сульфатною кислотоюне реагують мідь а), ртуть, золото,
платина, інші хімічно пасивні метали.
Якщо реагентом є концентрована сульфатна кислота, то
відновлюється Сульфур. Із концентрованою кислотою
реагують також метали, розміщені в ряду активності після
водню (крім золота,платини).
14.
Малоактивні метали відновлюють–2
кислоту
+4
до SO2 ,а дуже активні —до
H2S:
Cu + H2SO4(конц.)→CuSO4+ SO2↑+
H2O;
Mg + H2SO4(конц.)→MgSO4+ H2S↑+
H2O.
Складіть схеми окиснення, відновлення й
доберіть коефіцієнти методом
електронного балансу.
15.
Якщо в холодну концентровану сульфатну кислотузанурити кусочок заліза, то ми не помітимо взаємодії
речовин.
Насправді кислота починає реагувати з металом:2Fe
+ 3H2SO4 (конц.) = Fe2O3+ 3SO2↑+ 3H2O.
Однак реакція відразу припиняється, бо на поверхні
металу утворюється тонка плівка ферум(ІІІ) оксиду,
інертна щодо кислоти (оксид реагує з кислотою тільки
при нагріванні).
Таке явище називають пасивацією. Аналогічно
поводиться щодо цієї кислоти алюміній.
16. Реакції зі складними речовинами.
Сульфатна кислота взаємодіє зосновними оксидами амфотерними
оксидами,
основами,
амфотерними гідроксидами
з утворенням у кожному випадку солі
(сульфату) і води.
•H2SO4 + MnO →
•H2SO4 + Ві(OH)3→
17.
Будучи нелеткою і сильною кислотою, вонавступає в реакції обміну з більшістю солей.
H2SO4 + Pb(NO3)2→
H2SO4 + NaF →
Напишіть рівняння реакцій сульфатної
кислоти зі сполуками, що мають такі
формули:
Li2O,
Fe(OH)3,
Na3PO4.
18. Розклад цукру і целюлози під дією сульфатної кислоти
19.
20. Цю речовину називають «хлібом»хімічної промисловості.
21. Сульфати.
Сульфатна кислота утворює солі, загальнаназва яких — сульфати
Більшість сульфатів розчиняється у воді.
При випарюванні їх розчинів часто
виділяються кристалогідрати, наприклад
CuSO4•5H2O, FeSO4•7H2O,
Al2(SO4)3•18H2O.
Малорозчинними є солі CaSO4 і Ag2SO4, а
практично нерозчинними — BaSO4 і
PbSO4.
22.
23. Найважливіші природні сульфати
гіпсСаSO4·2Н2О; глауберова сільNa2SO4·10H2О; гіркасільMgSO4·7H2О.
Із наведених формул стає зрозуміло, що це
кристалогідрати, тобто вони містять кристалізаційну воду,
яка при нагріванні випаровується.
На цій властивості кристалогідратів ґрунтується
виробництво алебастру 2СаSO4·Н2О з природного гіпсу,
який нагрівають до 120–190 °С, у наслідок чого він
втрачає частину води.
При змочуванні водою кімнатної температури алебастр
легко приєднує воду й знову перетворюється на гіпс.
Це відбувається щоразу при накладанні гіпсових пов’язок
на травмовані частини тіла, під час виготовлення гіпсових
виробів художнього та будівельного призначення.
24.
25.
Глауберову сіль Na2SO4·10H2Озастосовують у виробництві скла, соди,
фарб, у медицині.
Гірку сіль MgSO4·7H2О використовують
в обробці тканин, дубінні шкіри,
виготовленні медичних препаратів.
Купрум(ІІ) сульфат, пентагідрат, або
мідний купорос
CuSO4•5H2O,застосовують у сільському
господарстві як засіб проти хвороб і
шкідників рослин.
26.
27.
28.
Якісною реакцією на сульфат аніони євзаємодія їх з катіонами Барію
(розчинними у воді сполуками Барію), у
результаті чого утворюється нерозчинний
у воді і кислотах білий
дрібнокристалічний осад барій сульфату.
Скорочене йонне рівняння якісної реакції
таке:
Ba² + SO4 = BaSO4 ²ˉ↓
29.
Охорона навколишнього середовища відзабруднення викидами сульфуровмісних
речовин.
Серед сульфуровмісних забрудників
навколишнього середовища найбільш
шкідливими є сульфур(ІV) оксид і гідроген
сульфід, або сірководень.
Щодо гідроген сульфіду, то потрібно
наголосити на високій токсичності цієї
газуватої речовини з неприємним
запахом тухлих яєць (утворюється при
гнитті білка курячого яйця й спричинює
його неприємний запах).
30.
31. Поняття про кислотні дощі та причини їх виникнення.
Чи доводилося вам спостерігати, як після довгоочікуваного літньогодощу рослини замість того, щоб рости й давати врожай,
жовкнуть,в’януть і навіть гинуть (досить часто це трапляється з
огірками)?
З великою ймовірністю можна стверджувати, що дощ був не
звичайний, а кислотний, і завдав шкоди рослинам. Кислотні дощі
пошкоджують листки, руйнують їх захисні воскові покриви, через що
ті стають легкопроникними для комах, шкідливих грибів і
мікроорганізмів. Окрім рослин, кислотні дощі завдають шкоди
тваринам,водоймам, ґрунтам.
Хімічний аналіз кислотних дощів показує наявність у них сульфатної
та нітратної кислот. Поява цих речовин — наслідок розглянутих
хімічних перетворень оксидів Сульфуру і Нітрогену в атмосфері.
Кислотний дощ— це дощ, що містить певну кількість кислот,
утворених унаслідок взаємодії з водою наявних у повітрі таких
забруднювачів, як оксиди Сульфуру і Нітрогену.
Щороку внаслідок спалювання твердого палива, роботи двигунів
внутрішнього згорання, промислових викидів заводів по виробництву
сульфатної і нітратної кислот концентрація цих оксидів у повітрі
збільшується. Тому кислотні дощі створюють реальну загрозу
людині, рослинному й тваринному світу.
32.
Фізіологічна дія гідроген сульфідупроявляється в тому, що він блокує
дихальний центр.
Смертельною дозою для людини є
вдихання протягом 5–10 хв повітря з
об’ємною часткою гідроген сульфіду
0,08%.
Забруднюють повітря сульфуровмісними
речовинами викиди нафтопереробних
заводів, теплові електростанції.
33.
Охорона навколишнього середовища полягаєнасамперед у зменшенні викидів, а отже, у модернізації
виробництва, запровадженні технології замкненого
циклу, коли гази, що є відходами названих виробництв,
використовують як сировину для інших виробництв.
Користь від цього подвійна — не забруднюється
навколишнє середовище, а вироблена з гідроген
сульфідних відходів нафтопереробної промисловості
сульфатна кислота має найменшу вартість.
Удосконаленням технології виробництва сульфатної
кислоти
займався український хімік Іван Євграфович Ададуров
(1879–1938).
34.
З якими з перелічених речовин взаємодієрозбавлена сульфатна кислота: залізо, купрум(ІІ)
оксид, мідь, натрій гідроксид, нітратна кислота,
калій карбонат, нітроген(ІІ) оксид? Напишіть
молекулярні рівняння реакцій, зазначте їх типи.
Запропонуйте спосіб розпізнавання
концентрованої та розбавленої сульфатної
кислоти, що перебувають у банках без
етикеток.Мотивуйте його.
Обчисліть масову частку кристалізаційної води в
гіркій солі.
35.
Ознайомтеся з виданими вам зразкамисульфатів і сульфідів.
Дослідіть агрегатний стан й такі їх фізичні
властивості: колір, розчинність у воді.
Використовуючи міжпредметні зв’язки з
географією, назвіть поклади природних
сульфатів і сульфідів в Україні.
Одержані результати оформіть у робочому
зошиті у вигляді таблиці.
36. ВИСНОВКИ
Сульфатна кислота H2SO4 — безбарвнаоліїста рідина без запаху, яка необмежено
розчиняється у воді. Це сильна й нелетка
двохосновна кислота.
Вона реагує з металами, основними й
амфотерними оксидами, основами,
амфотерними гідроксидами, а також
солями з утворенням сульфатів.
Сульфатну кислоту та її солі широко
використовують у різних галузях.



































 chemistry
chemistry








