Similar presentations:
Электролиз расплавов и растворов солей
1. Электролиз расплавов и растворов солей
2. Электролиз –
это окислительновосстановительный процесс,протекающий на электродах,
при пропускании постоянного
электрического тока через
раствор или расплав
электролита.
3.
4.
5.
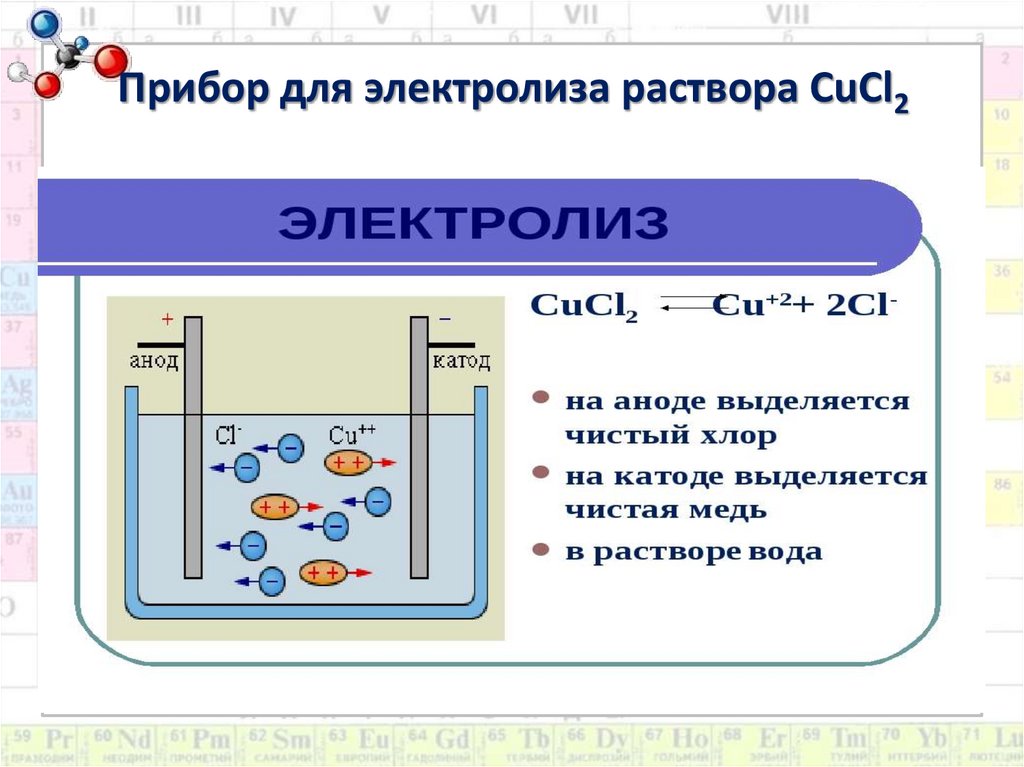
6. Прибор для электролиза раствора CuCl2
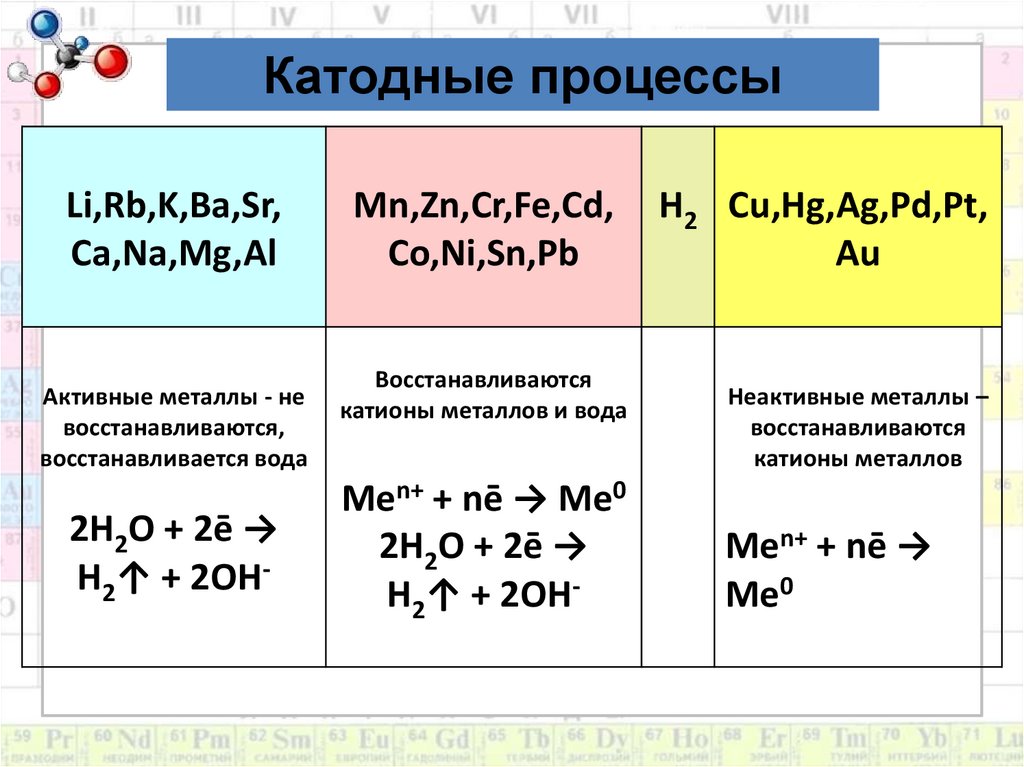
7. Катодные процессы:
1. Катионы металлов после Н (от Cu2+ до Au3+)полностью восстанавливаются на катоде.
2. Катионы металлов от Li+ до Al+3
включительно не восстанавливаются,
вместо них восстанавливаются молекулы
воды:
2H2O + 2ē → H2↑+2OHˉ
3. Катионы металлов от Al 3+ до H+
восстанавливаются одновременно с
молекулами воды.
8.
Катодные процессыLi,Rb,K,Ba,Sr,
Ca,Na,Mg,Al
Активные металлы - не
восстанавливаются,
восстанавливается вода
2H2O + 2ē →
H2↑ + 2OH-
Mn,Zn,Cr,Fe,Cd,
Co,Ni,Sn,Pb
Восстанавливаются
катионы металлов и вода
Men+ + nē → Me0
2H2O + 2ē →
H2↑ + 2OH-
H2 Cu,Hg,Ag,Pd,Pt,
Au
Неактивные металлы –
восстанавливаются
катионы металлов
Men+ + nē →
Me0
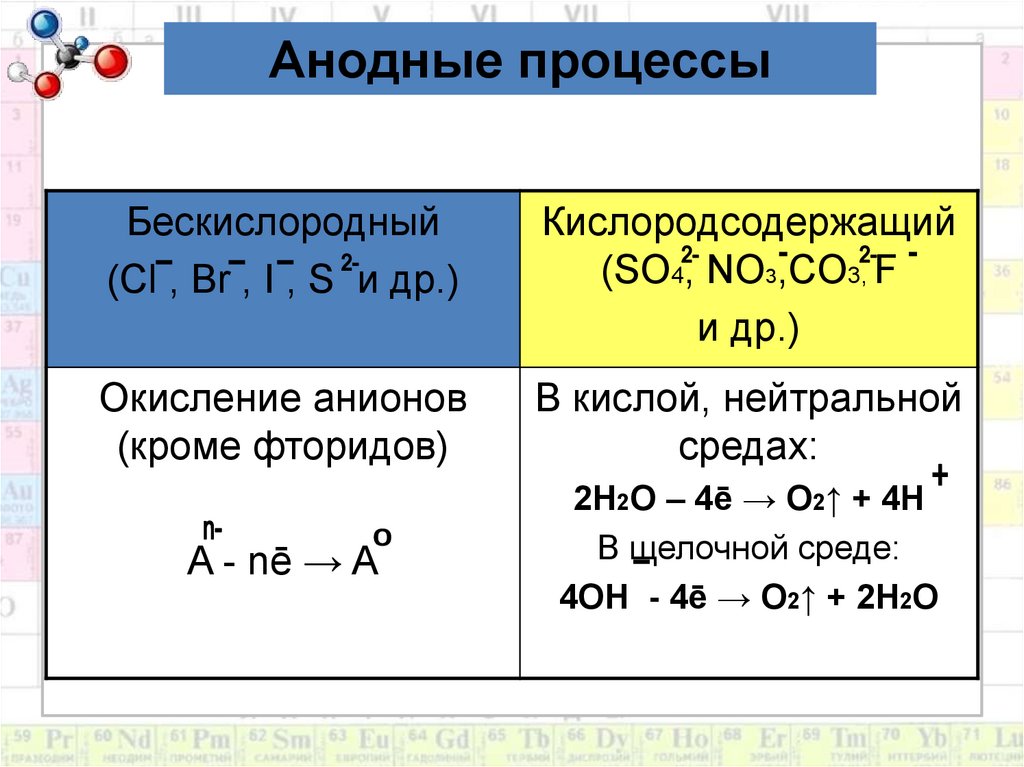
9. Анодные процессы
1. В первую очередь на анодеокисляются бескислородные анионы:
S²ˉ, Iˉ, Brˉ, Clˉ (кроме Fˉ )и анионы
органических кислот:
2RCOOˉ - 2ē → 2 CO2↑ + R-R
2. Во вторую очередь OHˉ анионы,
окисляются молекулы воды:
2H2О – 4ē → О2↑ + 4Н+
10.
Анодные процессыБескислородный
(Cl , Br , I , S и др.)
Кислородсодержащий
(SO4, NO3,CO3, F
и др.)
Окисление анионов
(кроме фторидов)
В кислой, нейтральной
средах:
A - nē → A
2H2O – 4ē → O2↑ + 4H
B щелочной среде:
4OH - 4ē → O2↑ + 2H2O
11.
ПримерыCuSO4 → Cu2+ + SO4²ˉ
-К: Cu2+ + 2ē → Cuº
+A: 2H2O – 4ē → O2↑ + 4Н+
ˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉ
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
12.
Na2CО3 → 2Na+ + CО3²ˉ-K: 2H2O + 2ē → H2º +2OH ˉ
+А : 2H2O – 4ē → O2º +4H+
2H2O→ 2H2º +O2º
13.
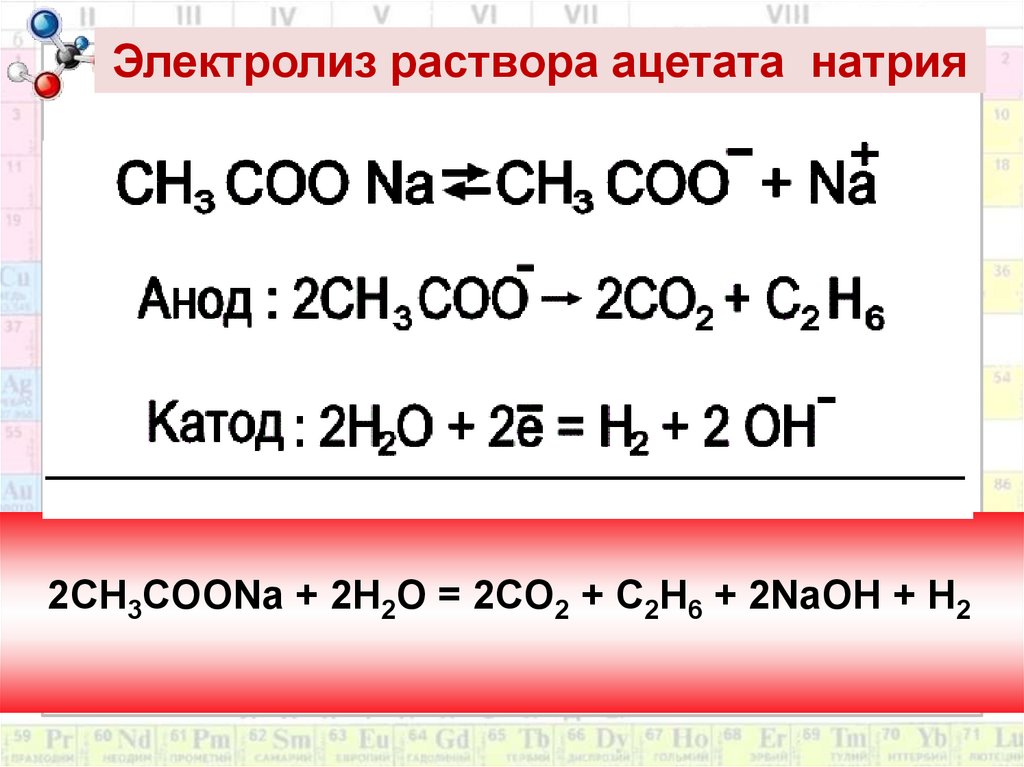
Электролиз раствора ацетата натрия2СH3COONa + 2H2O = 2CO2 + C2H6 + 2NaOH + H2
14.
15.
Опыт 1Электролиз водного раствора йодида
калия
В U-образную трубку налить раствор йодида
калия. В оба колена добавить 4-5-капель
фенолфталеина,
опустить
графитовые
электроды, присоединить последние к блоку
питания. Пропустить ток
16.
17.
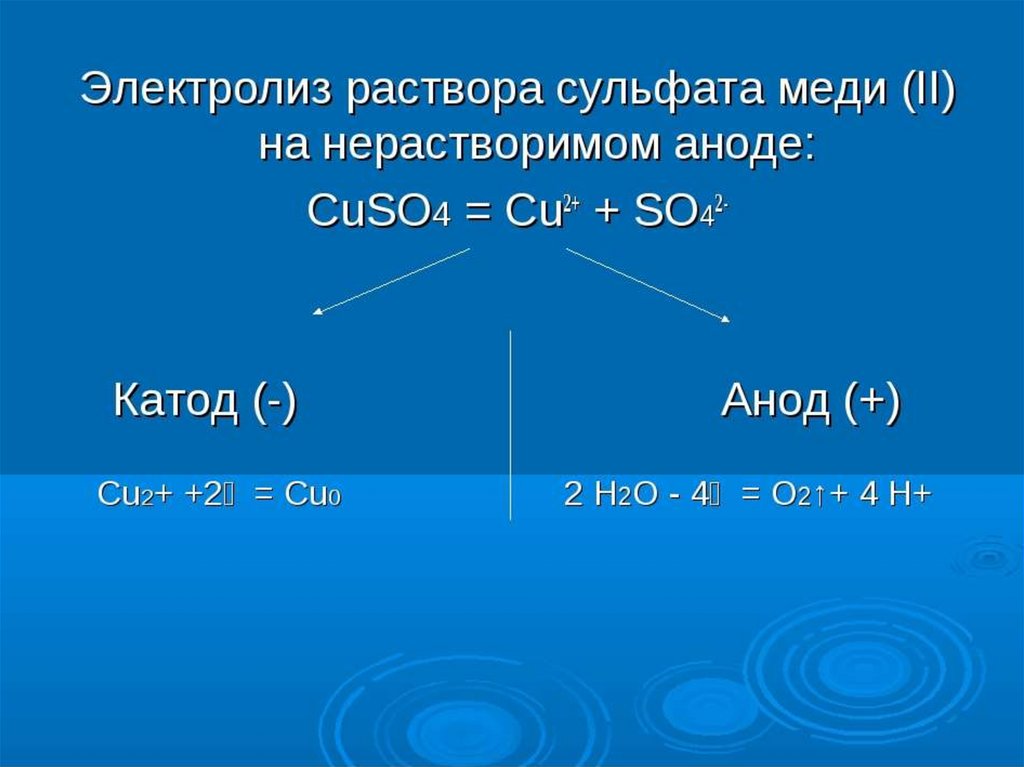
Опыт 2Электролиз водного раствора сульфата
меди (II) с инертными электродами
В U-образную трубку налить раствор сульфата
меди (II), опустить в него графитовые
электроды и пропустить электрический ток
через выпрямитель
18.
19.
20.
Опыт 3Электролиз водного раствора сульфата
меди (II) с активным медным анодом
Поменять местами электроды (опыт 2),
вследствие чего анод окажется омедненным.
Снова пропустить электрический ток
21.
22.
Опыт 4Электролиз водного раствора сульфата
натрия
В U-образную трубку налить раствор сульфата
натрия, опустить в него универсальные
индикаторы и графитовые электроды.
Пропустить электрический ток

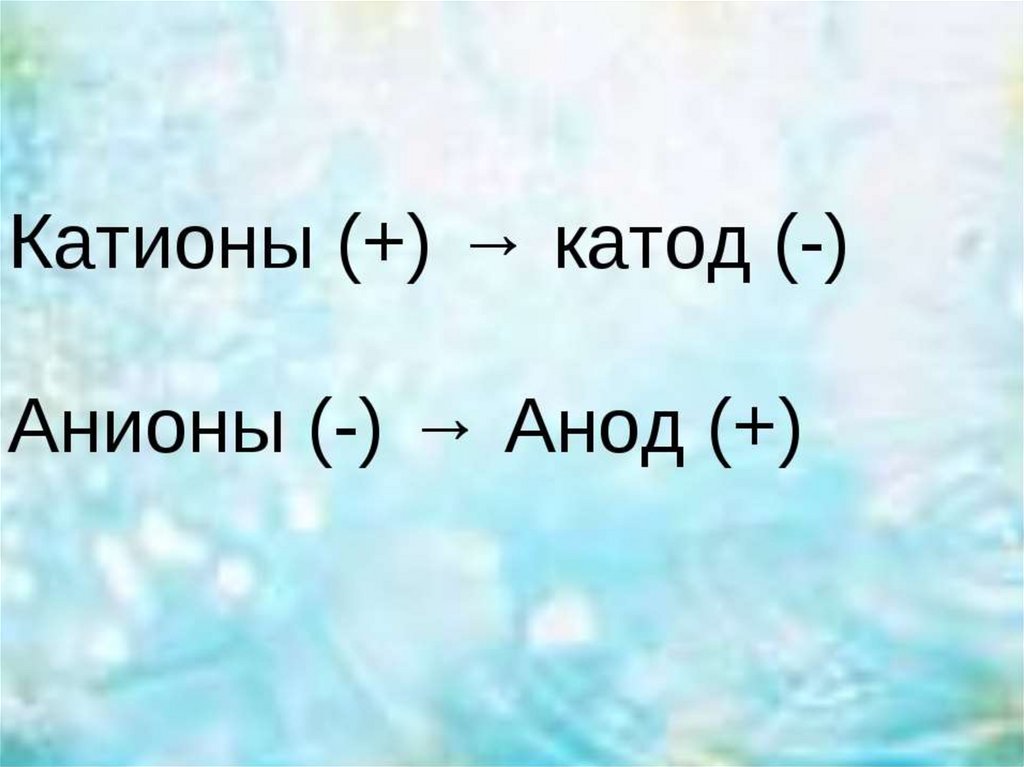
















 chemistry
chemistry








