Similar presentations:
Inżynieria materiałowa i konstrukcja urządzeń
1. INŻYNIERIA MATERIAŁOWA I KONSTRUKCJA URZĄDZEŃ
dr hab. inż. Marcin GnybaKatedra Metrologii i Optoelektroniki
pokój 346, tel. 347 24 82,
e-mail: mgnyba@eti.pg.edu.pl, marcin.gnyba@gmail.com
04.06.2021
1
2. ORGANIZACJA ZAJĘĆ
• WYKŁAD (II semestr) – 15 godzinI połowa semestru– 2 godziny/tydzień
• LABORATORIUM (II semestr) – 15 godzin
II połowa semestru – 2 godziny/tydzień
ZASADY ZALICZENIA - WSPÓLNA OCENA:
• Skala 0-100 pkt:
– 0-60 pkt. – wykład – jeden/dwa sprawdziany pisemne (każdy musi
zostać zaliczony)
– 0-40 pkt. – laboratorium – zaliczenie laboratorium
Konieczność uzyskania połowy punktów z każdej części!
-------------------------------------------------------------------------------
• PROJEKT (III semestr) – 15 godzin
04.06.2021
2
3. LITERATURA
1.Zdzisław Celiński, „Materiałoznawstwo elektrotechniczne”,
Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa
1998 (2005)
2.
Karol Radecki i wsp., „Materiały i elementy elektroniczne
bierne”, Wydawnictwa Politechniki Warszawskiej, Warszawa
1991
3.
Marek Blicharski, „Wstęp do inżynierii materiałowej”,
Wydawnictwa Naukowo-Techniczne, Warszawa 1998
4.
Henryk Rawa, „Podstawy elektromagnetyzmu”, Oficyna
Wydawnicza Politechniki Warszawskiej, Warszawa 1996
5.
S.O. Kasap, „Principles of Electronic Materials and Devices”,
McGraw-Hill International Edition 2006
6.
Franciszek Kostrubiec, „Podstawy fizyczne
materiałoznawstwa dla elektryków”, Politechnika Łódzka
04.06.2021
1999
3
4.
04.06.20214
5. TEMATYKA ZAJĘĆ
Jak działają układy (urządzenia) elektroniczne ?
Jak projektować urządzenia/układy?
Z czego budować? (materiały)
W jaki sposób budować? (technologia montażu)
DZIAŁY MATERIAŁOZNAWSTWA:
Nauka o materiałach
Technologia materiałów
Zastosowania materiałow
04.06.2021
5
6. TEMATYKA ZAJĘĆ
Podstawy budowy materii
– struktura atomu i wiązania chemiczne
– struktura krystaliczna
Materiały i elementy magnetyczne
– oddziaływanie materiałów z polem magnetycznym
– cewki indukcyjne i transformatory
– magnesy
– inne zastosowania magnetyków
Materiały i elementy dielektryczne
– właściwości fizyczne i polaryzacja dielektryków
– kondensatory
– materiały konstrukcyjne
– inne zastosowania dielektryków
Materiały i elementy rezystywne
– rezystory liniowe
– rezystory nieliniowe
04.06.2021
6
7. PODSTAWY BUDOWY MATERII
Kryterium podstawowe - oddziaływanie materiału z falą elektromagnetycznąEy
y
Velocity = c
Direction
of Propagation
x
z
x
HBzz
Fig. 3.1: The classical view of light as an electromagnetic wave. An
electromagnetic wave is a travelling wave which has time varying
electric and magnetic fields which are perpendicular to each other
and to the direction of propagation.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
7
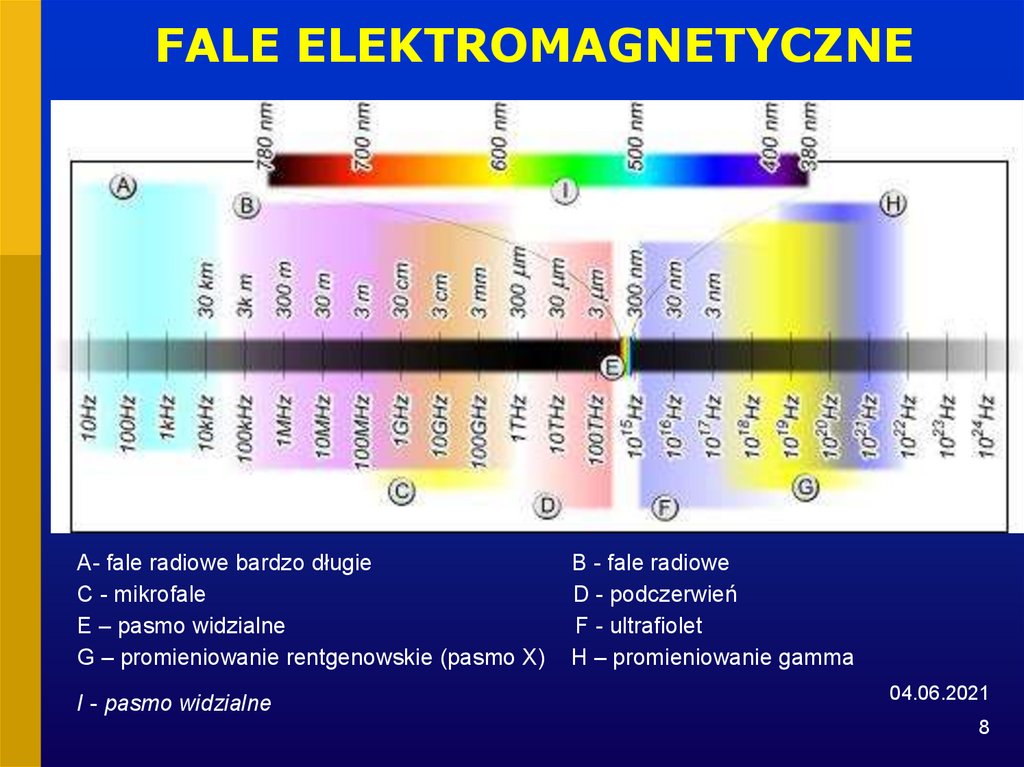
8. FALE ELEKTROMAGNETYCZNE
A- fale radiowe bardzo długieC - mikrofale
E – pasmo widzialne
G – promieniowanie rentgenowskie (pasmo X)
I - pasmo widzialne
B - fale radiowe
D - podczerwień
F - ultrafiolet
H – promieniowanie gamma
04.06.2021
8
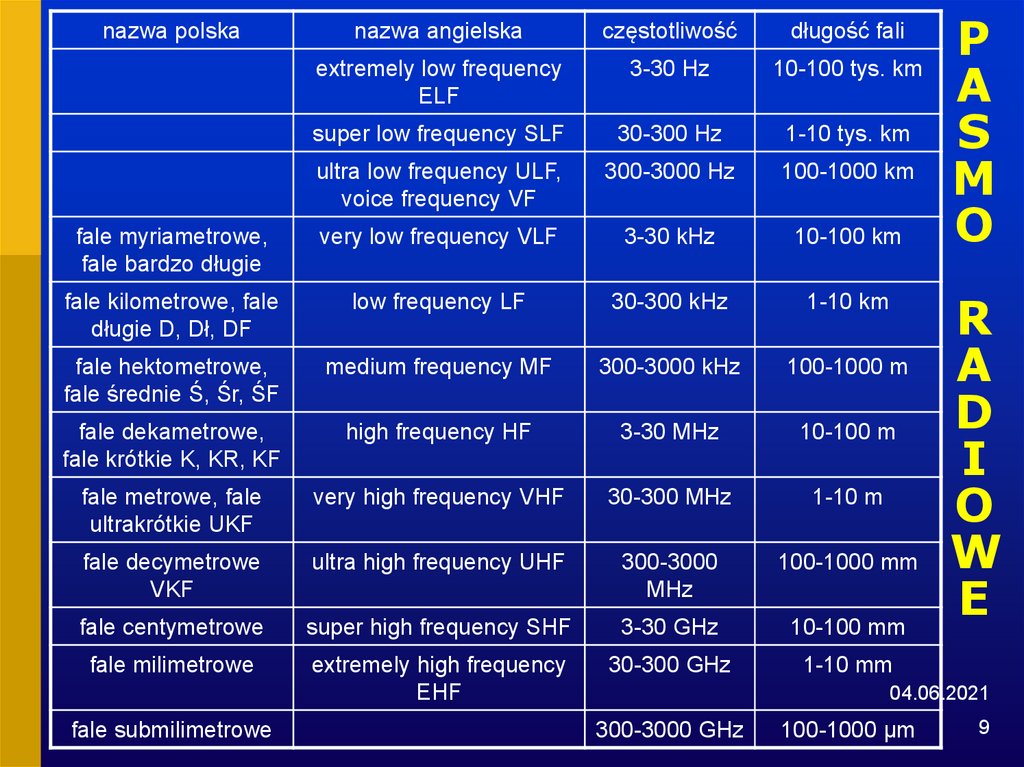
9. PASMO RADIOWE
nazwa angielskaczęstotliwość
długość fali
extremely low frequency
ELF
3-30 Hz
10-100 tys. km
super low frequency SLF
30-300 Hz
1-10 tys. km
ultra low frequency ULF,
voice frequency VF
300-3000 Hz
100-1000 km
fale myriametrowe,
fale bardzo długie
very low frequency VLF
3-30 kHz
10-100 km
fale kilometrowe, fale
długie D, Dł, DF
low frequency LF
30-300 kHz
1-10 km
fale hektometrowe,
fale średnie Ś, Śr, ŚF
medium frequency MF
300-3000 kHz
100-1000 m
fale dekametrowe,
fale krótkie K, KR, KF
high frequency HF
3-30 MHz
10-100 m
fale metrowe, fale
ultrakrótkie UKF
very high frequency VHF
30-300 MHz
1-10 m
fale decymetrowe
VKF
ultra high frequency UHF
300-3000
MHz
100-1000 mm
fale centymetrowe
super high frequency SHF
3-30 GHz
10-100 mm
fale milimetrowe
extremely high frequency
EHF
30-300 GHz
1-10 mm
nazwa polska
fale submilimetrowe
P
A
S
M
O
R
A
D
I
O
W
E
04.06.2021
300-3000 GHz
100-1000 μm
9
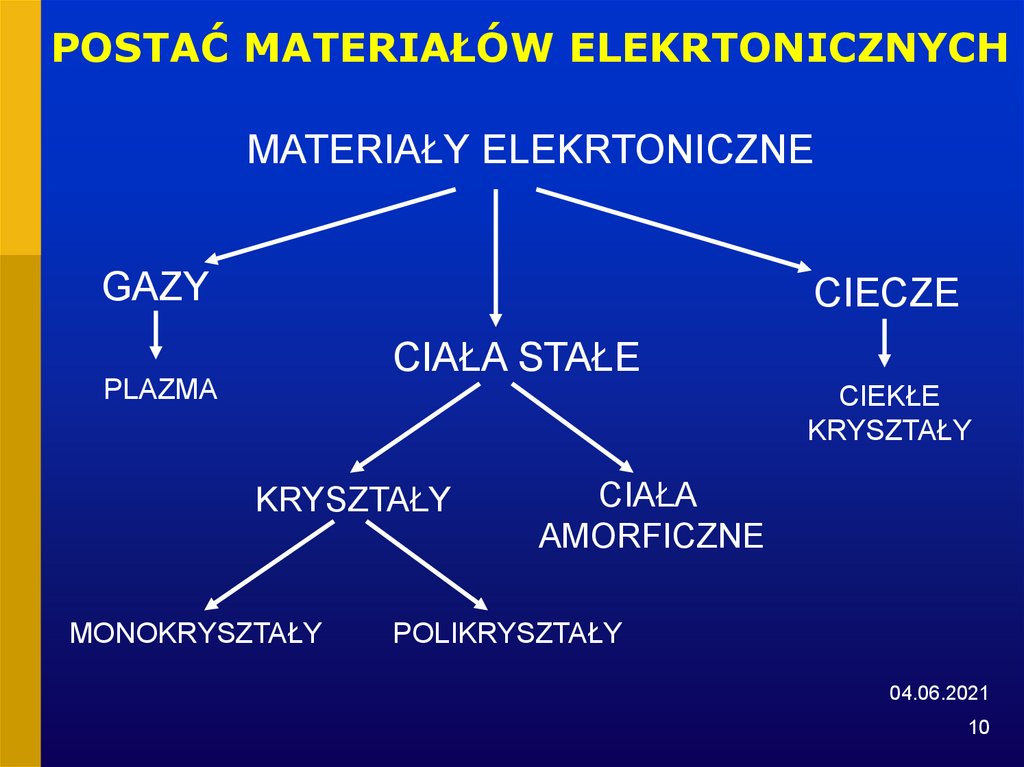
10. POSTAĆ MATERIAŁÓW ELEKRTONICZNYCH
MATERIAŁY ELEKRTONICZNEGAZY
CIECZE
CIAŁA STAŁE
PLAZMA
CIEKŁE
KRYSZTAŁY
KRYSZTAŁY
MONOKRYSZTAŁY
CIAŁA
AMORFICZNE
POLIKRYSZTAŁY
04.06.2021
10
11.
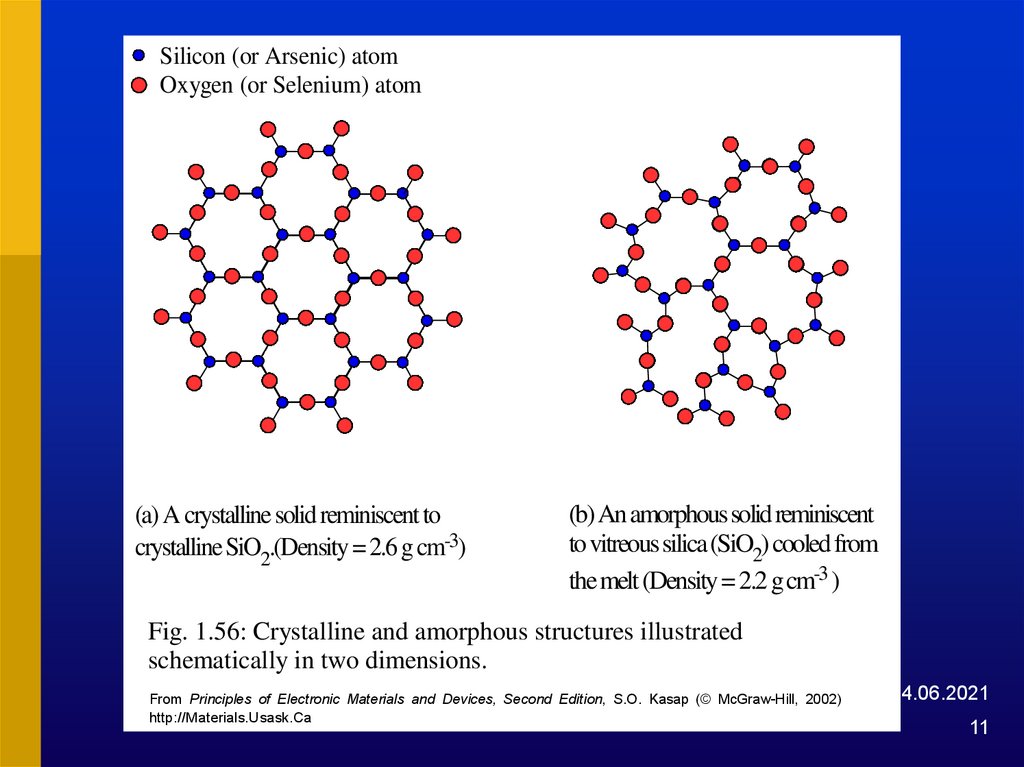
Silicon (or Arsenic) atomOxygen (or Selenium) atom
(a) A crystalline solid reminiscent to
crystalline SiO2.(Density = 2.6 g cm-3)
(b) An amorphous solid reminiscent
to vitreous silica (SiO2) cooled from
the melt (Density = 2.2 g cm-3 )
Fig. 1.56: Crystalline and amorphous structures illustrated
schematically in two dimensions.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
11
12. PODSTAWY BUDOWY MATERII
Pojęcie struktury materiału obejmuje:1) Charakterystykę uporządkowania atmowego
2) Opis wielkości, kształtu i jednorodności, ewentualnie
uprzywilejowanej orientacji ziaren w układach
polikrystalicznych
3) Rodzaj, liczbę i rozmieszczenie faz w układach
wieloskładnikowych
4) Opis makrostruktury – niejednorodności i defektów
odnoszących się do większych obszarów materiału
5) Charakterystykę naprężeń własnych
04.06.2021
12
13. BUDOWA ATOMU
L shell withtwo subshells
Nucleus
1s
K
L
2s
2p
1s22s22p2 or [He]2s22p2
Fig. 1.1: The shell model of the atom in which the electrons are
confined to live within certain shells and in subshells within shells.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
B
U
D
O
W
A
A
T
O
M
U
04.06.2021
13
14. BUDOWA ATOMU
1. Główna liczba kwantowa nokreśla numer porządkowy powłoki elektronowej i rozmiary orbity;
przybiera wartości kolejnych liczb naturalnych: 1 (powłoka K), 2 (L),
3 (M), 4 (N), 5 (O), 6 (P), 7 (Q)…
2. Orbitalna liczba kwantowa l
określa możliwość istnienia w poszczególnych powłokach warstw
orbit o jednakowych kształtach – podpowłok; określa kształt orbity;
może przybierać skończoną ilość wartości (maksymalnie n)
04.06.2021
14
15. ORBITALNA LICZBA KWANTOWA
04.06.2021Zdzisław Celiński, „Materiałoznawstwo elektrotechniczne”, Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 1998 (2005)
15
16. BUDOWA ATOMU
1. Główna liczba kwantowa nokreśla numer porządkowy powłoki elektronowej i rozmiary orbity;
przybiera wartości kolejnych liczb naturalnych: 1 (powłoka K), 2 (L),
3 (M), 4 (N), 5 (O), 6 (P), 7 (Q)…
2. Orbitalna liczba kwantowa l
określa możliwość istnienia w poszczególnych powłokach warstw
orbit o jednakowych kształtach – podpowłok; określa kształt orbity;
może przybierać skończoną ilość wartości (maksymalnie n)
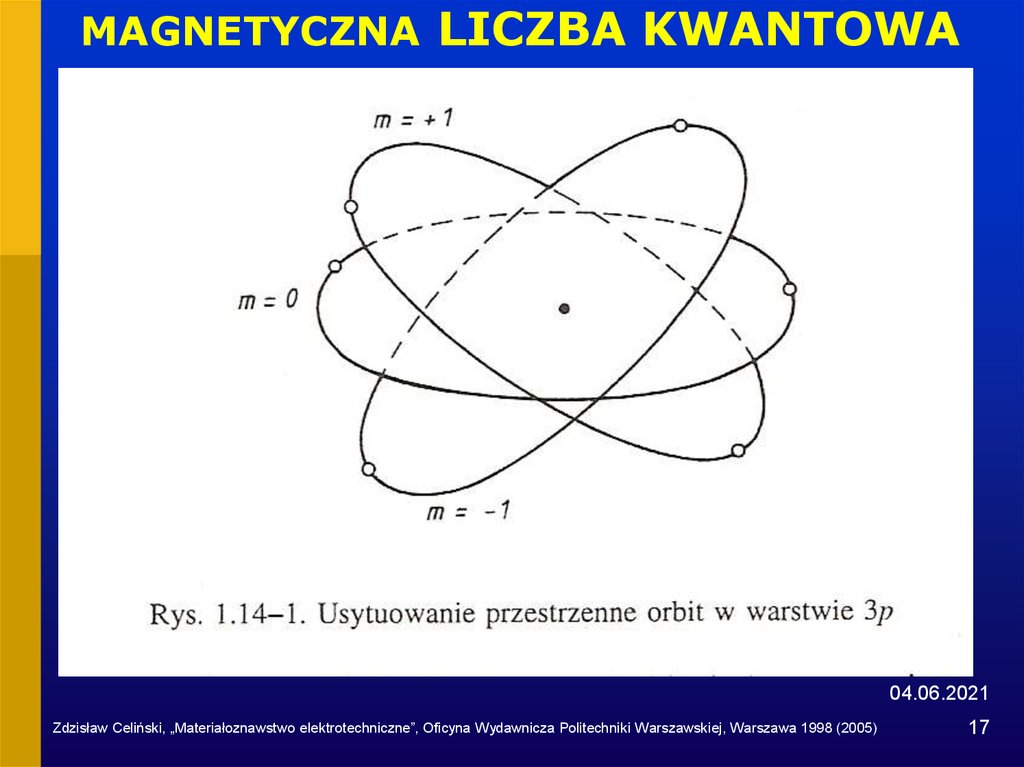
3. Magnetyczna liczba kwantowa m
określa orientację przestrzenną orbity; może przybierać 2l+1
całkowitych wartości, zawartych między –l i +l
04.06.2021
16
17. MAGNETYCZNA LICZBA KWANTOWA
04.06.2021Zdzisław Celiński, „Materiałoznawstwo elektrotechniczne”, Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 1998 (2005)
17
18. BUDOWA ATOMU
1. Główna liczba kwantowa nokreśla numer porządkowy powłoki elektronowej i rozmiary orbity;
przybiera wartości kolejnych liczb naturalnych: 1 (powłoka K), 2 (L),
3 (M), 4 (N), 5 (O), 6 (P), 7 (Q)…
2. Orbitalna liczba kwantowa l
określa możliwość istnienia w poszczególnych powłokach warstw
orbit o jednakowych kształtach – podpowłok; określa kształt orbity;
może przybierać skończoną ilość wartości (maksymalnie n)
3. Magnetyczna liczba kwantowa m
określa orientację przestrzenną orbity; może przybierać 2l+1
całkowitych wartości, zawartych między –l i +l
4. Spinowa liczba kwantowa s
może przyjmować tylko dwie wartości: +1/2 i -1/2; opisuje dwa
04.06.2021
możliwe kierunki wirowania elektronu wokół własnej osi
18
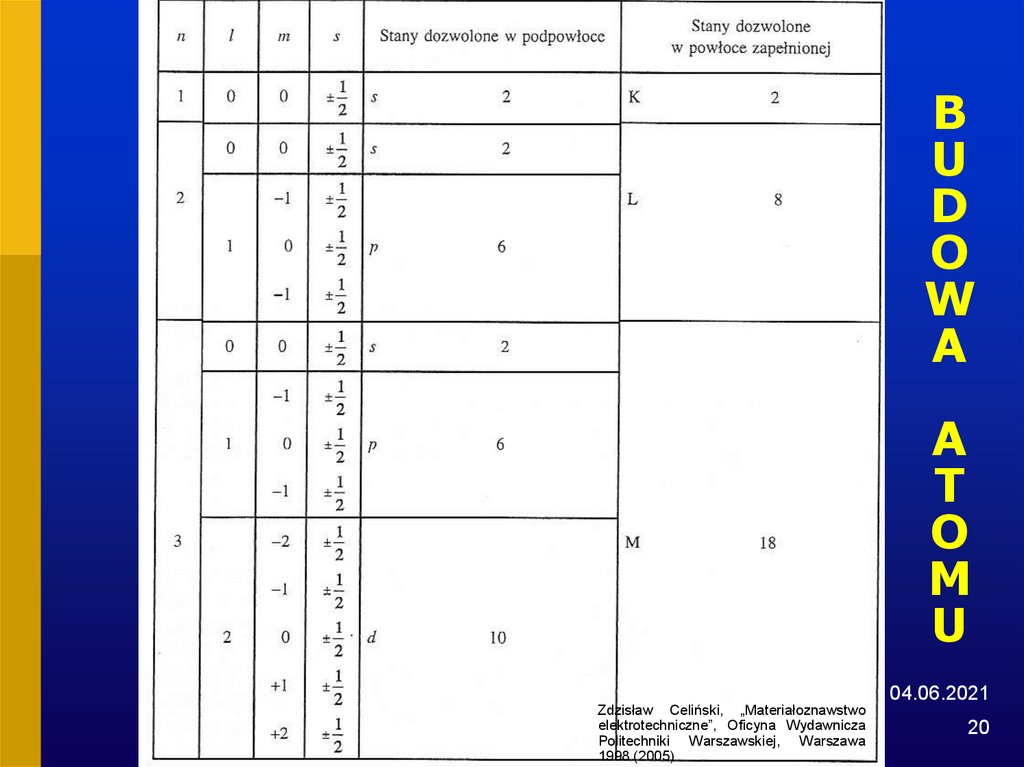
19. BUDOWA ATOMU
Table 1.1Maximum possible number of electrons in the shells and subshells of an atom.
---------------------------------------------------------------------------------------------------Subshell
l =
n
0
1
2
3
s
p
d
f
Shell
---------------------------------------------------------------------------------------------------1
K
2
2
L
2
6
3
M
2
6
10
4
N
2
6
10
---------------------------------------------------------------------------------------------------From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
14
B
U
D
O
W
A
A
T
O
M
U
04.06.2021
19
20. BUDOWA ATOMU
BU
D
O
W
A
A
T
O
M
U
Zdzisław Celiński, „Materiałoznawstwo
elektrotechniczne”, Oficyna Wydawnicza
Politechniki Warszawskiej, Warszawa
1998 (2005)
04.06.2021
20
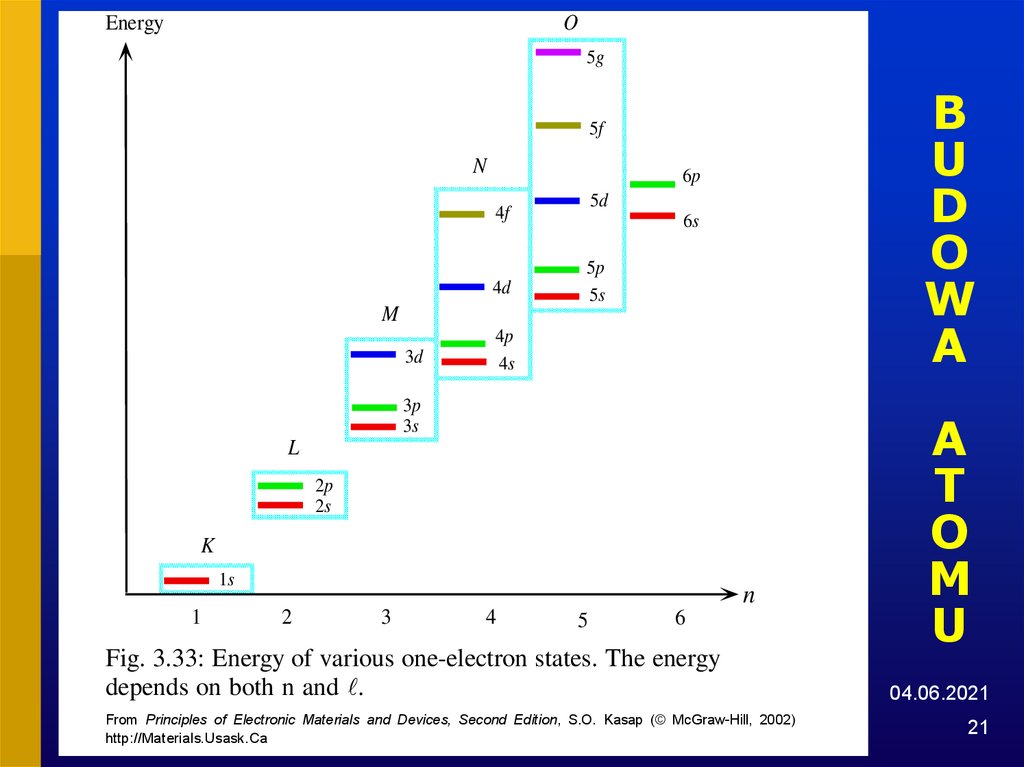
21. BUDOWA ATOMU
OEnergy
5g
B
U
D
O
W
A
5f
N
6p
5d
4f
4d
6s
5p
5s
M
3d
4p
4s
3p
3s
L
2p
2s
K
1s
1
n
2
3
4
5
6
Fig. 3.33: Energy of various one-electron states. The energy
depends on both n and .
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
A
T
O
M
U
04.06.2021
21
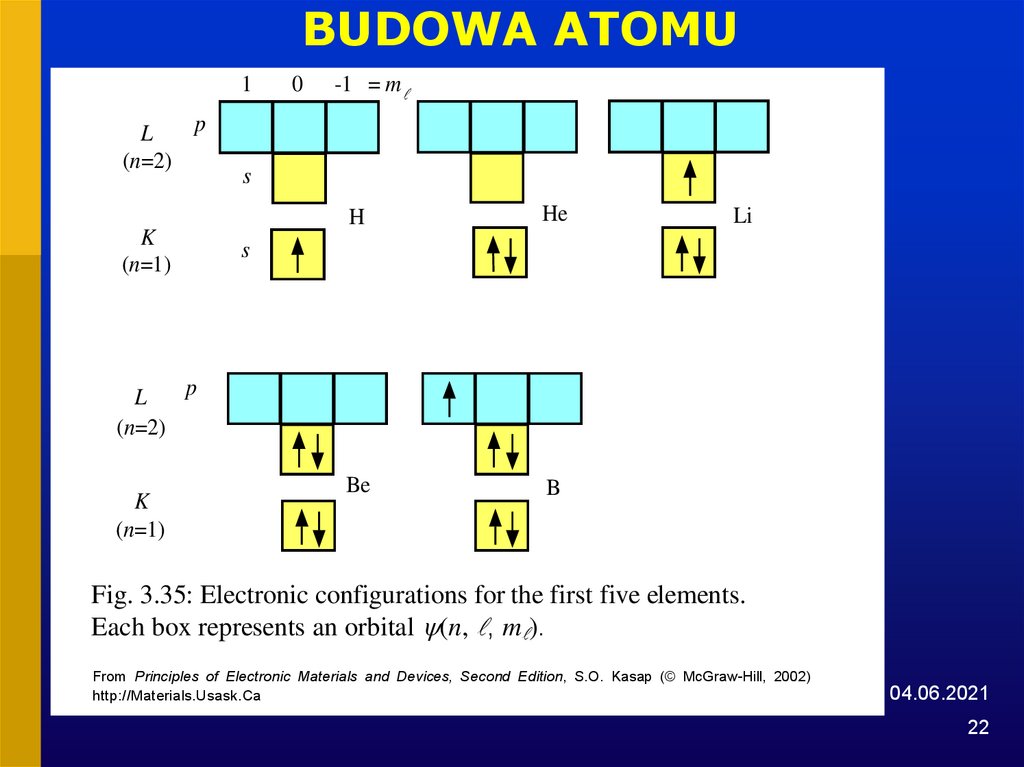
22.
BUDOWA ATOMU1
p
L
(n=2)
K
(n=1)
0
-1 = m
s
H
He
Be
B
Li
s
p
L
(n=2)
K
(n=1)
Fig. 3.35: Electronic configurations for the first five elements.
Each box represents an orbital (n, , m ).
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
22
23. BUDOWA ATOMU
CO
N
p
L
s
K
s
F
Ne
p
L
s
K
s
Fig. 3.36: Electronic configurations for C, N, O, F and Ne atoms.
Notice that Hund's rule forces electrons to align their spins in C, N
and O. The Ne atom has all the K and L orbitals full.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
23
24. BUDOWA ATOMU
BU
D
O
W
A
A
T
O
M
U
Zdzisław Celiński, „Materiałoznawstwo
elektrotechniczne”, Oficyna Wydawnicza
Politechniki Warszawskiej, Warszawa
1998 (2005)
04.06.2021
24
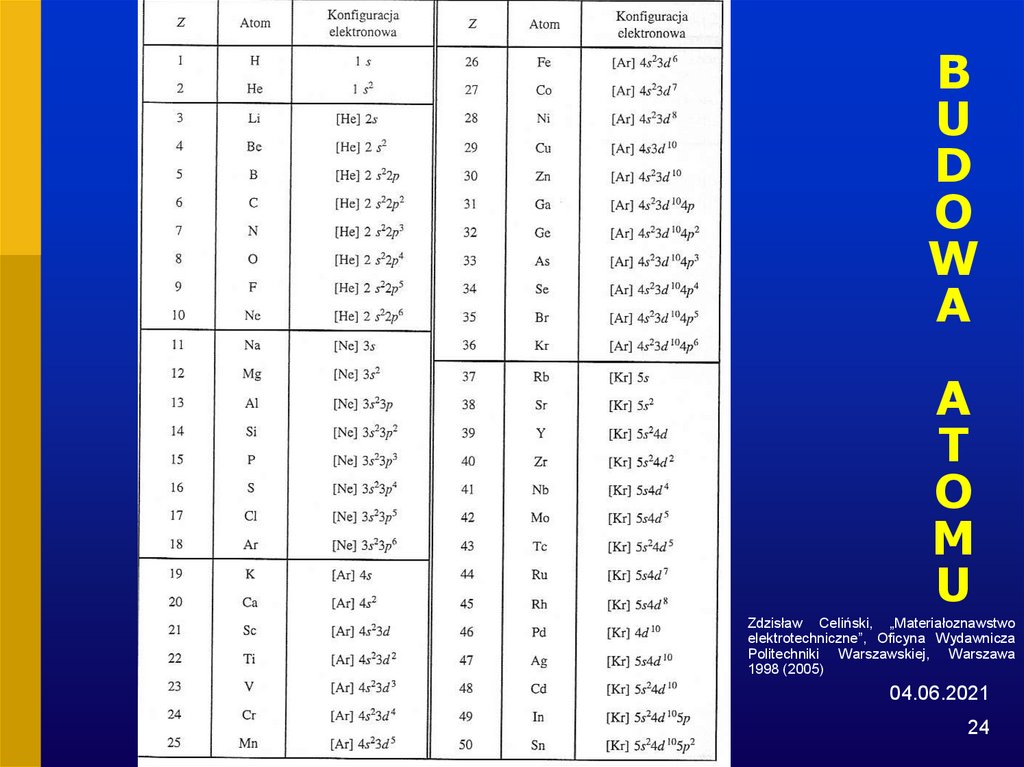
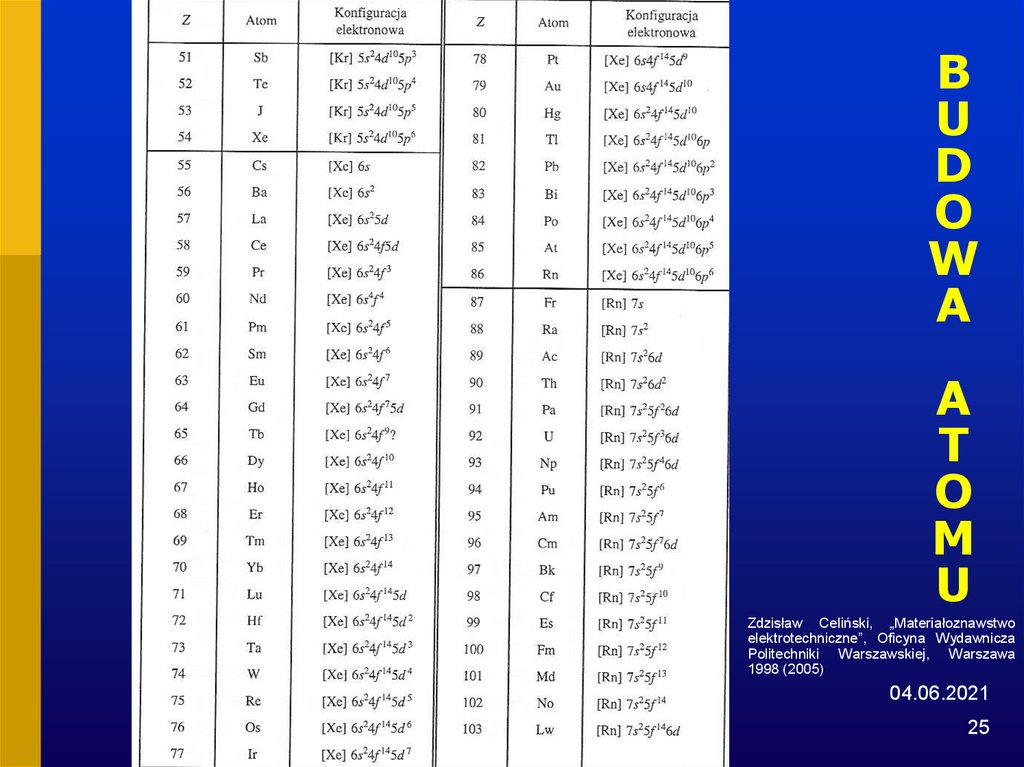
25. BUDOWA ATOMU
BU
D
O
W
A
A
T
O
M
U
Zdzisław Celiński, „Materiałoznawstwo
elektrotechniczne”, Oficyna Wydawnicza
Politechniki Warszawskiej, Warszawa
1998 (2005)
04.06.2021
25
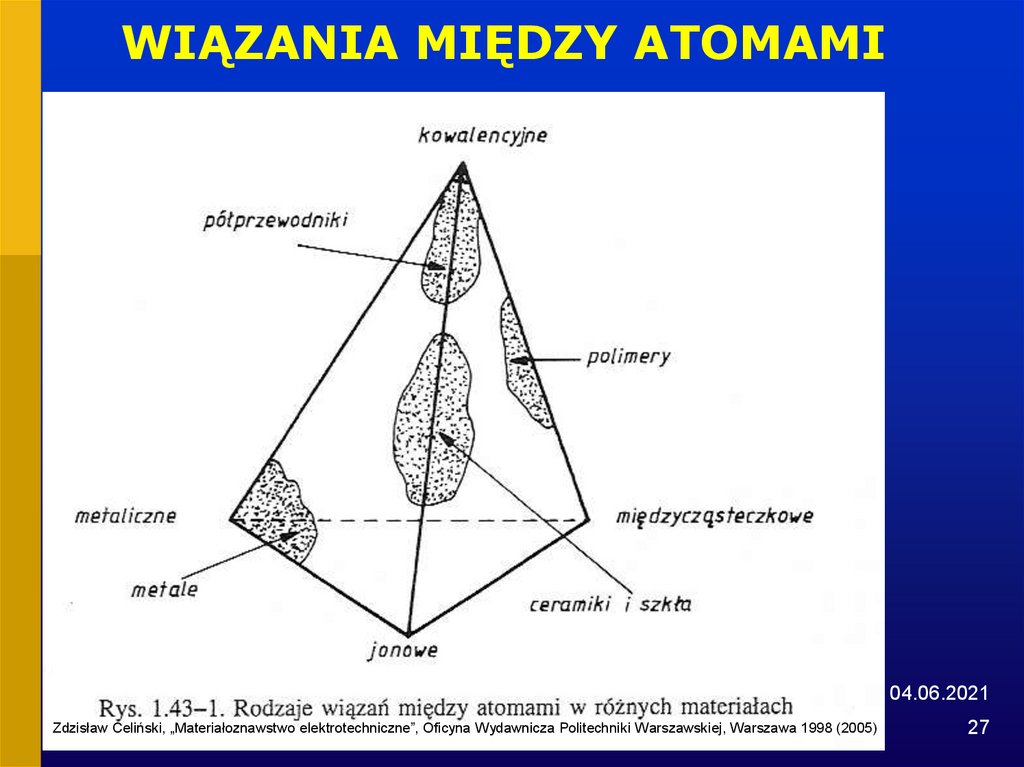
26. WIĄZANIA MIĘDZY ATOMAMI
1. Wiązania metalicznemetale
2. Wiązania kowalencyjne
półprzewodniki, polimery, ceramiki i szkła
3. Wiązania jonowe
sole, ceramiki i szkła
4. Wiązania międzycząsteczkowe (van der
Waalsa)
polimery
04.06.2021
26
27. WIĄZANIA MIĘDZY ATOMAMI
04.06.2021Zdzisław Celiński, „Materiałoznawstwo elektrotechniczne”, Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 1998 (2005)
27
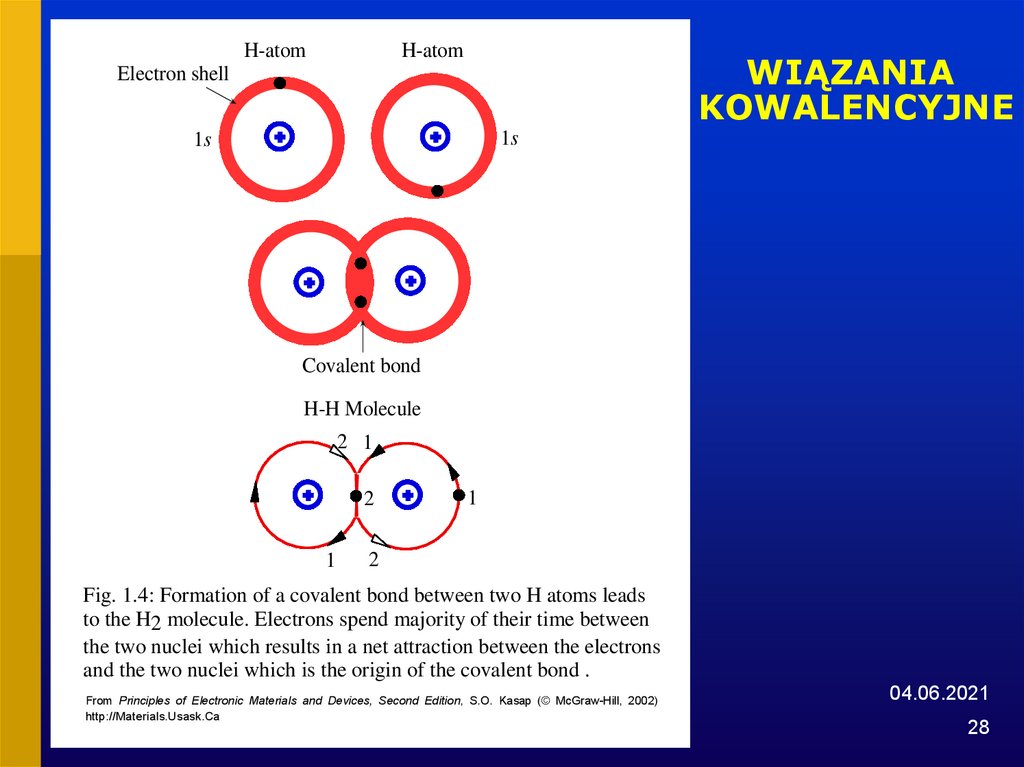
28. WIĄZANIA KOWALENCYJNE
H-atomH-atom
WIĄZANIA
KOWALENCYJNE
Electron shell
1s
1s
Covalent bond
H-H Molecule
2 1
2
1
1
2
Fig. 1.4: Formation of a covalent bond between two H atoms leads
to the H2 molecule. Electrons spend majority of their time between
the two nuclei which results in a net attraction between the electrons
and the two nuclei which is the origin of the covalent bond .
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
28
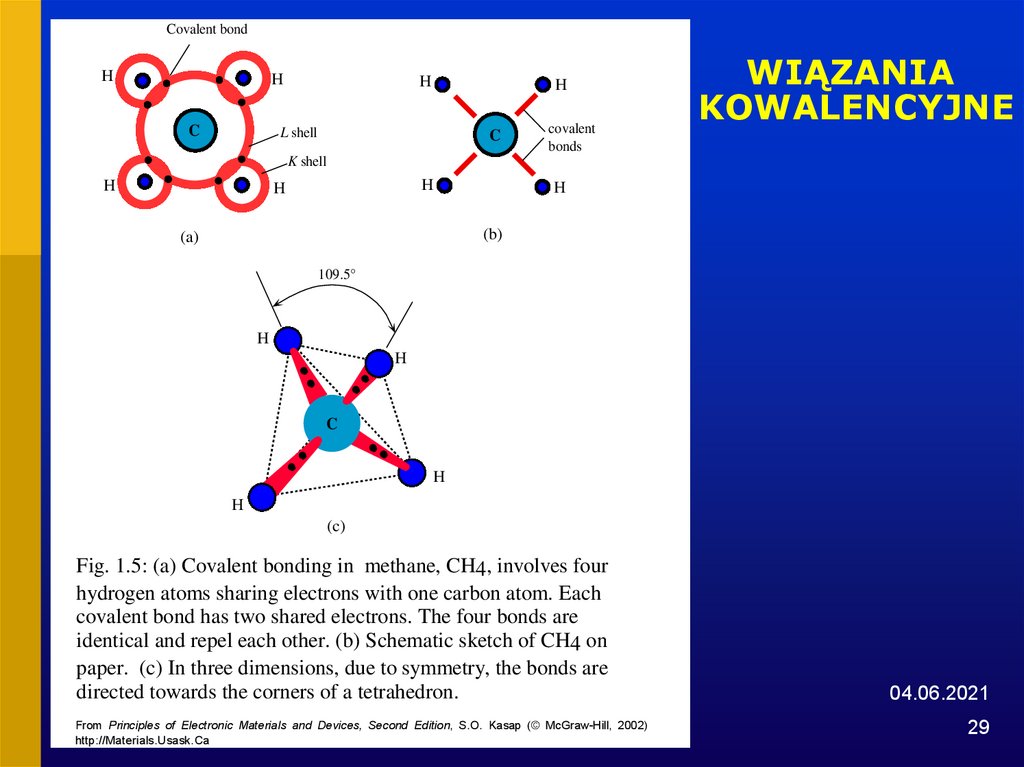
29.
Covalent bondH
H
C
H
H
L shell
C
covalent
bonds
WIĄZANIA
KOWALENCYJNE
K shell
H
H
H
H
(b)
(a)
109.5°
H
H
C
H
H
(c)
Fig. 1.5: (a) Covalent bonding in methane, CH4, involves four
hydrogen atoms sharing electrons with one carbon atom. Each
covalent bond has two shared electrons. The four bonds are
identical and repel each other. (b) Schematic sketch of CH4 on
paper. (c) In three dimensions, due to symmetry, the bonds are
directed towards the corners of a tetrahedron.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
29
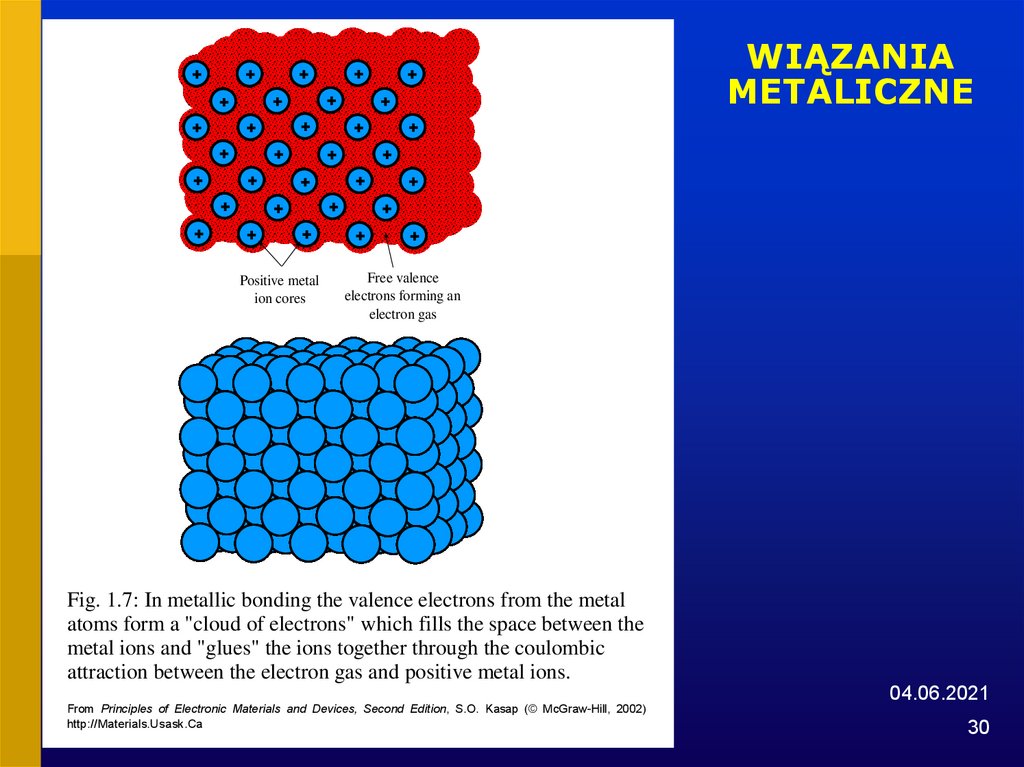
30. WIĄZANIA METALICZNE
Positive metalion cores
Free valence
electrons forming an
electron gas
Fig. 1.7: In metallic bonding the valence electrons from the metal
atoms form a "cloud of electrons" which fills the space between the
metal ions and "glues" the ions together through the coulombic
attraction between the electron gas and positive metal ions.
04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
30
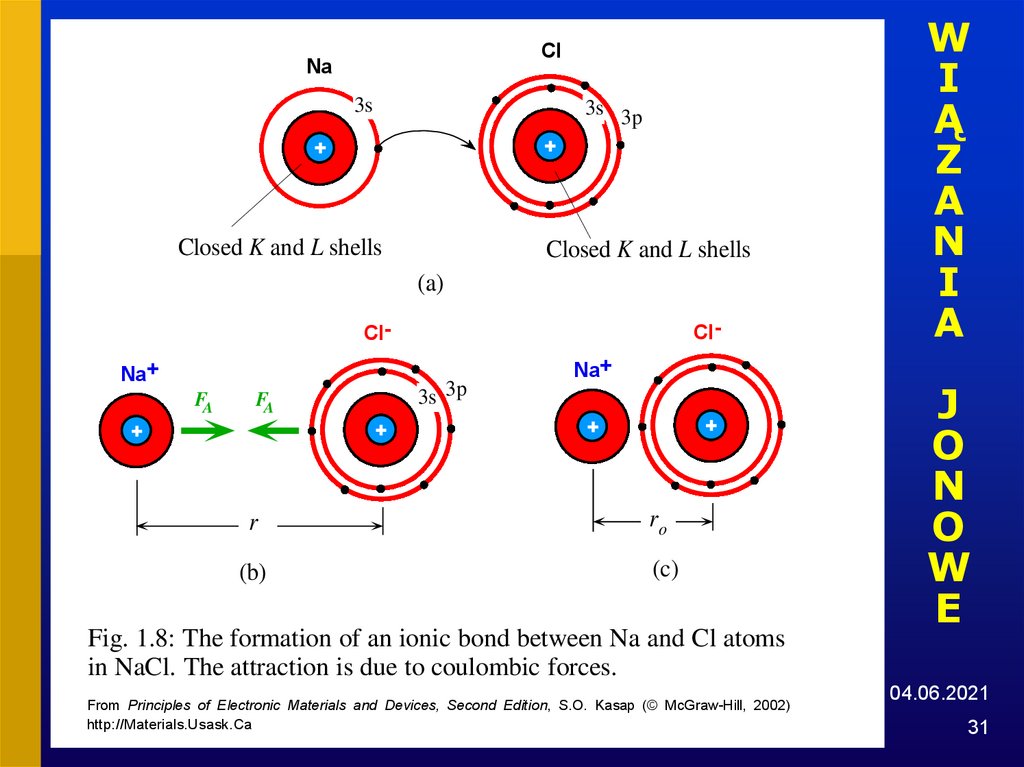
31.
ClNa
3s
3s 3p
Closed K and L shells
Closed K and L shells
(a)
Cl-
ClNa+
FA
FA
r
(b)
3s 3p
Na+
ro
(c)
Fig. 1.8: The formation of an ionic bond between Na and Cl atoms
in NaCl. The attraction is due to coulombic forces.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
W
I
Ą
Z
A
N
I
A
J
O
N
O
W
E
04.06.2021
31
32.
Na+Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
(a)
W
I
Ą
Z
A
N
I
A
(b)
Fig. 1.9: (a) A schematic illustration of a cross section from solid
NaCl. NaCl solid is made of Cl- and Na+ ions arranged alternatingly
so that the oppositely charged ions are closest to each other and
attract each other. There are also repulsive forces between the likeions. In equilibrium the net force acting on any ion is zero. (b) Solid
NaCl.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
J
O
N
O
W
E
04.06.2021
32
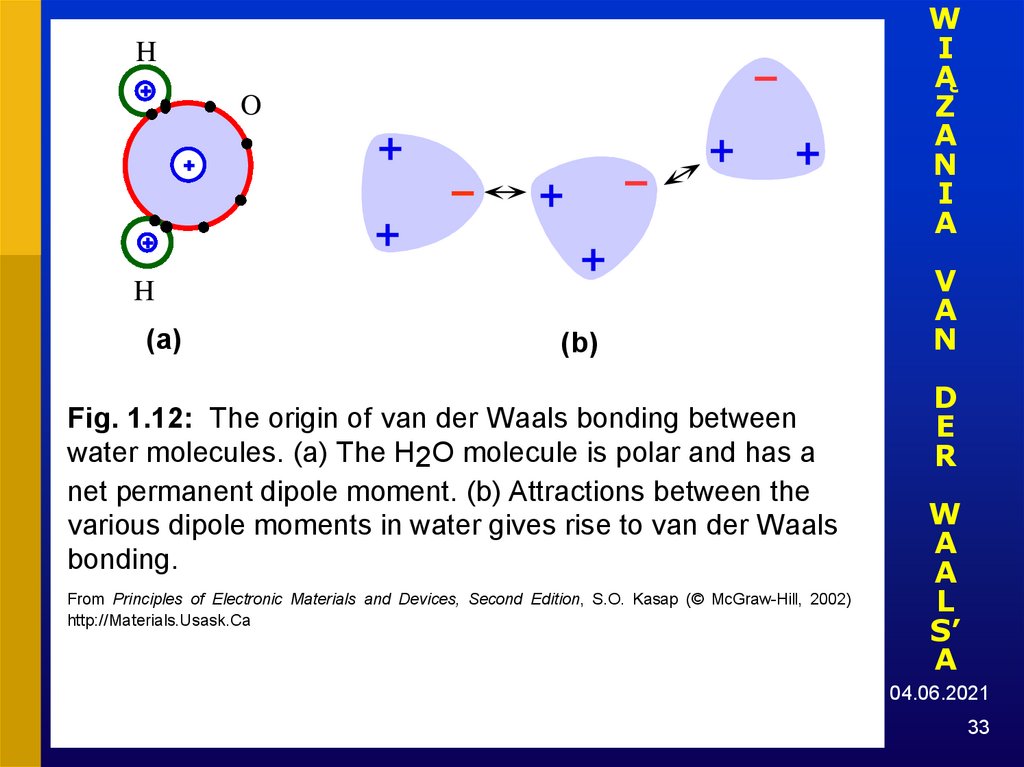
33.
WI
Ą
Z
A
N
I
A
H
O
H
(a)
(b)
Fig. 1.12: The origin of van der Waals bonding between
water molecules. (a) The H2O molecule is polar and has a
net permanent dipole moment. (b) Attractions between the
various dipole moments in water gives rise to van der Waals
bonding.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
V
A
N
D
E
R
W
A
A
L
S’
A
04.06.2021
33
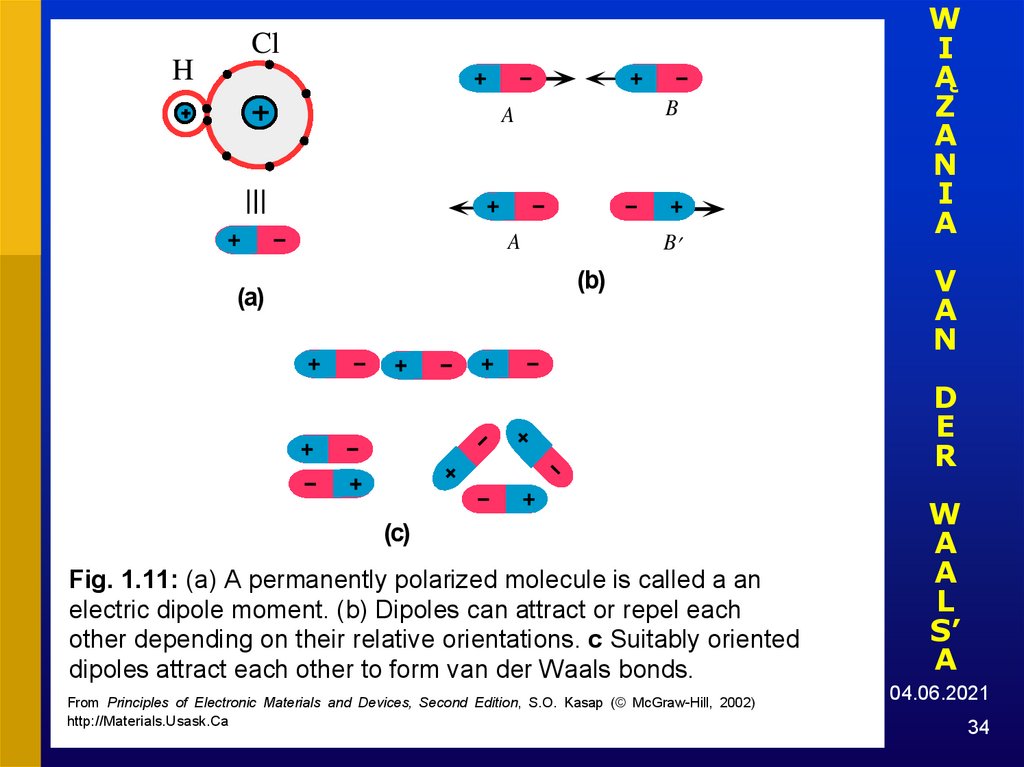
34.
HCl
A
B
A
B
(b)
(a)
W
I
Ą
Z
A
N
I
A
V
A
N
D
E
R
(c)
Fig. 1.11: (a) A permanently polarized molecule is called a an
electric dipole moment. (b) Dipoles can attract or repel each
other depending on their relative orientations. c Suitably oriented
dipoles attract each other to form van der Waals bonds.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
W
A
A
L
S’
A
04.06.2021
34
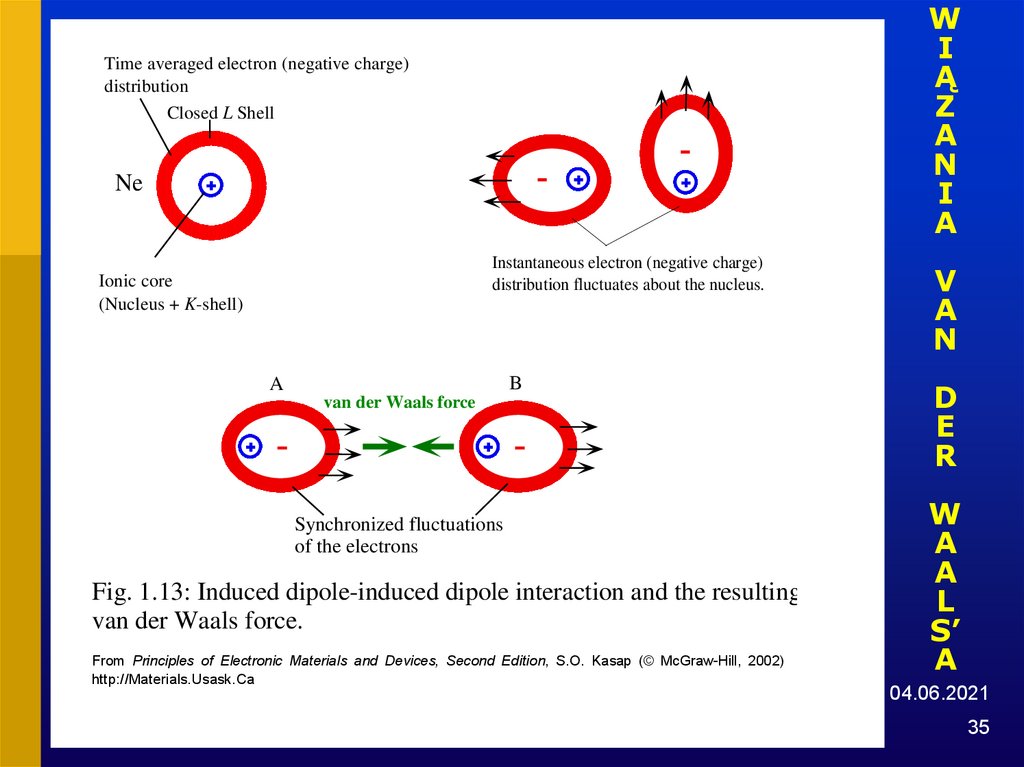
35.
WI
Ą
Z
A
N
I
A
Time averaged electron (negative charge)
distribution
Closed L Shell
Ne
Instantaneous electron (negative charge)
distribution fluctuates about the nucleus.
Ionic core
(Nucleus + K-shell)
B
A
van der Waals force
Synchronized fluctuations
of the electrons
Fig. 1.13: Induced dipole-induced dipole interaction and the resulting
van der Waals force.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
V
A
N
D
E
R
W
A
A
L
S’
A
04.06.2021
35
36.
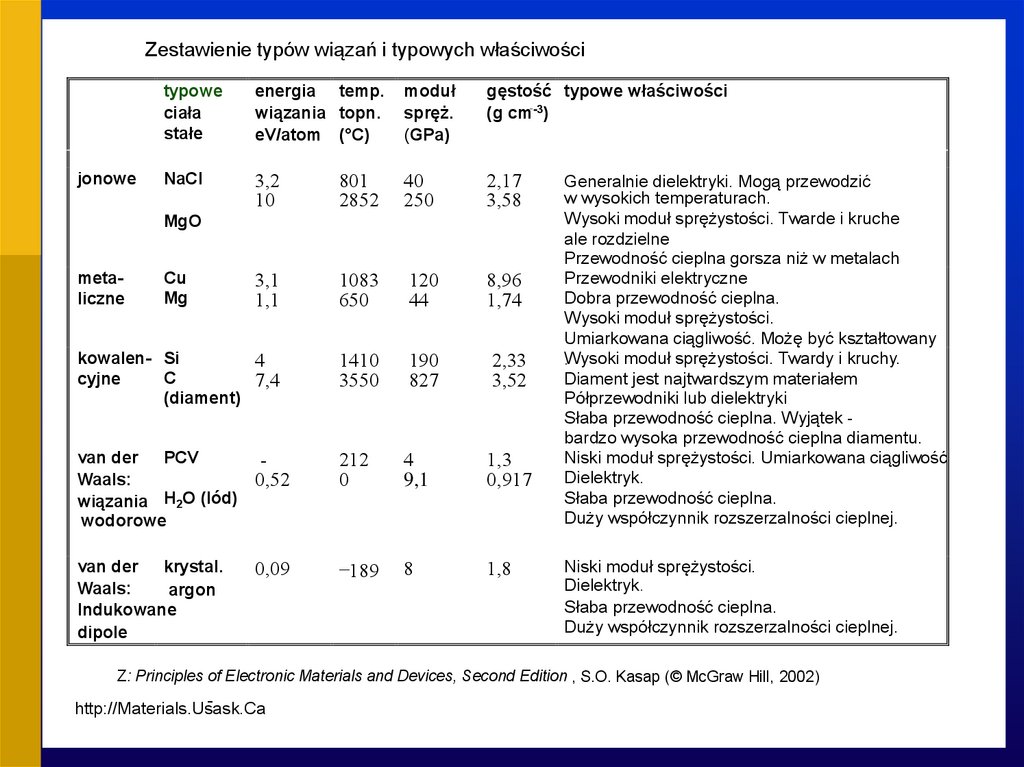
Zestawienie typów wiązań i typowych właściwościtypowe
ciała
stałe
energia temp.
wiązania topn.
eV/atom (°C)
moduł
spręż.
(GPa)
gęstość typowe właściwości
(g cm--3)
NaCl
3,2
10
801
2852
40
250
2,17
3,58
3,1
1,1
1083
650
120
44
8,96
1,74
kowalen- Si
4
C
cyjne
7,4
(diament)
1410
3550
190
827
2,33
3,52
jonowe
MgO
metaliczne
Cu
Mg
van der PCV
Waals:
wiązania H2O (lód)
wodorowe
0,52
212
0
4
9,1
1,3
0,917
van der krystal..
Waals:
argon
Indukowane
dipole
0,09
-189
8
1,8
Generalnie dielektryki. Mogą przewodzić
w wysokich temperaturach.
Wysoki moduł sprężystości. Twarde i kruche
ale rozdzielne
Przewodność cieplna gorsza niż w metalach
Przewodniki elektryczne
Dobra przewodność cieplna.
Wysoki moduł sprężystości.
Umiarkowana ciągliwość. Możę być kształtowany
Wysoki
moduł sprężystości. Twardy i kruchy.
.
Diament jest najtwardszym materiałem
Półprzewodniki lub dielektryki
Słaba przewodność cieplna. Wyjątek bardzo wysoka przewodność cieplna diamentu.
Niski moduł sprężystości. Umiarkowana ciągliwość
Dielektryk.
Słaba przewodność cieplna.
Duży współczynnik rozszerzalności cieplnej.
Niski moduł sprężystości.
Dielektryk.
Słaba przewodność cieplna.
Duży współczynnik rozszerzalności cieplnej.
Z: Principles of Electronic Materials and Devices, Second Edition , S.O. Kasap (© McGraw Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
36
37.
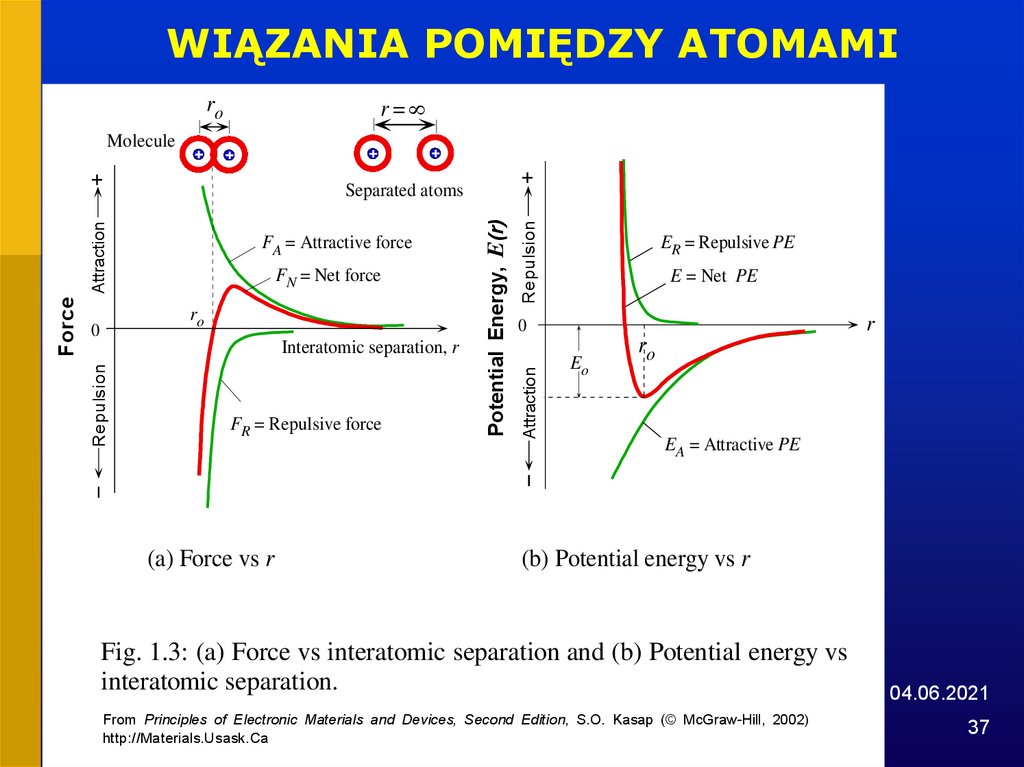
WIĄZANIA POMIĘDZY ATOMAMIr=
ro
Molecule
Interatomic separation, r
FR = Repulsive force
(a) Force vs r
Repulsion
FN = Net force
Potential Energy, E(r)
Attraction
FA = Attractive force
ro
0
Repulsion
Force
+
Separated atoms
ER = Repulsive PE
E = Net PE
r
0
Attraction
+
Eo
ro
EA = Attractive PE
(b) Potential energy vs r
Fig. 1.3: (a) Force vs interatomic separation and (b) Potential energy vs
interatomic separation.
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
37
38.
STRUKTURA KRYSTALICZNAMonokryształy – pojedyńcze duże kryształy.
Polikryształy – ciała składające się z wielu zrośniętych
kryształów makroskopijnej lub mikroskopijnej wielkości –
krystalitów.
Ciała amorficzne (bezpostaciowe) – istnieje
uporządkowanie jedynie bliskiego zasięgu – na
przestrzeni kilku odległości międzyatomowych występują
wyraźnie odchylenia od regularnej struktury
przestrzennej; uzyskiwane (szkła) poprzez
przechłodzenie cieczy poniżej temperatury topnienia;
izotropowe.
Nanokryształy
04.06.2021
38
39.
STRUKTURA KRYSTALICZNA04.06.2021
39
40.
STRUKTURA KRYSTALICZNA04.06.2021
40
41.
STRUKTURA KRYSTALICZNA04.06.2021
41
42.
STRUKTURA KRYSTALICZNA04.06.2021
42
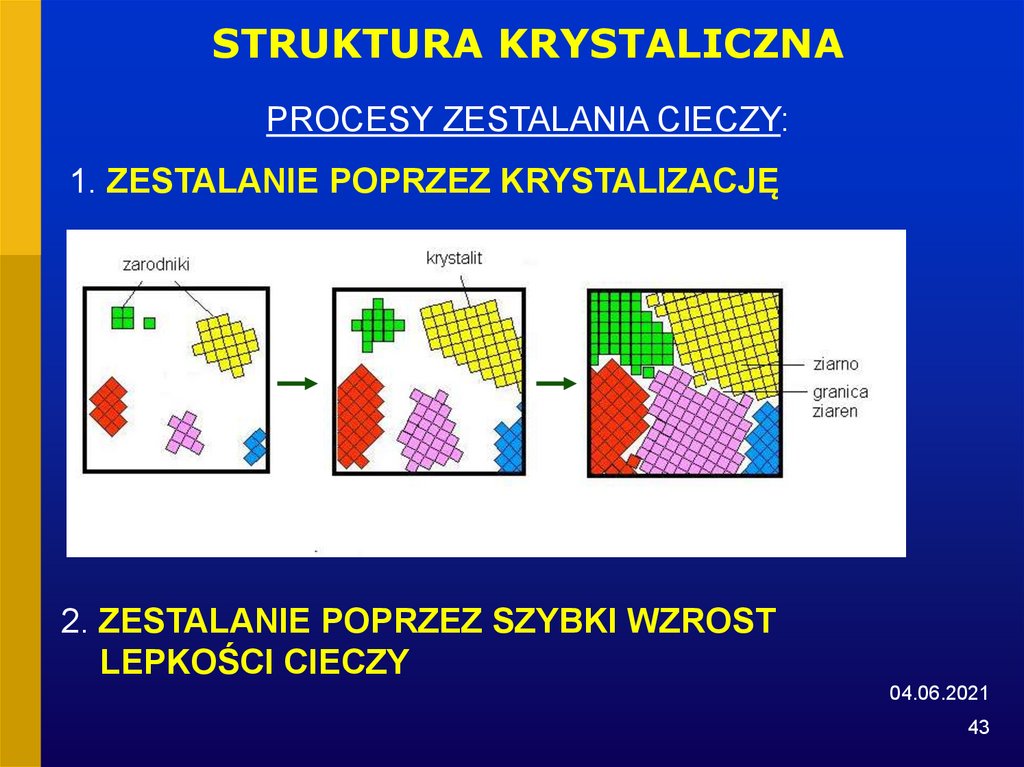
43.
STRUKTURA KRYSTALICZNAPROCESY ZESTALANIA CIECZY:
1. ZESTALANIE POPRZEZ KRYSTALIZACJĘ
2. ZESTALANIE POPRZEZ SZYBKI WZROST
LEPKOŚCI CIECZY
04.06.2021
43
44.
IZOTROPIA i ANIZOTROPIAAnizotropia (an- 'nie'; gr. isos 'równy, jednakowy'; gr. trópos 'zwrot, obrót') –
zależność od kierunku. Wykazywanie odmiennych właściwości (np.
rozszerzalność termiczna, przewodnictwo elektryczne, współczynnik załamania
światła, szybkość wzrostu i rozpuszczania kryształu) w zależności od kierunku.
Przeciwieństwem anizotropii jest izotropowość.
Kryształ jest anizotropowy ze względu na rozpatrywaną własność.
Wielkości niezależne od kierunku: masa, objętość -> gęstość
Od kierunku pomiaru mogą zależeć:
•przewodność elektryczna,
•przewodnictwo cieplne,
•polaryzacja dielektryka pod wpływem pola elektrycznego (podatność dielektryczna),
•zmiana indukcji magnetycznej w para- i diamagnetykach pod wpływem pola
magnetycznego (przenikalność para- i diamagnetyczna),
•polaryzacja kryształu wywołana przez naprężenia mechaniczne (piezoelektryczność),
•odkształcenie spowodowane działaniem naprężenia mechanicznego (sprężystość),
•dwójłomność pod wpływem pola elektrycznego (zjawisko elektrooptyczne) lub
naprężenia (zjawisko elastooptyczne).
04.06.2021
44
45.
IZOTROPIA i ANIZOTROPIAMateriał izotropowy:
j1 = σE1,
j2 = σE2,
j3 = σE3
Kryształ anizotropowy:
j1 = σ11E1+ σ12E2+ σ13E3
j2 = σ21E1+ σ22E2+ σ23E3
j3 = σ31E1+ σ32E2+ σ33E3
11 12 13
21 22 23
31 32 33
04.06.2021
45
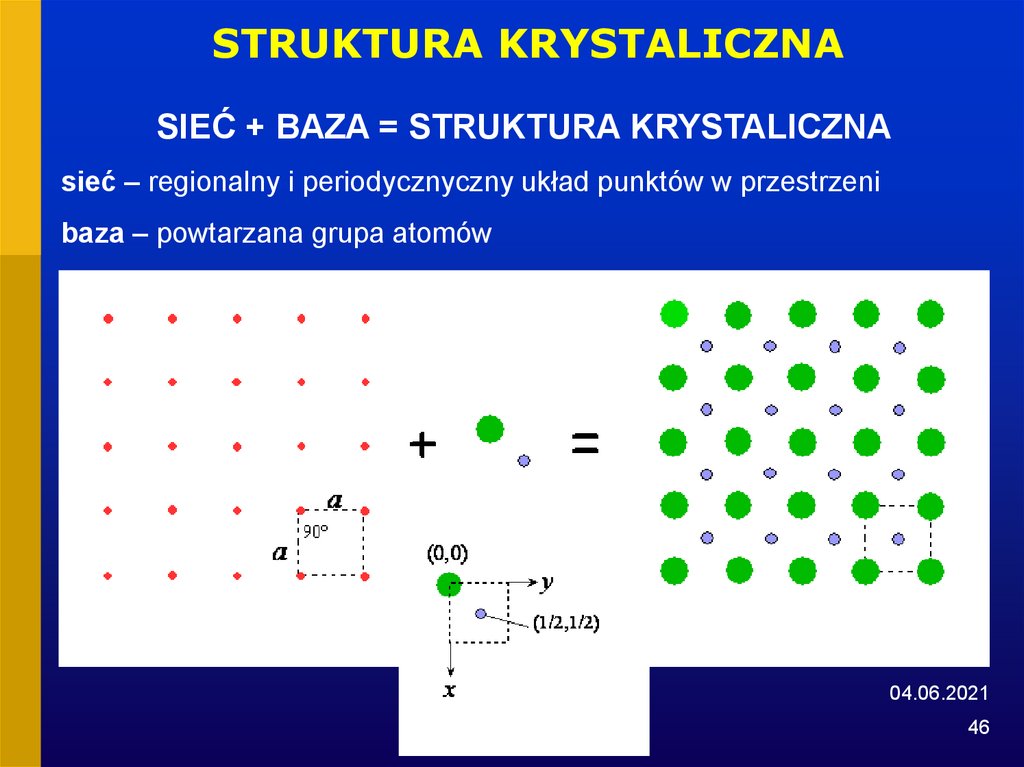
46.
STRUKTURA KRYSTALICZNASIEĆ + BAZA = STRUKTURA KRYSTALICZNA
sieć – regionalny i periodycznyczny układ punktów w przestrzeni
baza – powtarzana grupa atomów
04.06.2021
46
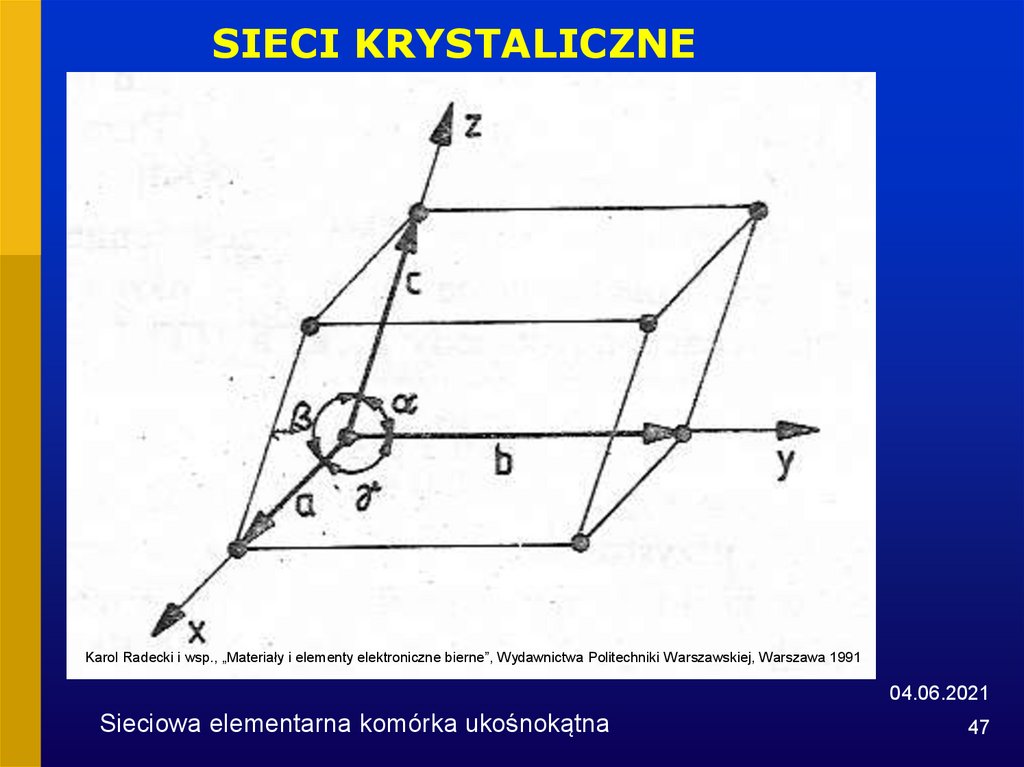
47.
SIECI KRYSTALICZNEKarol Radecki i wsp., „Materiały i elementy elektroniczne bierne”, Wydawnictwa Politechniki Warszawskiej, Warszawa 1991
04.06.2021
Sieciowa elementarna komórka ukośnokątna
47
48.
OPIS STRUKTURY KRYSTALICZNEJ• Parametry komórki elementarnej;
• Liczba koordynacyjna – ilość sąsiadów dla każdego
atomu w sieci;
• Odległość pomiędzy dwoma najbliższymi atomami w
krysztale – zawiera się w zakresie od 0,1 nm (1 Å ) dla
kryształów prostych do ok. 2 nm dla kryształów złożonych;
• Liczba atomów tworzących komórkę elementarną;
• Współczynnik upakowania – stosunek objętości
zajmowanej przez atomy (modelowane jako kulki) do
całkowitej objętości kryształu.
04.06.2021
48
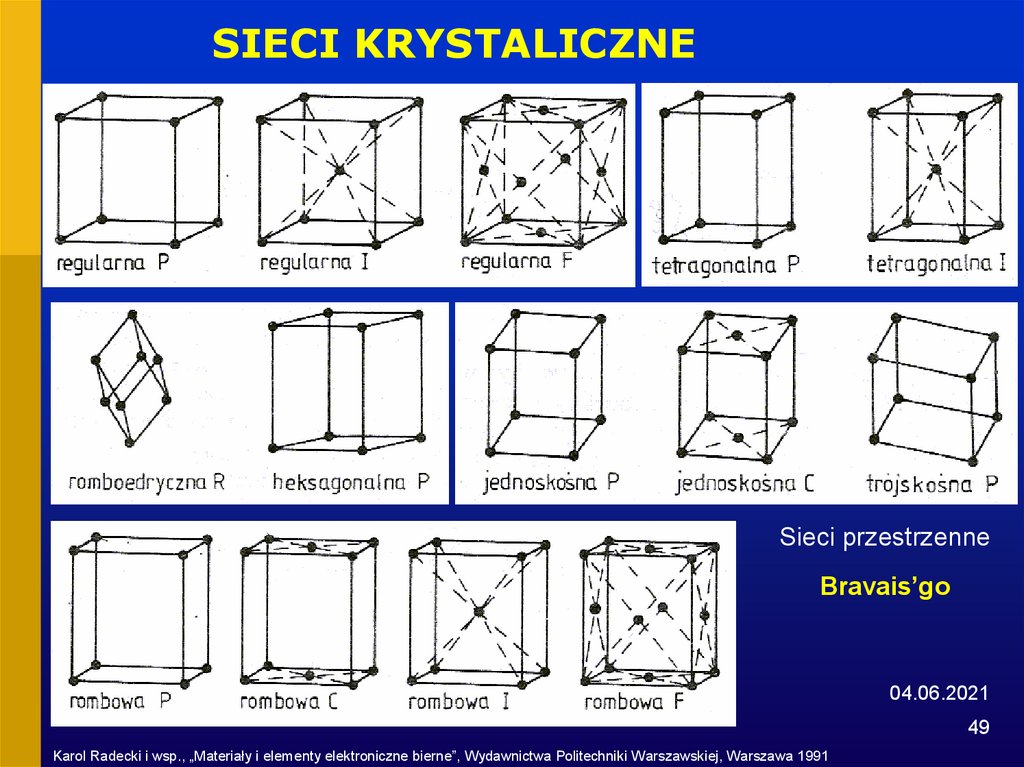
49.
SIECI KRYSTALICZNESieci przestrzenne
Bravais’go
04.06.2021
49
Karol Radecki i wsp., „Materiały i elementy elektroniczne bierne”, Wydawnictwa Politechniki Warszawskiej, Warszawa 1991
50.
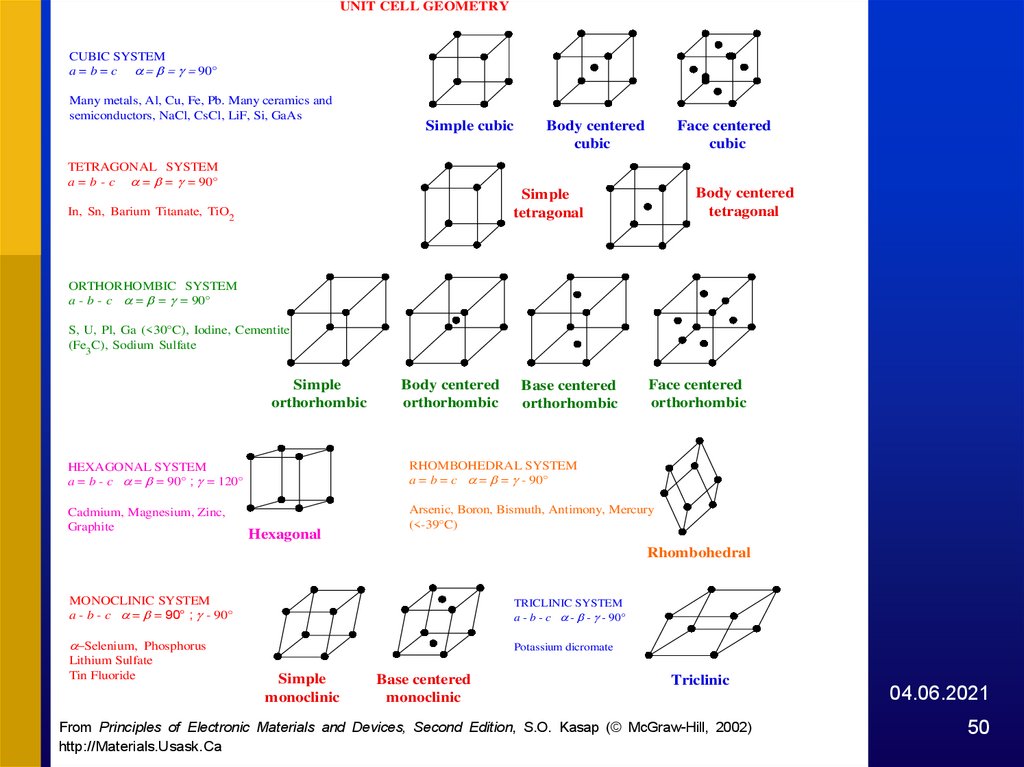
UNIT CELL GEOMETRYCUBIC SYSTEM
a = b = c 90°
Many metals, Al, Cu, Fe, Pb. Many ceramics and
semiconductors, NaCl, CsCl, LiF, Si, GaAs
Simple cubic
Body centered
cubic
Face centered
cubic
TETRAGONAL SYSTEM
a = b - c = = = 90°
Body centered
tetragonal
Simple
tetragonal
In, Sn, Barium Titanate, TiO2
ORTHORHOMBIC SYSTEM
a - b - c = = = 90°
S, U, Pl, Ga (<30°C), Iodine, Cementite
(Fe3C), Sodium Sulfate
Simple
orthorhombic
Body centered
orthorhombic
Base centered
orthorhombic
Face centered
orthorhombic
HEXAGONAL SYSTEM
a = b - c = = 90° ; = 120°
RHOMBOHEDRAL SYSTEM
a = b = c = = - 90°
Cadmium, Magnesium, Zinc,
Graphite
Arsenic, Boron, Bismuth, Antimony, Mercury
(<-39°C)
Hexagonal
Rhombohedral
MONOCLINIC SYSTEM
a - b - c = = 90° ; - 90°
TRICLINIC SYSTEM
a - b - c - - - 90°
-Selenium, Phosphorus
Potassium dicromate
Lithium Sulfate
Tin Fluoride
Simple
monoclinic
Base centered
monoclinic
Triclinic
Fig.
1.71: The
seven crystal
systems
(unit Second
cell geometries)
fourteen
Bravais2002)
From
Principles
of Electronic
Materials
and Devices,
Edition, S.O.and
Kasap
(© McGraw-Hill,
http://Materials.Usask.Ca
lattices.
04.06.2021
50
51.
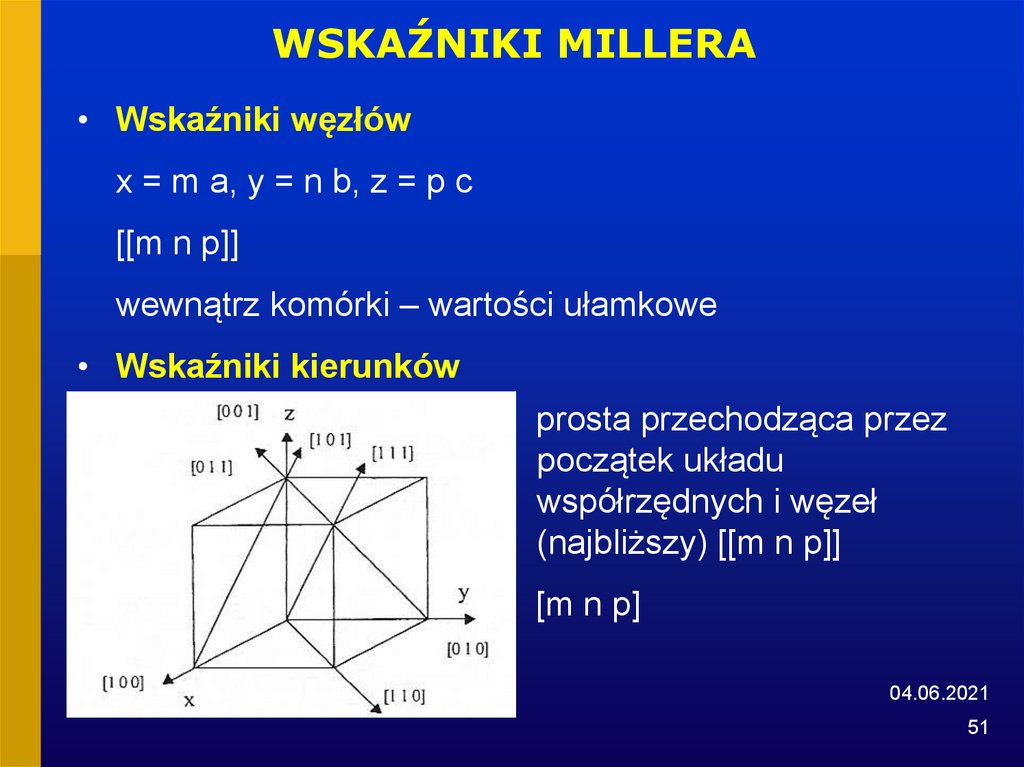
WSKAŹNIKI MILLERA• Wskaźniki węzłów
x = m a, y = n b, z = p c
[[m n p]]
wewnątrz komórki – wartości ułamkowe
• Wskaźniki kierunków
prosta przechodząca przez
początek układu
współrzędnych i węzeł
(najbliższy) [[m n p]]
[m n p]
04.06.2021
51
52.
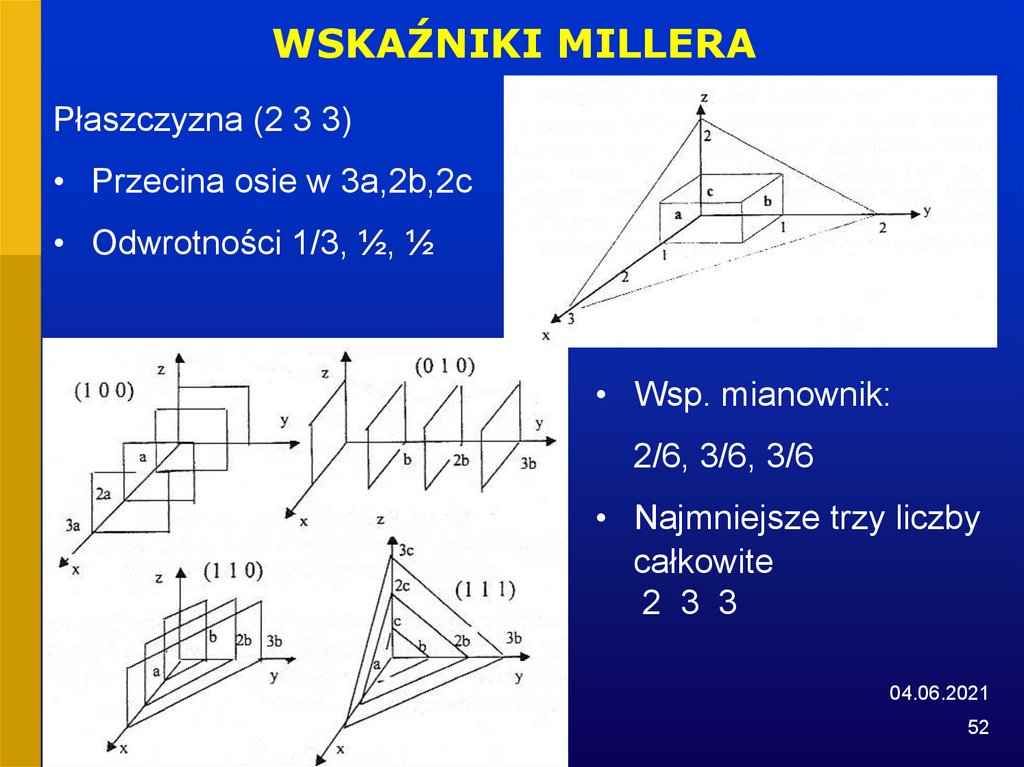
WSKAŹNIKI MILLERAPłaszczyzna (2 3 3)
• Przecina osie w 3a,2b,2c
• Odwrotności 1/3, ½, ½
• Wsp. mianownik:
2/6, 3/6, 3/6
• Najmniejsze trzy liczby
całkowite
2 3 3
04.06.2021
52
53.
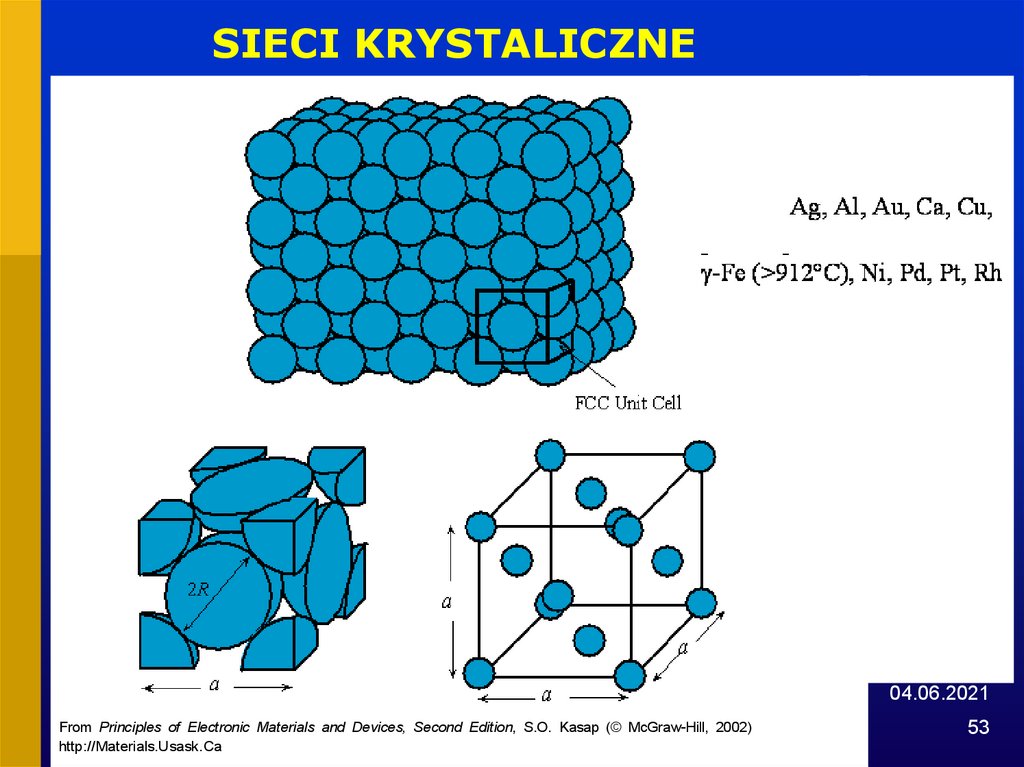
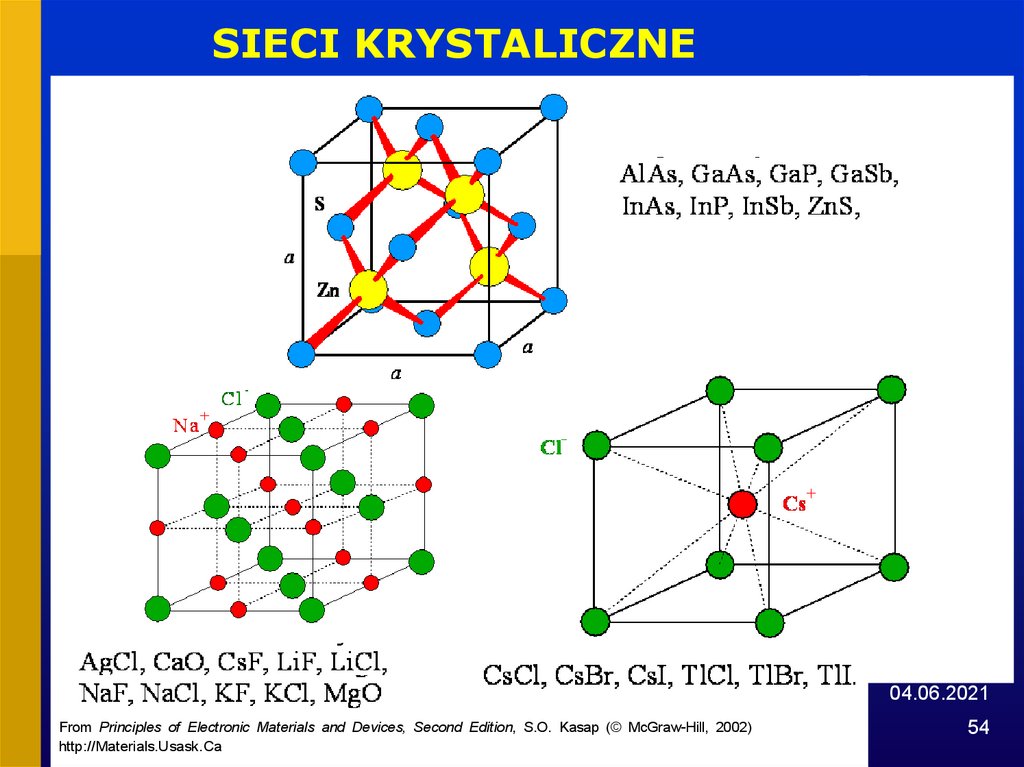
SIECI KRYSTALICZNE04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
53
54.
SIECI KRYSTALICZNE04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
54
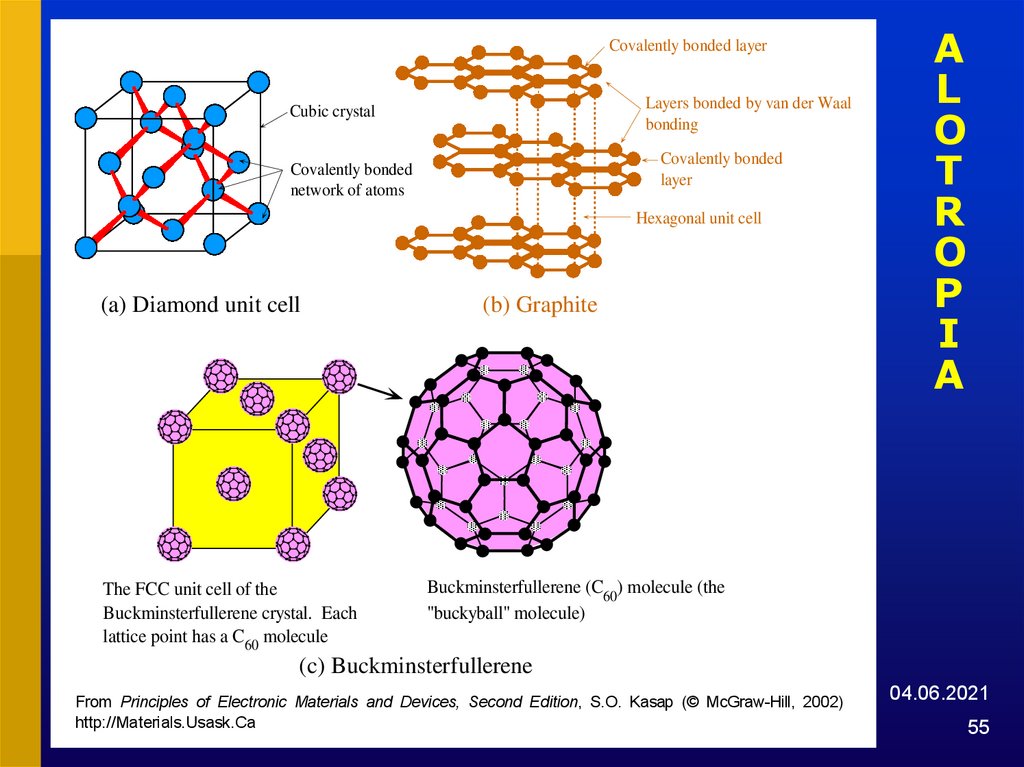
55. ALOTROPIA
Covalently bonded layerLayers bonded by van der Waals
bonding
Cubic crystal
Covalently bonded
layer
Covalently bonded
network of atoms
Hexagonal unit cell
(a) Diamond unit cell
The FCC unit cell of the
Buckminsterfullerene crystal. Each
lattice point has a C60 molecule
(b) Graphite
A
L
O
T
R
O
P
I
A
Buckminsterfullerene (C60) molecule (the
"buckyball" molecule)
(c) Buckminsterfullerene
FromFig.
Principles
Electronic
and Devices,
Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
1.42:ofThe
threeMaterials
allotropes
of carbon.
http://Materials.Usask.Ca
04.06.2021
55
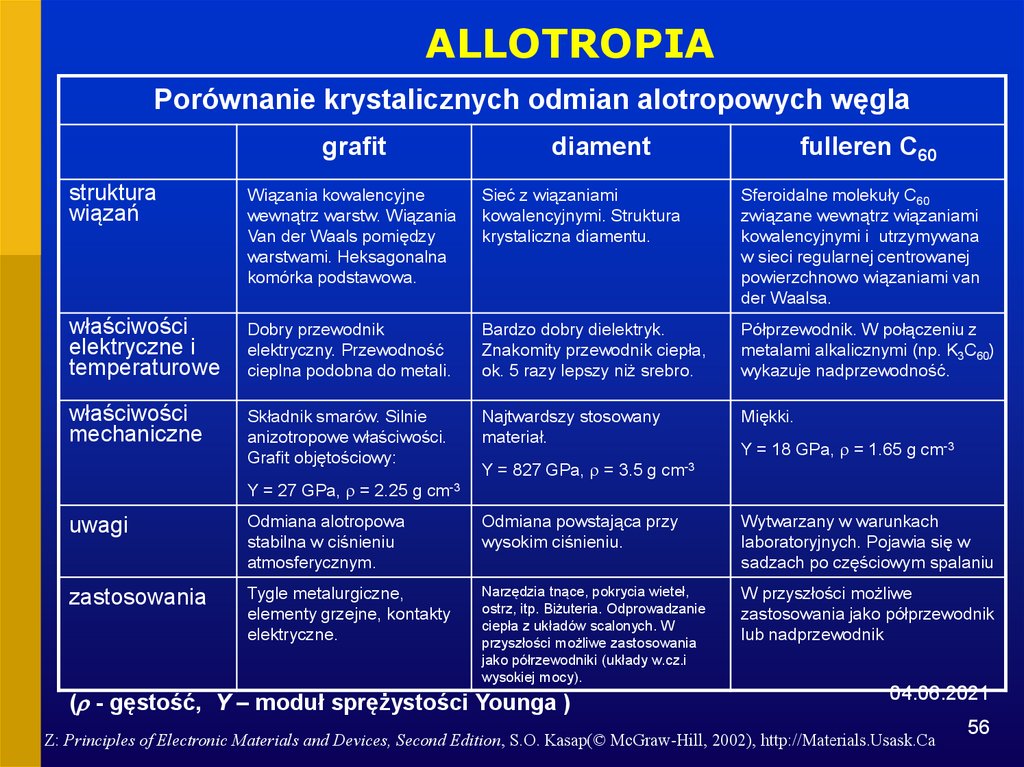
56.
ALLOTROPIAPorównanie krystalicznych odmian alotropowych węgla
grafit
struktura
wiązań
właściwości
elektryczne i
temperaturowe
właściwości
mechaniczne
diament
fulleren C60
Wiązania kowalencyjne
wewnątrz warstw. Wiązania
Van der Waals pomiędzy
warstwami. Heksagonalna
komórka podstawowa.
Sieć z wiązaniami
kowalencyjnymi. Struktura
krystaliczna diamentu.
Sferoidalne molekuły C60
związane wewnątrz wiązaniami
kowalencyjnymi i utrzymywana
w sieci regularnej centrowanej
powierzchnowo wiązaniami van
der Waalsa.
Dobry przewodnik
elektryczny. Przewodność
cieplna podobna do metali.
Bardzo dobry dielektryk.
Znakomity przewodnik ciepła,
ok. 5 razy lepszy niż srebro.
Półprzewodnik. W połączeniu z
metalami alkalicznymi (np. K3C60)
wykazuje nadprzewodność.
Składnik smarów. Silnie
anizotropowe właściwości.
Grafit objętościowy:
Najtwardszy stosowany
materiał.
Miękki.
Y = 27 GPa, = 2.25 g
Y = 827 GPa, = 3.5 g
Y = 18 GPa, = 1.65 g cm-3
cm-3
cm-3
uwagi
Odmiana alotropowa
stabilna w ciśnieniu
atmosferycznym.
Odmiana powstająca przy
wysokim ciśnieniu.
Wytwarzany w warunkach
laboratoryjnych. Pojawia się w
sadzach po częściowym spalaniu
zastosowania
Tygle metalurgiczne,
elementy grzejne, kontakty
elektryczne.
Narzędzia tnące, pokrycia wieteł,
ostrz, itp. Biżuteria. Odprowadzanie
ciepła z układów scalonych. W
przyszłości możliwe zastosowania
jako półrzewodniki (układy w.cz.i
wysokiej mocy).
W przyszłości możliwe
zastosowania jako półprzewodnik
lub nadprzewodnik
( - gęstość, Y – moduł sprężystości Younga )
04.06.2021
Z: Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap(© McGraw-Hill, 2002), http://Materials.Usask.Ca
56
57.
DEFEKTY SIECI KRYSTALICZNYCH• Defekty powierzchniowe
powierzchnie zewnętrzne, powierzchnie wewnętrzne,
granice ziaren, itp.
• Defekty liniowe
dyslokacje
• Defekty punktowe
luki, atomy międzywęzłowe, atomy domieszkowe, atomy
substytucyjne, atomy zanieczyszczeń
• Drgania cieplne atomów
04.06.2021
57
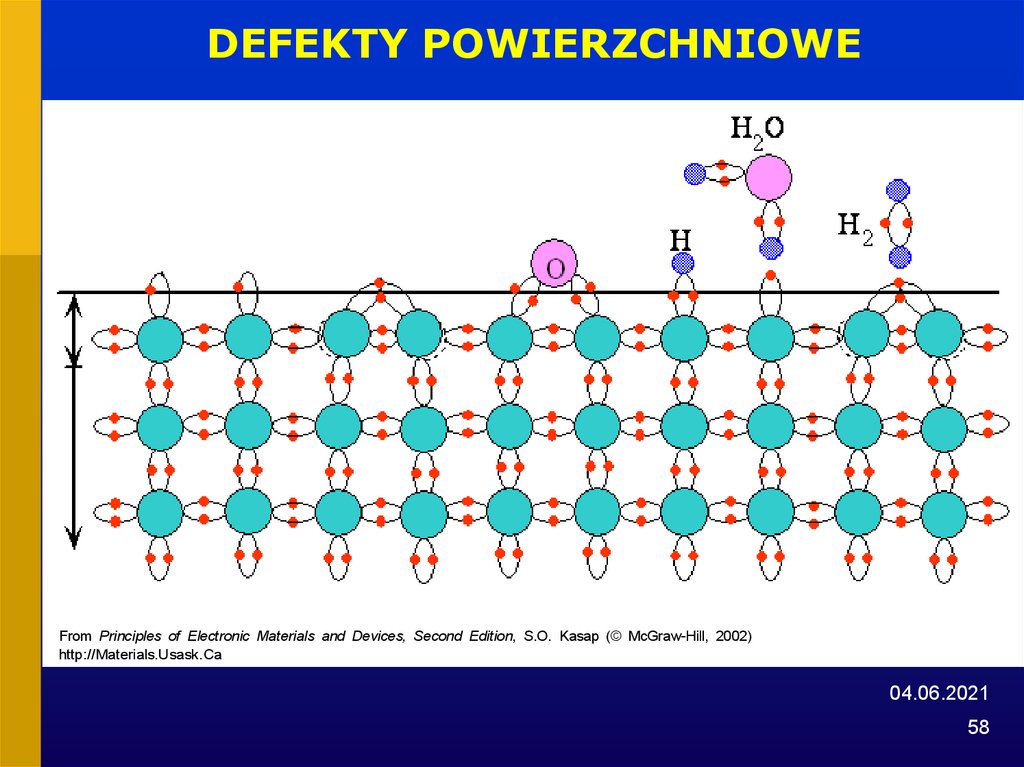
58.
DEFEKTY POWIERZCHNIOWEFrom Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
58
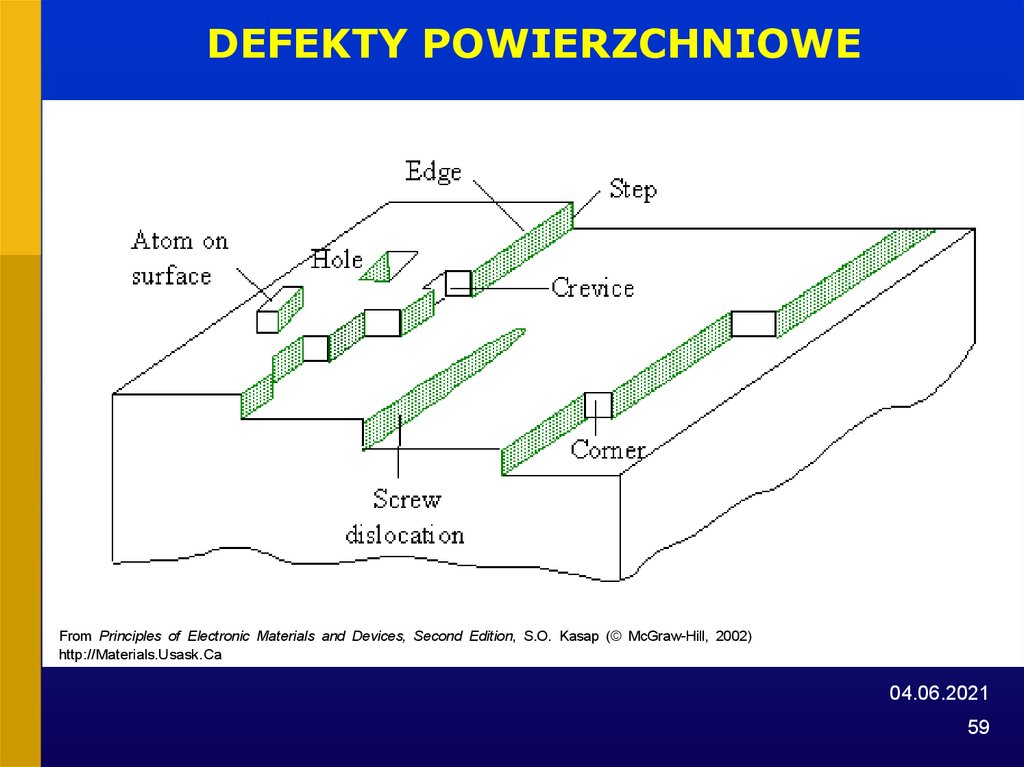
59.
DEFEKTY POWIERZCHNIOWEFrom Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
59
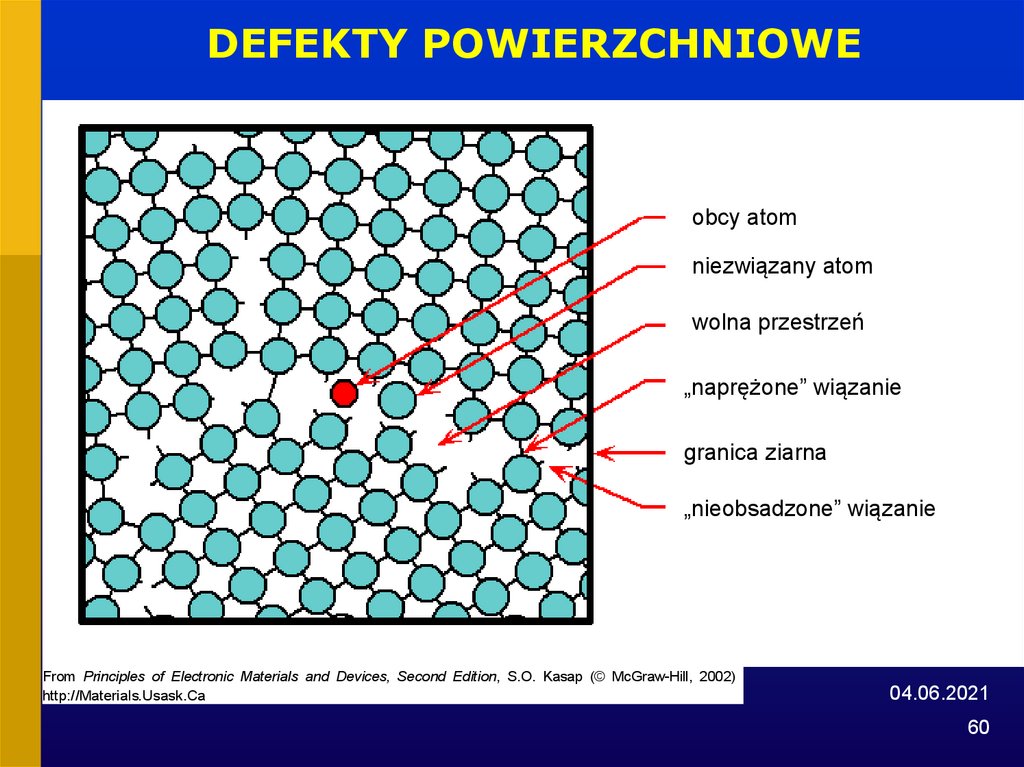
60.
DEFEKTY POWIERZCHNIOWEobcy atom
niezwiązany atom
wolna przestrzeń
„naprężone” wiązanie
granica ziarna
„nieobsadzone” wiązanie
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
60
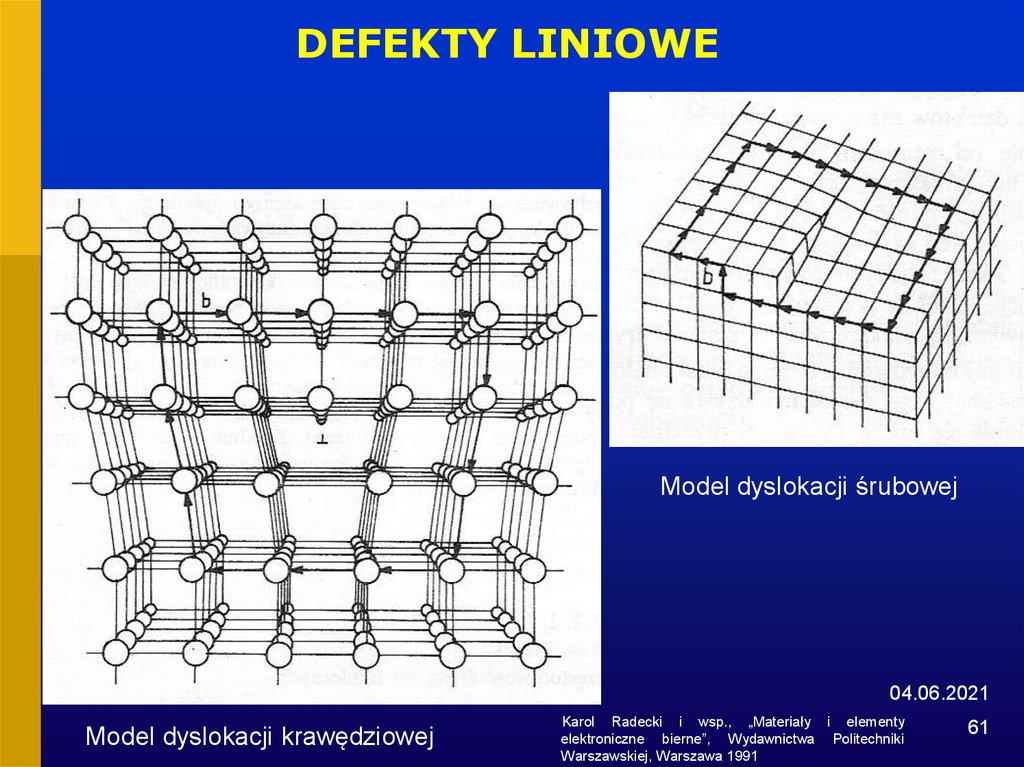
61.
DEFEKTY LINIOWEModel dyslokacji śrubowej
04.06.2021
Model dyslokacji krawędziowej
Karol Radecki i wsp., „Materiały i elementy
elektroniczne bierne”, Wydawnictwa Politechniki
Warszawskiej, Warszawa 1991
61
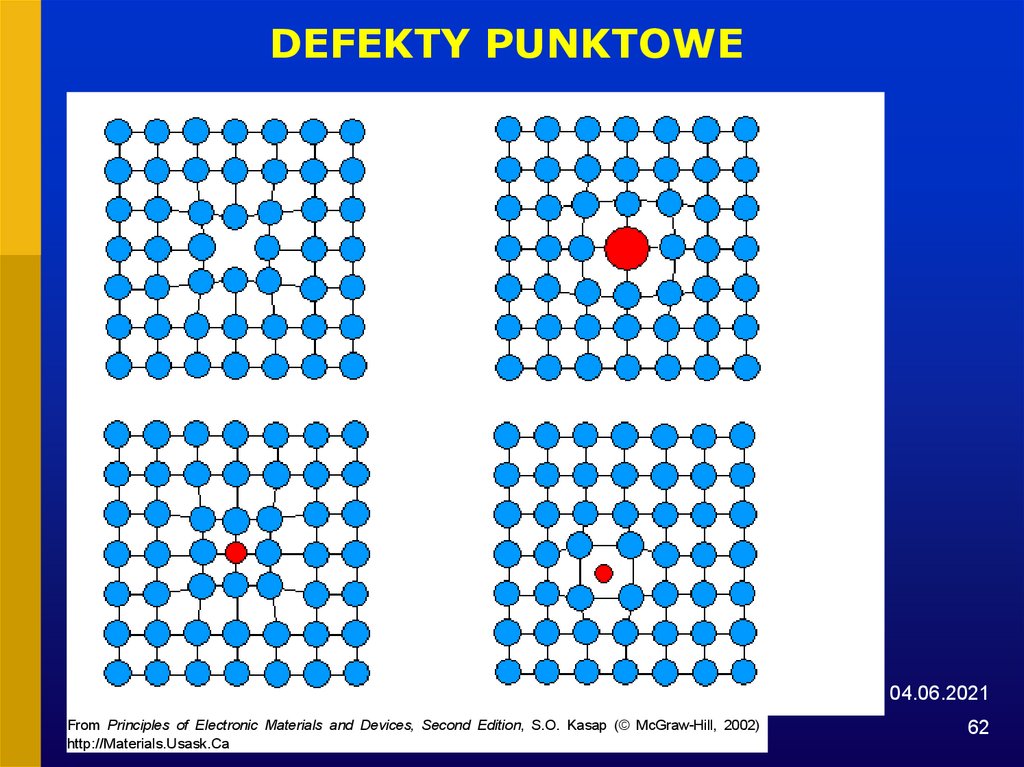
62.
DEFEKTY PUNKTOWE04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
62
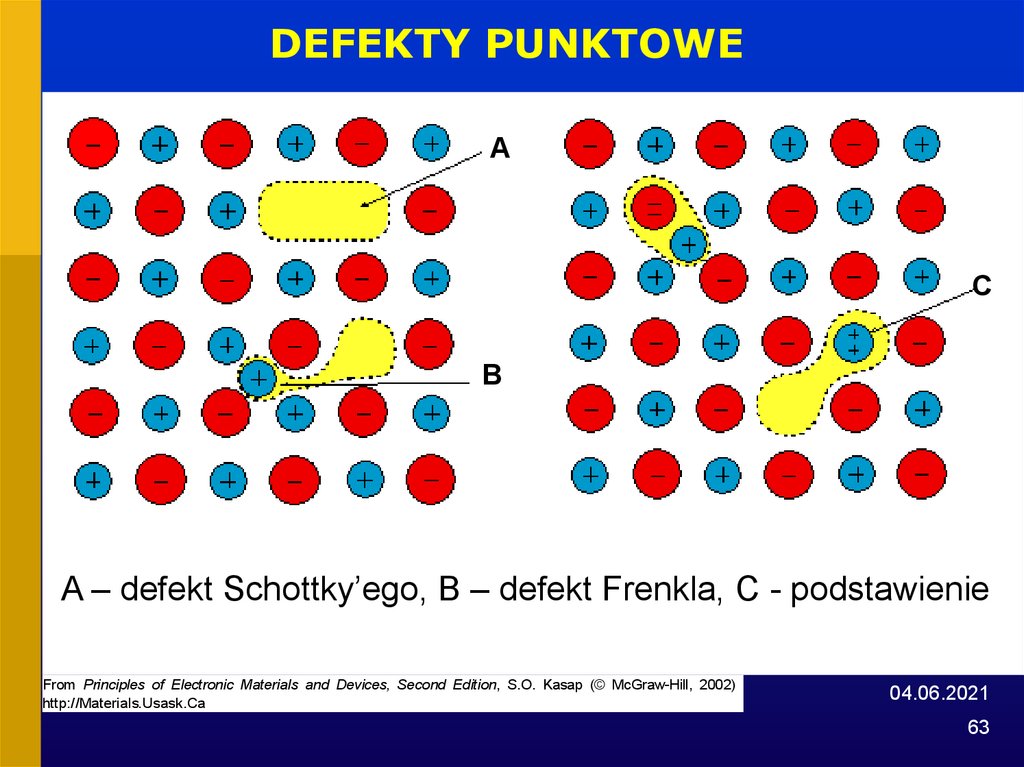
63.
DEFEKTY PUNKTOWEA
C
B
A – defekt Schottky’ego, B – defekt Frenkla, C - podstawienie
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
04.06.2021
63
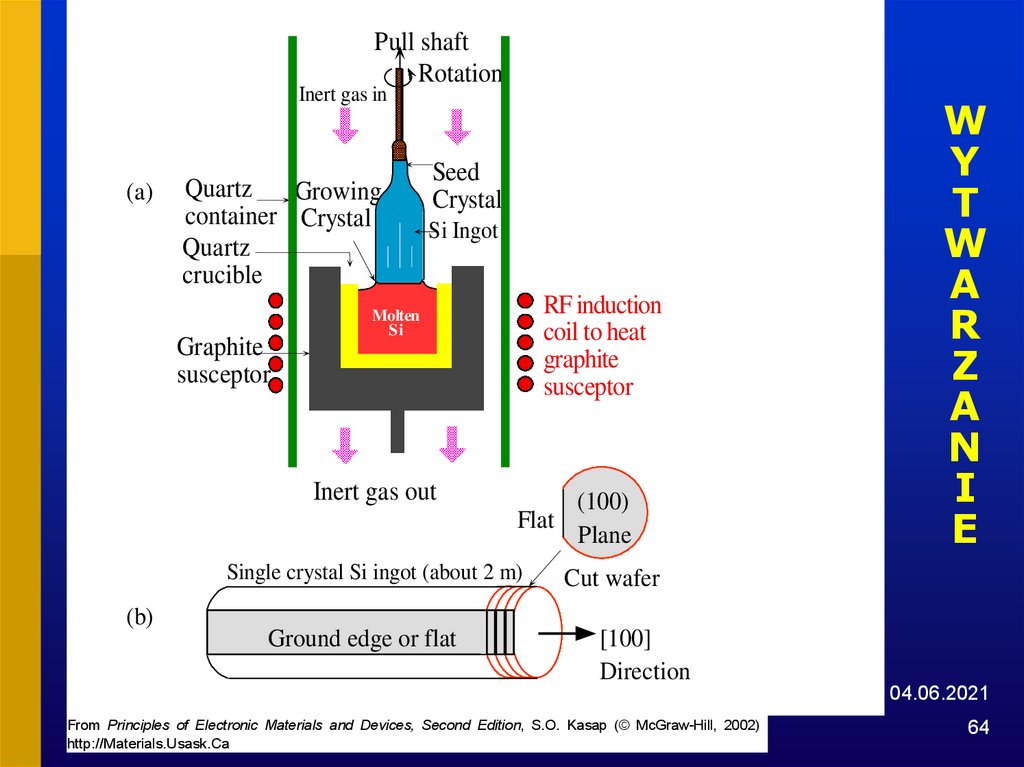
64.
Pull shaftRotation
Inert gas in
(a)
Quartz
Growing
container Crystal
Quartz
crucible
Graphite
susceptor
Seed
Crystal
Si Ingot
RF induction
coil to heat
graphite
susceptor
Molten
Si
Inert gas out
Flat
Single crystal Si ingot (about 2 m)
(b)
Ground edge or flat
(100)
Plane
W
Y
T
W
A
R
Z
A
N
I
E
Cut wafer
[100]
Direction
04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
64
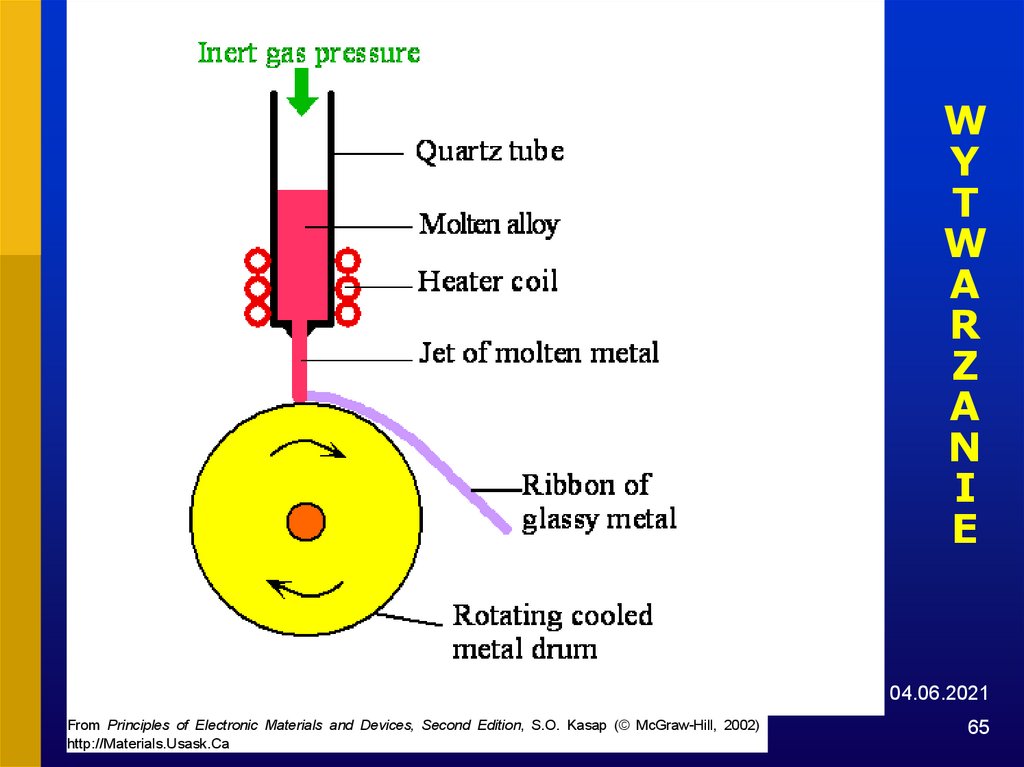
65.
WY
T
W
A
R
Z
A
N
I
E
04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
65
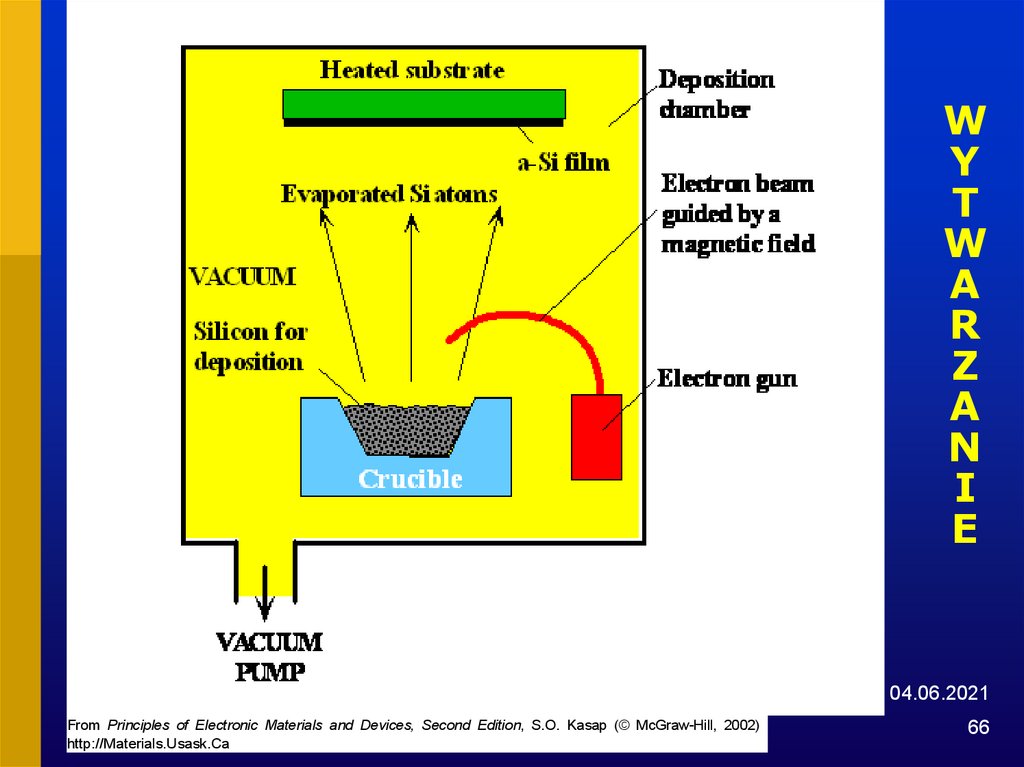
66.
WY
T
W
A
R
Z
A
N
I
E
04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
66
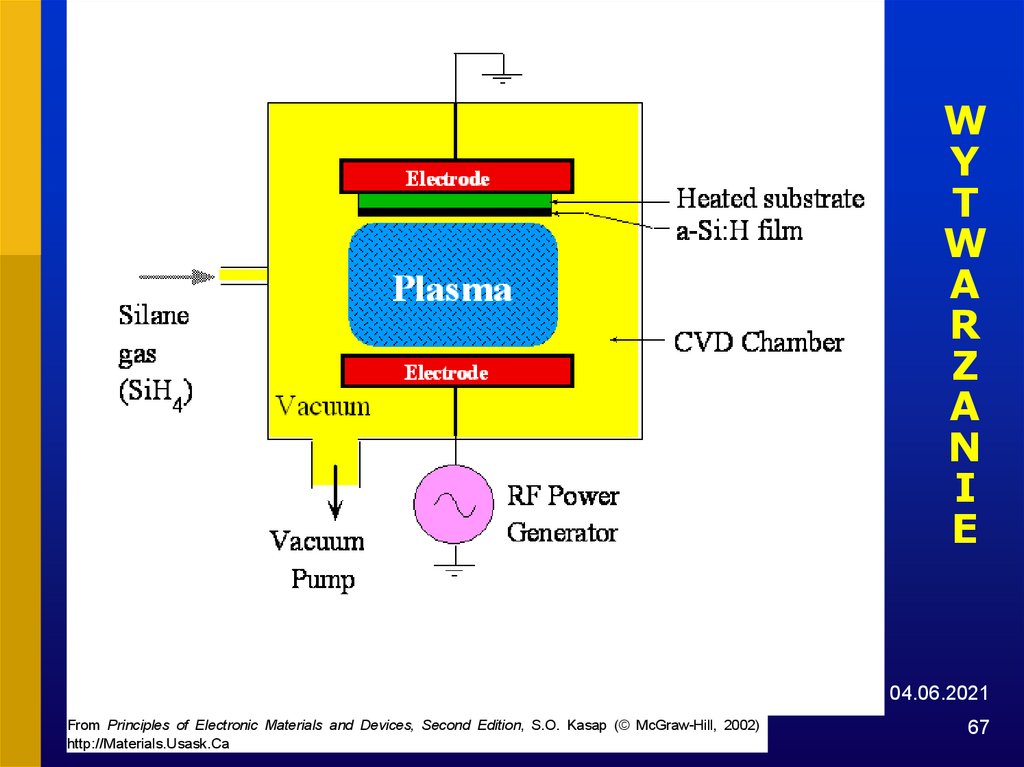
67.
WY
T
W
A
R
Z
A
N
I
E
04.06.2021
From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (© McGraw-Hill, 2002)
http://Materials.Usask.Ca
67


























 electronics
electronics

