Similar presentations:
Аммиак. Состав вещества
1. школа
школа1
2.
Состав веществаПолучение
Применение
Строение
Свойства
2
3.
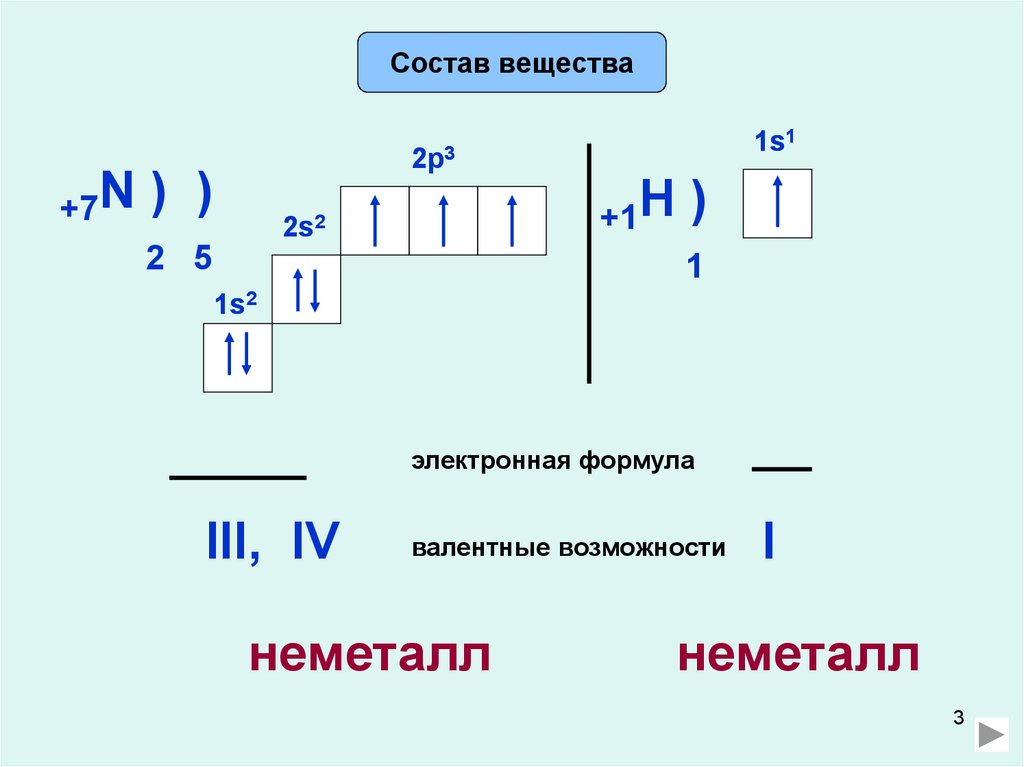
Состав вещества+7N
1s1
2p3
) )
+1H
2s2
2 5
)
1
1s2
электронная формула
III, IV
валентные возможности
неметалл
I
неметалл
3
4.
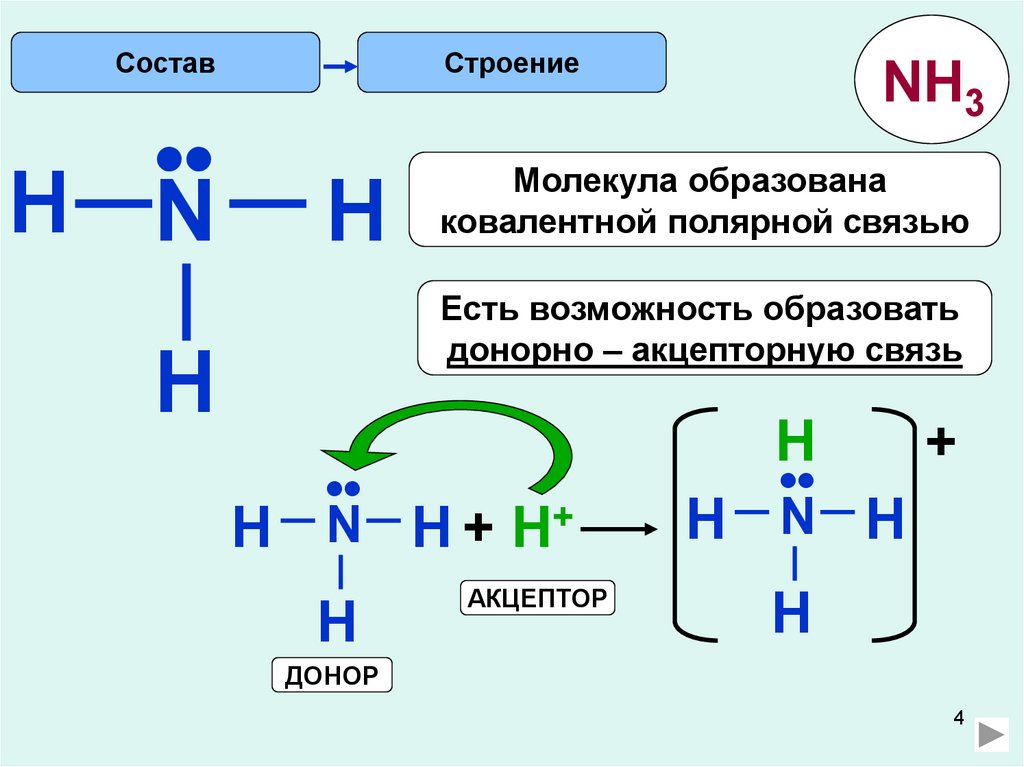
СоставСтроение
•
H N
H
NH3
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно – акцепторную связь
H
H
•
N H + H+
H
АКЦЕПТОР
H
H
•
N H
+
H
ДОНОР
4
5.
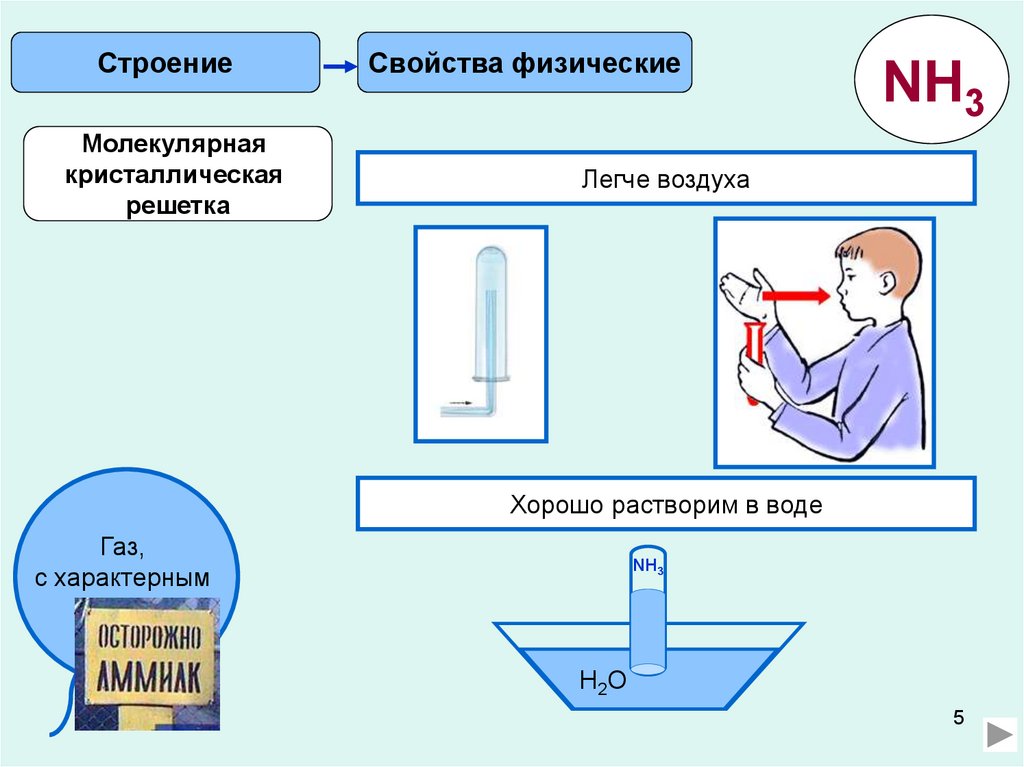
СтроениеМолекулярная
кристаллическая
решетка
Свойства физические
NH3
Легче воздуха
Хорошо растворим в воде
Газ,
с характерным
запахом.
NH3
H2O
5
6.
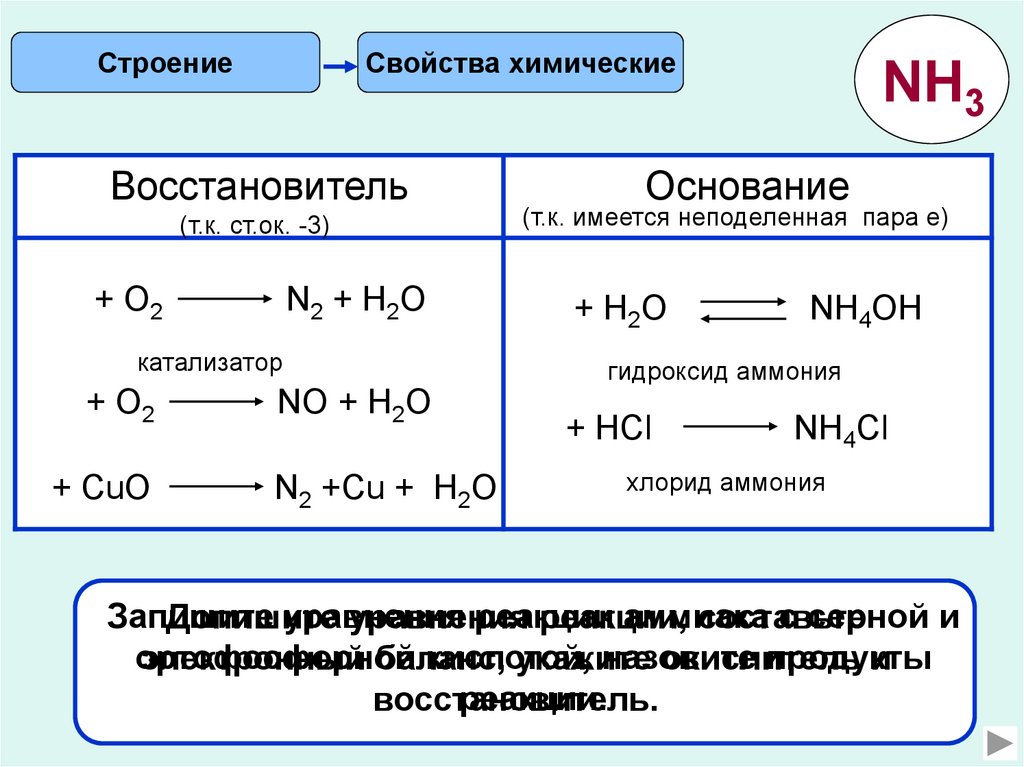
СтроениеСвойства химические
Восстановитель
(т.к. ст.ок. -3)
+ О2
N2 + Н2О
катализатор
+ О2
+ CuО
NО + Н2О
N2 +Cu + Н2О
NH3
Основание
(т.к. имеется неподеленная пара е)
+ H2O
NH4OH
гидроксид аммония
+ HCl
NH4Cl
хлорид аммония
Запишите
уравнения
реакции
аммиака
с серной и
Допишите
уравнения
реакции,
составьте
ортофосфорной
кислотой,
назовите
продукты
электронный баланс,
укажите
окислитель
и
реакции.
восстановитель.
6
7.
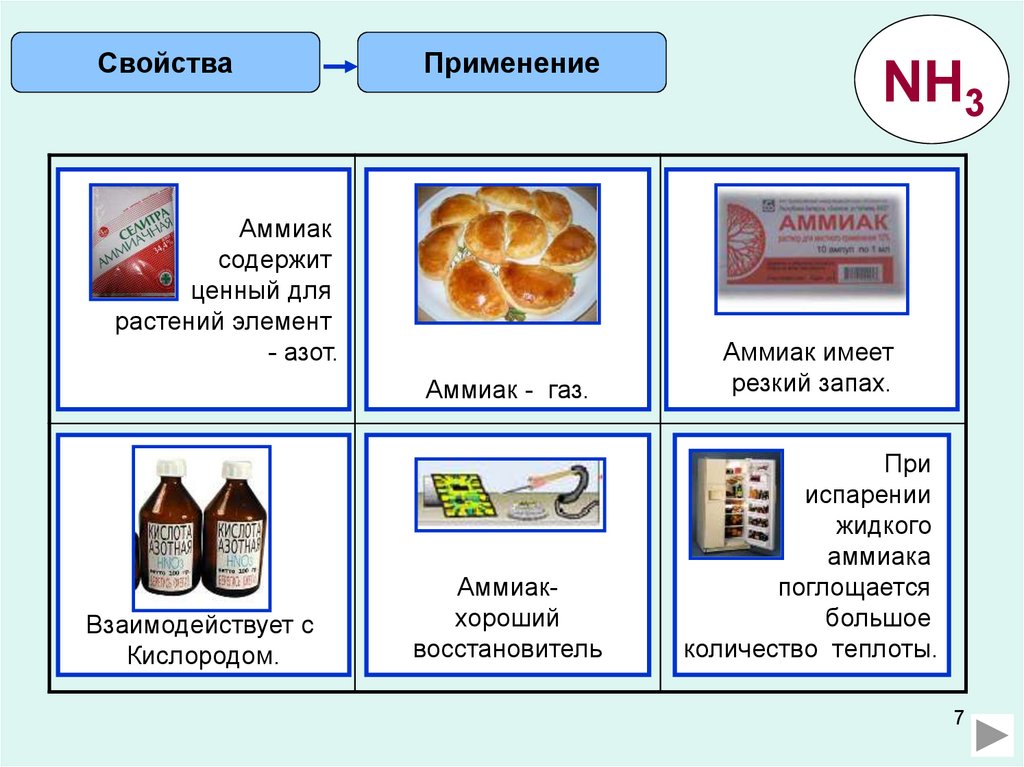
СвойстваПрименение
NH3
Рассчитайте
Аммиак
массовую
содержит
долю азота
в
ценный для
растений элемент
аммиачной
- азот.
селитре
Запишите
уравнение
реакции
разложения
гидрокарбоната
Аммиак
- газ.
аммония
Рассчитайте объем
аммиака для
приготовления 50г
5% - ного
нашатырного
спирта
Аммиак имеет
(при запах.
н.у.)
резкий
Как осуществить
превращения?
NH3 → NO → NO2
HNO3
Составьте
окислительновосстановительную
реакцию
взаимодействия
Аммиакхлорида
аммония с
хороший
оксидом
меди.
восстановитель
Какой объем При
при
испарении
нормальных
условияхжидкого
будет
аммиака
занимать
1 кг
поглощается
большое
жидкого
количество
теплоты.
аммиака.
Взаимодействует с
Кислородом.
7
8.
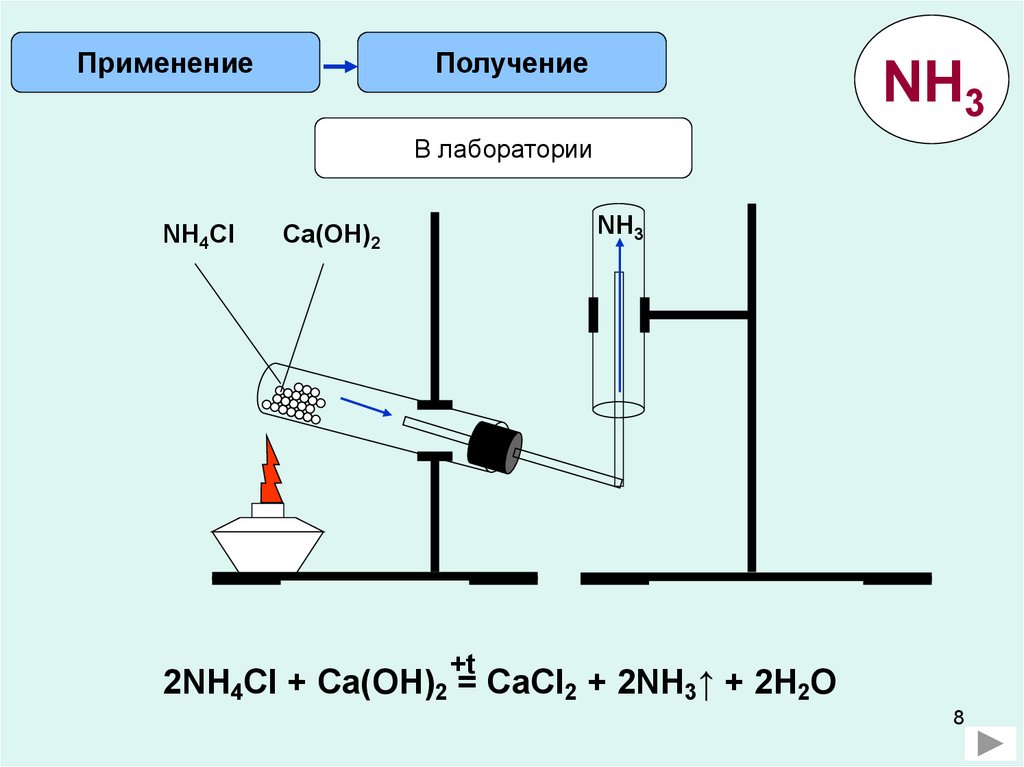
ПрименениеПолучение
NH3
В лаборатории
NH4Cl
NH3
Ca(OH)2
+t
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
8
9.
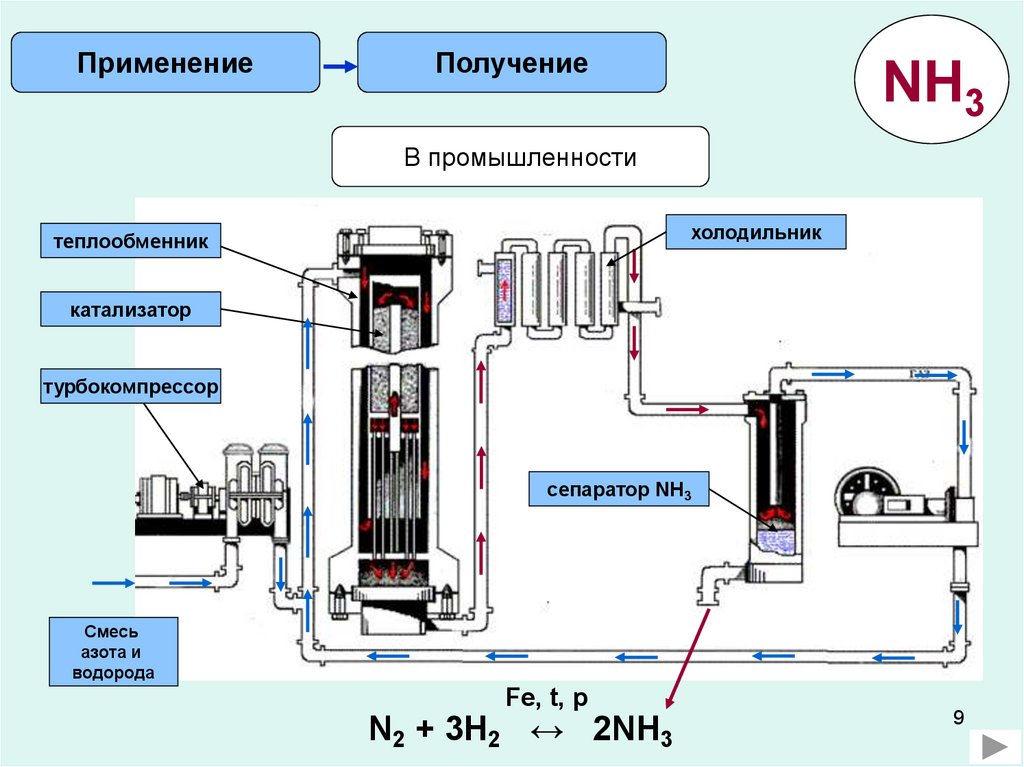
ПрименениеПолучение
NH3
В промышленности
холодильник
теплообменник
катализатор
турбокомпрессор
сепаратор NH3
Смесь
азота и
водорода
Fe, t, p
N2 + 3H2 ↔ 2NH3
9
10.
Проверка знанийДля аммиака
характерны свойства:
1
2
NH3
Аммиак
взаимодействует с
Ошибка
кислот
Ошибка
солей
щелочами
Ошибка
Правильно!
кислотами
Правильно!
оснований
оксидов
Ошибка
неметаллами
Ошибка
металлами
Ошибка
3
Цвет лакмуса в
растворе аммиака:
фиолетовый
Ошибка
бесцветный
Ошибка
Аммиак –
4
восстановитель в реакции
красный
Ошибка
С кислотами
Ошибка
Правильно!
синий
Правильно!
металлов
С оксидами
с неметаллами
Ошибка
С металлами
Ошибка
10
11. Контрольный тест
1.Химическая связь между атомамиводорода одной молекулы и очень
электроотрицательным элементом другой
молекулы (например O, N или F )
называется
…………………………………….
11
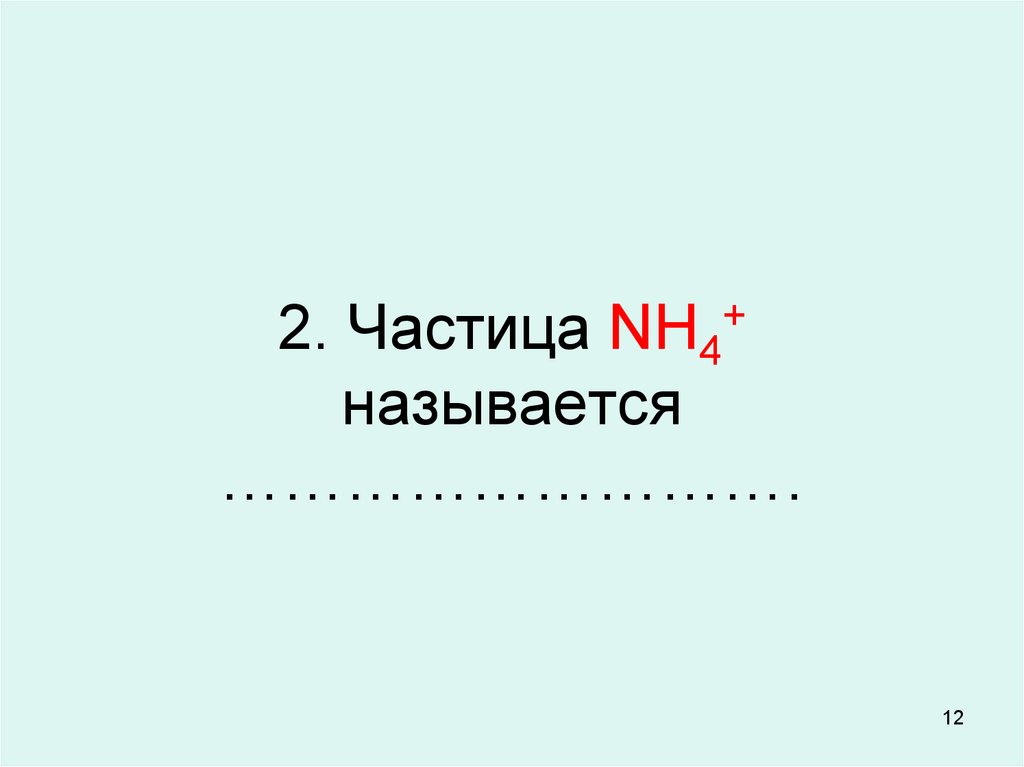
12. 2. Частица NH4+ называется ……………………….
1213. 3. Раствор аммиака в воде называется …………………………….
1314. 4. Распознать аммиак можно раствором …………………………..
1415. 5.Механизм образования ковалентной связи, возникающей благодаря свободной орбитали одного атома и паре электронов другого атома
называется………………………………….
15
16. Домашнее задание параграф 29 № 6
Домашнее заданиепараграф 29
№6
16







 chemistry
chemistry








