Similar presentations:
Ароматические углеводороды. Арены
1. Ароматические углеводороды. Арены.
2.
План урока1.
2.
3.
4.
5.
6.
7.
8.
Гомологический ряд.
Изомерия аренов.
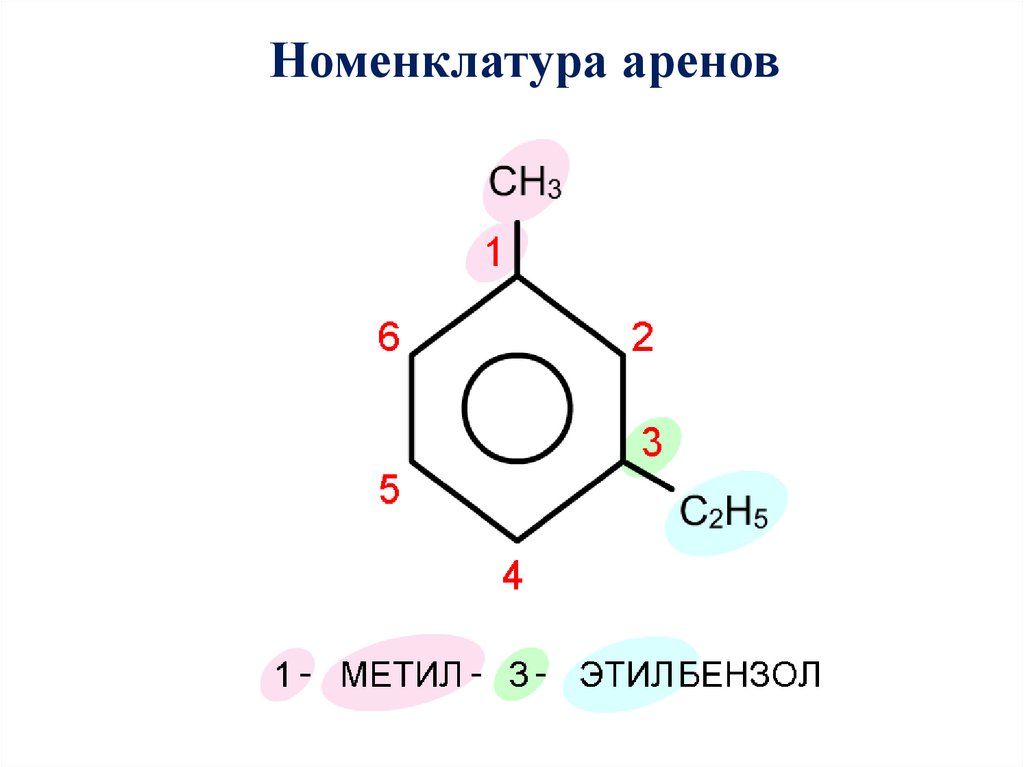
Номенклатура аренов.
Строение аренов.
Физические свойства аренов.
Химические свойства аренов.
Получение аренов.
Применение аренов.
3. Арены
Ароматическиеуглеводороды (арены) –
это углеводороды с общей
формулой СnH2n-6,
в молекулах которых
имеется хотя бы одно
бензольное кольцо
4. Арены
Ароматические соединения (отСЛОВАРЬ
греч. árômа — благовоние), класс
органических циклических соединений, все
атомы которых участвуют в образовании
единой сопряжённой системы; pэлектроны такой системы образуют
устойчивую, т. е. замкнутую,
электронную оболочку.
Название «Ароматические соединения»
закрепилось вследствие того, что первые
открытые и изученные представители
этого класса веществ обладали приятным
запахом.
Общая формула ароматических
углеводородов
CnH2n-6. (n не менее 6)
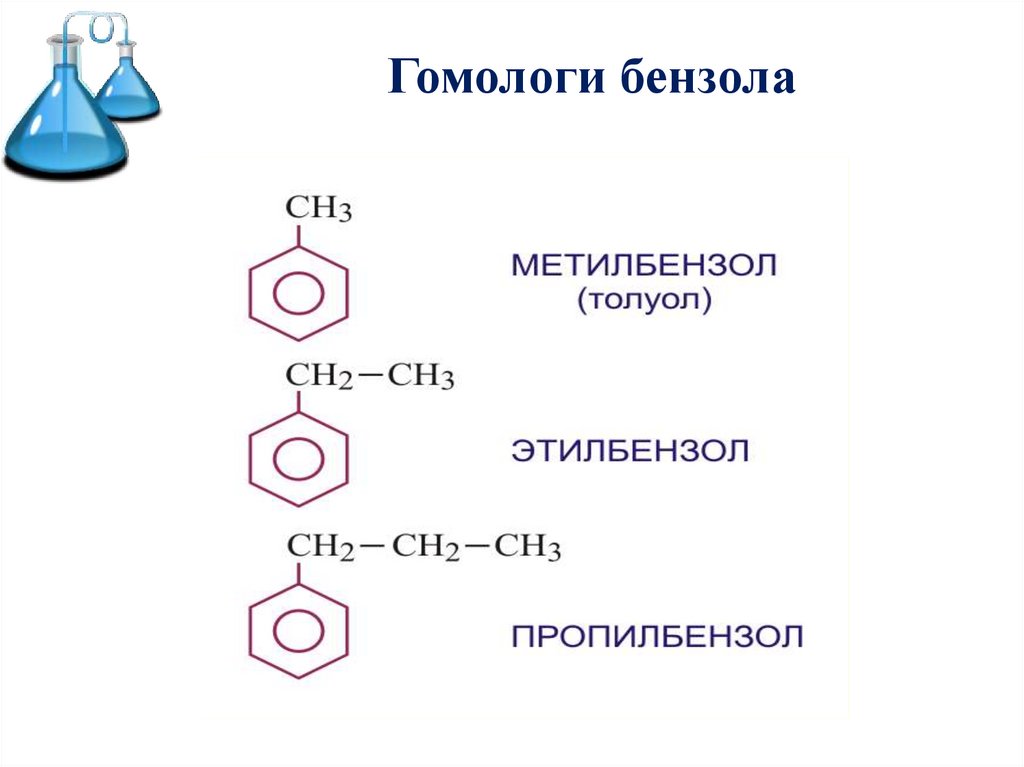
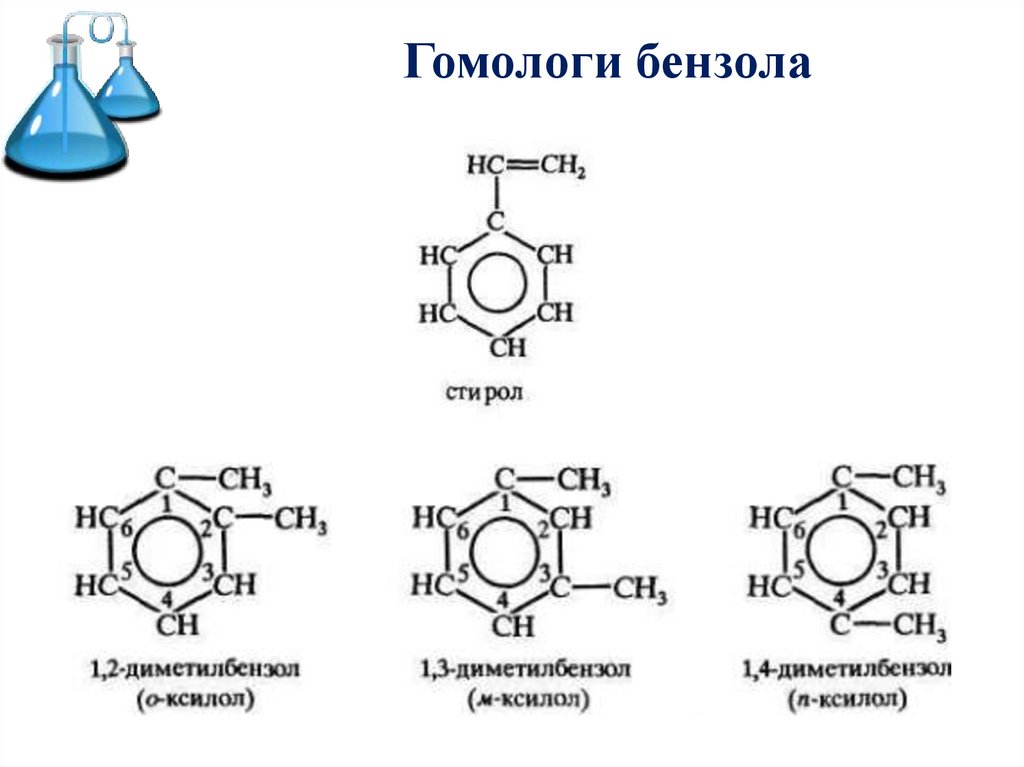
5. Гомологи бензола
6.
Гомологи бензола7.
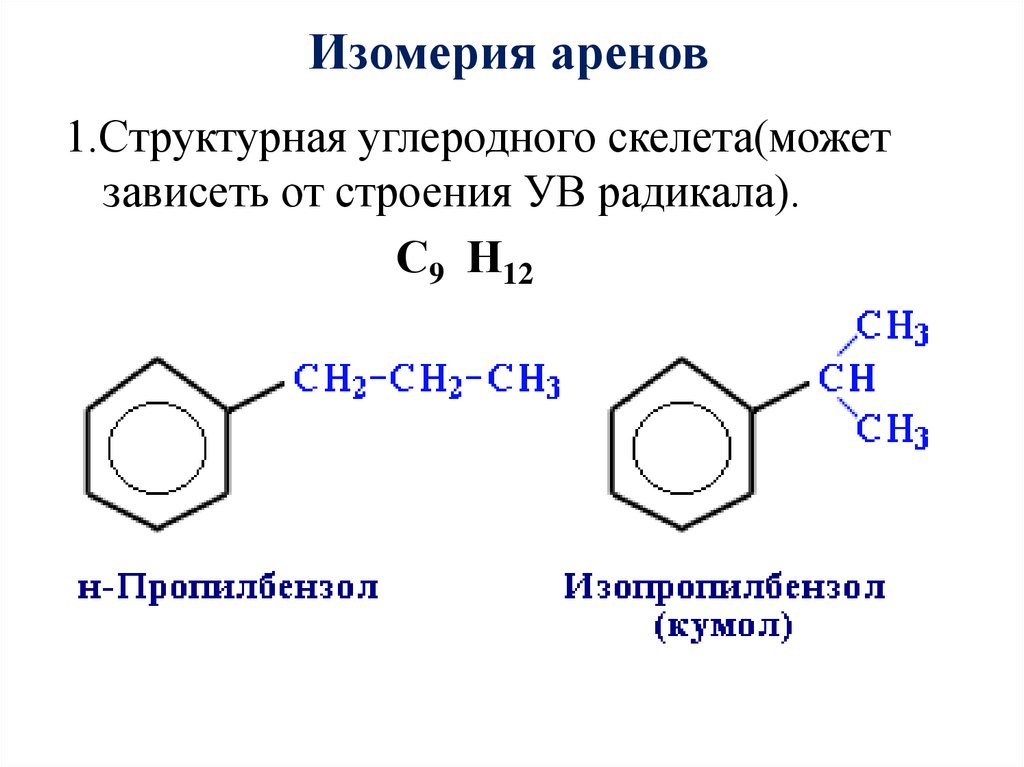
Изомерия аренов1.Структурная углеродного скелета(может
зависеть от строения УВ радикала).
С9 Н12
8.
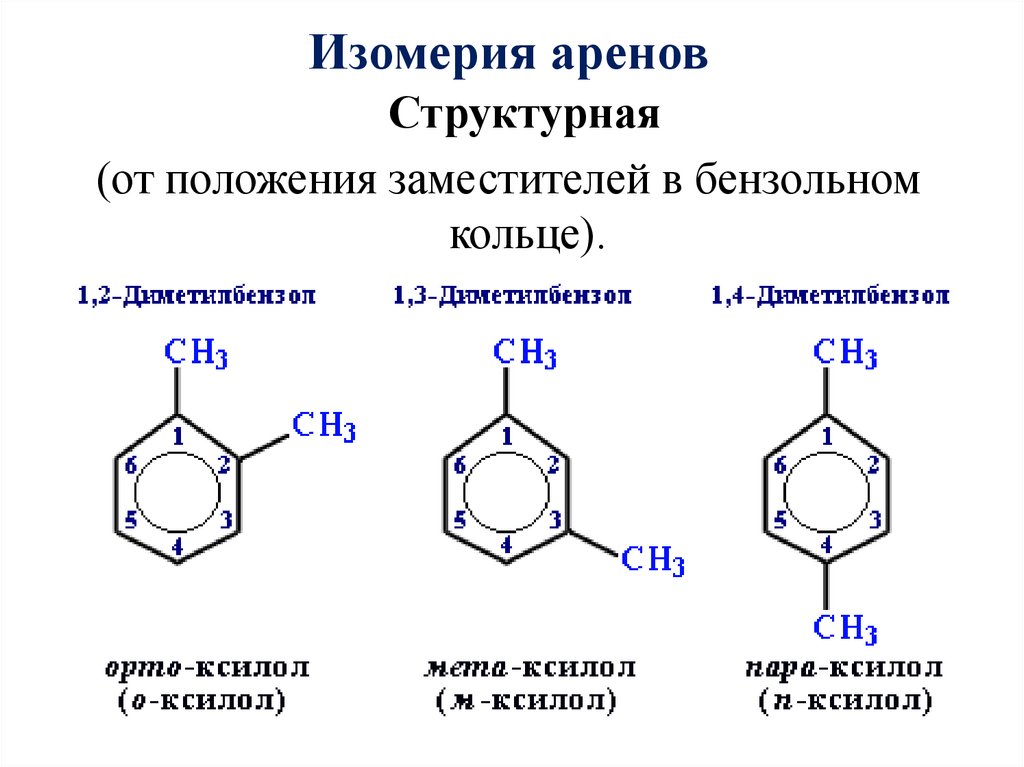
Изомерия ареновСтруктурная
(от положения заместителей в бензольном
кольце).
9.
Номенклатура ареновГомологи бензола – соединения, образованные заменой
одного или нескольких атомов водорода в молекуле бензола
на углеводородные радикалы (R):
С6Н5 R (алкилбензол),
R С6Н4 R (диалкилбензол) и т.д.
Номенклатура. Широко используются тривиальные названия
(толуол, ксилол, кумол и т.п.). Систематические названия
строят из названия углеводородного радикала (приставка) и
слова бензол
С6Н5 СH3
метилбензол
С6Н5 С2H5
этилбензол
С6Н5 С3H7
пропилбензол
10.
Номенклатура аренов11.
История открытия бензолаВпервые бензол описал немецкий химик Иоганн
Глаубер, который получил это соединение в
1649 году в результате перегонки каменноугольной смолы. Но ни названия вещество не
получило, ни состав его не был известен.
Своё второе рождение бензол получил благодаря
работам Фарадея. Бензол был открыт в 1825 году
английским физиком Майклом Фарадеем, который
выделил его из жидкого конденсата светильного
газа.
В 1833 году немецкий физик и химик Эйльгард
Мичерлих получил бензол при сухой перегонке
кальциевой соли бензойной кислоты (именно
от этого и произошло название бензол)
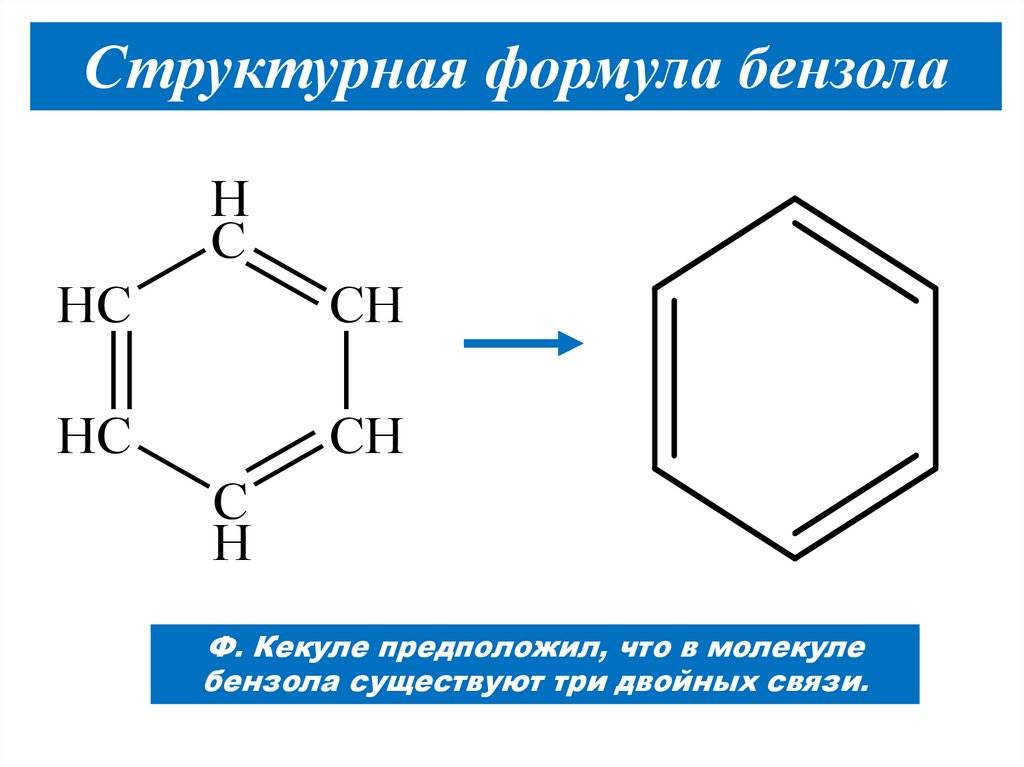
12. Структурная формула бензола
Была предложена немецкимученым А. Кекуле в 1865 году
Н0
Бензол не взаимодействует с
бромной водой и
раствором перманганата
калия!
А.Кекуле
13.
Структурная формула бензолаH
C
HC
CH
HC
CH
C
H
Ф. Кекуле предположил, что в молекуле
бензола существуют три двойных связи.
14.
Электронное строение бензолаСовременное представление об
электронной природе связей в бензоле
основывается на гипотезе американского
физика и химика, дважды лауреата
Нобелевской премии
Л. Полинга.
Именно по его предложению
молекулу бензола стали
изображать в виде шестиугольника
с вписанной окружностью,
подчеркивая тем самым
отсутствие фиксированных
двойных связей и наличие единого
электронного облака,
охватывающего все шесть атомов
углерода цикла.
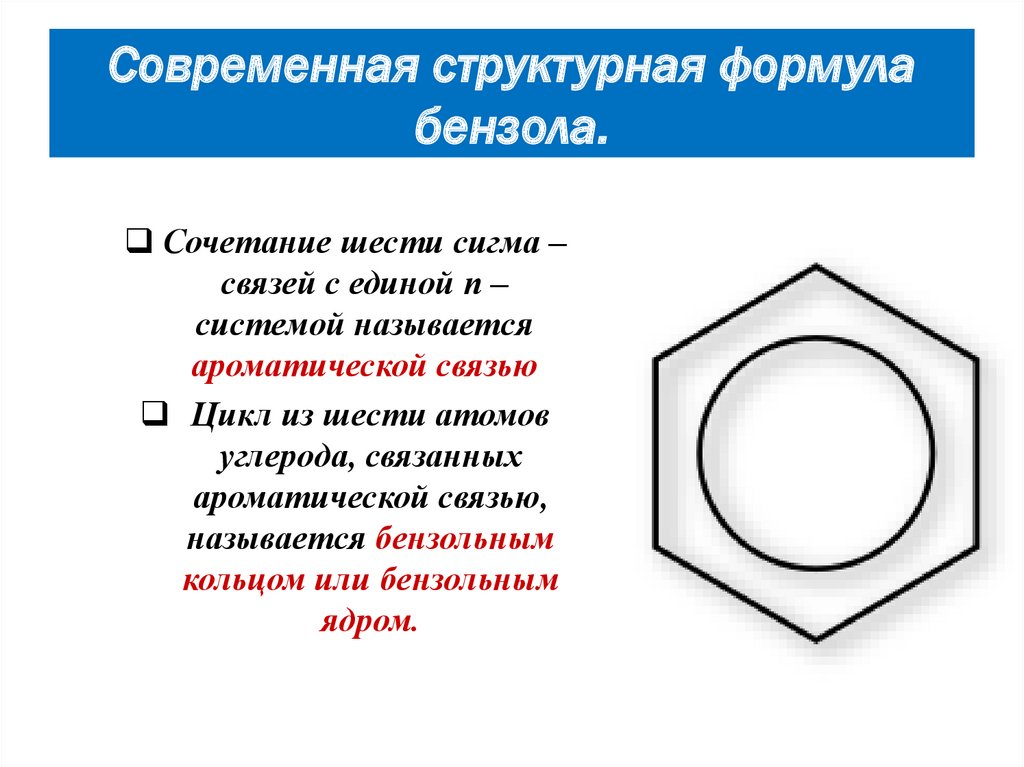
15. Современная структурная формула бензола.
Сочетание шести сигма –связей с единой п –
системой называется
ароматической связью
Цикл из шести атомов
углерода, связанных
ароматической связью,
называется бензольным
кольцом или бензольным
ядром.
16.
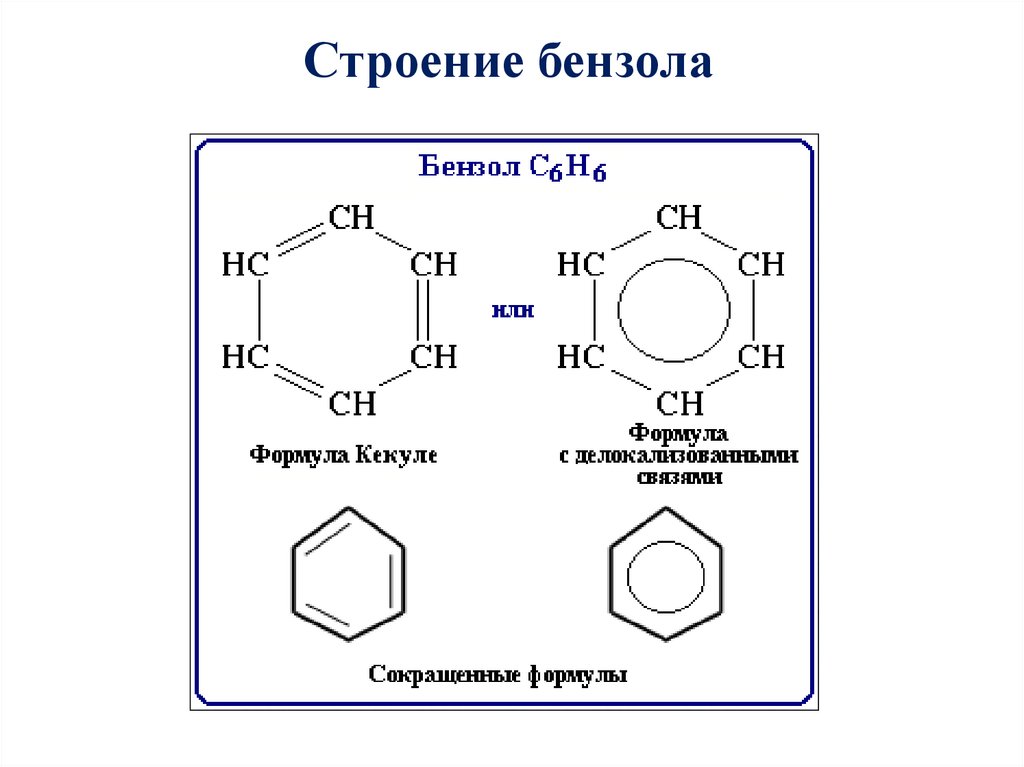
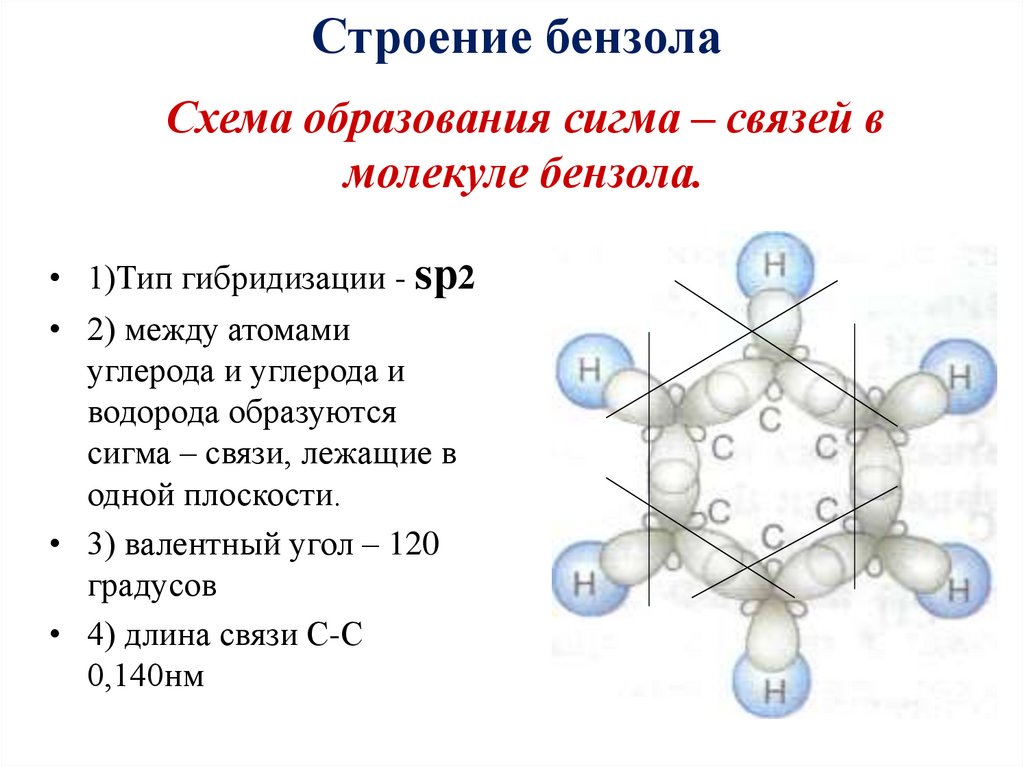
Строение бензола17. Схема образования сигма – связей в молекуле бензола.
Строение бензолаСхема образования сигма – связей в
молекуле бензола.
• 1)Тип гибридизации - sр2
• 2) между атомами
углерода и углерода и
водорода образуются
сигма – связи, лежащие в
одной плоскости.
• 3) валентный угол – 120
градусов
• 4) длина связи С-С
0,140нм
18. Схема образования пи – связей в молекуле бензола
Строение бензолаСхема образования пи – связей в
молекуле бензола
За счет негибридных
р – электронных облаков в
молекуле бензола
перпендикулярно плоскости
образования сигма - связей
образуется единая
п- электронная система,
состоящая из 6 р –
электронов и общая для всех
атомов углерода.
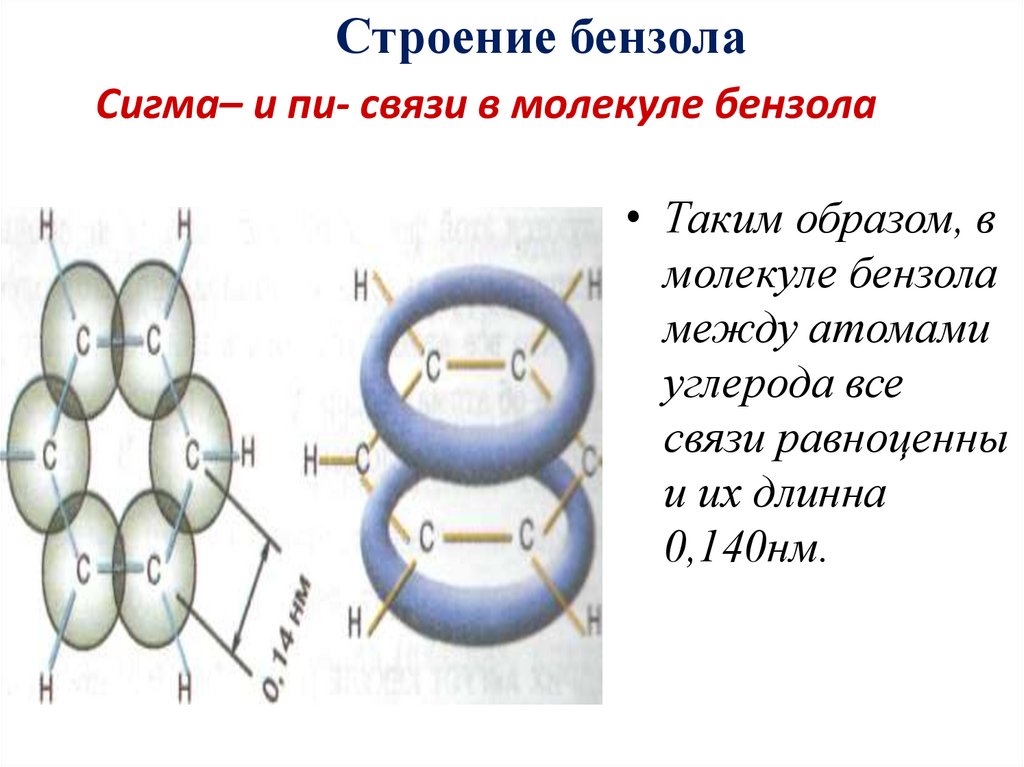
19. Сигма– и пи- связи в молекуле бензола
Строение бензолаСигма– и пи- связи в молекуле бензола
• Таким образом, в
молекуле бензола
между атомами
углерода все
связи равноценны
и их длинна
0,140нм.
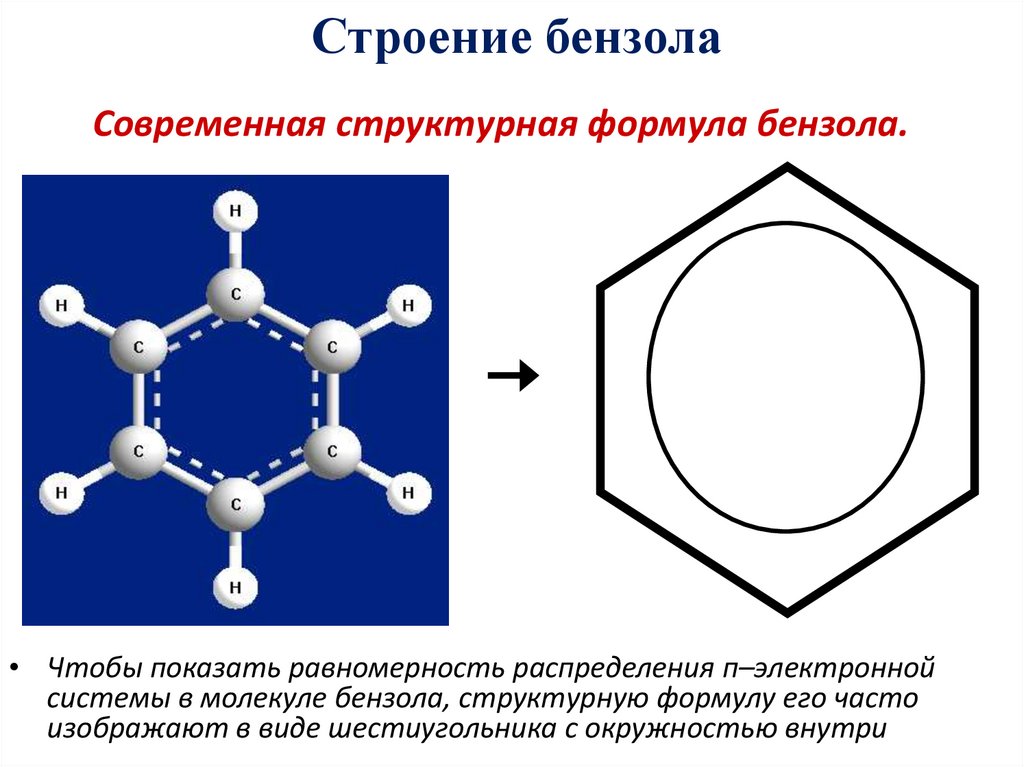
20. Современная структурная формула бензола.
Строение бензолаСовременная структурная формула бензола.
• Чтобы показать равномерность распределения п–электронной
системы в молекуле бензола, структурную формулу его часто
изображают в виде шестиугольника с окружностью внутри
21.
Физические свойства ареновБензол
Бесцветная, летучая, огнеопасная
жидкость
С неприятным запахом
Легче воды ( р=0,88 г/см3)
Не смешивается с водой
Растворим в органических
растворителях
Сам является растворителем.
Бензол кипит при 80,1 С
При охлаждении легко застывает в
белую кристаллическую массу
Бензол и его пары ядовиты
Систематическое вдыхание его паров
вызывает анемию и лейкемию.
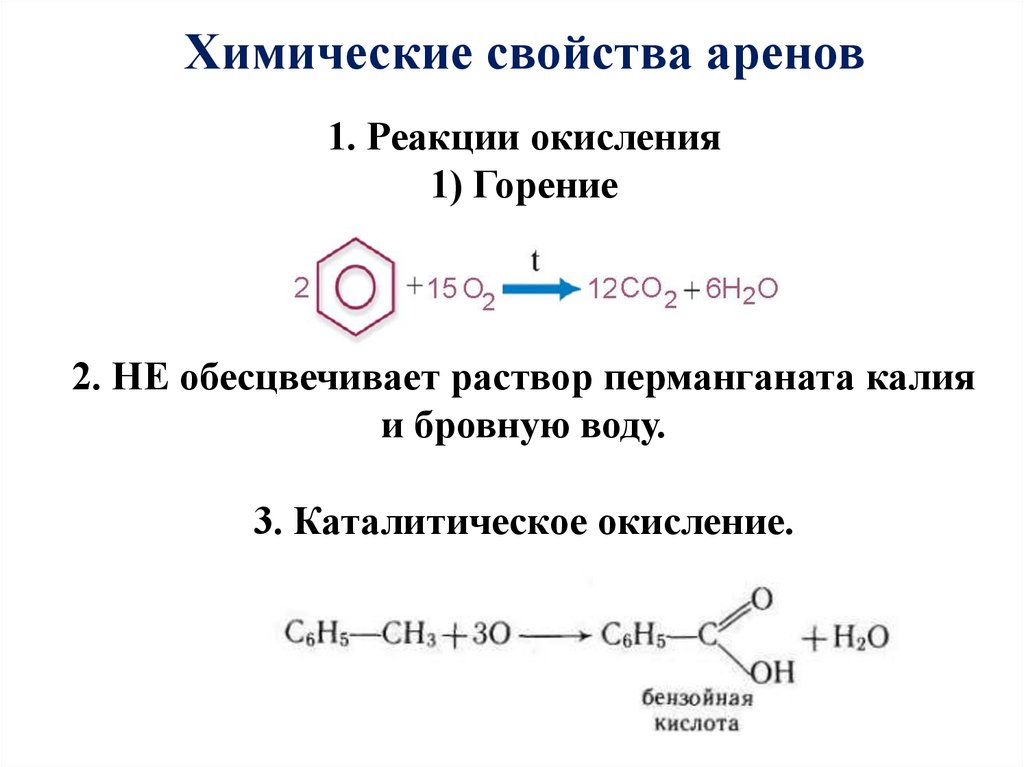
22. 1. Реакции окисления 1) Горение 2. НЕ обесцвечивает раствор перманганата калия и бровную воду. 3. Каталитическое окисление.
Химические свойства аренов1. Реакции окисления
1) Горение
2. НЕ обесцвечивает раствор перманганата калия
и бровную воду.
3. Каталитическое окисление.
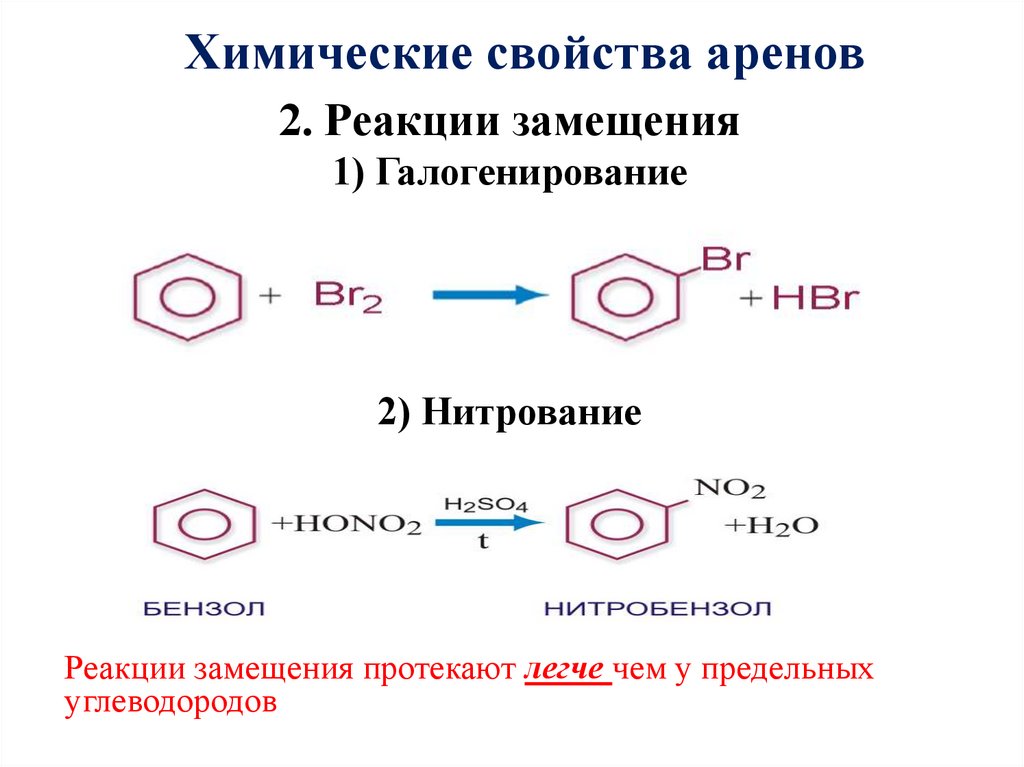
23. 2. Реакции замещения 1) Галогенирование 2) Нитрование
Химические свойства аренов2. Реакции замещения
1) Галогенирование
2) Нитрование
Реакции замещения протекают легче чем у предельных
углеводородов
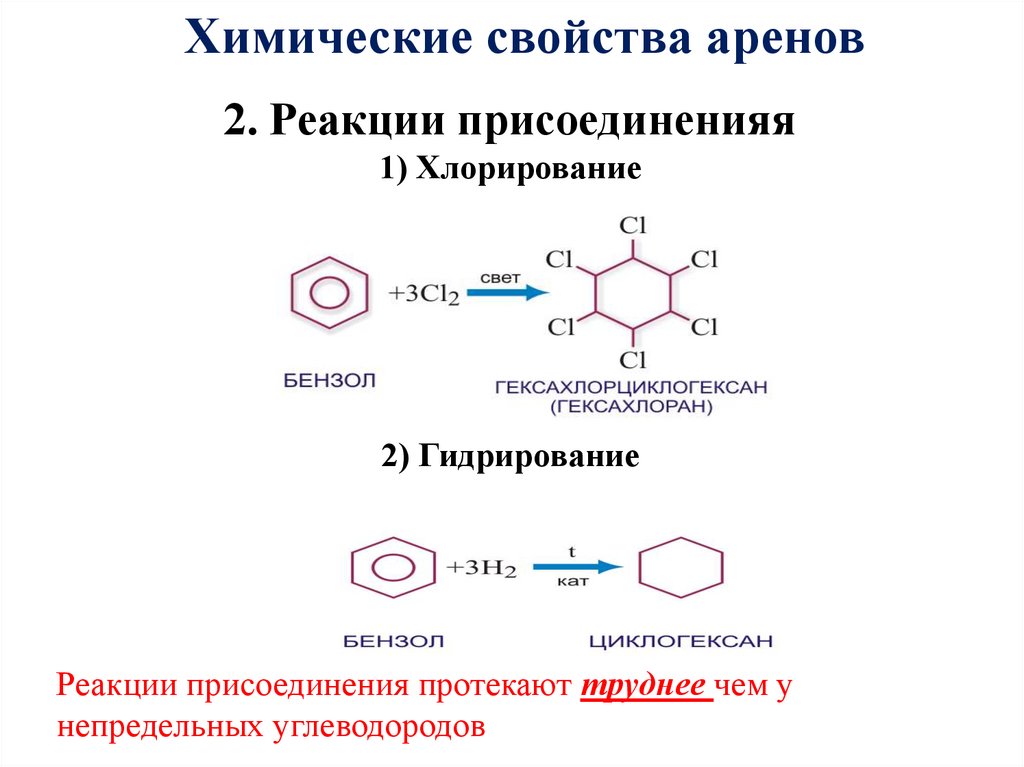
24. 2. Реакции присоединенияя 1) Хлорирование 2) Гидрирование
Химические свойства аренов2. Реакции присоединенияя
1) Хлорирование
2) Гидрирование
Реакции присоединения протекают труднее чем у
непредельных углеводородов
25.
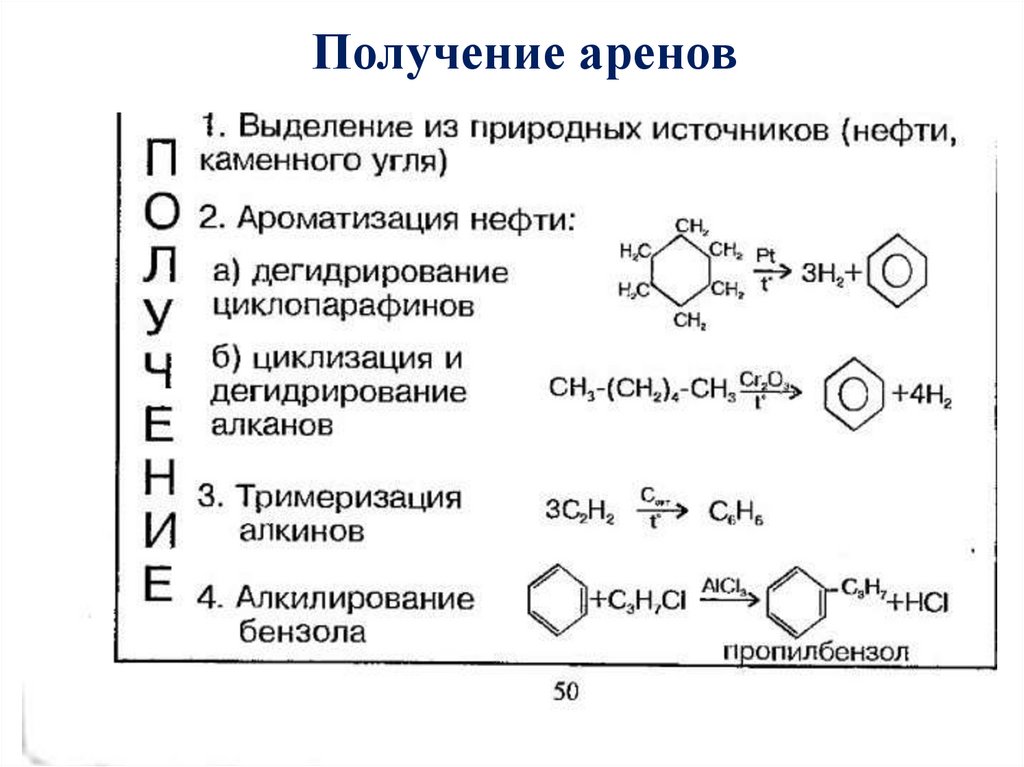
Получение аренов26.
Применение ареновБензол С6Н6
используется как
исходный продукт
для получения
различных
ароматических
соединений –
нитробензола,
хлорбензола,
анилина, фенола,
стирола и т.д.,
применяемых в
производстве
лекарств,
пластмасс,
красителей,
ядохимикатов и
многих других
органических
веществ.
Толуол С6Н5-СН3 применяется в
производстве красителей,
лекарственных и взрывчатых
веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси
трех изомеров (орто-, мета- и
пара-ксилолов) – технический
ксилол – применяется как
растворитель и исходный
продукт для синтеза многих
органических соединений.
Изопропилбензол (кумол) С6Н4СН(СН3)2 – исходное вещество для
получения фенола и ацетона.
Винилбензол (стирол) C6H5CН=СН2 используется для
получения ценного полимерного
материала полистирола.












 chemistry
chemistry








