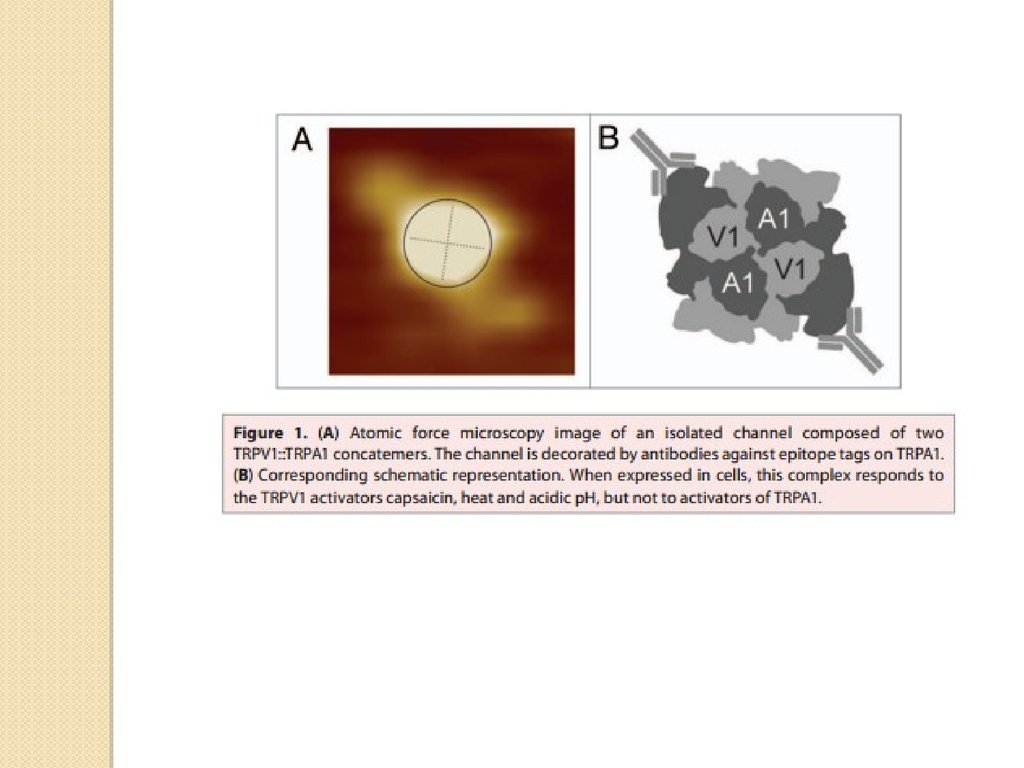
Similar presentations:
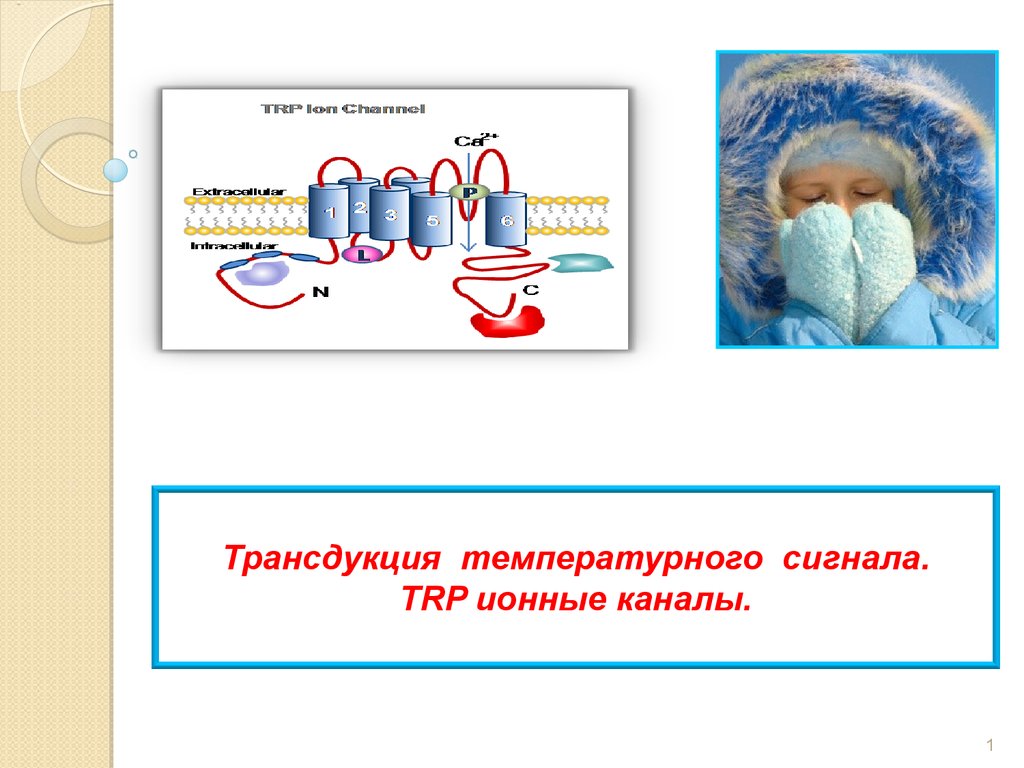
Трансдукция температурного сигнала. TRP ионные каналы
1.
Трансдукция температурного сигнала.TRP ионные каналы.
1
2.
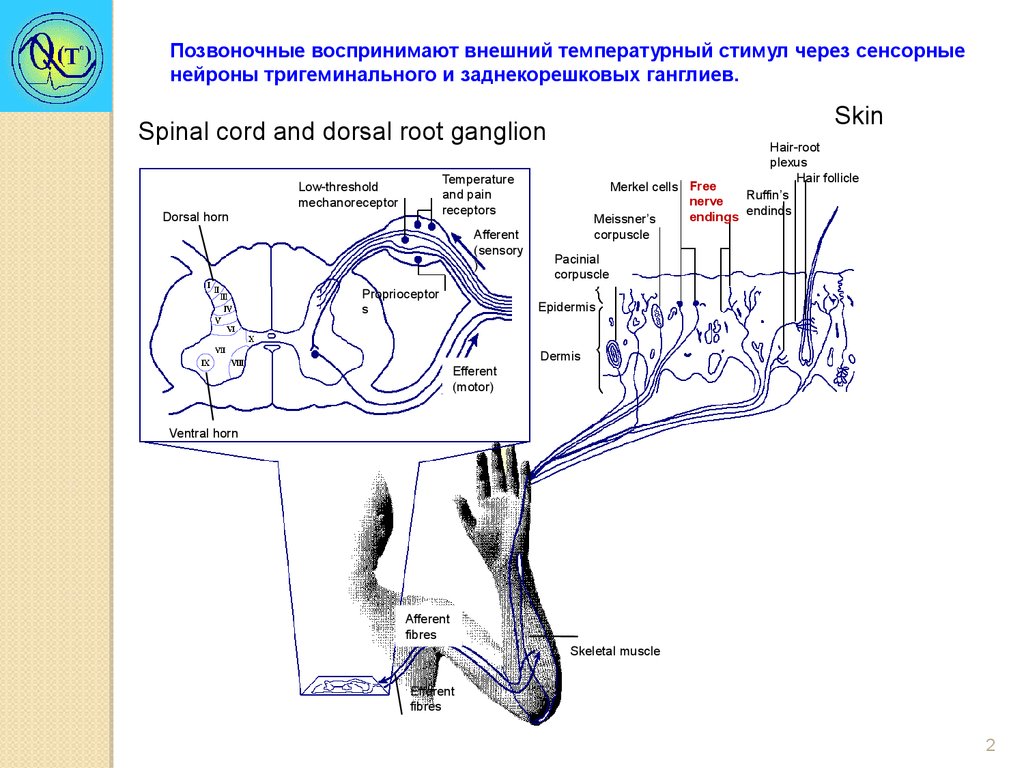
Позвоночные воспринимают внешний температурный стимул через сенсорныенейроны тригеминального и заднекорешковых ганглиев.
Skin
Spinal cord and dorsal root ganglion
Dorsal horn
Hair-root
plexus
Hair follicle
Merkel cells Free
Ruffin’s
nerve
endings endinds
Meissner’s
corpuscle
Temperature
and pain
receptors
Low-threshold
mechanoreceptor
Afferent
(sensory
)
Proprioceptor
s
Pacinial
corpuscle
Epidermis
Dermis
Efferent
(motor)
Ventral horn
Afferent
fibres
Skeletal muscle
Efferent
fibres
2
3.
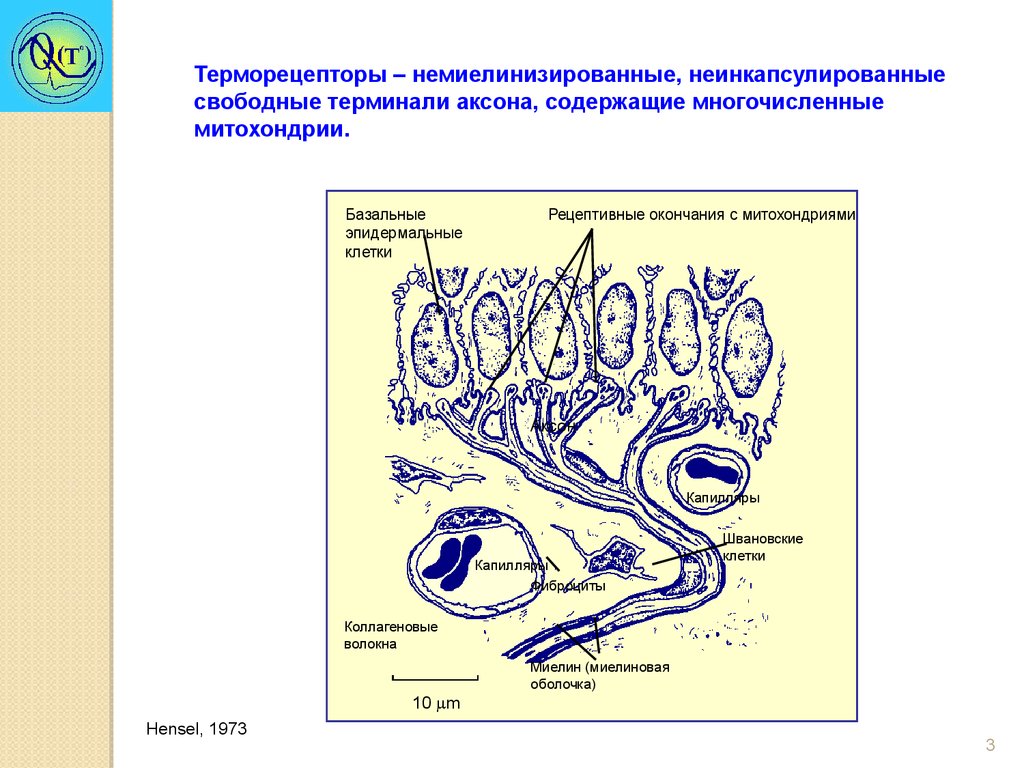
Терморецепторы – немиелинизированные, неинкапсулированныесвободные терминали аксона, содержащие многочисленные
митохондрии.
Базальные
эпидермальные
клетки
Рецептивные окончания с митохондриями
Аксон
Капилляры
Капилляры
Фиброциты
Швановские
клетки
Коллагеновые
волокна
10 m
Hensel, 1973
Миелин (миелиновая
оболочка)
3
4.
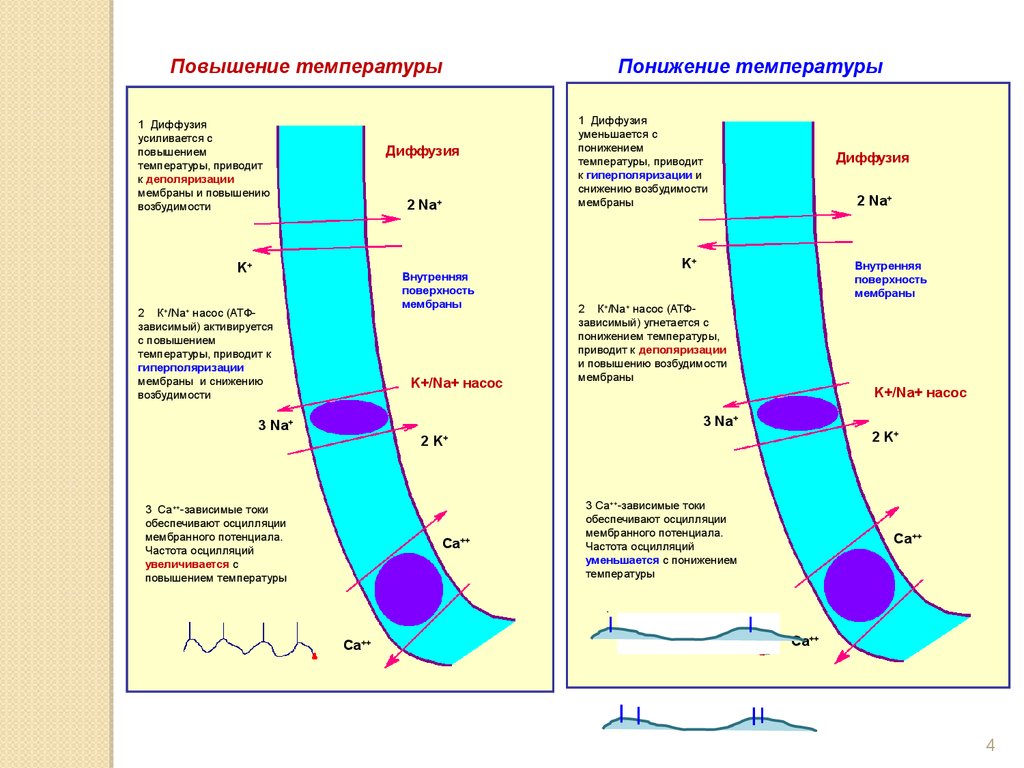
Повышение температуры1 Диффузия
усиливается с
повышением
температуры, приводит
к деполяризации
мембраны и повышению
возбудимости
Понижение температуры
Диффузия
2 Na+
K+
Внутренняя
поверхность
мембраны
2 К+/Na+ насос (АТФзависимый) активируется
с повышением
температуры, приводит к
гиперполяризации
мембраны и снижению
возбудимости
K+/Na+ насос
1 Диффузия
уменьшается с
понижением
температуры, приводит
к гиперполяризации и
снижению возбудимости
мембраны
Диффузия
2 Na+
K+
Внутренняя
поверхность
мембраны
2 К+/Na+ насос (АТФзависимый) угнетается с
понижением температуры,
приводит к деполяризации
и повышению возбудимости
мембраны
K+/Na+ насос
3 Na+
3 Na+
2 K+
2K
+
3 Са++-зависимые токи
обеспечивают осцилляции
мембранного потенциала.
Частота осцилляций
увеличивается с
повышением температуры
Ca++
Ca++
3 Са++-зависимые токи
обеспечивают осцилляции
мембранного потенциала.
Частота осцилляций
уменьшается с понижением
температуры
Ca++
Ca++
4
5.
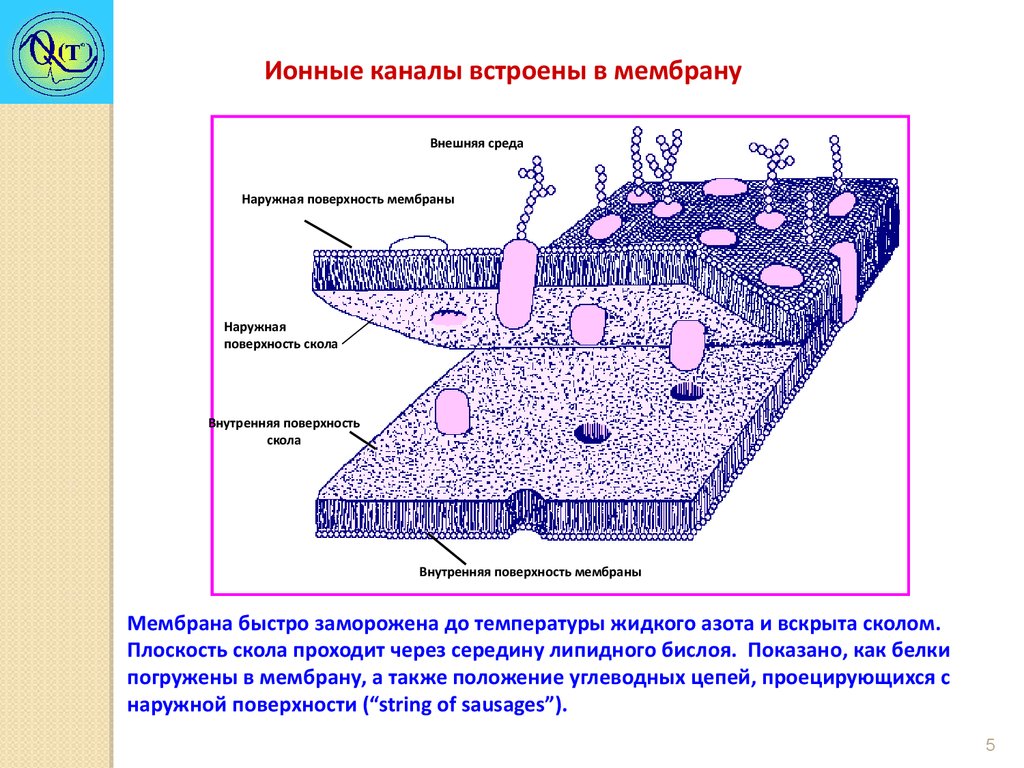
Ионные каналы встроены в мембрануВнешняя среда
Наружная поверхность мембраны
Наружная
поверхность скола
Внутренняя поверхность
скола
Внутренняя поверхность мембраны
Мембрана быстро заморожена до температуры жидкого азота и вскрыта сколом.
Плоскость скола проходит через середину липидного бислоя. Показано, как белки
погружены в мембрану, а также положение углеводных цепей, проецирующихся с
наружной поверхности (“string of sausages”).
5
6.
Ионные каналы участвуют во многих процессах,требующих быстрых изменений в клетке.
Возбуждение нервных клеток
Сокращение сердечной, скелетной и гладкой
мускулатуры
Эпителиальный транспорт
Активация иммунных Т-клеток
Выделение инсулина β-клетками поджелудочной
железы и т. д.
TRP (Transient Receptor Potential) каналы, как и другие ионные каналы,
служат для осуществления реакции клетки на различные внешние
стимулы путем усиления или ослабления проницаемости для
определенных ионов, в результате чего изменяется разность потенциалов
между внешней и внутренней сторонами мембраны.
6
7.
8.
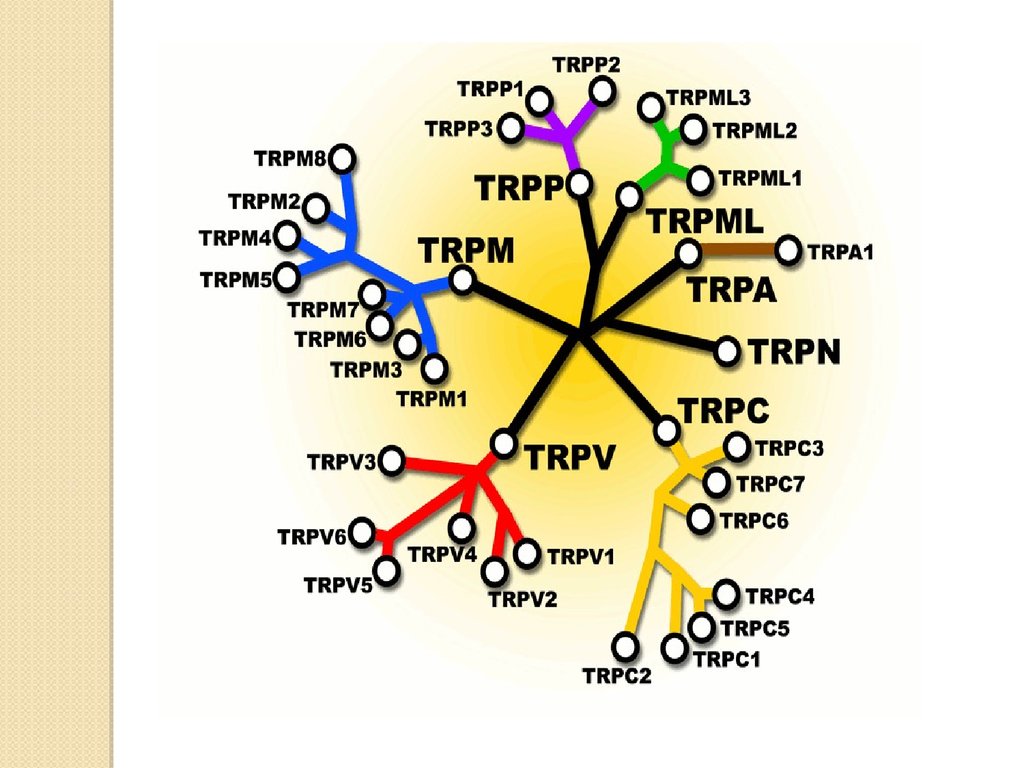
TRP каналы подразделяются на несколько классов:TRPС (canonical)
TRPP (polycystin)
TRPV (vanilloid)
TRPML (mucolipin)
TRPM (melastatin)
TRPA (ankyrin transmembrane protein)
TRP каналы различны по типу ионов, для которых
проницаемы:
Селективные для Са2+
Селективные для К+
Неселективные катионные
Селективные для Na+
8
9.
TRP каналы различны по способу их активации• Напряжение
• Концентрация внутриклеточного Са2+,
• Температура,
• рН,
• Осмолярность,
• Механический стимул,
• Некоторые TRP каналы открыты постоянно.
9
10.
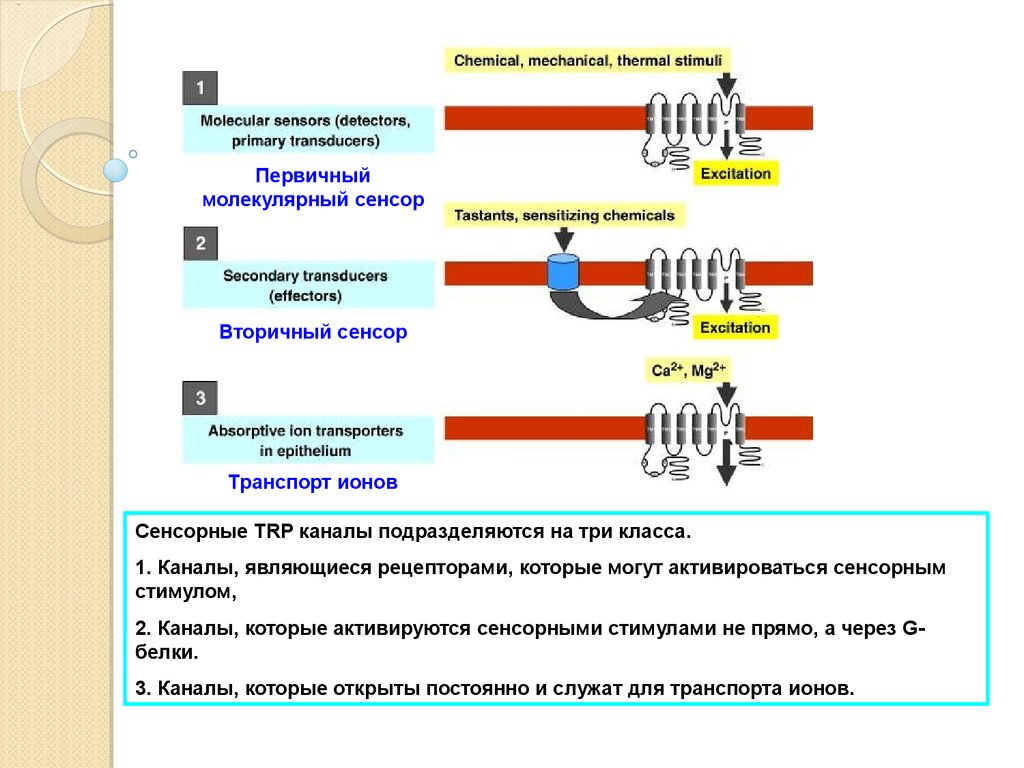
Первичныймолекулярный сенсор
Вторичный сенсор
Транспорт ионов
Fig. 1
Сенсорные
TRP каналы подразделяются на три класса.
Diagram portraying 3 different molecular roles of TRP channels in the digestive system: (1) TRP
1.channels
Каналы,
рецепторами,
которые
могут активироваться
сенсорным
asявляющиеся
molecular sensors
(detectors or primary
transducers)
of chemical and physical
stimuli,
стимулом,
(2) TRP channels as secondary transducers (downstream transducers or effectors) of cell activation
2+
by которые
G protein-coupled
receptorsсенсорными
or ion channel receptors,
andне
(3)прямо,
TRP channels
as Ca
or
2.induced
Каналы,
активируются
стимулами
а
через
GMg2+ transport channels.
белки.
3. Каналы, которые открыты постоянно и служат для транспорта ионов.
11.
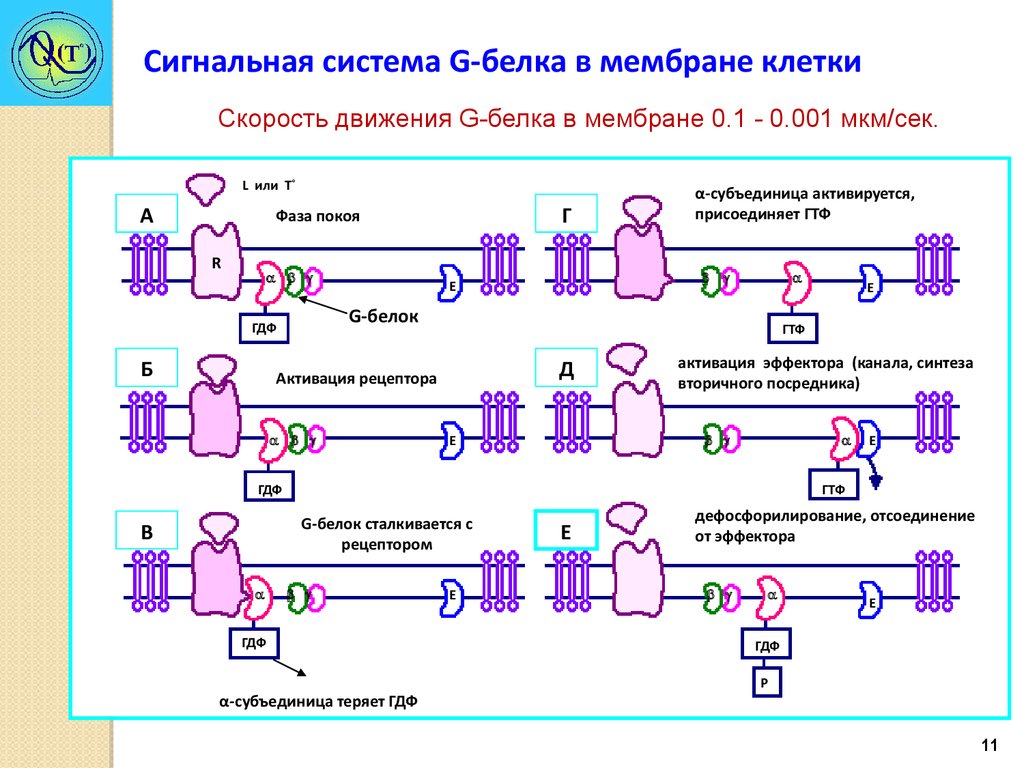
Сигнальная система G-белка в мембране клеткиСкорость движения G-белка в мембране 0.1 - 0.001 мкм/сек.
L или Т˚
А
Г
Фаза покоя
R
Е
G-белок
ГДФ
Б
α-субъединица активируется,
присоединяет ГТФ
ГТФ
Д
Активация рецептора
активация эффектора (канала, синтеза
вторичного посредника)
Е
ГДФ
Е
ГТФ
G-белок сталкивается с
рецептором
В
Е
ГДФ
α-субъединица теряет ГДФ
Е
Е
дефосфорилирование, отсоединение
от эффектора
Е
ГДФ
Р
11
12.
Термочувствительные TRP ионные каналы– молекулярная основа терморецепции.
12
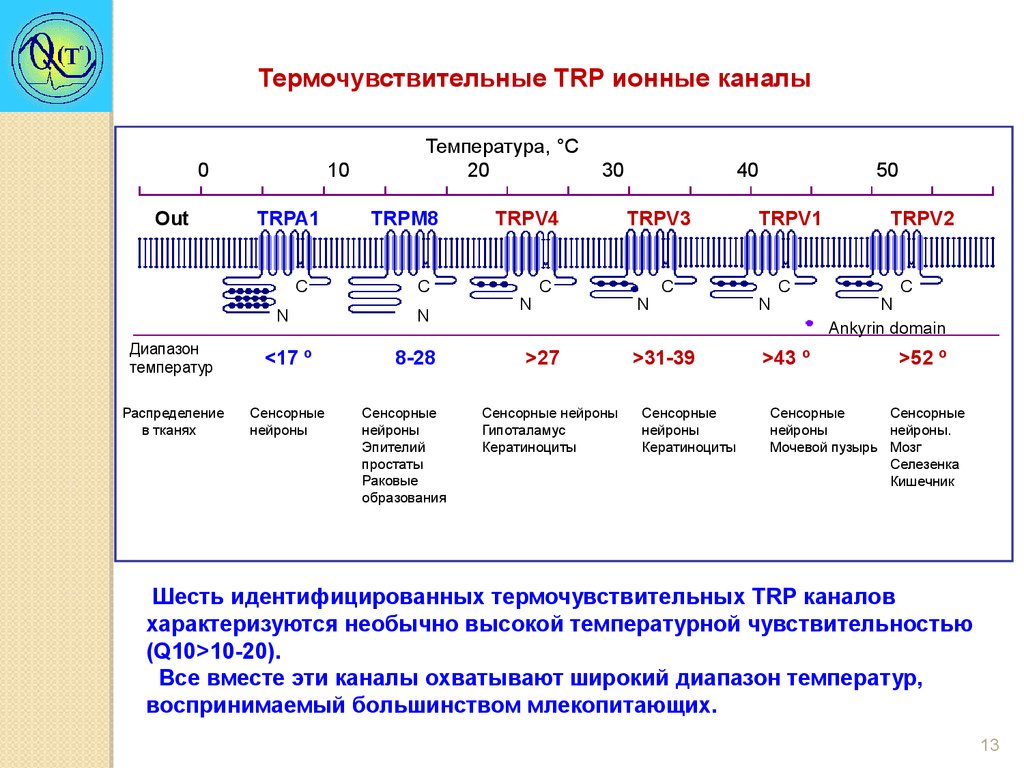
13.
Термочувствительные TRP ионные каналы0
Out
10
TRPA1
C
N
Диапазон
температур
<17 º
Распределение
в тканях
Сенсорные
нейроны
Температура, °C
20
TRPM8
C
N
8-28
Сенсорные
нейроны
Эпителий
простаты
Раковые
образования
30
TRPV4
N
C
>27
Сенсорные нейроны
Гипоталамус
Кератиноциты
40
TRPV3
N
C
>31-39
Сенсорные
нейроны
Кератиноциты
50
TRPV1
N
C
>43 º
TRPV2
C
N
Ankyrin domain
>52 º
Сенсорные
Сенсорные
нейроны
нейроны.
Мочевой пузырь Мозг
Селезенка
Кишечник
Шесть идентифицированных термочувствительных TRР каналов
характеризуются необычно высокой температурной чувствительностью
(Q10>10-20).
Все вместе эти каналы охватывают широкий диапазон температур,
воспринимаемый большинством млекопитающих.
13
14.
Жгучий перец - TRPV1Чеснок, горчичное масло - TRPA1
Камфора - TRPV3
Имбирь, корица – TRPA1
Мята, ментол – TRPM8
15.
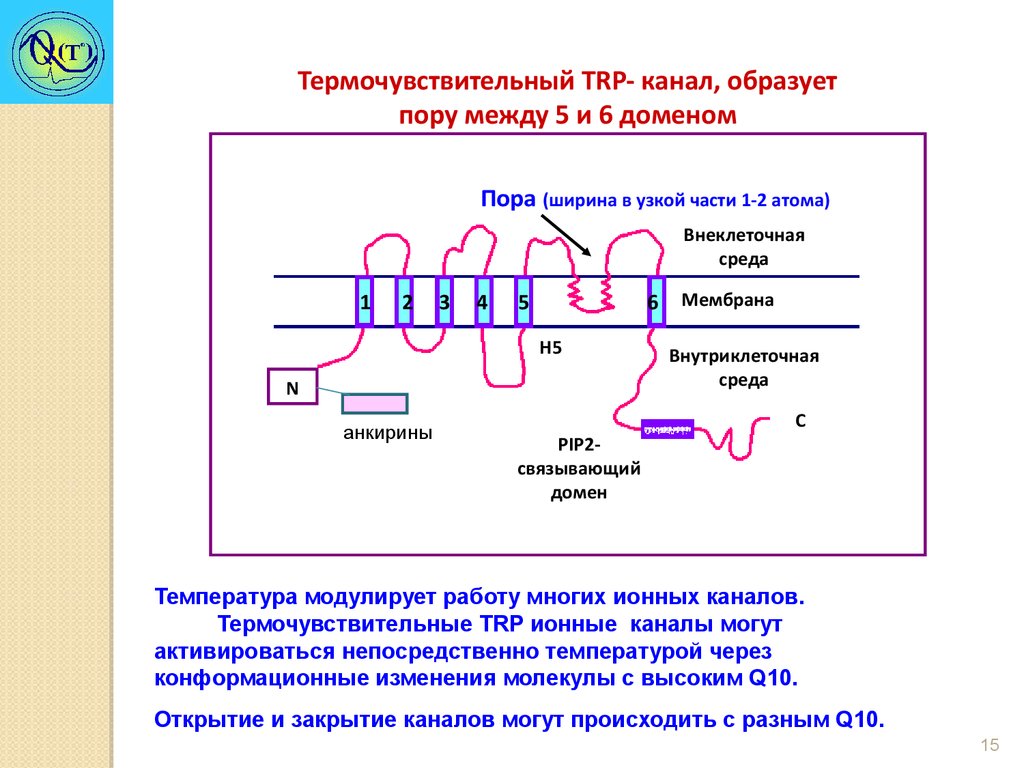
Термочувствительный TRP- канал, образуетпору между 5 и 6 доменом
Пора (ширина в узкой части 1-2 атома)
Внеклеточная
среда
1
2
3
4
6 Мембрана
5
Н5
N
анкирины
PIP2связывающий
домен
Внутриклеточная
среда
С
Температура модулирует работу многих ионных каналов.
Термочувствительные TRP ионные каналы могут
активироваться непосредственно температурой через
конформационные изменения молекулы с высоким Q10.
Открытие и закрытие каналов могут происходить с разным Q10.
15
16.
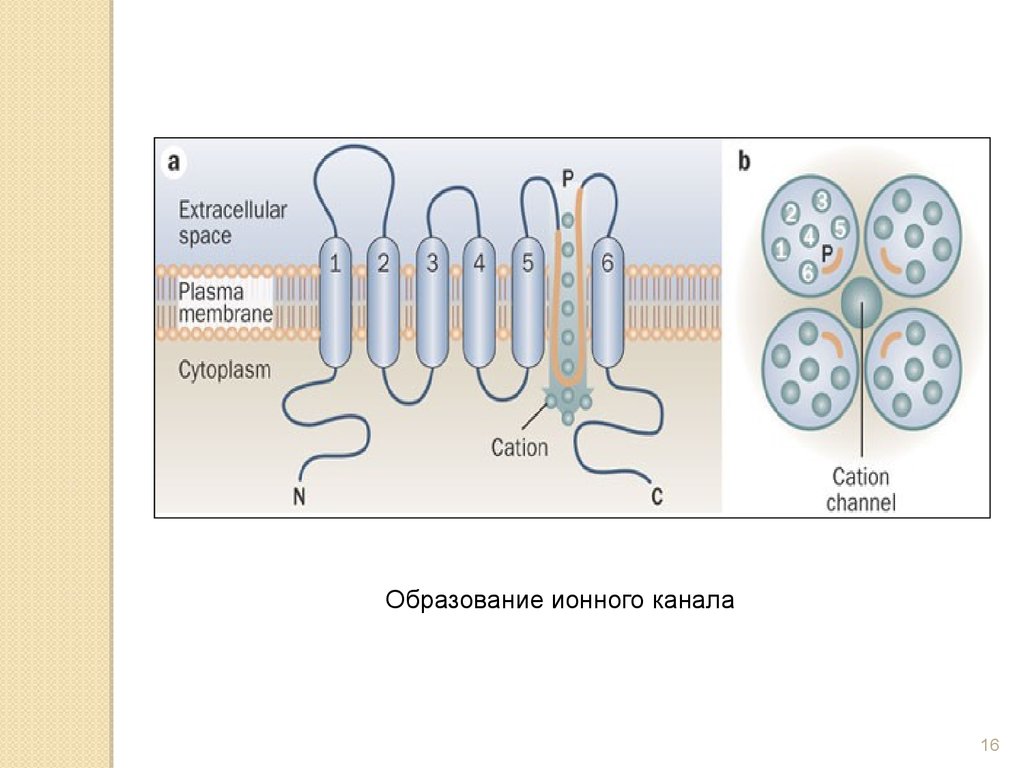
Образование ионного канала16
17.
Встраивание ионных каналов в мембрану клетки18.
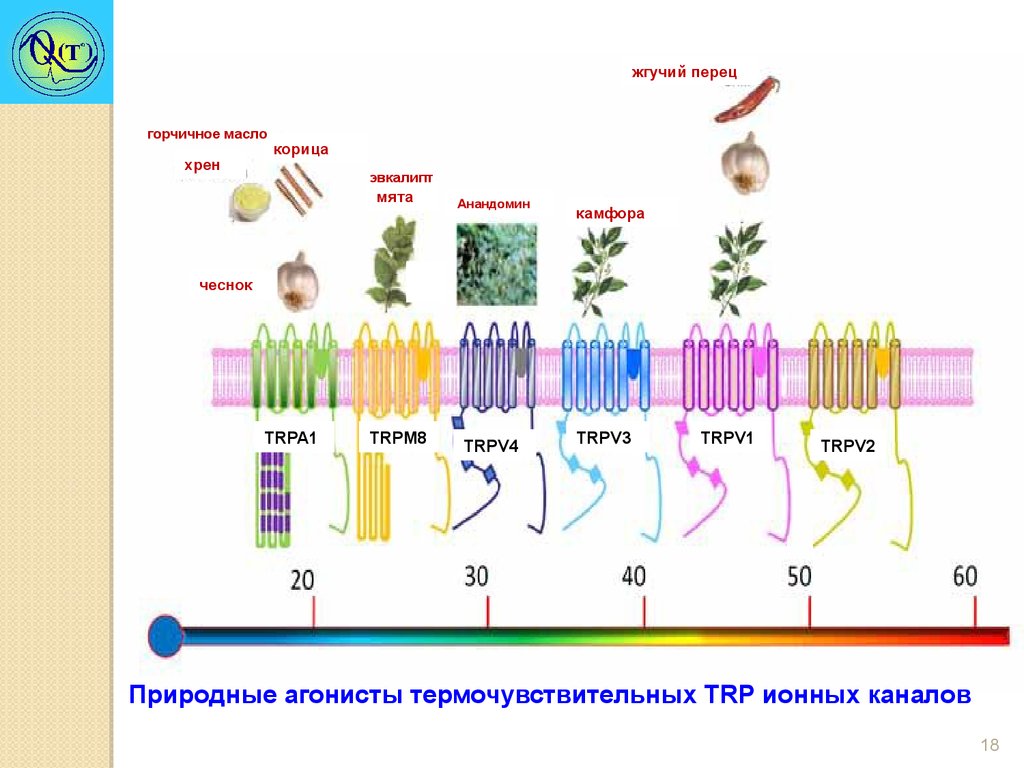
жгучий перецгорчичное масло
хрен
корица
эвкалипт
мята
Анандомин
камфора
чеснок
TRPA1
TRPM8
TRPV4
TRPV3
TRPV1
TRPV2
Природные агонисты термочувствительных TRP ионных каналов
18
19.
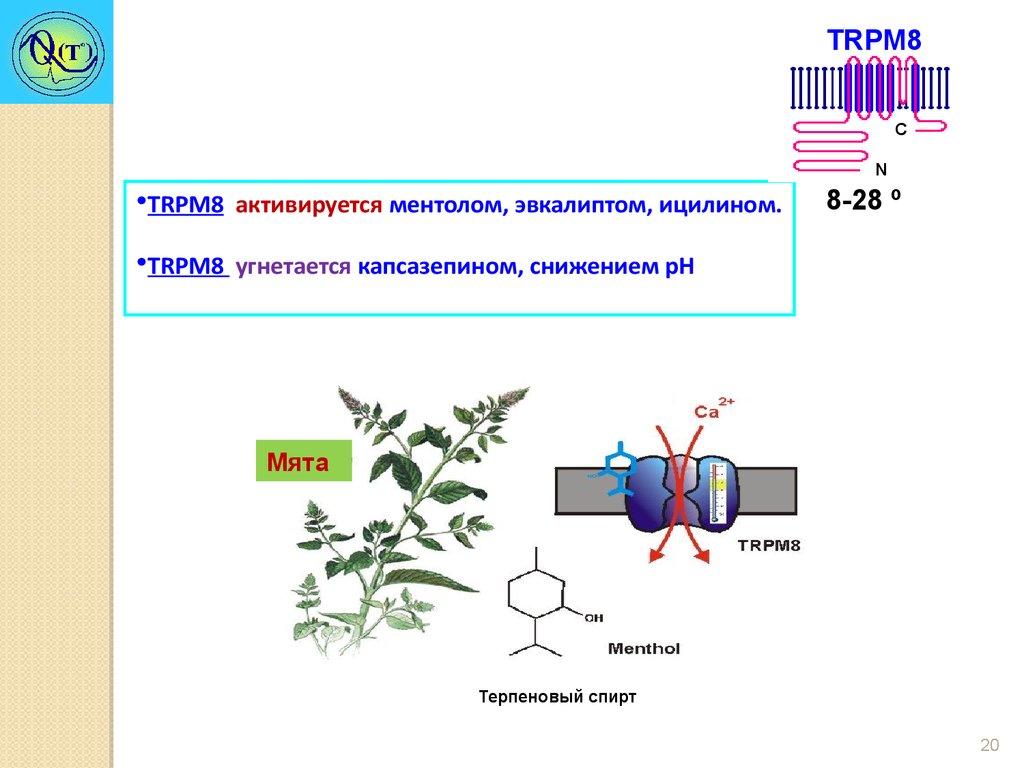
TRPM8Холодовой рецептор
C
N
8-28 º
•Имеет температурный порог активации 28°С с увеличивающимся током
вплоть до 8°С.
•Преимущественно Са2+ канал.
•Биофизические свойства клеток, экспрессирующих TRPM8, сходны с
таковыми у холодо-чувствительных сенсорных нейронов.
•У мышей с дефицитом TRPM8 изменена чувствительность к холоду.
19
20.
TRPM8C
N
•TRPM8 активируется ментолом, эвкалиптом, ицилином.
8-28 º
•TRPM8 угнетается капсазепином, снижением рН
Мята
Терпеновый спирт
20
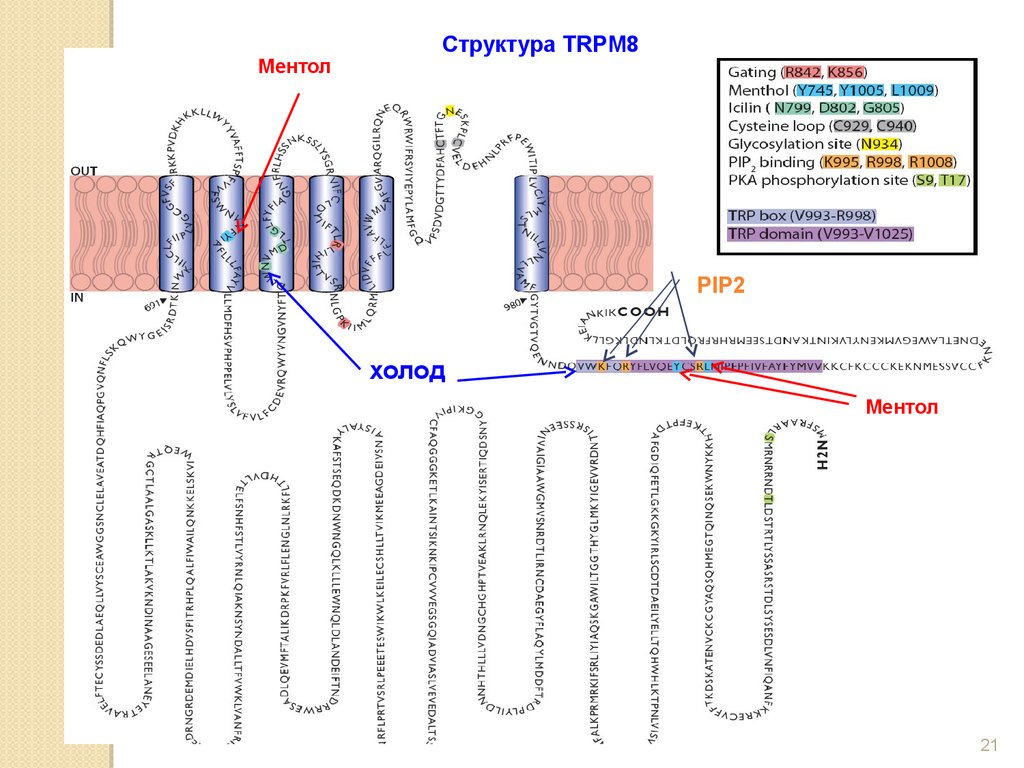
21.
МентолСтруктура TRPM8
PIP2
холод
Ментол
21
22.
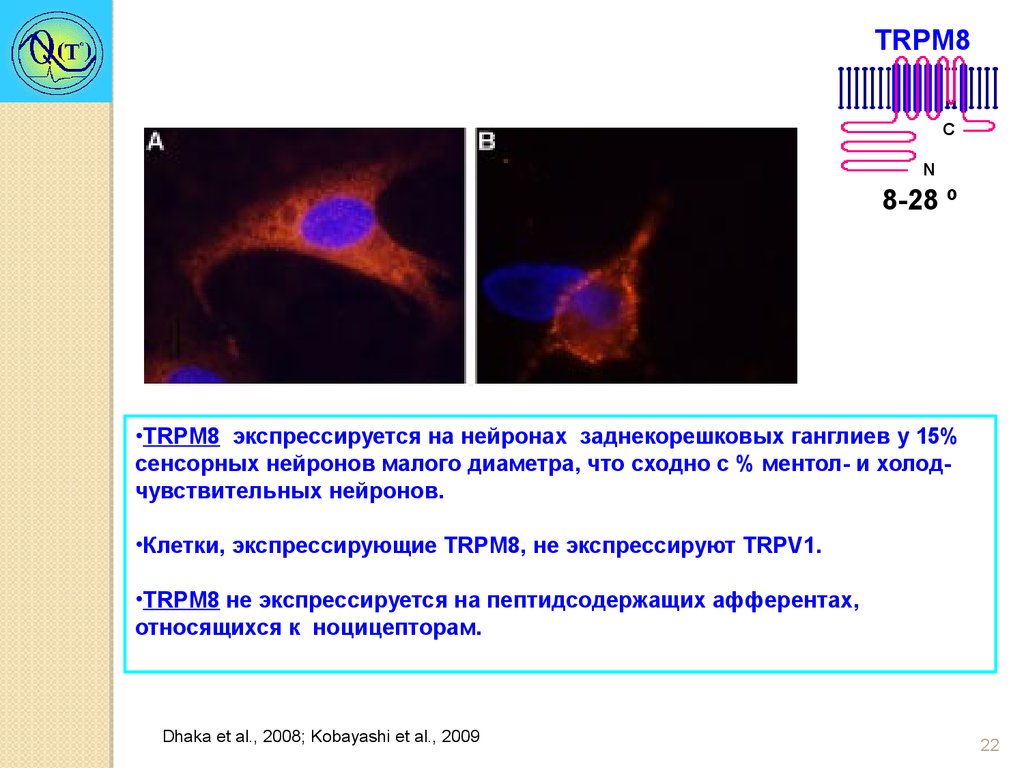
TRPM8C
N
8-28 º
•TRPM8 экспрессируется на нейронах заднекорешковых ганглиев у 15%
сенсорных нейронов малого диаметра, что сходно с % ментол- и холодчувствительных нейронов.
•Клетки, экспрессирующие TRPM8, не экспрессируют TRPV1.
•TRPM8 не экспрессируется на пептидсодержащих афферентах,
относящихся к ноцицепторам.
Dhaka et al., 2008; Kobayashi et al., 2009
22
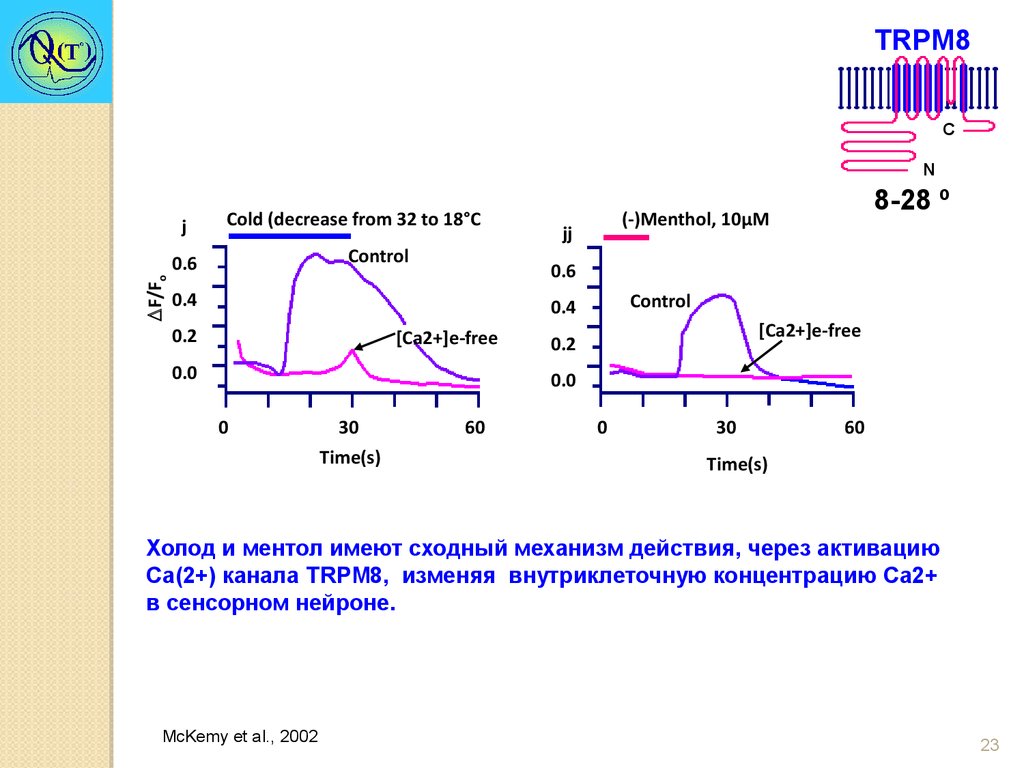
23.
TRPM8C
N
j
Cold (decrease from 32 to 18°С
Control
F/Fo
0.6
jj
0.6
0.4
Control
0.4
0.2
8-28 º
(-)Menthol, 10μM
[Ca2+]e-free
0.0
[Ca2+]e-free
0.2
0.0
0
30
Time(s)
60
0
30
60
Time(s)
Холод и ментол имеют сходный механизм действия, через активацию
Са(2+) канала TRPM8, изменяя внутриклеточную концентрацию Ca2+
в сенсорном нейроне.
McKemy et al., 2002
23
24.
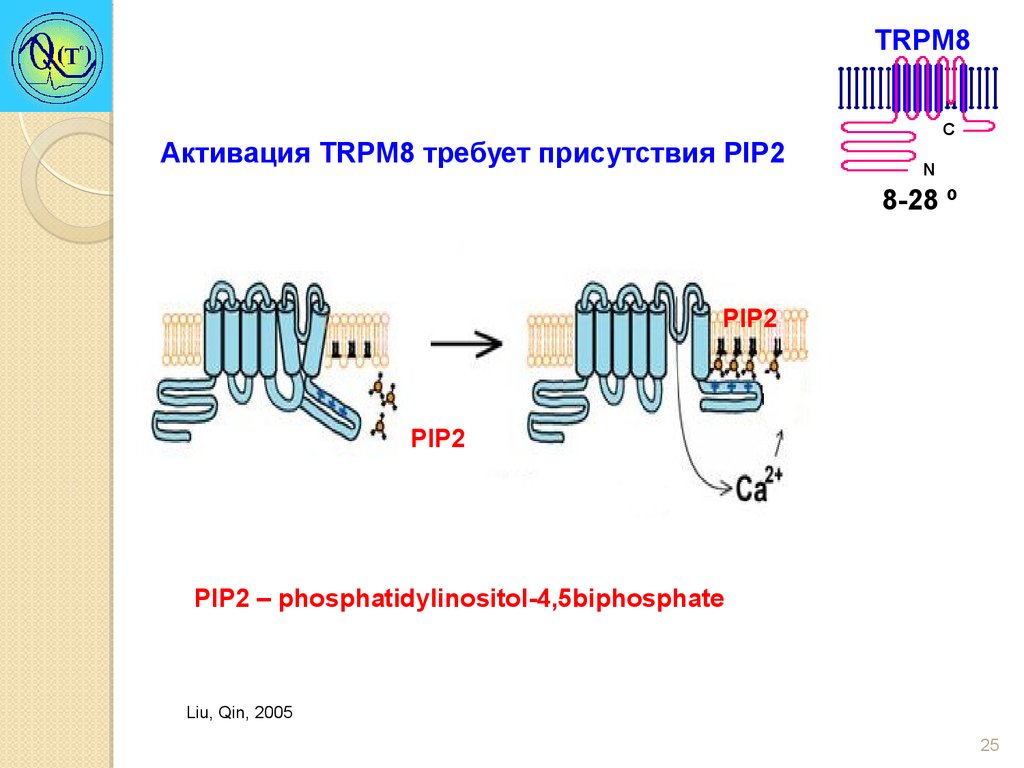
Single channel recordings of TRPM8 channels25.
TRPM8Активация TRPM8 требует присутствия PIP2
C
N
8-28 º
PIP2
PIP2
PIP2 – phosphatidylinositol-4,5biphosphate
Liu, Qin, 2005
25
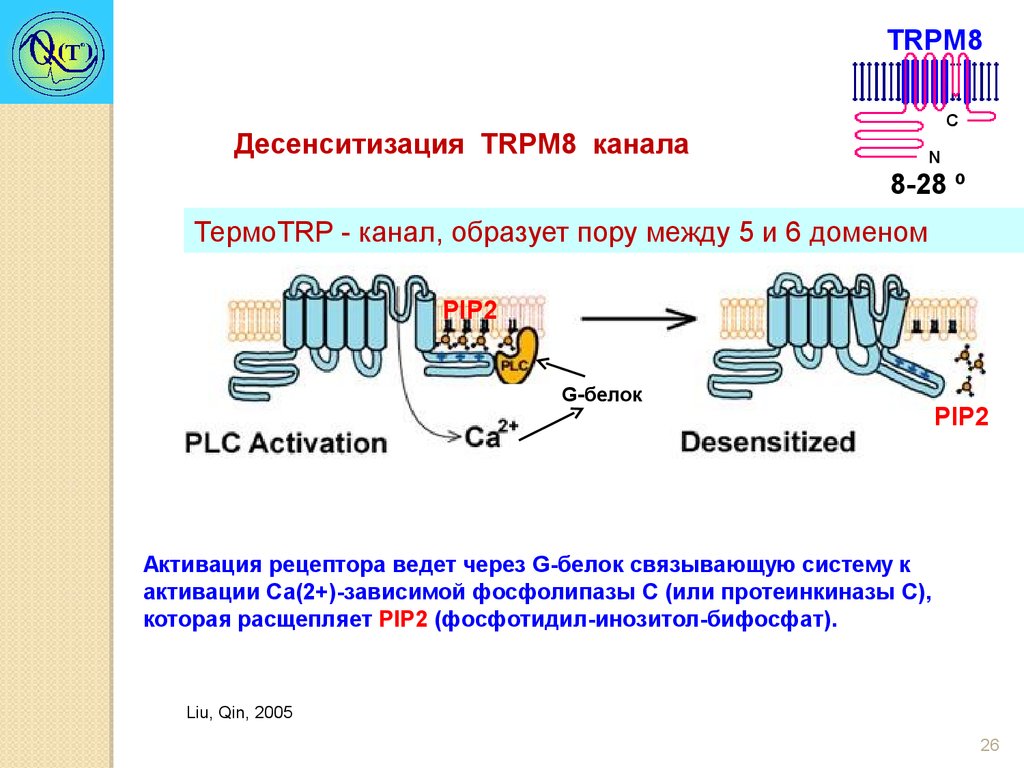
26.
TRPM8Десенситизация TRPM8 канала
C
N
8-28 º
ТермоTRP - канал, образует пору между 5 и 6 доменом
PIP2
G-белок
PIP2
Активация рецептора ведет через G-белок связывающую систему к
активации Са(2+)-зависимой фосфолипазы С (или протеинкиназы С),
которая расщепляет PIP2 (фосфотидил-инозитол-бифосфат).
Liu, Qin, 2005
26
27.
TRPA1Холодочувствительный ионный канал
C
N
<17 º
•TRPА1 активируется холодом при более низкой температуре <17°С.
Возможно, является сенсором холодового повреждения.
•Неселективный катионный канал, не чувствителен к ментолу.
•Кроме температуры активируется горчичным маслом, имбирным
маслом, корицей, гвоздичным маслом, слезоточивым газом, чесноком.
•Чувствителен к брадикинину, по-видимому, обусловливает
гиперчувствительность к холоду, участвует в воспалении.
•TRPА1 экспрессируется на сенсорных нейронах, которые не
экспрессируют TRPM8, но экспрессируют CGRP, SP (маркеры ноцицепторов)
•TRPА1, экспрессируется также на нейронах, содержащих TRPV1.
•Воспаление и повреждение нерва увеличивает экспрессию TRPA1,
возможно за счет действия NGF (фактора роста нервов), что может
приводить к гипералгезии к холоду (нейропатические боли).
•TRPА1 может быть активирован через фосфолипазу С.
27
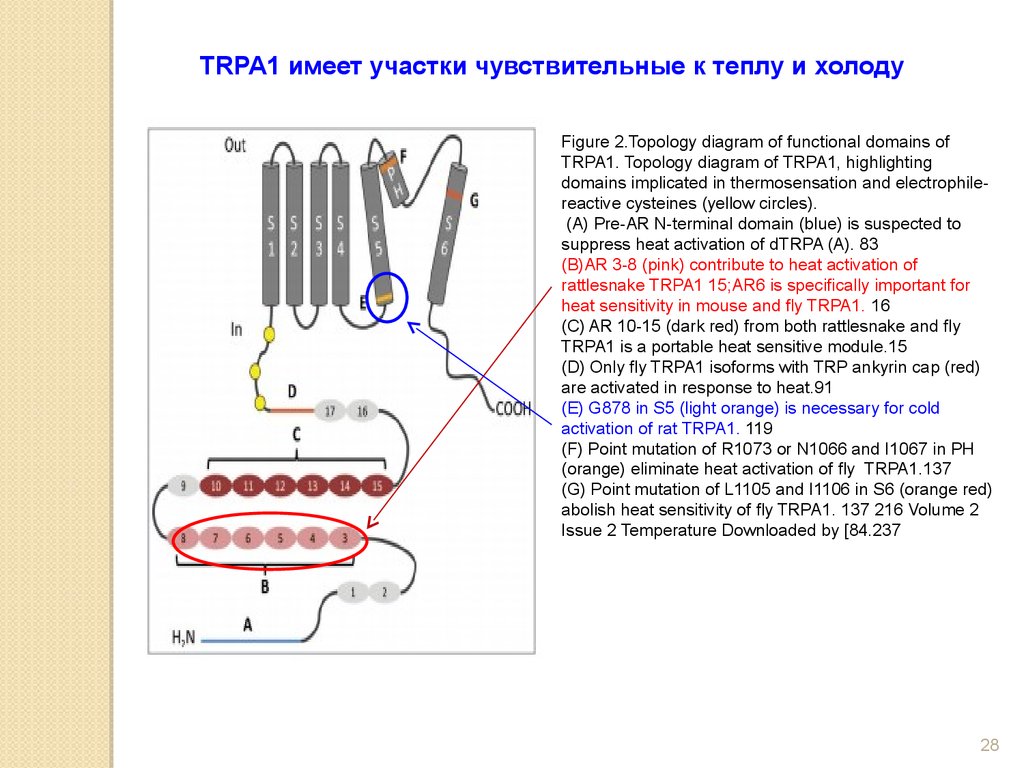
28.
TRPA1 имеет участки чувствительные к теплу и холодуFigure 2.Topology diagram of functional domains of
TRPA1. Topology diagram of TRPA1, highlighting
domains implicated in thermosensation and electrophilereactive cysteines (yellow circles).
(A) Pre-AR N-terminal domain (blue) is suspected to
suppress heat activation of dTRPA (A). 83
(B)AR 3-8 (pink) contribute to heat activation of
rattlesnake TRPA1 15;AR6 is specifically important for
heat sensitivity in mouse and fly TRPA1. 16
(C) AR 10-15 (dark red) from both rattlesnake and fly
TRPA1 is a portable heat sensitive module.15
(D) Only fly TRPA1 isoforms with TRP ankyrin cap (red)
are activated in response to heat.91
(E) G878 in S5 (light orange) is necessary for cold
activation of rat TRPA1. 119
(F) Point mutation of R1073 or N1066 and I1067 in PH
(orange) eliminate heat activation of fly TRPA1.137
(G) Point mutation of L1105 and I1106 in S6 (orange red)
abolish heat sensitivity of fly TRPA1. 137 216 Volume 2
Issue 2 Temperature Downloaded by [84.237
28
29.
Warm sensitiveTRPA1
Cold sensitive
29
30.
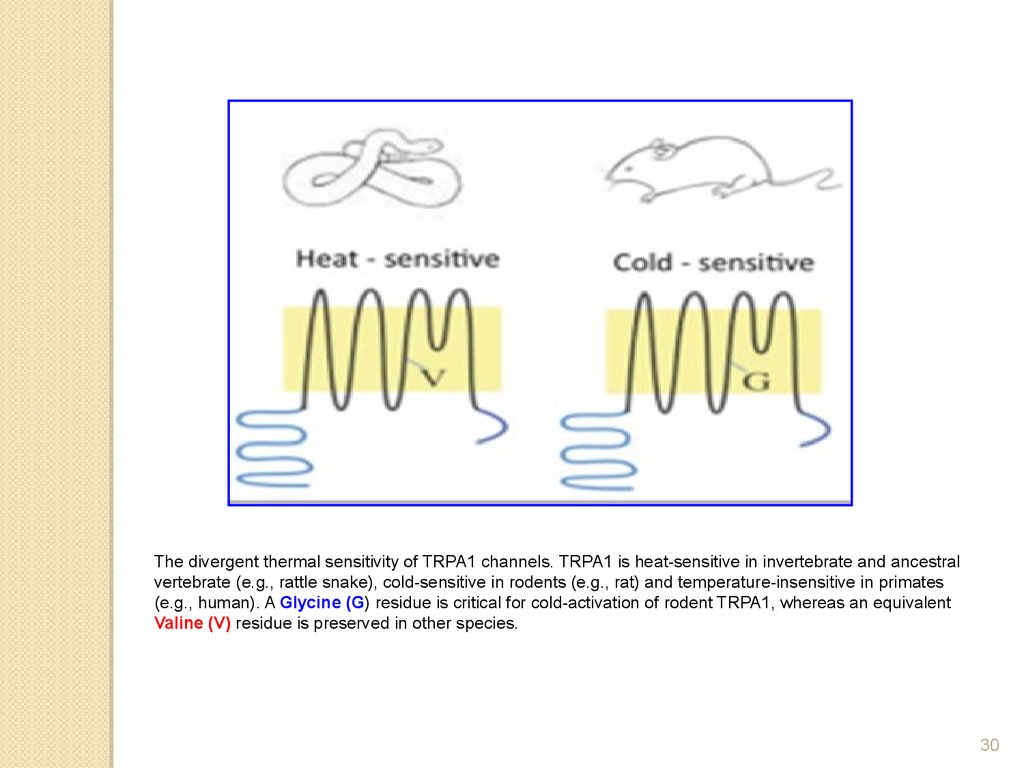
The divergent thermal sensitivity of TRPA1 channels. TRPA1 is heat-sensitive in invertebrate and ancestralvertebrate (e.g., rattle snake), cold-sensitive in rodents (e.g., rat) and temperature-insensitive in primates
(e.g., human). A Glycine (G) residue is critical for cold-activation of rodent TRPA1, whereas an equivalent
Valine (V) residue is preserved in other species.
30
31.
Теплочувствительный каналTRPV1
N
C
>42 º
•Активируется температурой >42°С.
•Известен, как ваниллоидный рецептор.
•Высоко чувствителен к температуре, Q10>20.6.
•Неселективный катионный канал, проницаем для ионов Са2+ и Na+.
•У TRPV1-дефицитных мышей изменен порог теплового ответа.
•Ответственен за гипералгезию при воспалении
Локализация
•Экспрессируется на С- и Аδ-волокнах пептидэргических сенсорных
нейронах, а также в мозге, включая спинной мозг, в коже, мочевом
пузыре, языке.
•Не соэкспрессируется с TRPM8, но соэкспрессируется с TRPA1.
31
32.
Природныелиганды
TRPA1
горчица, корица
TRPM8
ментол
C
C
N
ºC
50
Термочувствительные
афференты
Ощущения
N
N
40
30
30
10
Холод
ºC
C
ºC
50
40
20
TRPV1
жгучий перец
20
10
Болевые
ощущения холода
и тепла
32
33.
TRPV1N
C
>42 º
Активируется: капсаицином, низким рН (в противоположность
TRPM8).
Сенситизируется также факторами, участвующими в воспалении:
•NGF (фактор роста нервов), вызывает температурную
гипералгезию, увеличивает уровень TRPV1 в коже в 25 раз, но не в
мозге),
•брадикинином (температурная гипералгезя),
•липидами (температурная гипералгезия),
•простагландинами,
•АТФ,
•протеинкиназой С.
Угнетается – капсазепином и рутением красным.
Десенситизируется - протеинкиназой А, АТФ, кальмодулином
33
34.
TRPV1N
C
>42 º
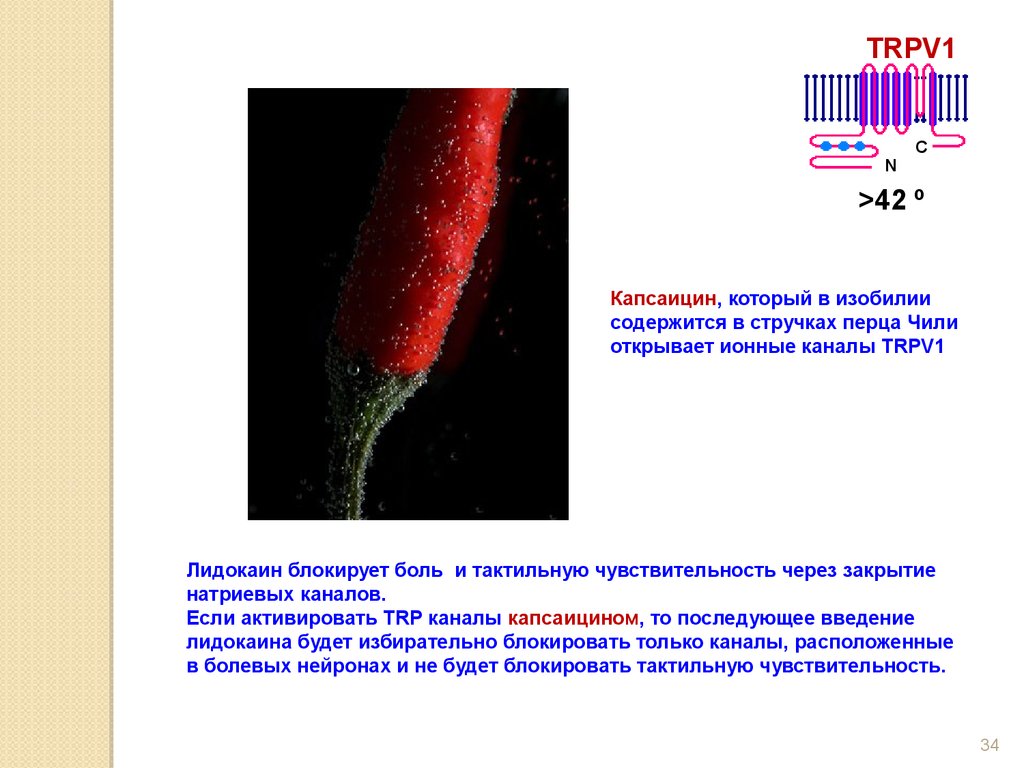
Капсаицин, который в изобилии
содержится в стручках перца Чили
открывает ионные каналы TRPV1
Лидокаин блокирует боль и тактильную чувствительность через закрытие
натриевых каналов.
Если активировать TRP каналы капсаицином, то последующее введение
лидокаина будет избирательно блокировать только каналы, расположенные
в болевых нейронах и не будет блокировать тактильную чувствительность.
34
35.
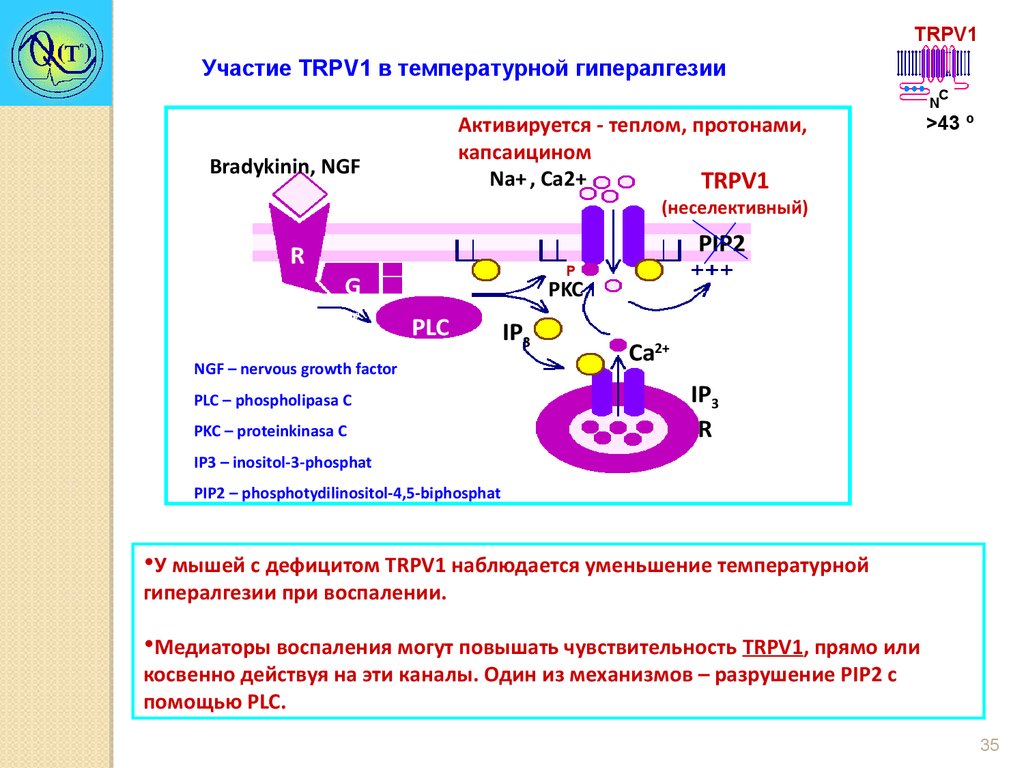
TRPV1Участие TRPV1 в температурной гипералгезии
Активируется - теплом, протонами,
капсаицином
+
Na+ , Ca2+ Na
TRPV1
Bradykinin, NGF
C
N
>43 º
(неселективный)
R
G
PIP
DAG
2
PLCβ
PLC 2
IP3
NGF – nervous growth factor
PLC – phospholipasa C
PKC – proteinkinasa C
Taste transduction
TRPM5
PIP2
Р
PKC
Ca2+
IP3
R
IP3 – inositol-3-phosphat
PIP2 – phosphotydilinositol-4,5-biphosphat
•У мышей с дефицитом TRPV1 наблюдается уменьшение температурной
гипералгезии при воспалении.
•Медиаторы воспаления могут повышать чувствительность TRPV1, прямо или
косвенно действуя на эти каналы. Один из механизмов – разрушение PIP2 с
помощью PLC.
35
36.
TRPV2Теплочувствительный канал
C
N
>52 º
• реагирует на температуру >52°С
• не активируется капсаицином и низкой рН
• активируется NGF (у мышей)
• блокируется рутением красным
Локализация
Обнаружен в Аδ-волокнах сенсорных нейронов заднекорешковых
ганглиев (в тех нейронах, где не экспрессируется TRPV1), а также в
нейронах мозга, включая спинной мозг, и в селезенке.
36
37.
TRPV3Теплочувствительный канал
N
C
>31-39 º
•Реагирует при температуре 31-39°С.
•Кроме температуры активируется камфорой.
•Обнаруживает сильную сенситизацию при повторяющихся тепловых
стимулах, увеличивая ответ.
Локализация
•Высокий уровень экспрессии на нейронах заднекорешковых ганглиев и
сенсорных волокнах кожи.
•Экспрессируется также на кератиноцитах, которые, модулируя уровень
Са2+ или активируя сигнальные факторы, такие как АТФ, способны
возбуждать сенсорные терминали.
•Наблюдается соэкспрессия с TRPV1.
37
38.
TRPV4Теплочувствительный канал
C
N
>27 º
•Активируется при 27-34°С. В диапазоне до 42°С обогрев вызывает увеличение
тока.
•Кроме температуры активируется анандомином (метаболит арахидоновой
кислоты)
•Блокируется рутением красным
•В отличие от TRPV3 десенситизируется при повторяющихся тепловых
стимулах.
Локализация
•TRPV4 экспрессируется на нейронах преоптической области гипоталамуса, а
также на сенсорных волокнах и нейронах заднекорешковых ганглиев,
эндотелии и кератиноцитах.
•Возможен вклад в вазодилятацию при обогреве.
38
39.
TRPM8TRPV1
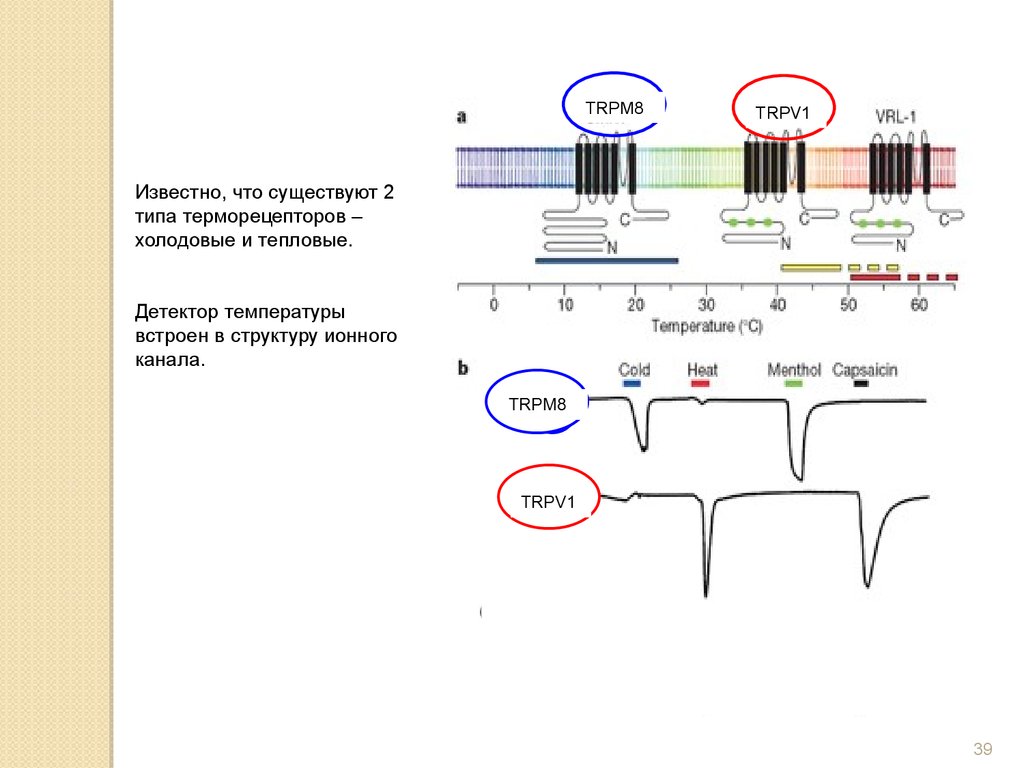
Известно, что существуют 2
типа терморецепторов –
холодовые и тепловые.
Детектор температуры
встроен в структуру ионного
канала.
39
40.
В 2003 году Нобелевская премия по химии была присуждена американскому учёномуРодерику Маккиннону (Roderick McKinnon) за открытие структуры ионного канала.
В 1998 году ему удалось кристаллографическими методами получить трёхмерную
молекулярную структуру калиевого канала бактерии Streptomyces lividans.
Этот белок состоит из 4 субъединиц, имеющих α-спиральное строение. Через
полость в центре и переносится катион калия.
40
41.
42.
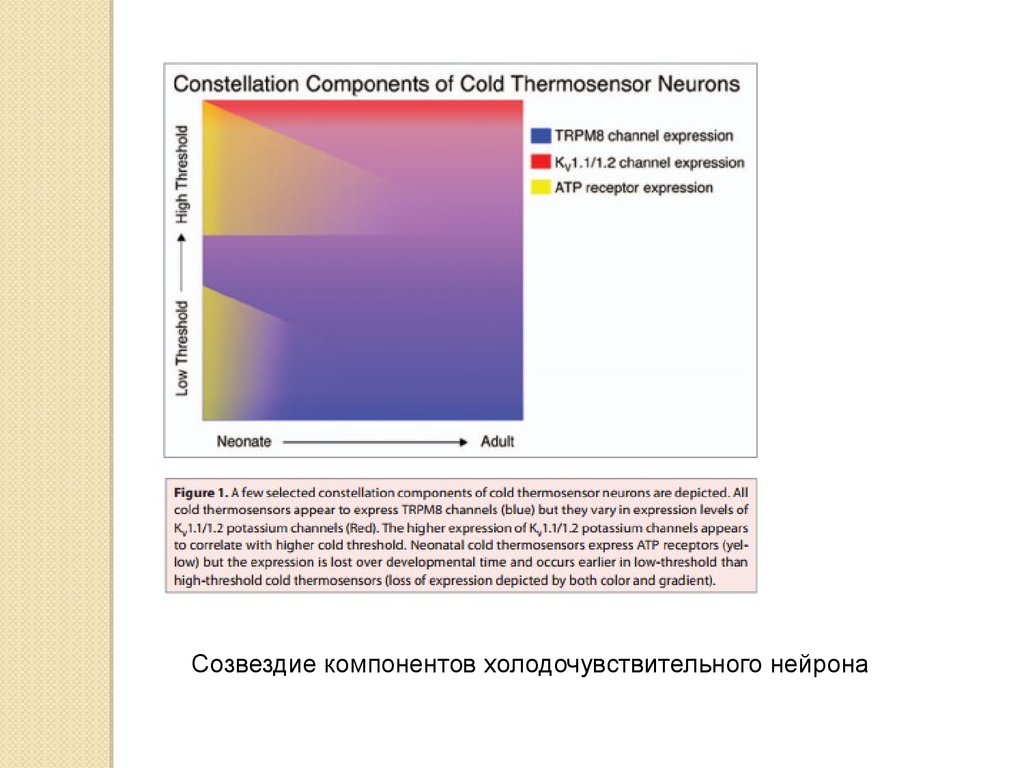
Созвездие компонентов холодочувствительного нейрона43.
С открытием TRP каналов стало возможным понимание молекулярнойосновы термочувствительности и ее кодирования.
Понимание, физиологического значения этих каналов в температурных
ощущениях и их регуляторное значение в поддержании температурного
гомеостаза организма приобретает важное значение .
43
44.
Влияет ли агонист ионного канала TRPM8 ментолна активность и количество функционирующих
холодовых афферентов?
44
45.
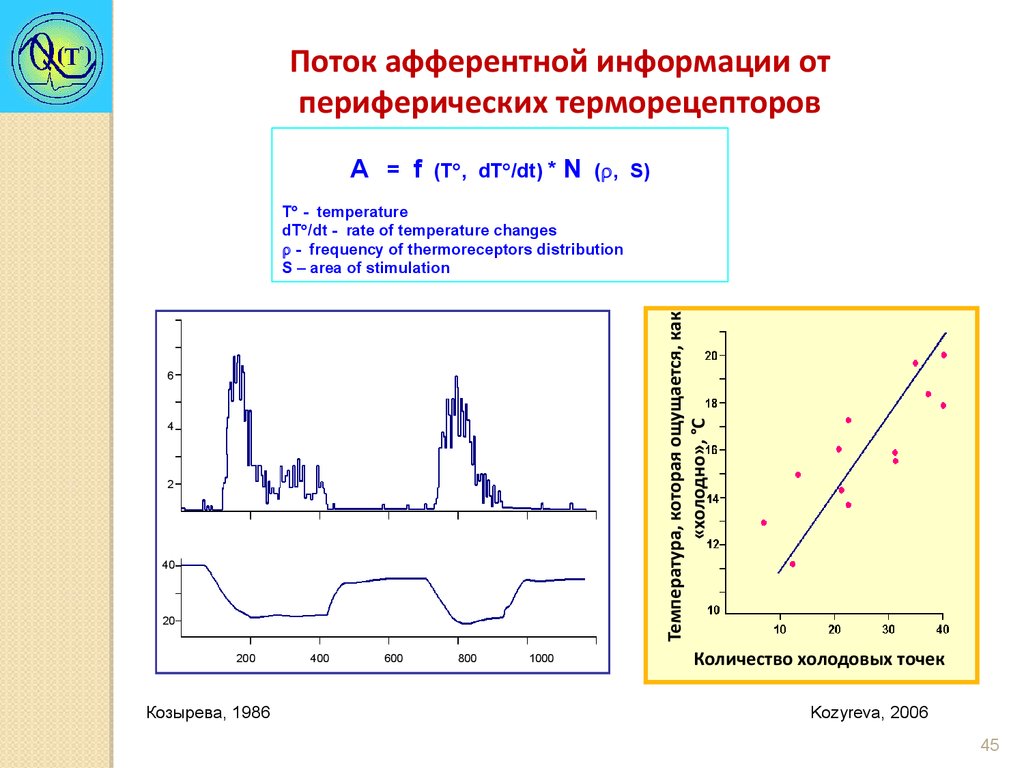
Поток афферентной информации отпериферических терморецепторов
А = f
(T , dT /dt) *
N
( , S)
Температура, которая ощущается, как
«холодно», °C
Т - temperature
dT /dt - rate of temperature changes
- frequency of thermoreceptors distribution
S – area of stimulation
6
4
2
40
20
200
Козырева, 1986
400
600
800
1000
Количество холодовых точек
Kozyreva, 2006
Козырева Т.В. 2006
45
46.
Влияние ментола на импульсную активность холодовогорецептора кожи
Static response
Dynamic response
Control
IMP· S-1
Menthol
IMP· S-1
nose
n=8
T = -5ºC
Menthol
Control
Temperature (ºC)
Initial temperature (ºC)
Schafer, Braun, Isenberg, 1986
46
47.
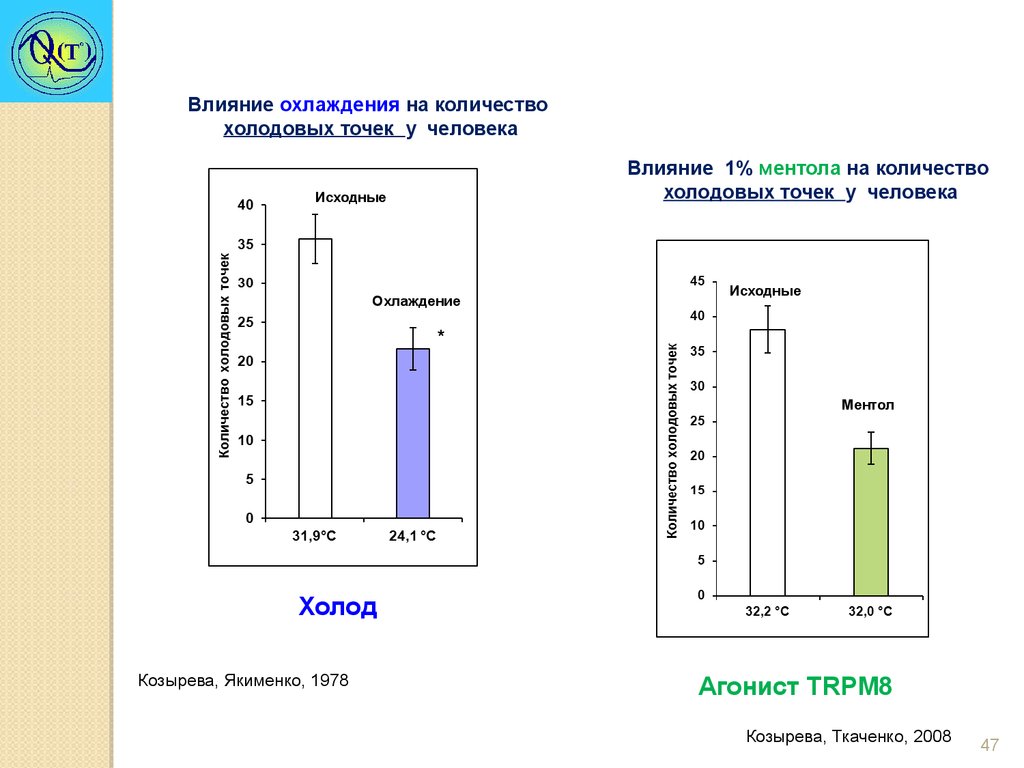
Влияние охлаждения на количествохолодовых точек у человека
Влияние 1% ментола на количество
холодовых точек у человека
Исходные
Охлаждение
Исходные
*
Ментол
Холод
Козырева, Якименко, 1978
Агонист TRPM8
Козырева, Ткаченко, 2008
47
48.
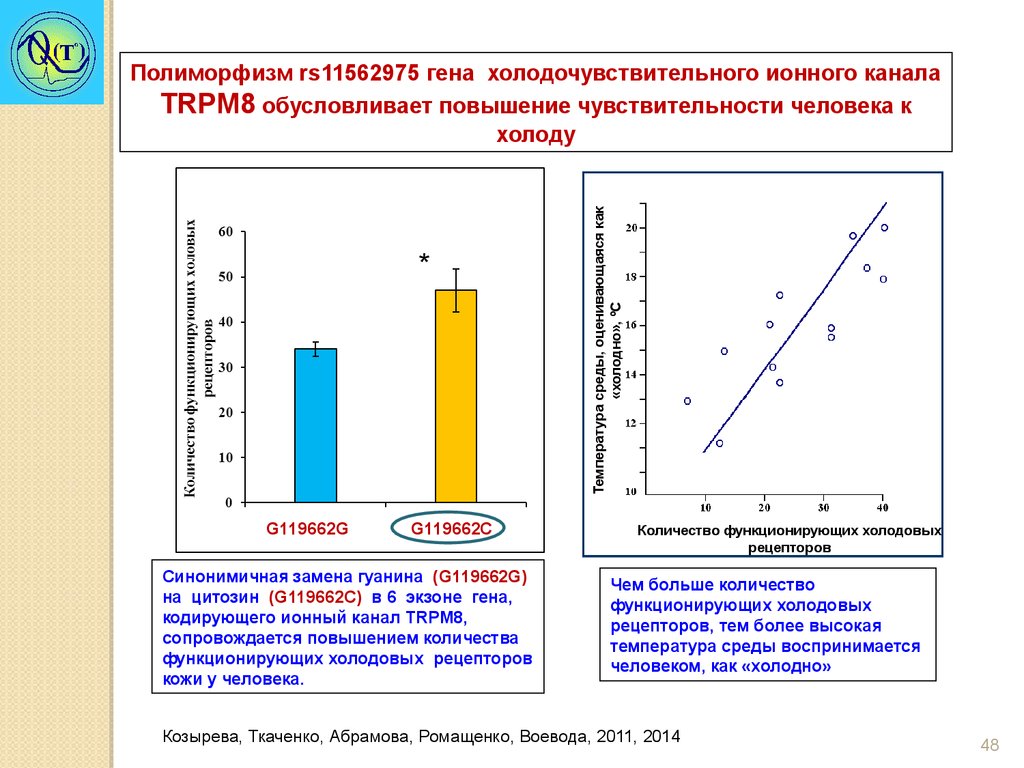
*G119662G
G119662С
Синонимичная замена гуанина (G119662G)
на цитозин (G119662С) в 6 экзоне гена,
кодирующего ионный канал TRPM8,
сопровождается повышением количества
функционирующих холодовых рецепторов
кожи у человека.
Температура среды, оценивающаяся как
«холодно», ºС
Полиморфизм rs11562975 гена холодочувствительного ионного канала
TRPM8 обусловливает повышение чувствительности человека к
холоду
Количество функционирующих холодовых
рецепторов
Чем больше количество
функционирующих холодовых
рецепторов, тем более высокая
температура среды воспринимается
человеком, как «холодно»
Козырева, Ткаченко, Абрамова, Ромащенко, Воевода, 2011, 2014
48
49.
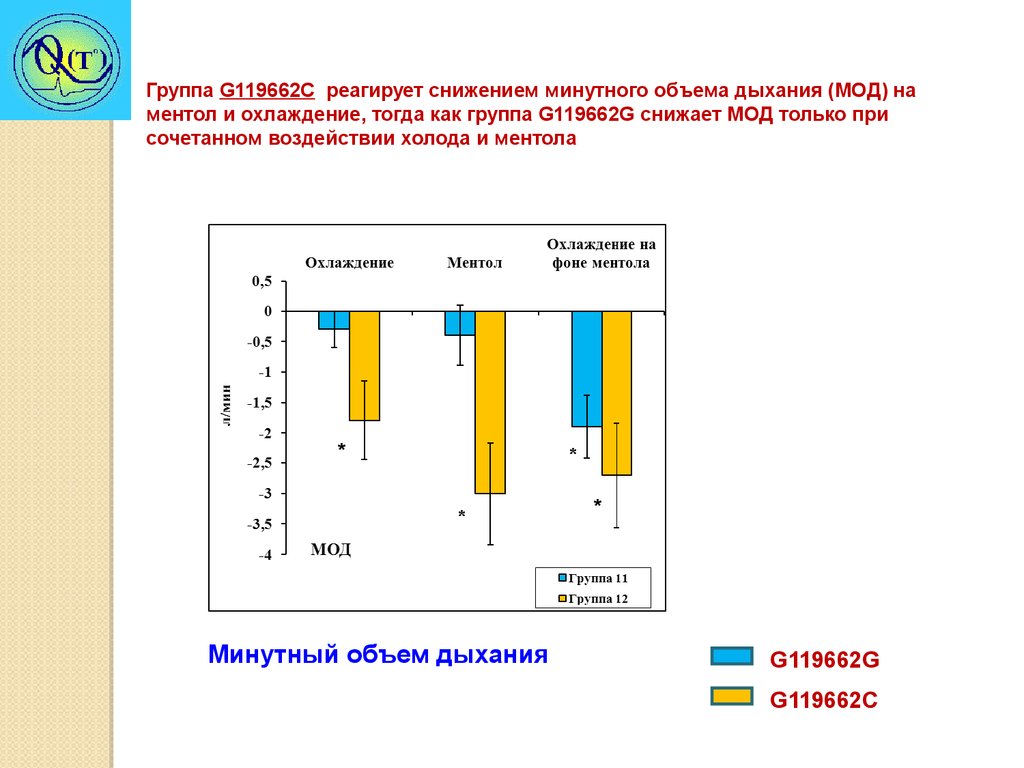
Группа G119662C реагирует снижением минутного объема дыхания (МОД) наментол и охлаждение, тогда как группа G119662G снижает МОД только при
сочетанном воздействии холода и ментола
*
*
*
Минутный объем дыхания
*
G119662G
G119662C
50.
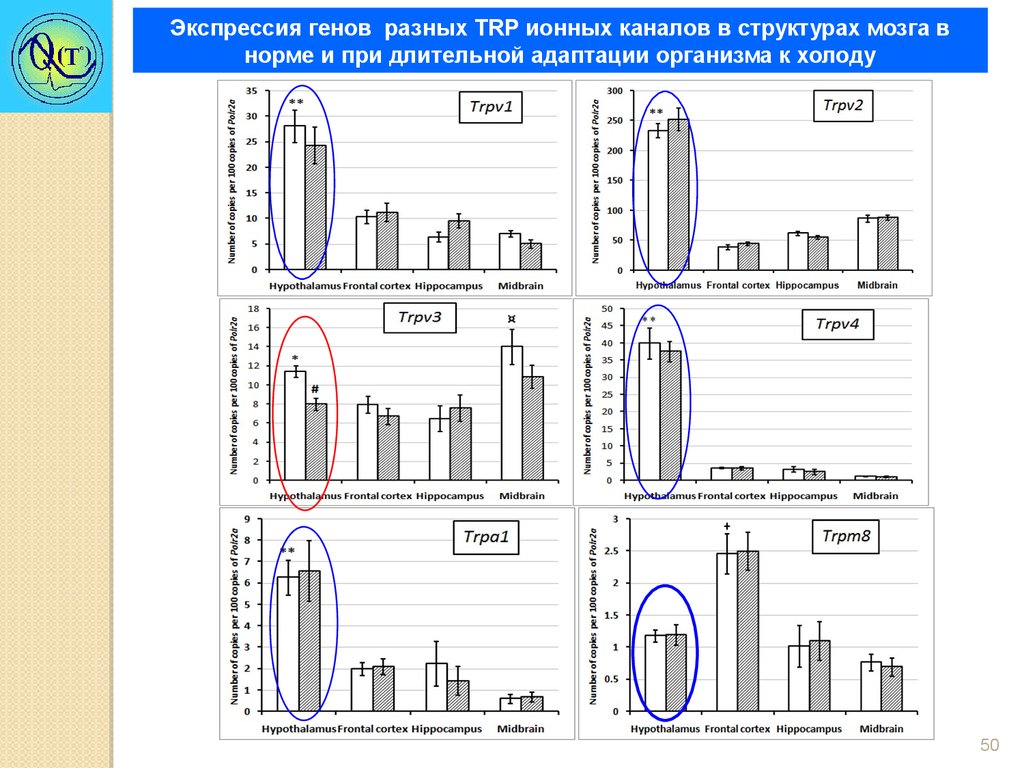
Экспрессия генов разных TRP ионных каналов в структурах мозга внорме и при длительной адаптации организма к холоду
50
51.
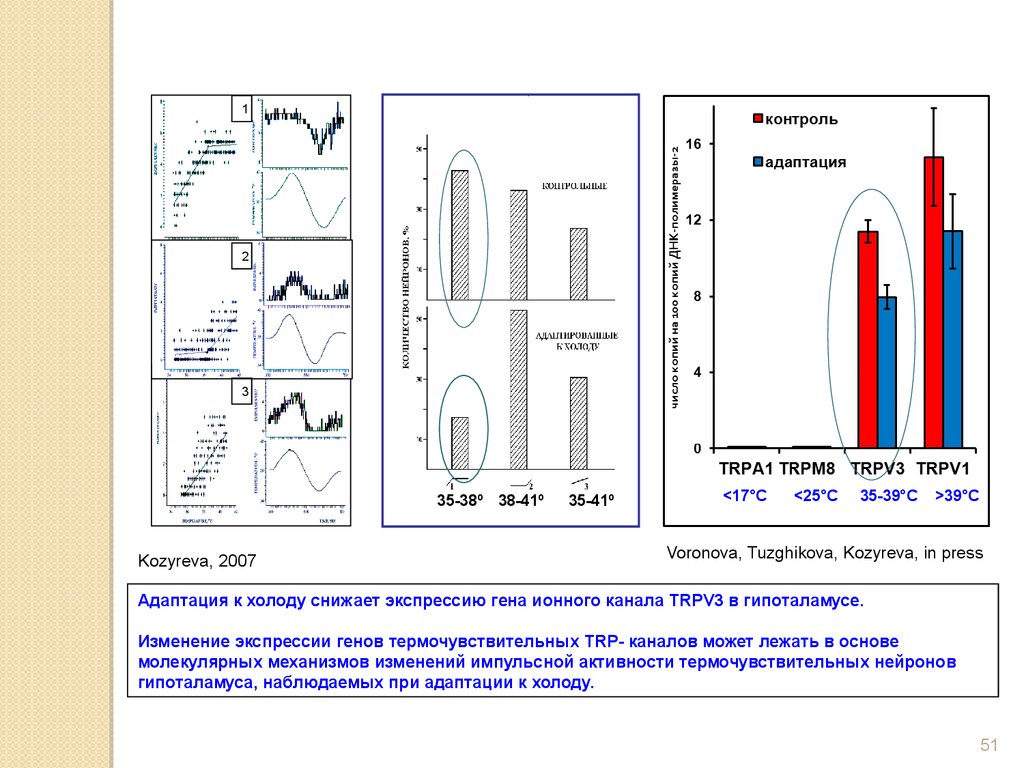
12
3
35-38º 38-41º
Kozyreva, 2007
35-41º
<17°C
<25°C
35-39°C
>39°C
Voronova, Tuzghikova, Kozyreva, in press
Адаптация к холоду снижает экспрессию гена ионного канала TRPV3 в гипоталамусе.
Изменение экспрессии генов термочувствительных TRP- каналов может лежать в основе
молекулярных механизмов изменений импульсной активности термочувствительных нейронов
гипоталамуса, наблюдаемых при адаптации к холоду.
51
52.
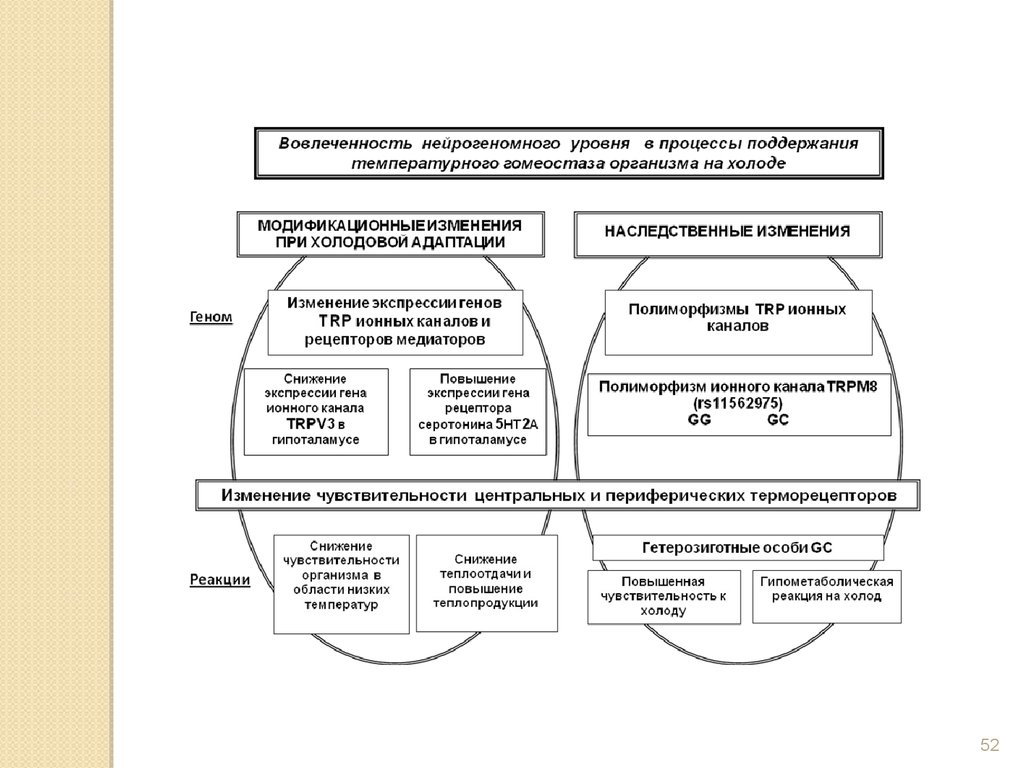
5253.
Каково влияние активации холодочувствительного ионногоканала TRPM8 в коже на терморегуляторные и иммунные
показатели?
Ментол
TRPM8
54.
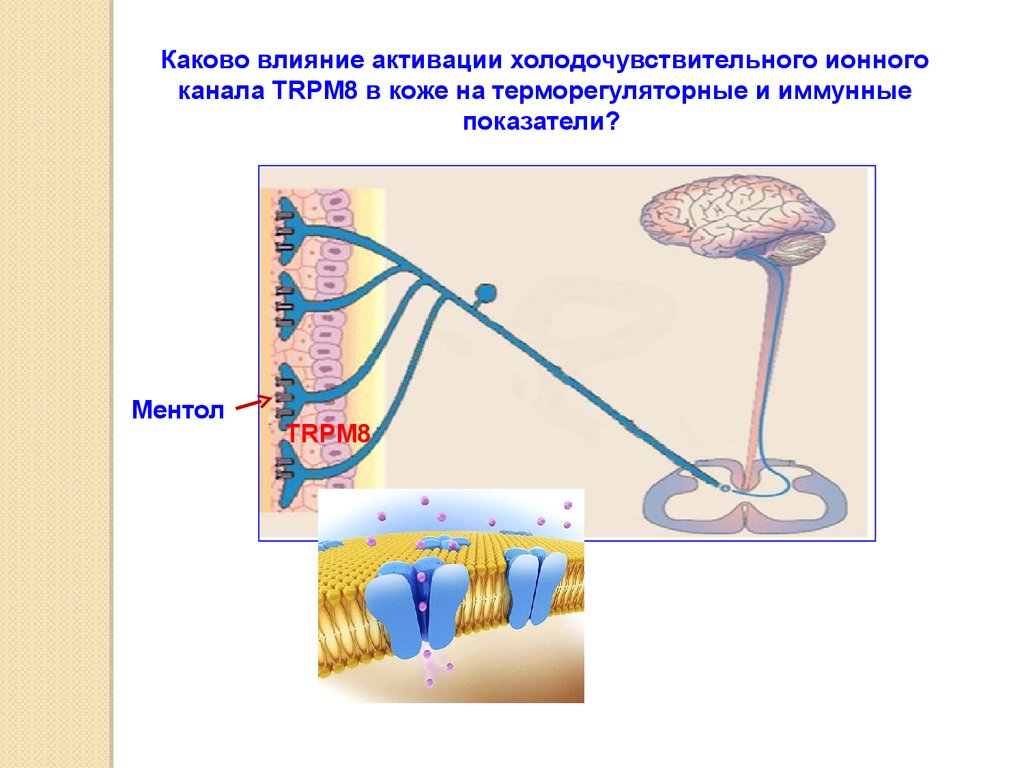
В термонейтральных условиях активация ионного канала TRPM8 приводит кповышению потребления кислорода и снижению дыхательного коэффициента,
последнее свидетельствует об усилении жирового обмена
*
Дыхательный коэффициент – СО2 выдыхаемого воздуха / потребленный О2
55.
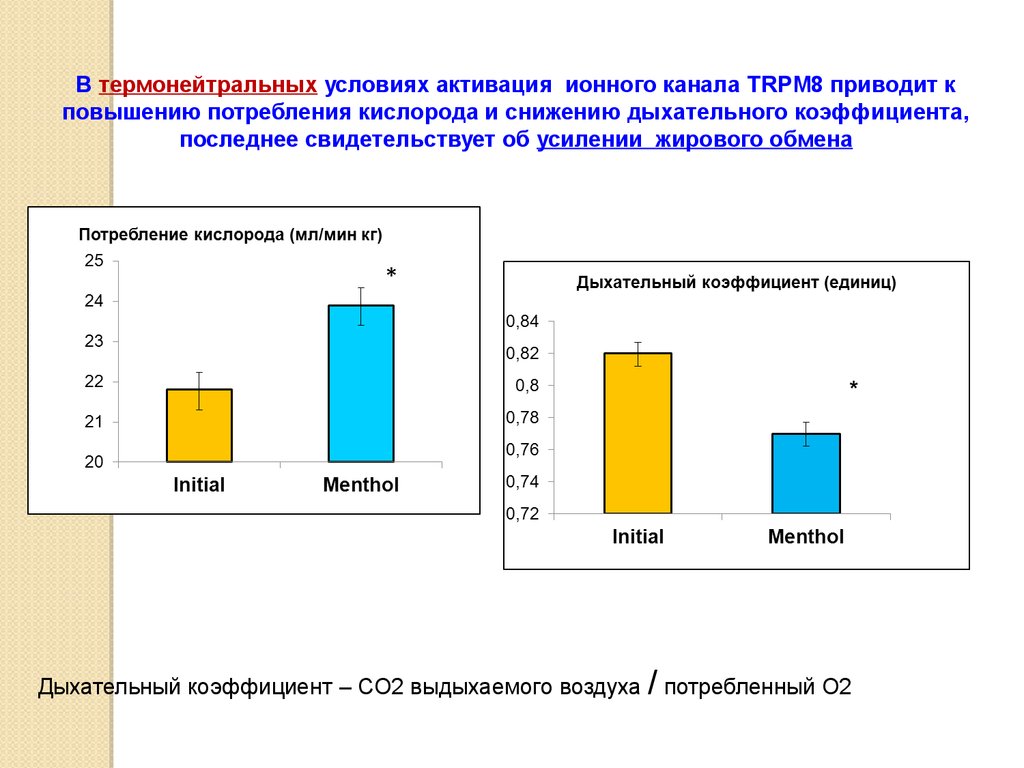
АнтигенсвязываниеАнтителообразование
Иммуноглобулины крови
Активация ионного канала TRPM8 ментолом изменяет параметры
иммунного ответа в термонейтральных условиях.
56.
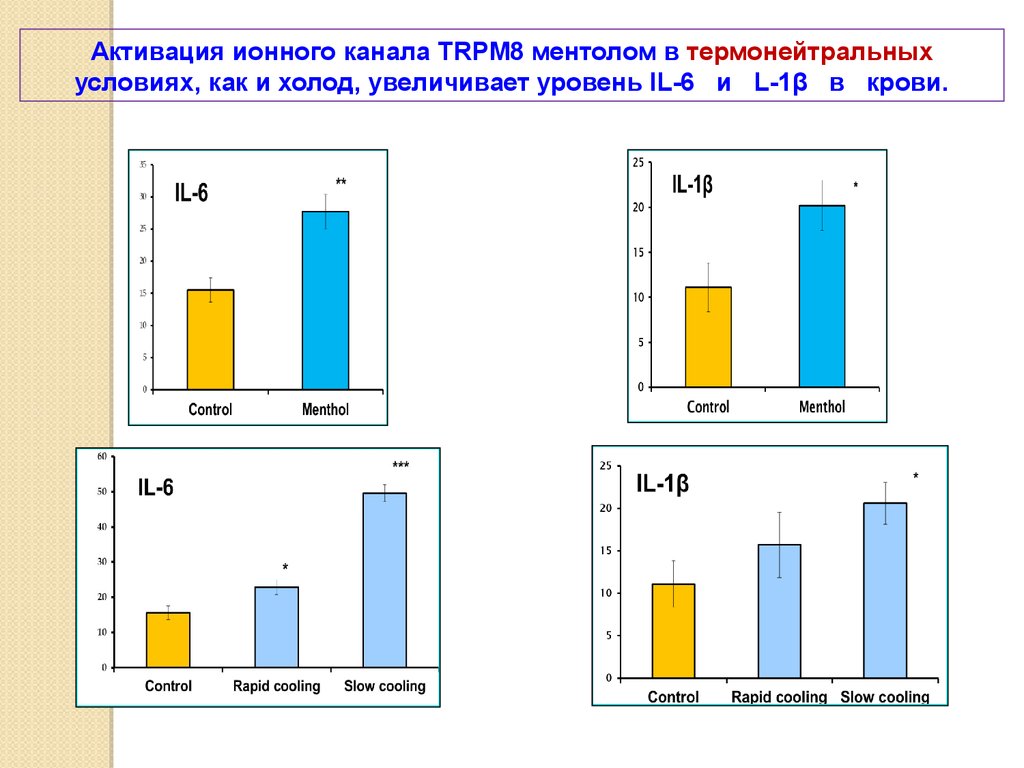
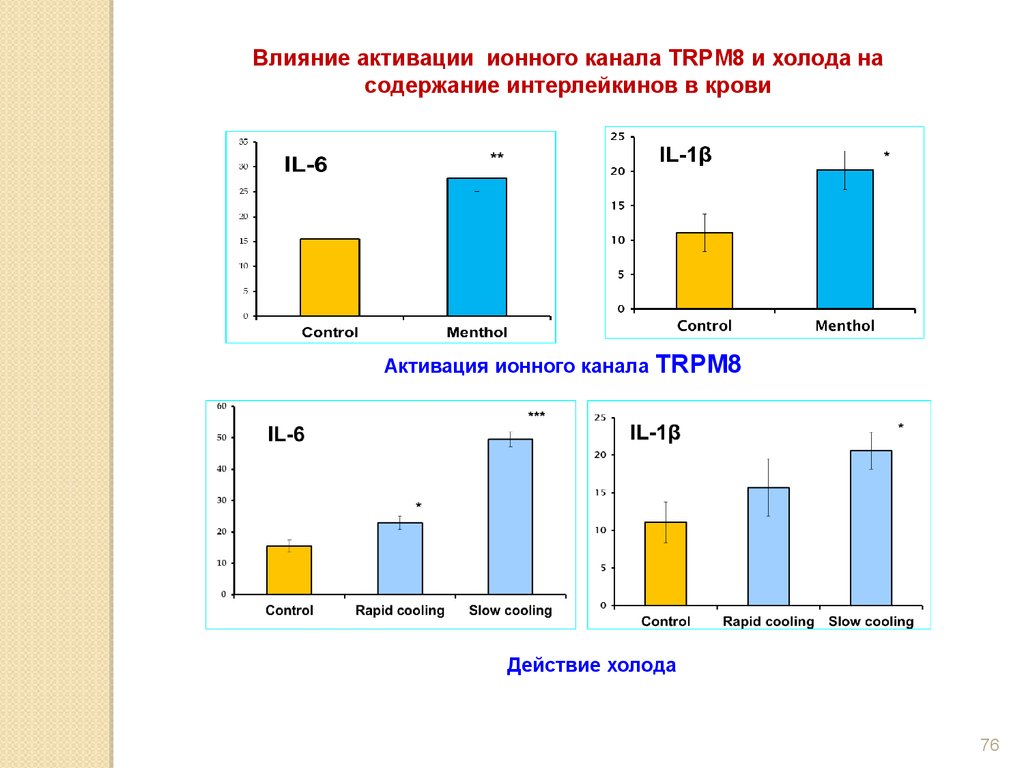
Активация ионного канала TRPM8 ментолом в термонейтральныхусловиях, как и холод, увеличивает уровень IL-6 и L-1β в крови.
57.
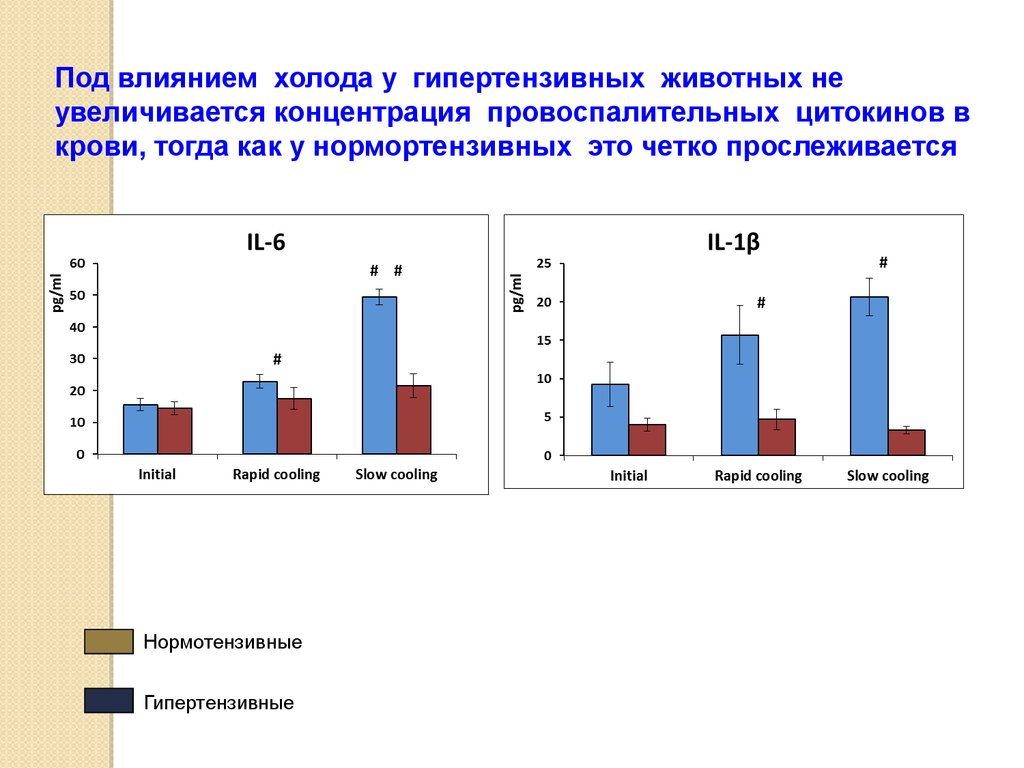
Под влиянием холода у гипертензивных животных неувеличивается концентрация провоспалительных цитокинов в
крови, тогда как у нормортензивных это четко прослеживается
Нормотензивные
Гипертензивные
58.
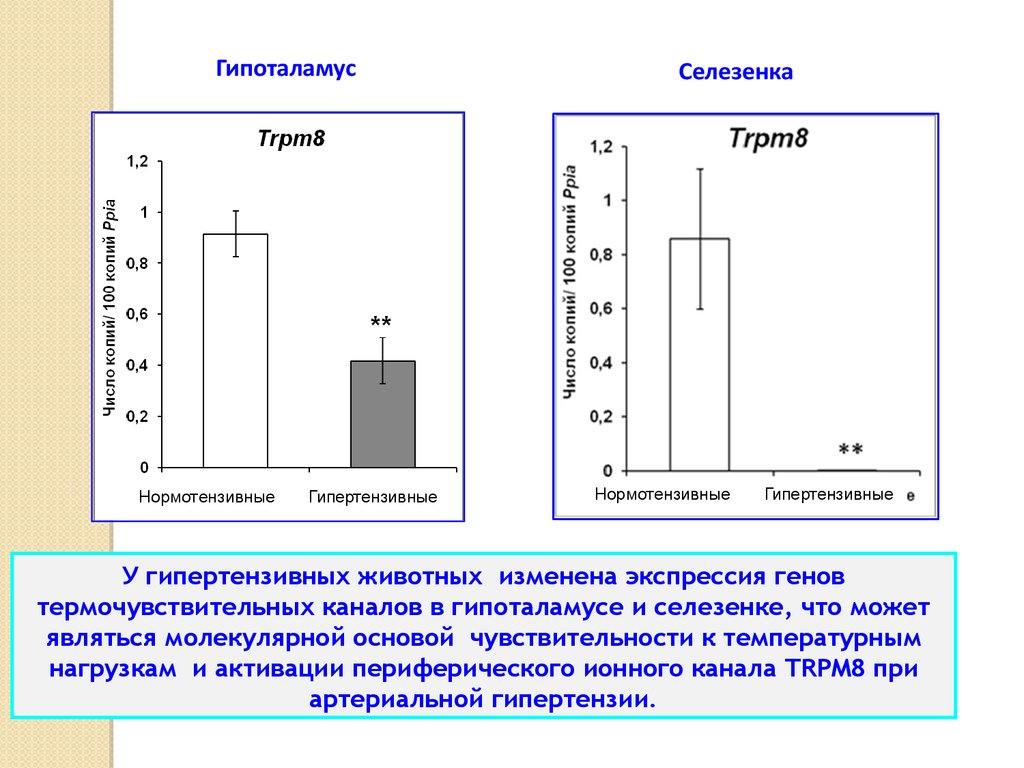
ГипоталамусНормотензивные
Гипертензивные
Селезенка
Нормотензивные
Гипертензивные
У гипертензивных животных изменена экспрессия генов
термочувствительных каналов в гипоталамусе и селезенке, что может
являться молекулярной основой чувствительности к температурным
нагрузкам и активации периферического ионного канала TRPM8 при
артериальной гипертензии.
59.
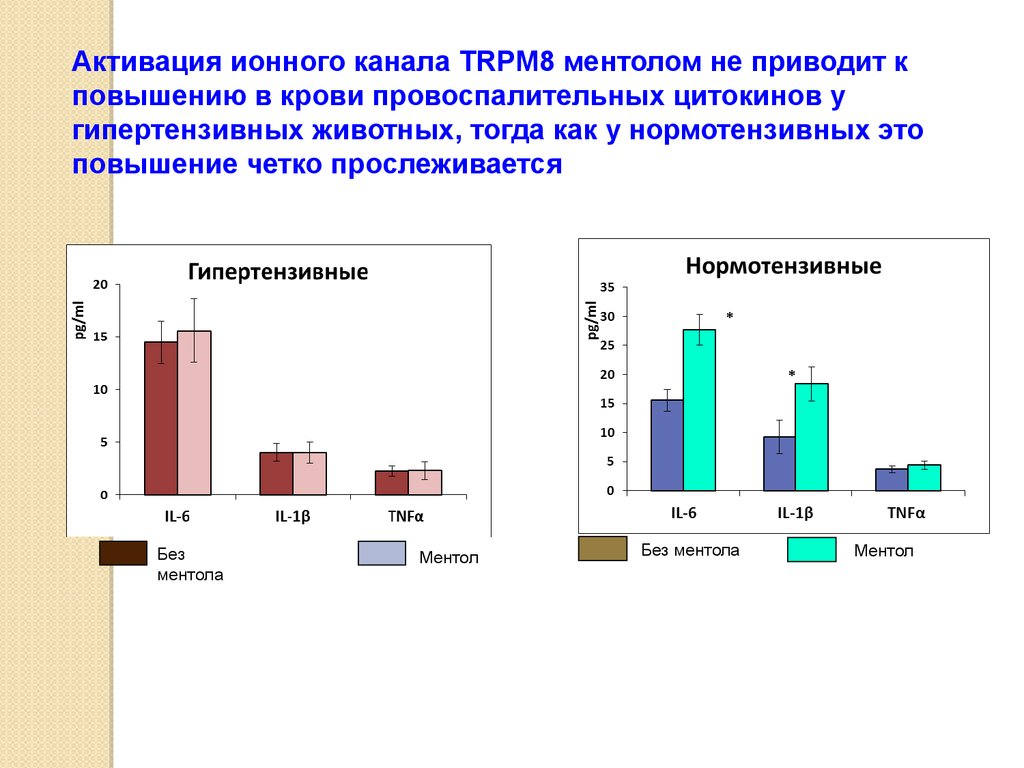
Активация ионного канала TRPM8 ментолом не приводит кповышению в крови провоспалительных цитокинов у
гипертензивных животных, тогда как у нормотензивных это
повышение четко прослеживается
Без
ментола
Ментол
Без ментола
Ментол
60.
Как активация холодо-чувствительного ионногоканала TRPM8 влияет на терморегуляторные и
иммунные показатели при действии холода на
организм?
61.
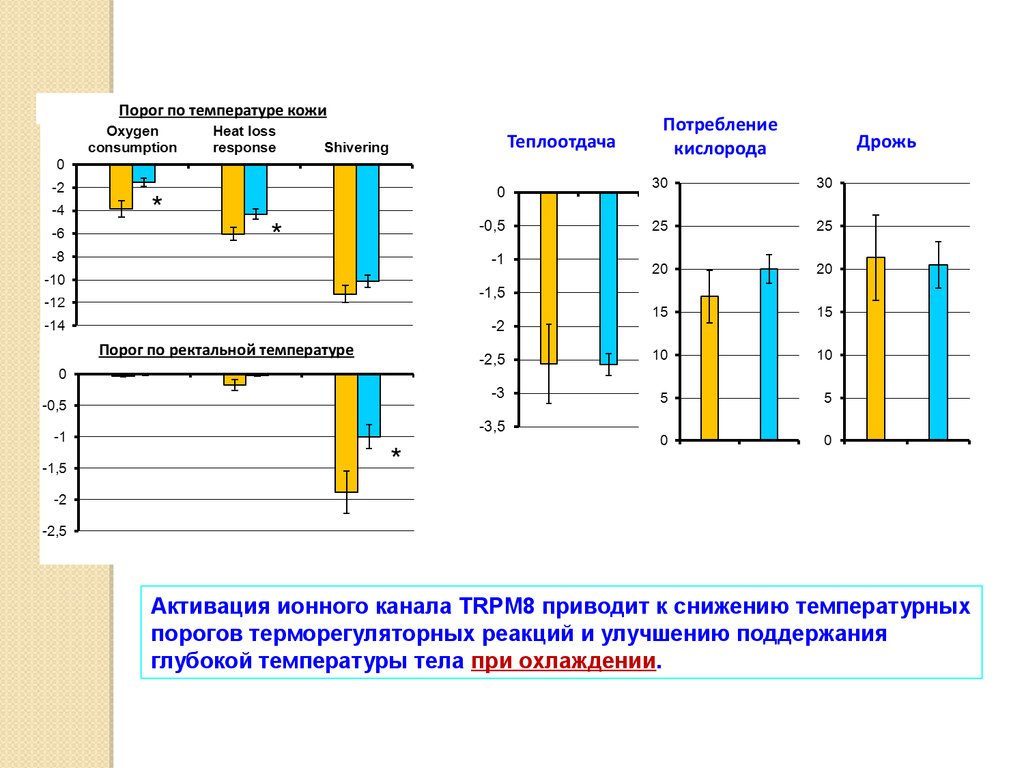
Порог по температуре кожиТеплоотдача
*
Потребление
кислорода
Дрожь
*
Порог по ректальной температуре
*
Активация ионного канала TRPM8 приводит к снижению температурных
порогов терморегуляторных реакций и улучшению поддержания
глубокой температуры тела при охлаждении.
62.
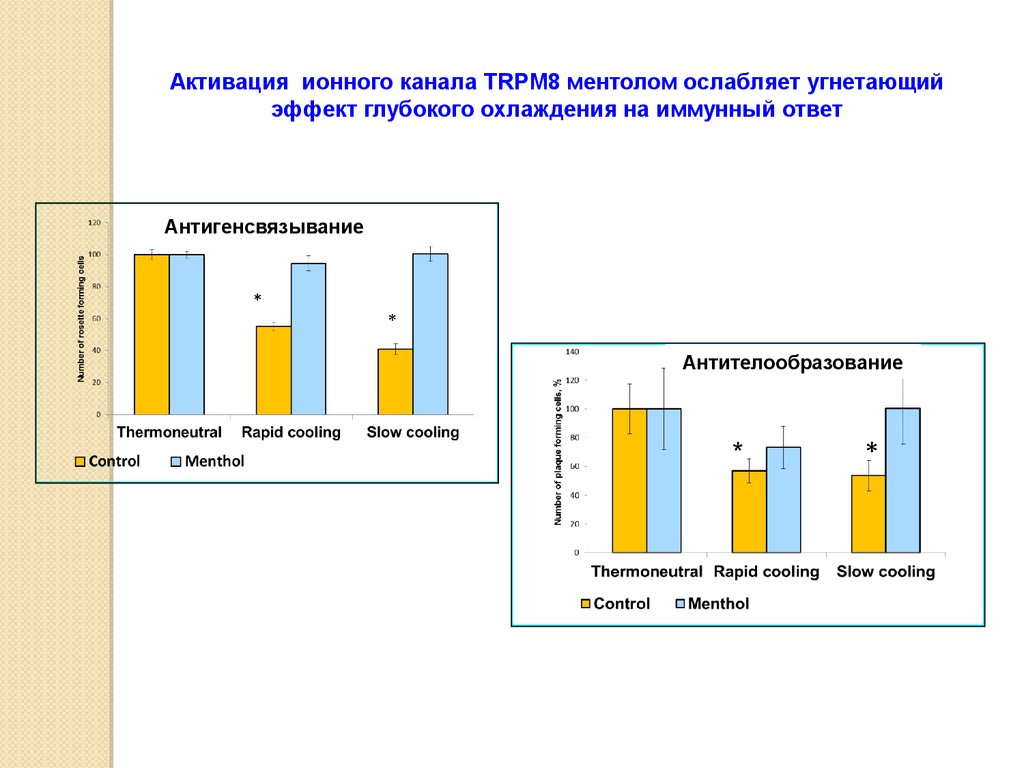
Активация ионного канала TRPM8 ментолом ослабляет угнетающийэффект глубокого охлаждения на иммунный ответ
Антигенсвязывание
Антителообразование
63.
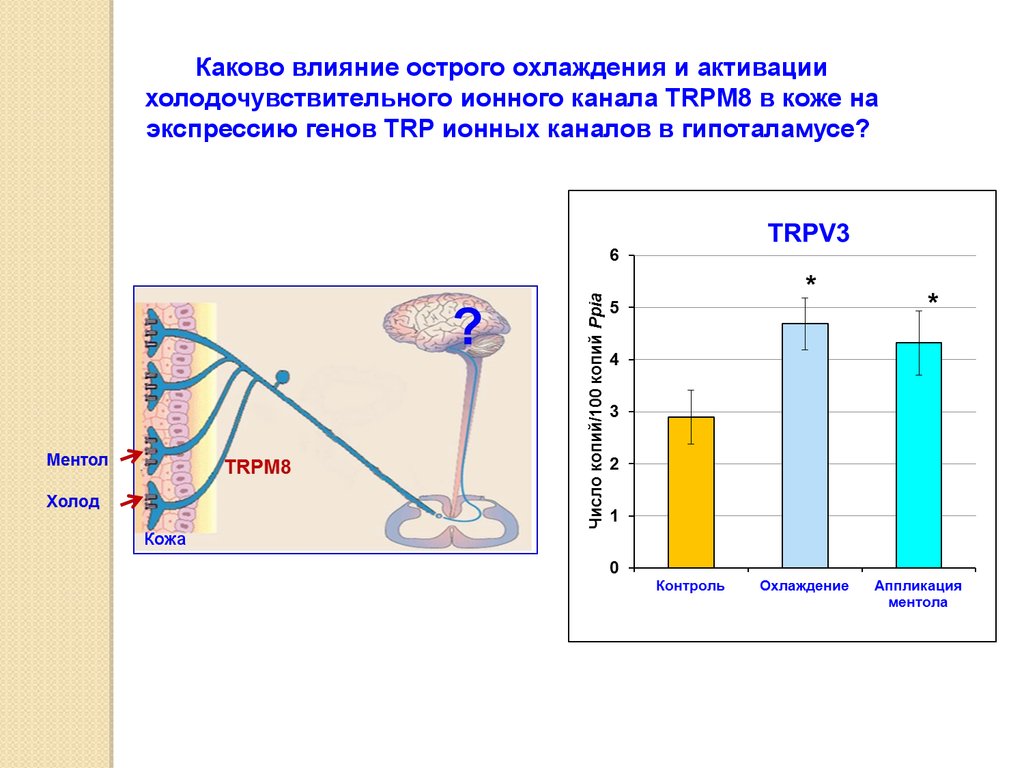
Каково влияние острого охлаждения и активациихолодочувствительного ионного канала TRPM8 в коже на
экспрессию генов TRP ионных каналов в гипоталамусе?
Кожа
64.
Итак, активация холодочувствительного ионногоканалаTRPМ8 оказывает существенное влияние на
регуляцию жирового обмена, терморегуляторных и
иммунных показателей
65.
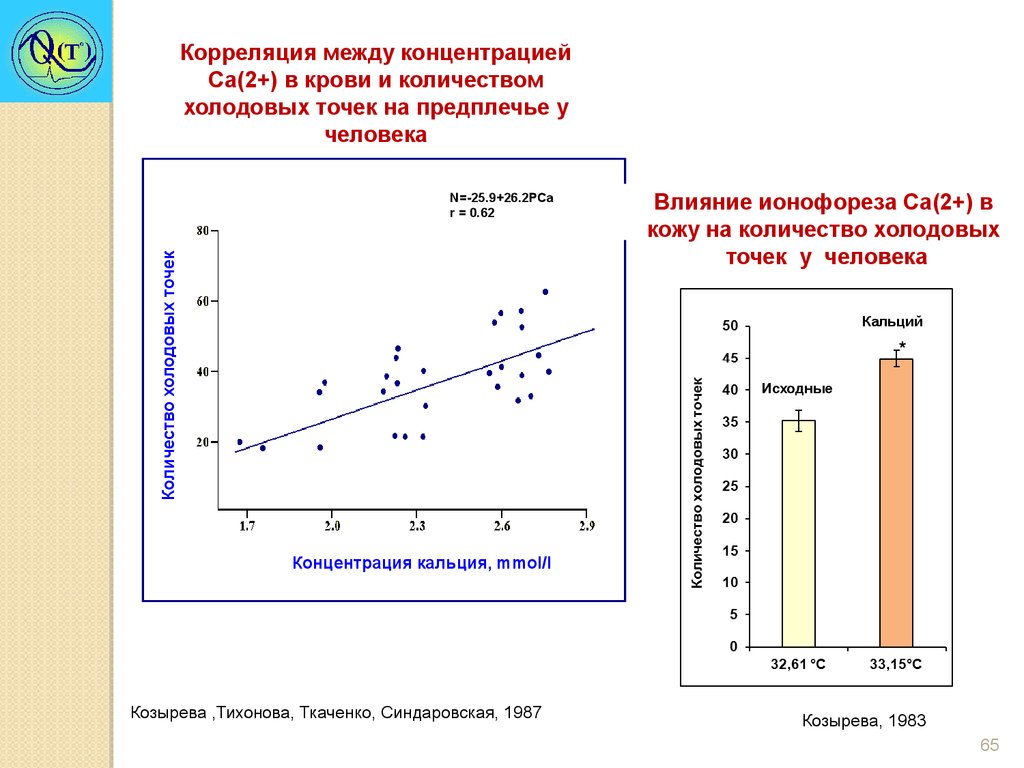
Корреляция между концентрациейCa(2+) в крови и количеством
холодовых точек на предплечье у
человека
Количество холодовых точек
N=-25.9+26.2PCa
r = 0.62
Влияние ионофореза Ca(2+) в
кожу на количество холодовых
точек у человека
Кальций
*
Исходные
Концентрация кальция, mmol/l
Козырева ,Тихонова, Ткаченко, Синдаровская, 1987
Козырева, 1983
65
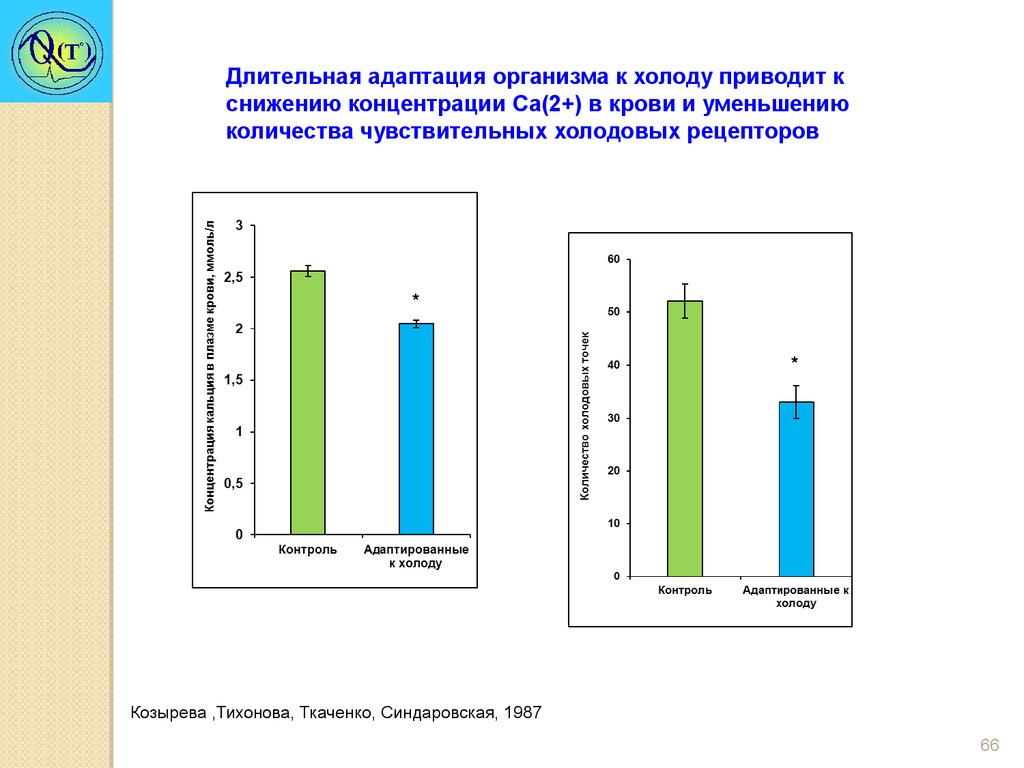
66.
Длительная адаптация организма к холоду приводит кснижению концентрации Са(2+) в крови и уменьшению
количества чувствительных холодовых рецепторов
*
*
Козырева ,Тихонова, Ткаченко, Синдаровская, 1987
66
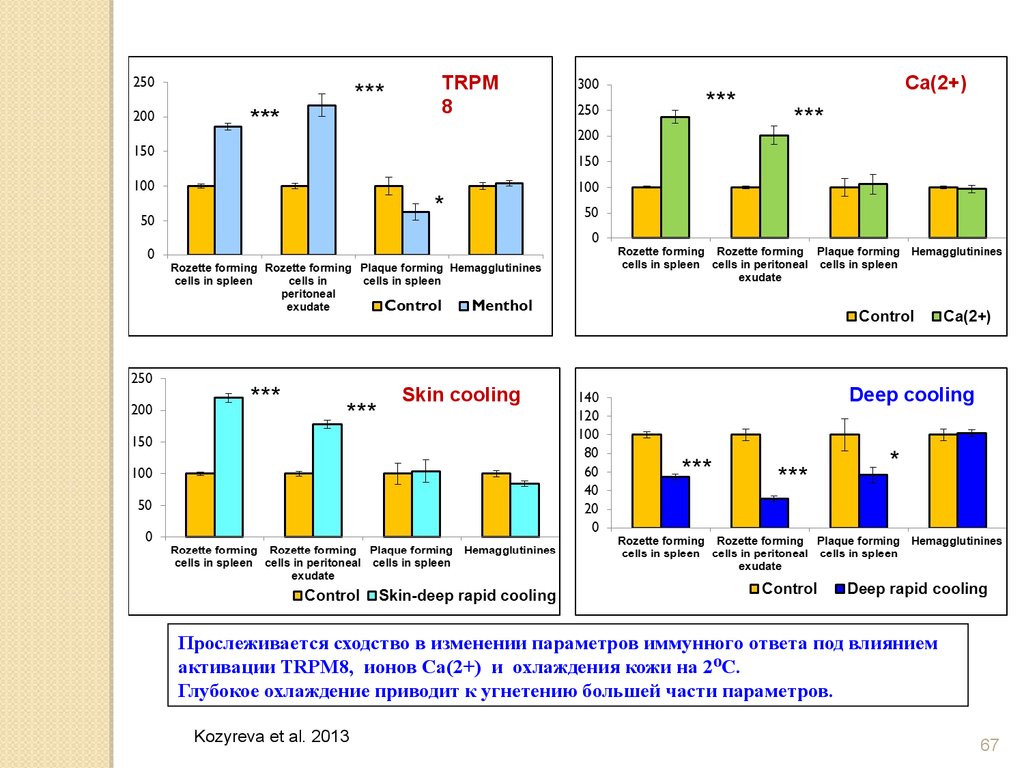
67.
***TRPM
8
Skin cooling
Ca(2+)
Deep cooling
Прослеживается сходство в изменении параметров иммунного ответа под влиянием
активации TRPM8, ионов Са(2+) и охлаждения кожи на 2 ⁰С.
Глубокое охлаждение приводит к угнетению большей части параметров.
Kozyreva et al. 2013
67
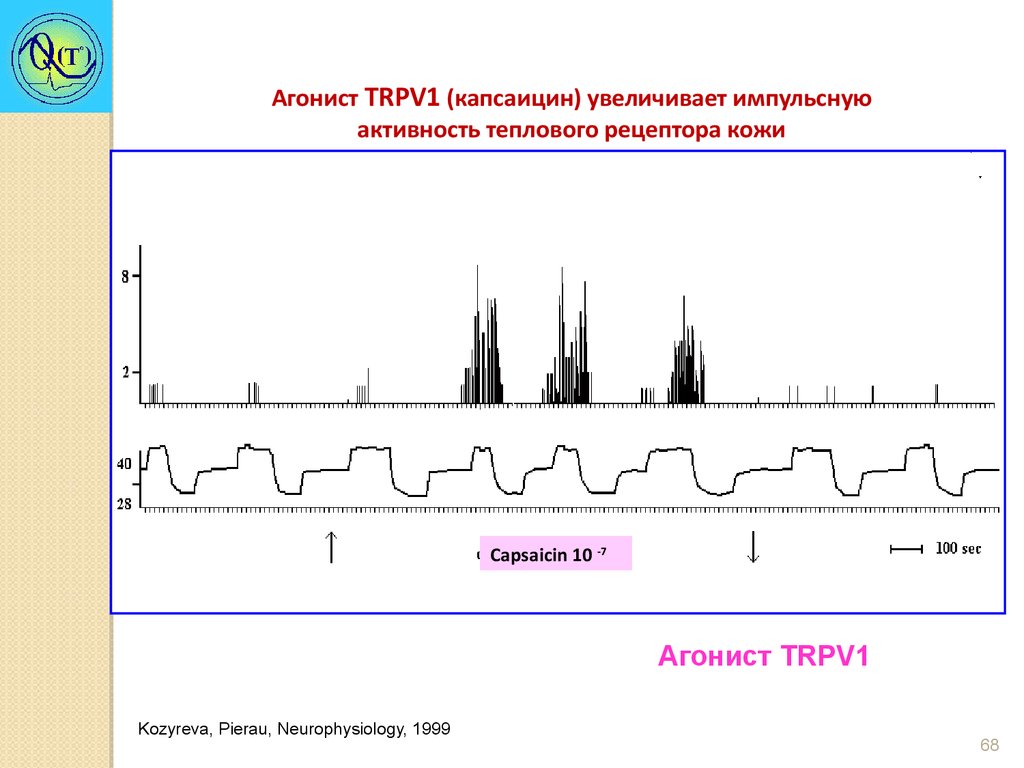
68.
Агонист TRPV1 (капсаицин) увеличивает импульснуюактивность теплового рецептора кожи
Capsaicin 10 -7
Агонист TRPV1
Kozyreva, Pierau, Neurophysiology, 1999
68
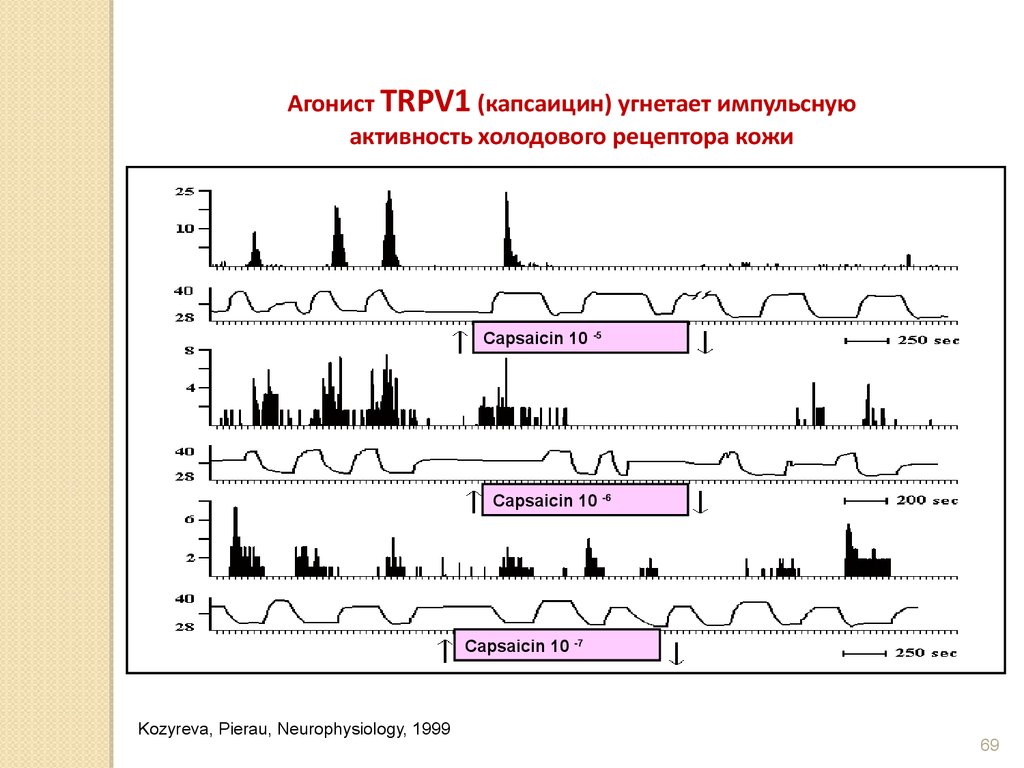
69.
Агонист TRPV1 (капсаицин) угнетает импульснуюактивность холодового рецептора кожи
Capsaicin 10 -5
Capsaicin 10 -6
Capsaicin 10 -7
Kozyreva, Pierau, Neurophysiology, 1999
69
70.
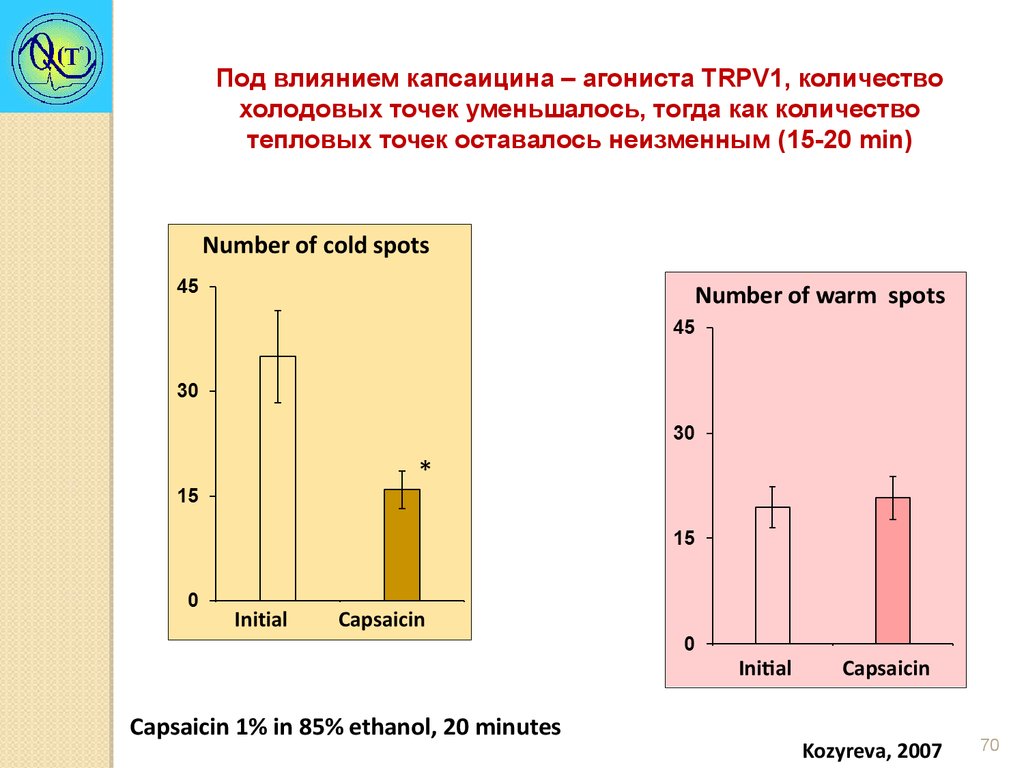
Под влиянием капсаицина – агониста TRPV1, количествохолодовых точек уменьшалось, тогда как количество
тепловых точек оставалось неизменным (15-20 min)
Number of warm spots
Initial
Capsaicin 1% in 85% ethanol, 20 minutes
Capsaicin
Kozyreva, 2007
70
71.
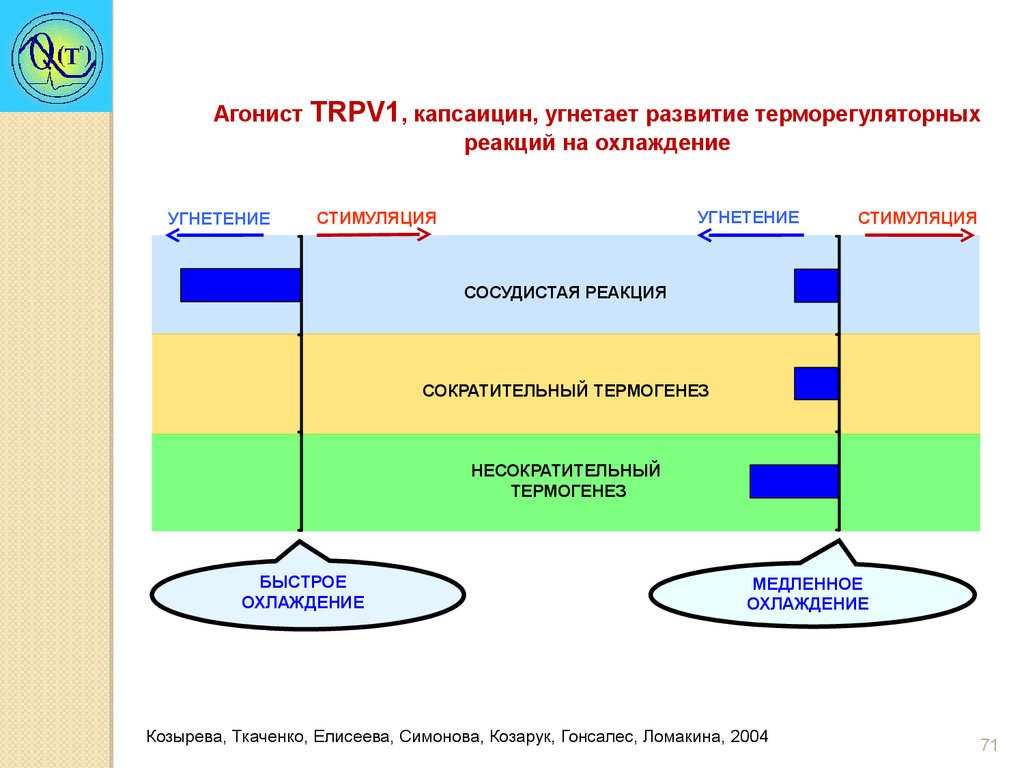
Агонист TRPV1, капсаицин, угнетает развитие терморегуляторныхреакций на охлаждение
УГНЕТЕНИЕ
УГНЕТЕНИЕ
CТИМУЛЯЦИЯ
СТИМУЛЯЦИЯ
СОСУДИСТАЯ РЕАКЦИЯ
СОКРАТИТЕЛЬНЫЙ ТЕРМОГЕНЕЗ
НЕСОКРАТИТЕЛЬНЫЙ
ТЕРМОГЕНЕЗ
БЫСТРОЕ
ОХЛАЖДЕНИЕ
МЕДЛЕННОЕ
ОХЛАЖДЕНИЕ
Козырева, Ткаченко, Елисеева, Симонова, Козарук, Гонсалес, Ломакина, 2004
71
72.
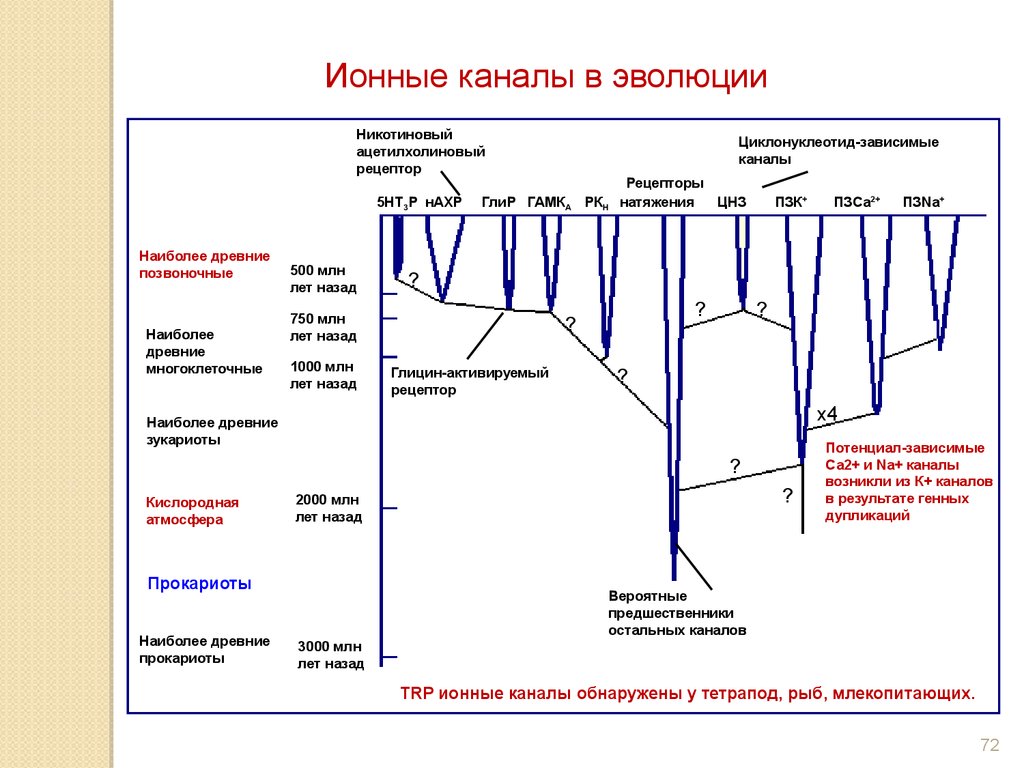
Ионные каналы в эволюцииНикотиновый
ацетилхолиновый
рецептор
5HT3P нАХР
Наиболее древние
позвоночные
Наиболее
древние
многоклеточные
500 млн
лет назад
ГлиР ГАМКА РКН
Рецепторы
натяжения
ЦНЗ
ПЗК+
?
?
Глицин-активируемый
рецептор
?
x4
?
?
2000 млн
лет назад
Прокариоты
Наиболее древние
прокариоты
ПЗNa+
?
Наиболее древние
зукариоты
Кислородная
атмосфера
ПЗСа2+
?
750 млн
лет назад
1000 млн
лет назад
Циклонуклеотид-зависимые
каналы
Потенциал-зависимые
Са2+ и Na+ каналы
возникли из К+ каналов
в результате генных
дупликаций
Вероятные
предшественники
остальных каналов
3000 млн
лет назад
TRP ионные каналы обнаружены у тетрапод, рыб, млекопитающих.
72
73.
7374.
Temperature (°C)0
Out
In
10
TRPA1
20
TRPM8
C
N
C
N
30
TRPV4
N
C
40
TRPV3
N
C
50
TRPV1
N
C
60
TRPV2
C
N
Ankyrin domain
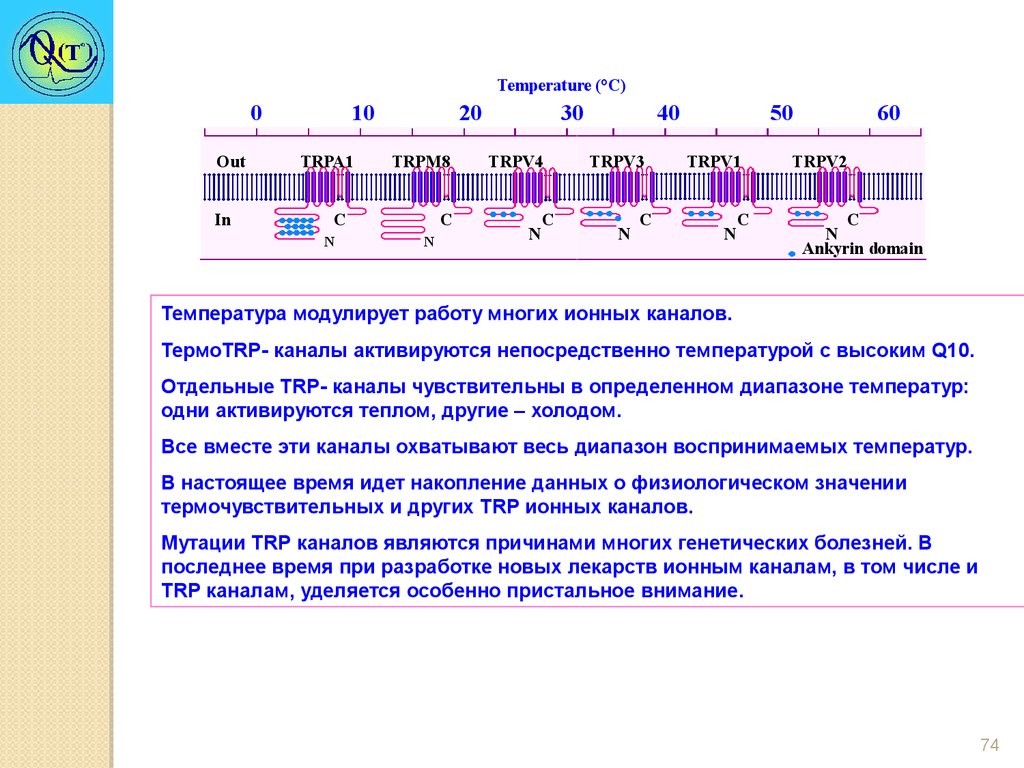
Температура модулирует работу многих ионных каналов.
ТермоTRP- каналы активируются непосредственно температурой с высоким Q10.
Отдельные TRP- каналы чувствительны в определенном диапазоне температур:
одни активируются теплом, другие – холодом.
Все вместе эти каналы охватывают весь диапазон воспринимаемых температур.
В настоящее время идет накопление данных о физиологическом значении
термочувствительных и других TRP ионных каналов.
Мутации TRР каналов являются причинами многих генетических болезней. В
последнее время при разработке новых лекарств ионным каналам, в том числе и
TRР каналам, уделяется особенно пристальное внимание.
74
75.
Dependence of the number of cold spots on the skintemperature
Number of cold spots
Adapted to exercise
Control
Adapted to hot
Adapted to cold
Skin temperature, °С
Kozyreva, 1984,2007
75
76.
Влияние активации ионного канала TRPM8 и холода насодержание интерлейкинов в крови
Активация ионного канала
TRPM8
Действие холода
76
77.
7778.
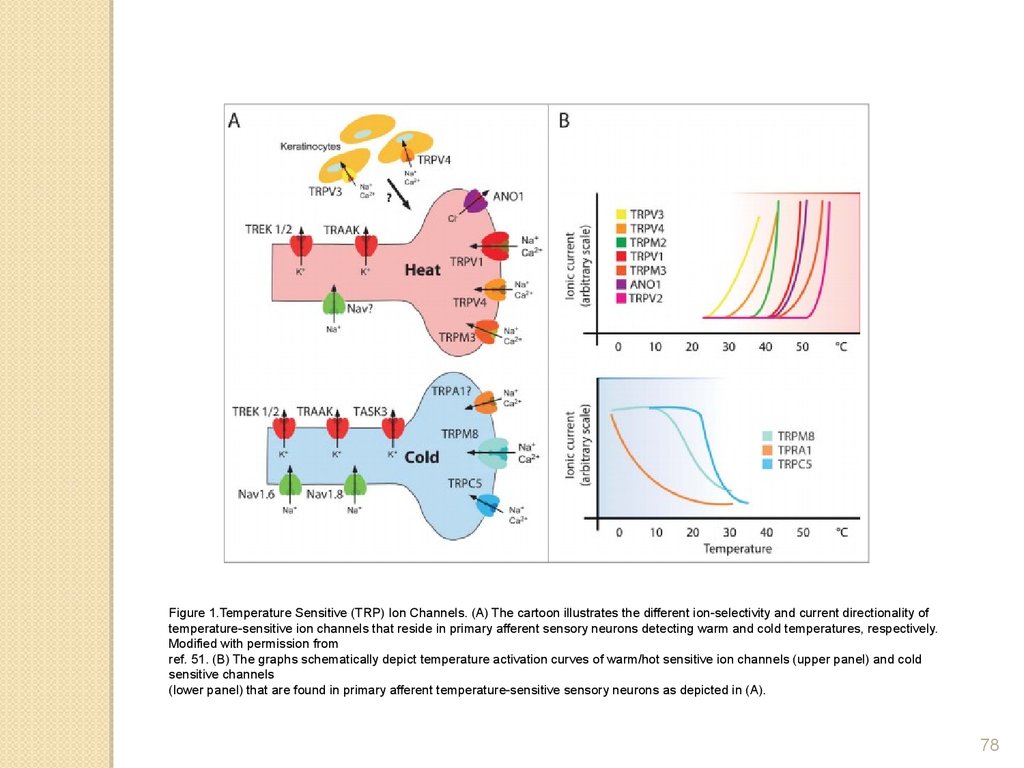
Figure 1.Temperature Sensitive (TRP) Ion Channels. (A) The cartoon illustrates the different ion-selectivity and current directionality oftemperature-sensitive ion channels that reside in primary afferent sensory neurons detecting warm and cold temperatures, respectively.
Modified with permission from
ref. 51. (B) The graphs schematically depict temperature activation curves of warm/hot sensitive ion channels (upper panel) and cold
sensitive channels
(lower panel) that are found in primary afferent temperature-sensitive sensory neurons as depicted in (A).
78
79.
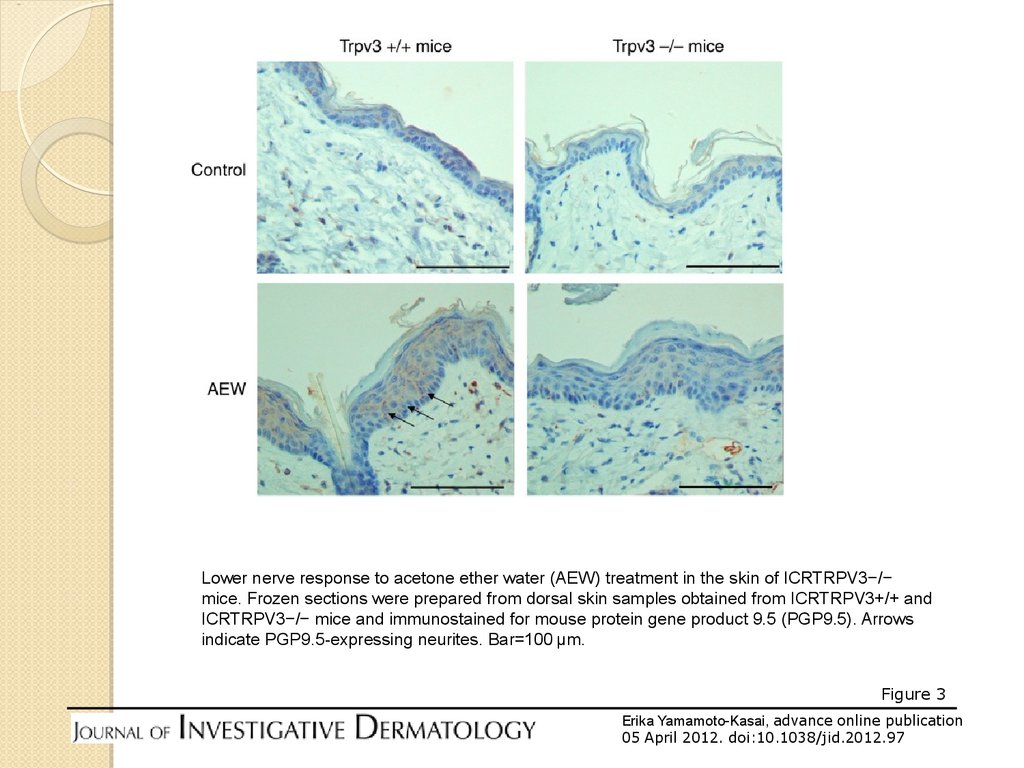
Lower nerve response to acetone ether water (AEW) treatment in the skin of ICRTRPV3−/−mice. Frozen sections were prepared from dorsal skin samples obtained from ICRTRPV3+/+ and
ICRTRPV3−/− mice and immunostained for mouse protein gene product 9.5 (PGP9.5). Arrows
indicate PGP9.5-expressing neurites. Bar=100 μm.
Figure 3
Erika Yamamoto-Kasai, advance online publication
05 April 2012. doi:10.1038/jid.2012.97
80.
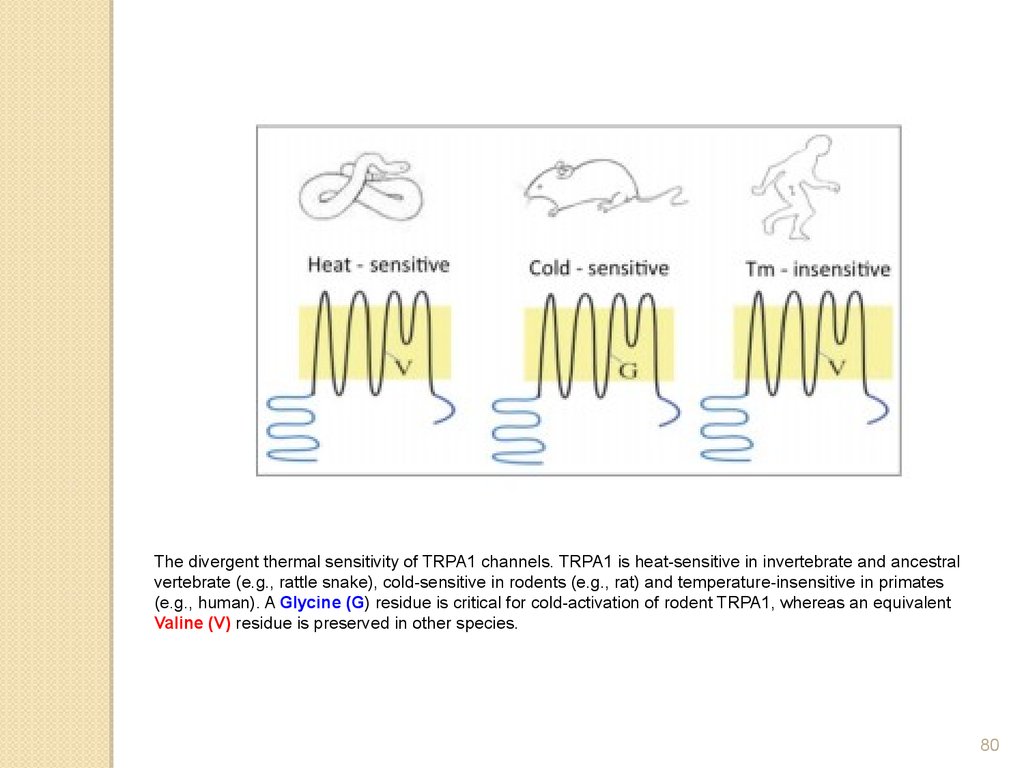
The divergent thermal sensitivity of TRPA1 channels. TRPA1 is heat-sensitive in invertebrate and ancestralvertebrate (e.g., rattle snake), cold-sensitive in rodents (e.g., rat) and temperature-insensitive in primates
(e.g., human). A Glycine (G) residue is critical for cold-activation of rodent TRPA1, whereas an equivalent
Valine (V) residue is preserved in other species.
80
81.
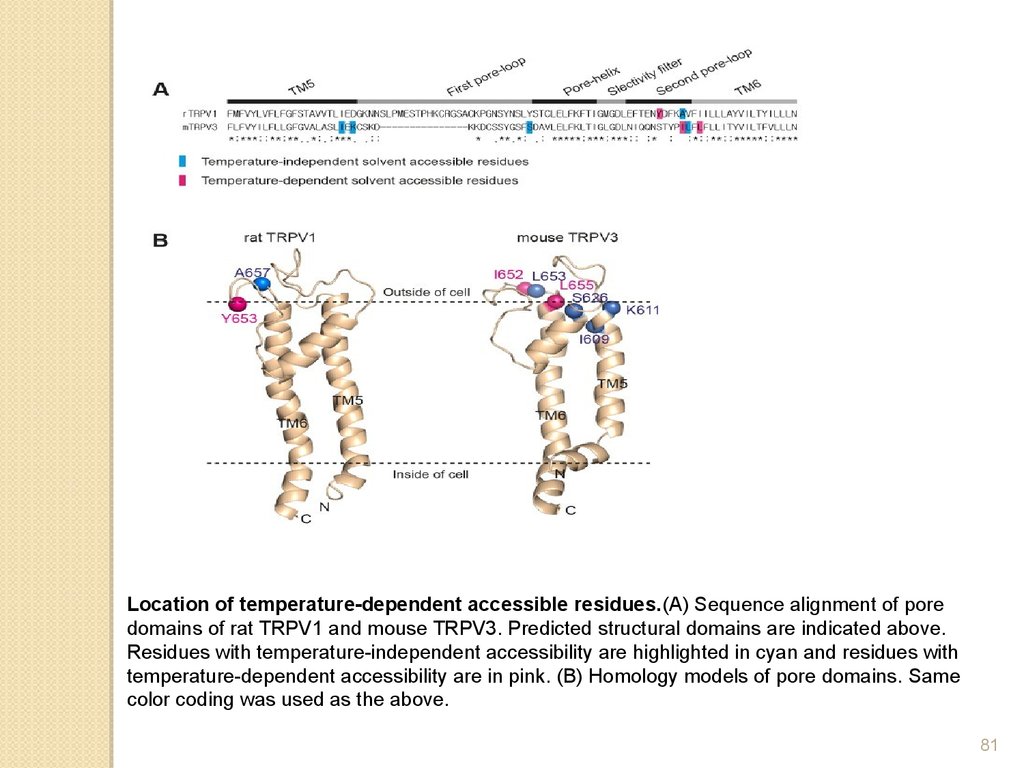
Location of temperature-dependent accessible residues.(A) Sequence alignment of poredomains of rat TRPV1 and mouse TRPV3. Predicted structural domains are indicated above.
Residues with temperature-independent accessibility are highlighted in cyan and residues with
temperature-dependent accessibility are in pink. (B) Homology models of pore domains. Same
color coding was used as the above.
81























 medicine
medicine








