Similar presentations:
Смеси и растворы
1. Смеси. Растворы
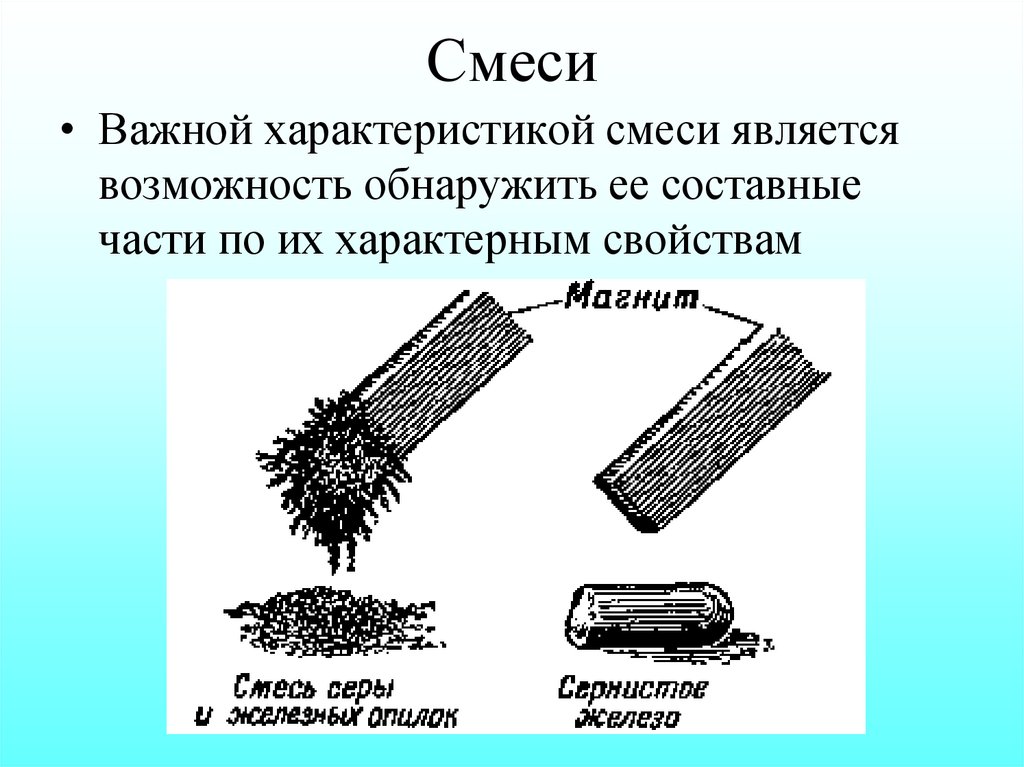
2. Смеси
• Важной характеристикой смеси являетсявозможность обнаружить ее составные
части по их характерным свойствам
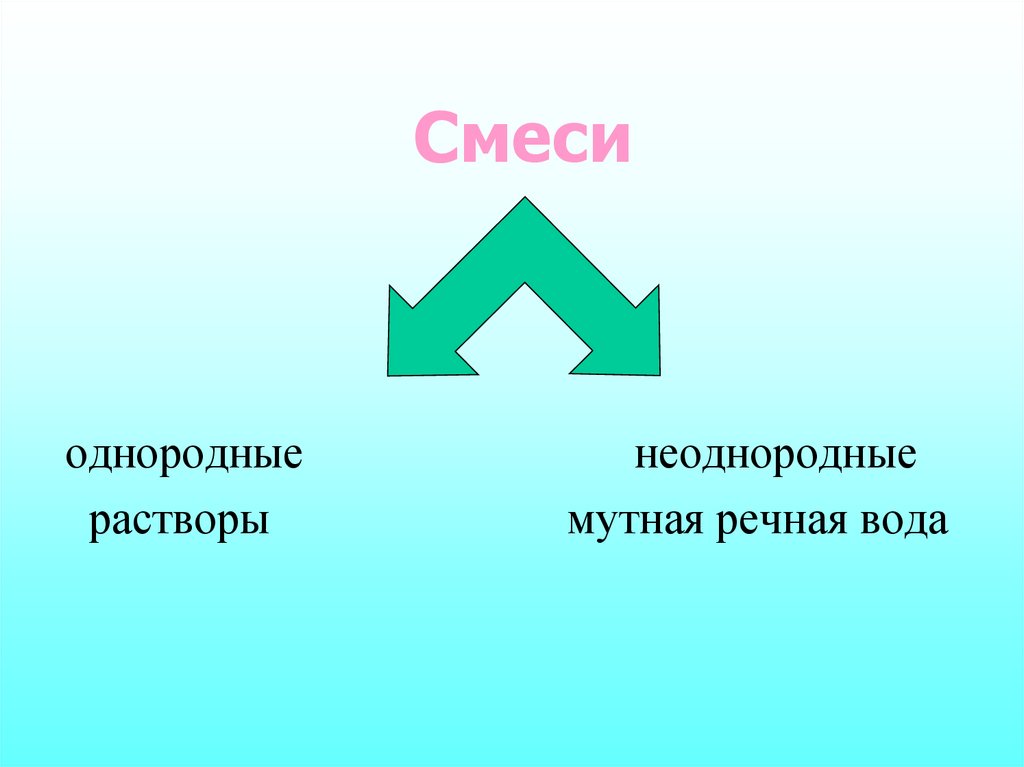
3. Смеси
однородныерастворы
неоднородные
мутная речная вода
4. Газ-газ
5. Газ-жидкость
6. Газ-твердое вещество
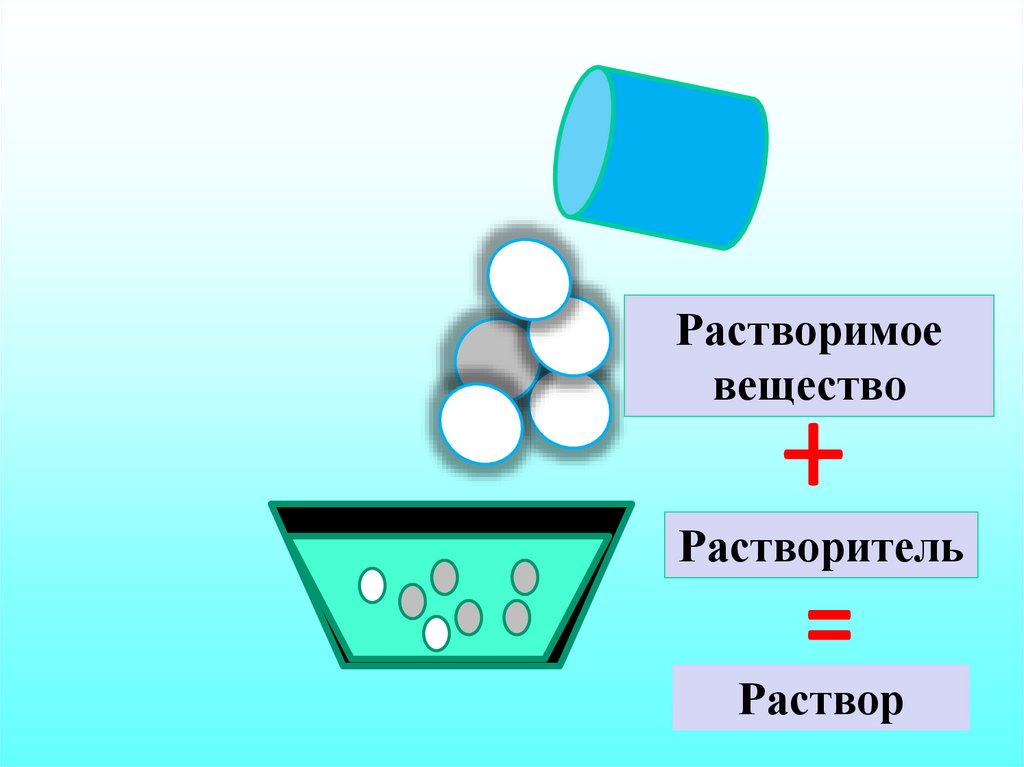
7. Жидкость-газ
8. Жидкость-жидкость
9. Жидкость-твердое вещество
10. Твердое вещество-газ
11. Твердое вещество-жидкость
12. Твердое вещество-твердое вещество
13.
Растворимоевещество
+
Растворитель
=
Раствор
14.
Раствор Однородная (гомогенная) физикохимическая многокомпонентная системапеременного состава, состоящая из:
1) растворителя (его больше, он в том же
агрегатном состоянии, что и весь раствор);
2) растворенного вещества;
3) продуктов взаимодействия между
растворителем и растворенным веществом
15.
Физическая система –потому что разрушается
кристаллическая решетка и
происходит диффузия
Химическая система –
потому что образуются
сольваты – продукты
взаимодействия между
растворителем и
растворенным веществом
16.
CuSO4 + 5H2O = CuSO4∙ 5H2Oбелый
голубой
17.
Многокомпонентнаясистема – потому что
растворенных веществ
может быть несколько
Переменного состава –
потому что не
выполняется закон
постоянства состава
вещества
18. Классификация растворов
КЛАССИФИКАЦИЯРАСТВОРОВ
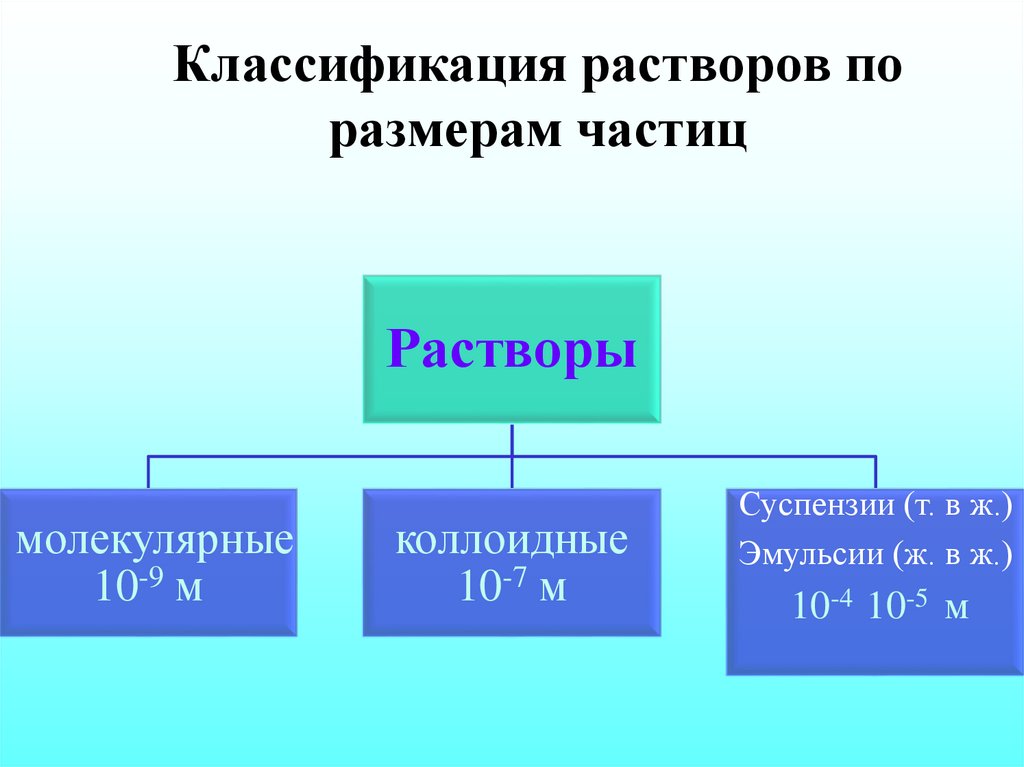
19. Классификация растворов по размерам частиц
Растворымолекулярные
10-9 м
коллоидные
10-7 м
Суспензии (т. в ж.)
Эмульсии (ж. в ж.)
10-4 10-5 м
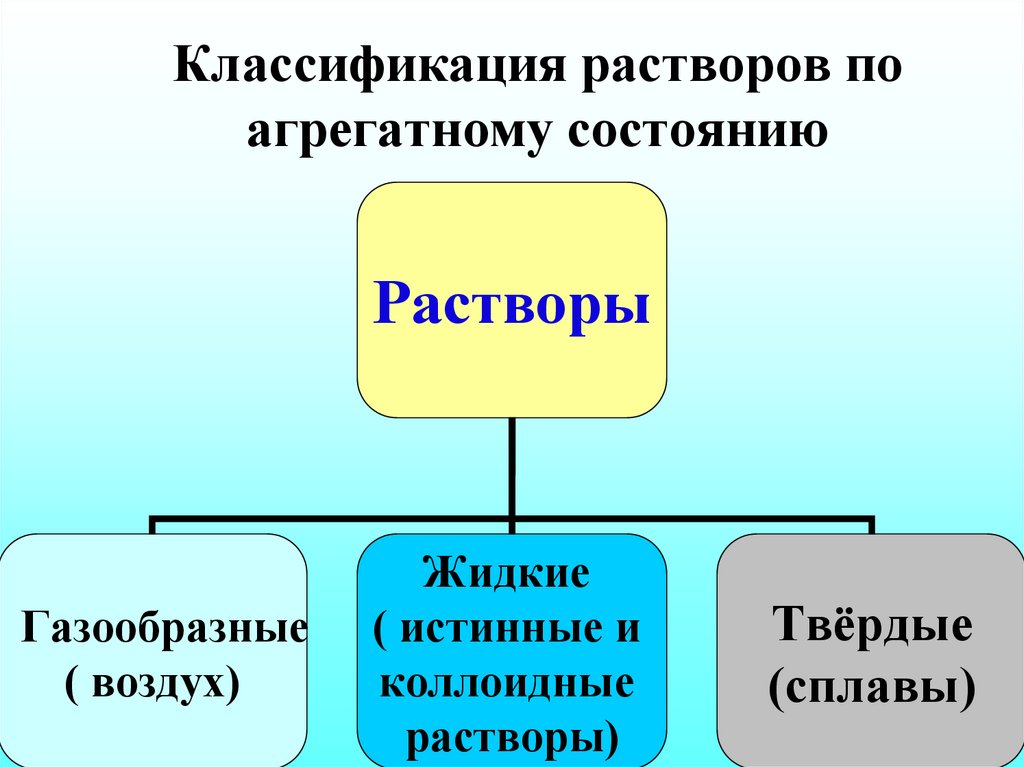
20. Классификация растворов по агрегатному состоянию
РастворыГазообразные
( воздух)
Жидкие
( истинные и
коллоидные
растворы)
Твёрдые
(сплавы)
21. Классификация растворов по растворимости в воде вещества:
• Растворимые (более1,0 г на 100 г воды)
• Малорастворимые(0,
1 г - 1,0 г на 100 г
воды);
• Нерастворимые
(менее 0,1 г на 100 г
воды).
22. Классификация растворов по концентрации растворенного вещества
• разбавленные• концентрированные
23.
Для раствора характерно наличиединамического равновесия, когда
процессы растворения и
кристаллизации уравновешивают
друг друга
Растворение
Кристаллизация
24.
Если равновесие устанавливаетсяпри определенной температуре, то
раствор считается насыщенным
Растворение
Кристаллизация
25.
Если равновесие смещается вправо,то раствор считается
ненасыщенным
Растворение
Кристаллизация
26.
Если равновесие смещается влево,то раствор считается
перенасыщенным
Растворение
Кристаллизация
27. Выражение концентрации раствора
ВЫРАЖЕНИЕКОНЦЕНТРАЦИИ РАСТВОРА
28.
Массовая доля растворенноговещества -w
Показывает долю растворенного вещества,
выраженную в % или долях единицы
mр-ра
m р.в-ва
– 100%
- w%
mр-ра
–1
m р.в-ва w
29.
Объемная доля растворенноговещества - φ
Показывает долю растворенного вещества,
выраженную в % или долях единицы
Vр-ра
V р.в-ва
– 100%
- φ%
Vр-ра
–1
V р.в-ва φ
30.
Молярная концентрация СмПоказывает число молей растворенного
вещества в 1л раствора
См= nр.в-ва/ Vр-ра
моль/л
31.
РастворимостьПоказывает концентрацию насыщенного
раствора при определенной температуре:
массу растворенного вещества в 100г воды
32. Пример решения задачи:
• Смешали 100г железа и 25г серы. Определитемассовые доли компонентов смеси
Дано:
m(Fe)=100г
m(S)=25г
Найти: w(Fe)=?
w (S)=?
Решение:
m(смеси)=100+25=125г
125г
- 100%
100г(Fe) - w(Fe)%
w(Fe)=100г∙100%/125г=80%
w (S)=20%
Ответ: массовая доля железа -80%, серы – 20%

























 chemistry
chemistry








