Similar presentations:
Адсорбционные процессы. Кафедра технологии неорганических веществ и электрохимических процессов
1. АДСОРБЦИОННЫЕ ПРОЦЕССЫ Кафедра технологии неорганических веществ и электрохимических процессов д.т.н., профессор Ануров Сергей Алексееви
АДСОРБЦИОННЫЕПРОЦЕССЫ
Кафедра технологии неорганических
веществ и электрохимических процессов
д.т.н., профессор Ануров Сергей Алексеевич
2. СОДЕРЖАНИЕ КУРСА
СОДЕРЖАНИЕ КУРСАВведение
Задачи и содержание курса. Роль курса в
подготовке инженеров-технологов, работающих в
области технологии неорганических веществ. Связь
с другими спецкурсами, читаемыми на кафедре.
1. Физико-химические и инженерные основы
адсорбционных процессов
1)Основные понятия в теории адсорбции
Адсорбция и силы ее обуславливающие, типы
адсорбционных взаимодействий, адсорбционный
потенциал на поверхности и в порах адсорбентов.
3. СОДЕРЖАНИЕ КУРСА
СОДЕРЖАНИЕ КУРСАВведение
Задачи и содержание курса. Роль курса в подготовке
инженеров-технологов, работающих в области технологии
неорганических веществ. Связь с другими спецкурсами,
читаемыми на кафедре.
1.
Физико-химические основы адсорбционных
процессов
1)Основные понятия в теории адсорбции
Адсорбция и силы ее обуславливающие, типы
адсорбционных взаимодействий, адсорбционный потенциал
на поверхности и в порах адсорбентов.
4.
2)Промышленные
адсорбенты
Характеристики промышленных адсорбентов. Активные
угли, силикагели, алюмогели, цеолиты. Структура,
химический состав, свойства поверхности, физические
свойства, получение, основные марки, применение.
3)Статика адсорбции
Теплота адсорбции. Теория мономолекулярной адсорбции
Ленгмюра. Теория полимолекулярной адсорбции БрунауэраЭммета-Теллера (БЭТ). Потенциальная теория Поляни. Теория
Классификация пор по Дубинину. Теория объемного
заполнения микропор. Слабо сорбирующиеся газы. Адсорбция
при повышенных давлениях. Адсорбция смесей.
5.
4)Кинетика
адсорбции
Предмет изучения, внешняя диффузия, внутренняя диффузия.
Виды переноса в порах. Расчет общего коэффициента
массопередачи.
5)Тепломассообмен
в адсорбционных процессах
Теплообмен и массообмен в зернистом слое.
Основные модели динамики адсорбции. Сравнительная
характеристика равновесных и неравновесных моделей
фронтальной изотермической и неизотермической адсорбции.
6.
2.Технология и расчет адсорбционных процессов
1)Основные этапы развития адсорбционных
процессов,
классификация
адсорбционных
процессов по способам регенерации.
2)Процессы с однократным использованием
адсорбента.
3)Процессы с многократным использованием
адсорбента.
4)Процессы с реактивацией адсорбента.
5)Процессы TSA (Thermal (Temperature) Swing
Adsorption)
с
термопродувочной
и
термовытеснительной регенерацией адсорбента.
6)Циклические процессы
Принципы
построения
процессов, подбор адсорбентов.
циклограмм,
организация
7. Процессы осушки Технология процесса, адсорбенты-осушители, основное оборудование. Расчет и анализ материальных и тепловых балансов проце
7)Процессыосушки
Технология процесса, адсорбенты-осушители, основное
оборудование. Расчет и анализ материальных и тепловых
балансов
процесса.
8)Рекуперация
углеводородов
Особенности технологии и аппаратуры процессов. Принципы
проектирования установок.
9)
Процессы PSA (Pressure Swing Adsorption)
•)очистка воздуха
•)очистка водорода
•)адсорбционное разделение воздуха
•)очистка от диоксида углерода
•)получение защитных атмосфер
•)Очистка от соединений серы
8.
Основные понятия и определенияАдсорбция – процесс самопроизвольного перераспределения
компонентов системы между поверхностным слоем и объемной фазой.
На любой границе раздела существует «поверхностный слой» –
переходная область от одной объемной фазы к другой. Поверхностный
слой имеет очень малую толщину (всего несколько молекул), но в ней
сосредоточен весь избыток поверхностной энергии.
Атомы (или молекулы), примыкающие к поверхности,
ограничивающей
конденсированную
фазу,
отличаются
от
расположенных в объеме той же фазы отсутствием части соседей и,
соответственно, не полной скомпенсированностью межатомных или
межмолекулярных связей.
Особое состояние таких атомов характеризуется величиной
избыточной поверхностной энергией, которая проявляется во многих
явлениях, называемых поверхностными явлениями.
9.
В однокомпонентных системах при формированииповерхностного слоя происходит изменение его структуры (сгущение,
уплотнение), которые часто называют автоадсорбцией.
В многокомпонентных системах в поверхностный слой
предпочтительнее переходит тот компонент, который сильнее
уменьшает межфазное (поверхностное) натяжение.
Движущей силой адсорбции является стремление системы
уменьшить свою поверхностную энергию за счет уменьшения
поверхностного натяжения:
G S
S
S
где - поверхностная энергия, равная средней энергии частицы,
G
находящейся на поверхности раздела фаз и средней
энергии частицы, находящейся в объеме фазы;
- отношение поверхностной энергии в к площади
поверхности раздела фаз;
S - величина поверхности раздела фаз
10. Основные определения
Адсорбция - поглощение частиц какого-либо веществаповерхностью поглотителя, приводящее к повышению
концентрации вещества на границе раздела фаз по
сравнению с концентрацией его в объеме данной фазы
Адсорбция – поглощение твёрдой поверхностью газов,
паров или жидкостей
С термодинамической точки зрения адсорбция –
самопроизвольный процесс выравнивания химических
потенциалов в объеме системы и поверхностном слое.
Слово адсорбция образовано из латинского слова sorbeo –
поглощение и приставки ad – т.е. над или у и означает
поглощение (точнее – концентрирование ) каких либо
компонентов из объема гомогенных сопредельных фаз на
границе (поверхности) раздела этих фаз.
11.
Обычно рассматривают адсорбцию компонентовгазообразной или жидкой среды (в общем случае–флюида) на
границе раздела с твердой или жидкой фазой.
Введем еще несколько терминов, предложенных
Международным союзом чистой и прикладной химии (IUPAC):
Адсорбент – твёрдое тело, на поверхности которого
происходит процесс поглощения
Адсорбтив – поглощаемое вещество, находящееся в объёме
фазы
Адсорбат – адсорбированное (поглощённое) вещество,
находящееся на поверхности (в порах) адсорбента
(т.е. адсорбтив адсорбируется на адсорбенте, превращаясь в
адсорбат)
Десорбция – процесс, обратный адсорбции
12.
Сорбция, сорбент, сорбат, сорбтив – термины применяют,когда механизм поглощения не ясен
Объемная фаза (синонимы: поток, среда) – среда,
подвергаемая очистке (разделению). Она представляет собой
жидкость или газ.
Подвергаемая очистке объемная фаза представляет собой
смесь компонентов, один (одни) из которых поглощается
лучше, чем другой (другие). Различия в адсорбируемости
компонентов вытекают из различий в свойствах, строении и
структуре молекул объемной фазы, взаимодействующих с
адсорбентом. Свое проявление эти различия находят в
адсорбционной
емкости
(синонимы:
адсорбционная
активность, величина адсорбции, концентрация адсорбата в
адсорбенте), которая характеризует способность единичной
массы (объема) адсорбента поглощать компоненты очищаемой
среды.
13.
Размерность адсорбционной емкости поглотителейАдсорбционную активность выражают в виде:
• числа молей адсорбата, поглощаемых 1 г адсорбента,
моль/г;
Пусть исследуется некоторая совокупность объектов,
•см3 (мл)/г;
каждому из которых ставится в соответствие
•г/100 г;
•некоторая
мг/г;
числовая функция — случайная величина
•г/м3;
распределенная по некоторому неизвестному закону.
•% массовые.
14.
Классификации типов адсорбции1. Классификация по типу взаимодействия
адсорбата и адсорбента
Пусть
исследуется некоторая
совокупность
Все
адсорбционные
явления можно
свести объектов,
к 2-м типам:
физическая адсорбция и сорбция, основанная на химическом
каждому из которых ставится в соответствие
взаимодействие между адсорбентом и адсорбатом.
некоторая числовая функция — случайная величина
распределенная по некоторому неизвестному закону.
15.
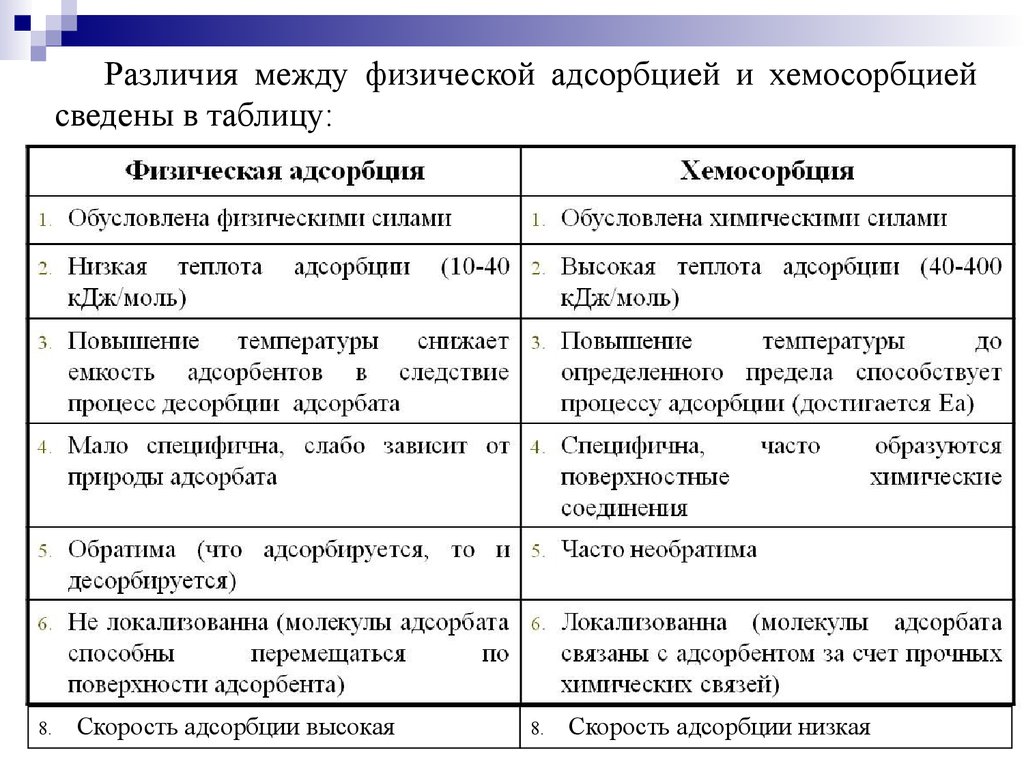
Различия между физической адсорбцией и хемосорбциейсведены в таблицу:
8.
Скорость адсорбции высокая
8.
Скорость адсорбции низкая
16.
2. Классификация на основе границы раздела.твердое тело – газ.
.жидкость - газ.
.твердое тело – жидкость (адсорбция из растворов).
17.
Физическая адсорбцияФизическая
адсорбция обусловлена
на 90 %
неспецифическими
(универсальными)
силами
межмолекулярного взаимодействия, в основном силами Вандер-Ваальса.
а) дисперсионные силы не зависят от характера
распределения электронной плотности молекул адсорбтива, их
величина приблизительно постоянна для адсорбентов любой
химической природы, и поэтому взаимодействие, вызываемое
ими, носит неспецифичный характер. Характерны для
адсорбции неполярных молекул (N2, О2, Н2 и инертных газов) на
неполярных адсорбентах (типа графита и угля);
18.
б) индукционные силы, порожденные взаимодействиемдиполя с другим наведенным им диполем, - характерны для
адсорбции неполярных молекул (N2, О2, Н2 и инертных газов)
на полярных адсорбентах с ионной связью (типа SiO2, Al2О3 и
др.) и для адсорбции полярных молекул (Н2O, СО2, NH3 и др.)
на неполярных адсорбентах и металлах;
в) ориентационные силы, порожденные взаимной
ориентацией взаимодействующих диполей, - характерны для
адсорбции полярных молекул (Н2О, СО2, NH3 и др.) на
полярных адсорбентах с ионной связью (типа SiO2 , и др.).
Кроме диполь-дипольных, в физической адсорбции
участвуют ион-дипольные и квадрупольные взаимодействия.
Электростатическое взаимодействие зависит от химической
природы адсорбента и адсорбтива и является специфическим.
19.
Водородная связь, в отличие от сил Ван-дер-Ваальса,является специфической, т.е. локальной, поскольку
обусловлена невалентным взаимодействием атома водорода
протонодонорной группы (OH, NH2, COOH) с
электроотрицательными атомами O, N, F, S, Cl, имеющими
неподеленную электронную пару (акцепторы протонов).
Водородная связь обеспечивает адсорбцию полярных
молекул (Н2О, CO2, NH3 и др.) на поверхности адсорбентов с
гидроксильными группами ОН или кислородом (типа стекол,
силикагелей и цеолитов). Распределение электронной
плотности в гидроксильных группах, прочно связанных с
атомами кремний-кислородного остова, таково, что
отрицательный заряд в них смещен к атому кислорода.
Следовательно, гидроксильная группа ОН представляет
собой электрический диполь с положительным зарядом у
атома водорода, выдвинутым наружу.
20.
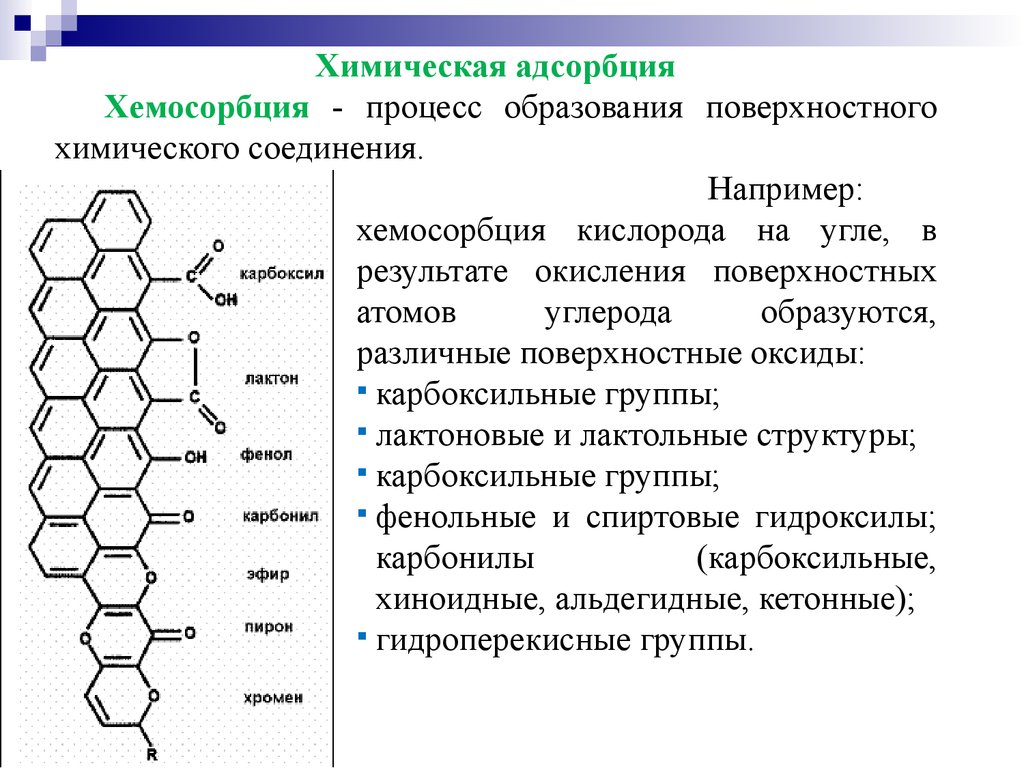
Химическая адсорбцияХемосорбция - процесс образования поверхностного
химического соединения.
Например:
хемосорбция кислорода на угле, в
результате окисления поверхностных
атомов
углерода
образуются,
различные поверхностные оксиды:
карбоксильные группы;
лактоновые и лактольные структуры;
карбоксильные группы;
фенольные и спиртовые гидроксилы;
карбонилы
(карбоксильные,
хиноидные, альдегидные, кетонные);
гидроперекисные группы.
21.
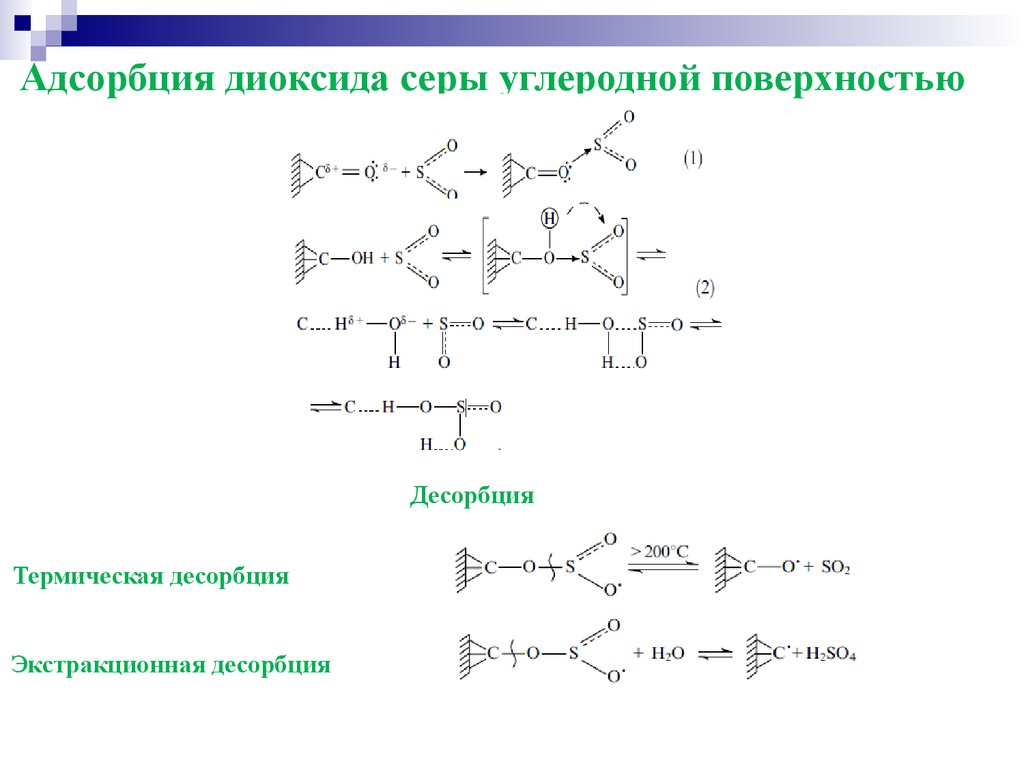
Адсорбция диоксида серы углеродной поверхностьюДесорбция
Термическая десорбция
Экстракционная десорбция
22.
Термическое уравнение адсорбцииАдсорбционный процесс заключается в приведении в
контакт объемной фазы, содержащей различные компоненты, и
адсорбента, в ходе которого нежелательные молекулы объемной
фазы поглощаются адсорбентом, а объемная фаза становится
чистой.
Отношение величины адсорбции целевого компонента (а или
А) к его концентрации в объемной фазе (С):
К = а/С
называется коэффициентом распределения адсорбата.
В системах адсорбент - адсорбат коэффициент
распределения зависит от типа системы и условий, в которых
она находиться; он лежит в пределах 101 - 106 и выше.
Отношение коэффициентов распределения двух адсорбатов,
находящихся в смеси, называют коэффициентом разделения.
23.
Адсорбционная емкость конкретного адсорбента поотношению к поглощаемому веществу зависит от его
концентрации в объемной фазе и температуры, т.е.:
а = (p, t)
Это уравнение называется термическим уравнением
адсорбции.
На практике сравнительная оценка адсорбционных свойств
твердых поглотителей по конкретным компонентам
осуществляется по их адсорбционная емкость в зависимости
от концентрации адсорбата в объемной фазе при постоянной
температуре, т.е.:
a = f (C) при t = const
Это уравнение называется изотермой адсорбции.
24.
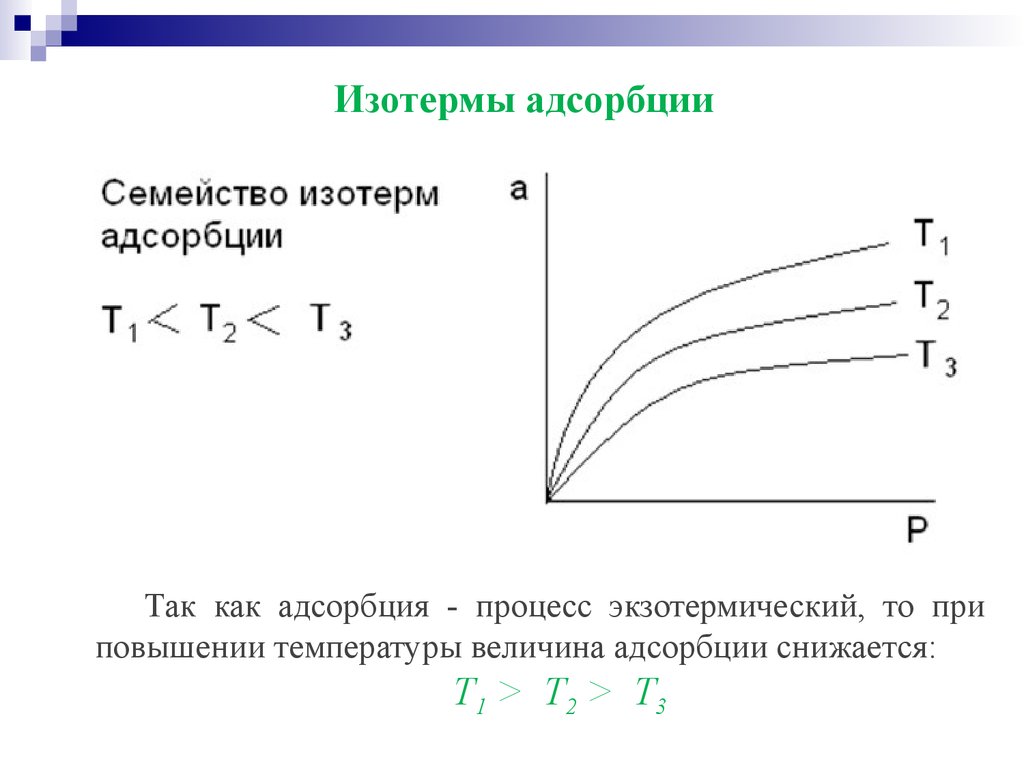
Изотермы адсорбцииТак как адсорбция - процесс экзотермический, то при
повышении температуры величина адсорбции снижается:
Т1 > Т 2 > Т 3
25.
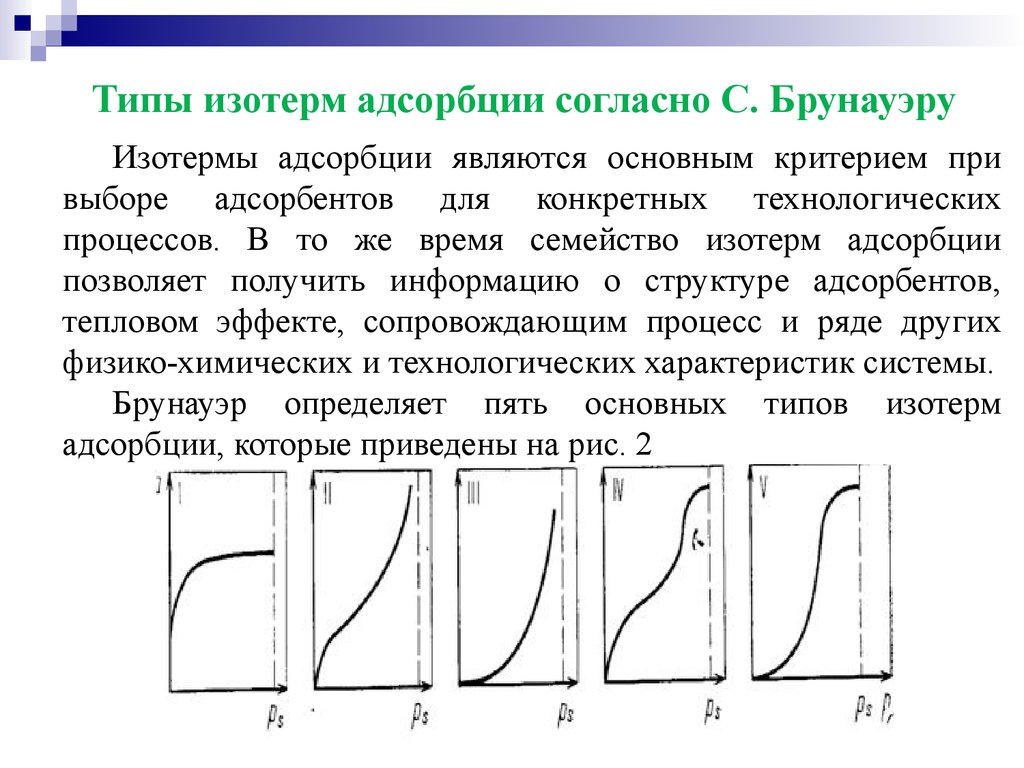
Типы изотерм адсорбции согласно С. БрунауэруИзотермы адсорбции являются основным критерием при
выборе адсорбентов для конкретных технологических
процессов. В то же время семейство изотерм адсорбции
позволяет получить информацию о структуре адсорбентов,
тепловом эффекте, сопровождающим процесс и ряде других
физико-химических и технологических характеристик системы.
Брунауэр определяет пять основных типов изотерм
адсорбции, которые приведены на рис. 2
26.
Типы изотерм адсорбции согласно С. БрунауэруИзотерма типа I отражает мономолекулярную адсорбцию
(описываемая уравнением Лэнгмюра). Изотермы типа II и III
обычно связывают с образованием при адсорбции многих
слоев, т.е. полимолекулярной адсорбцией. Различие между
этими изотермами обусловлены различным соотношением
энергии взаимодействия адсорбат-адсорбент и адсорбатадсорбат. Изотермы типа IV и V отличаются от изотерм II и III
тем, что в первых случаях адсорбция возрастает бесконечно при
приближении давления пара к давлению насыщения, а в других
случаях имеет место конечная адсорбция при давлениях
насыщения. Изотермы типа II и III обычно характерны для
адсорбции на непористом адсорбенте, а типа IV и V - на
пористом твердом теле. Все пять типов изотерм адсорбции
описываются теорией полимолекулярной адсорбции "БЭТ",
названной так по начальным буквам фамилии ее авторов.
27.
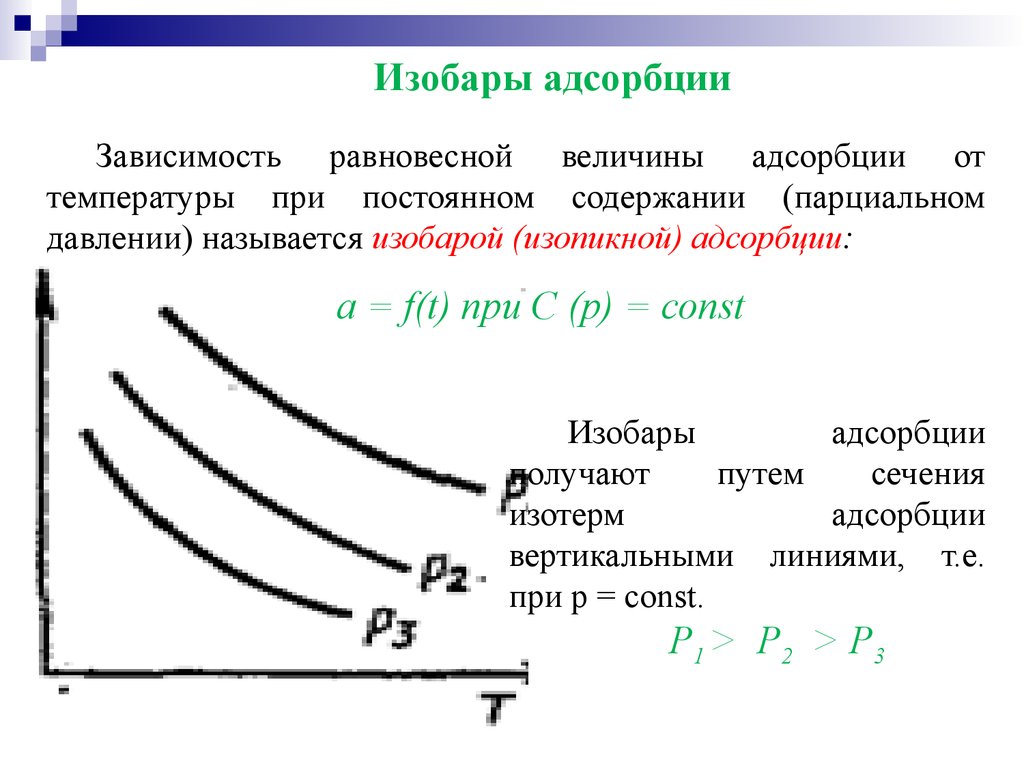
Изобары адсорбцииЗависимость равновесной величины адсорбции от
температуры при постоянном содержании (парциальном
давлении) называется изобарой (изопикной) адсорбции:
a = f(t) при C (p) = const
Изобары
адсорбции
получают
путем
сечения
изотерм
адсорбции
вертикальными линиями, т.е.
при р = const.
Р1 > Р2 > Р3
28.
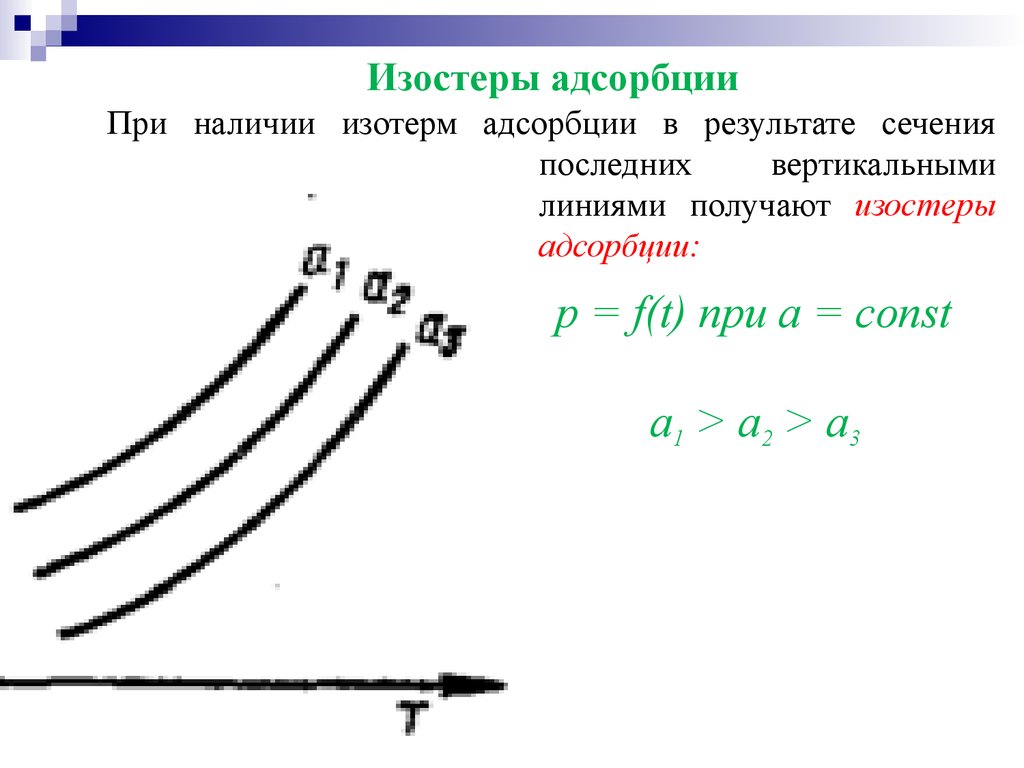
Изостеры адсорбцииПри наличии изотерм адсорбции в результате сечения
последних
вертикальными
линиями получают изостеры
адсорбции:
p = f(t) при a = const
а1 > а 2 > а 3
29.
Теплота адсорбцииОдновременное использование изотерм и изостер
адсорбции позволяет определить два важнейших свойства
системы: величину и теплоту адсорбции. Отметим, что
адсорбция – процесс экзотермичный и ее протекание всегда
сопровождается выделением тепла.
Различают два основных понятия:
• интегральная теплота адсорбции;
• дифференциальная теплота адсорбции.
Интегральной теплотой адсорбции Q называется полное
количество теплоты, выделяющейся при адсорбции n молей
адсорбата. Ее относят к единице массы адсорбента (Дж/кг):
qинт = Q/m
30.
Дифференциальной теплотой адсорбции q называютотнесенное к 1 моль адсорбата дополнительное количество
теплоты, выделяющейся при адсорбции бесконечно малого
количество адсорбата.
Пусть на поверхности адсорбента адсорбировалось n молей
адсорбата и выделилось Q калорий тепла. Затем
адсорбировалось еще dn молей адсорбата с тепловым эффектом
dQ. Дифференциальной теплотой адсорбции называется тепло,
выделившееся при дополнительной адсорбции малого
количества адсорбата и пересчитанное на один его моль.
qдиф = dQ/dn
31.
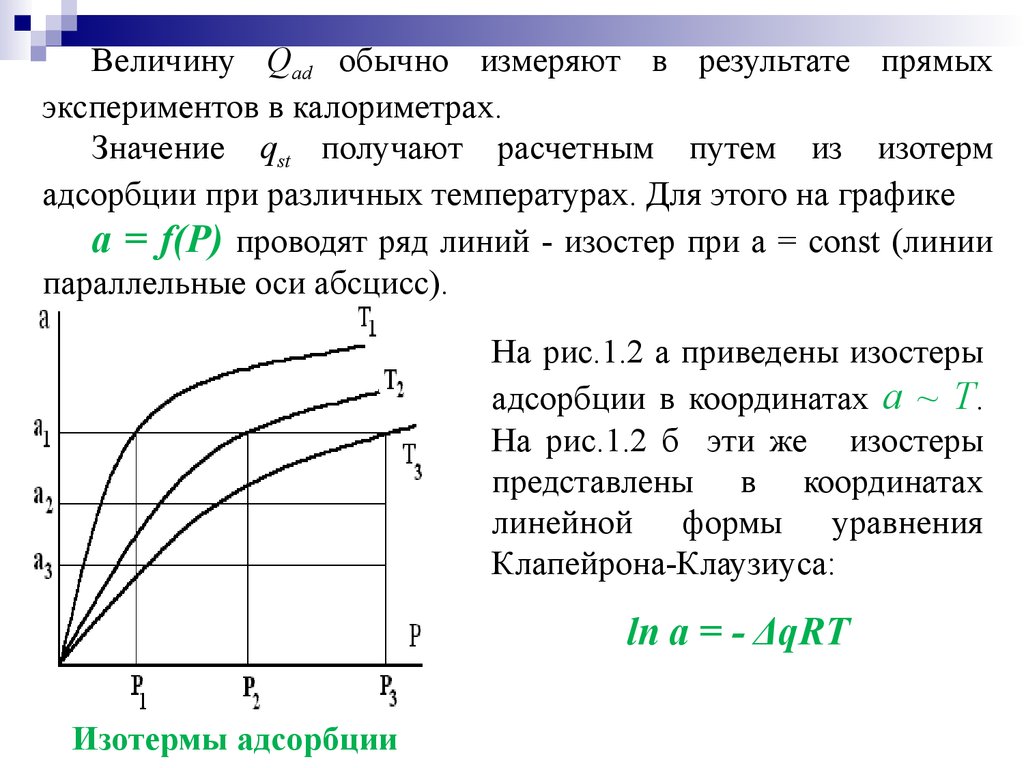
Величину Qad обычно измеряют в результате прямыхэкспериментов в калориметрах.
Значение qst получают расчетным путем из изотерм
адсорбции при различных температурах. Для этого на графике
а = f(P) проводят ряд линий - изостер при а = const (линии
параллельные оси абсцисс).
На рис.1.2 а приведены изостеры
адсорбции в координатах а ~ T.
На рис.1.2 б эти же изостеры
представлены в координатах
линейной формы уравнения
Клапейрона-Клаузиуса:
ln а = - ΔqRT
Изотермы адсорбции
32.
Из точек пресечения изостер с изотермами для всехизотерм адсорбции определяют Р1, Р2, Р3 и т.д. (каждому
значению Т соответствует своё значение Р).
На рис. 2.13 даны построения для изостеры a1. Полученные
данные
располагают
в
координатах lnP = f(1/Т)
(рис.2.14). Дифферециальномолярную изостерическую
теплоту адсорбции qst (на
рисунке - для адсорбции a1)
определяют из тангенса угла
наклона полученной прямой
qst = R tg . Аналогично
вычисляют
дифференциальные теплоты
и для других значений a.
Изоcтероы адсорбции
33.
34.
АдсорбентыАдсорбенты — высокодисперсные природные или
искусственные материалы с большой удельной поверхностью,
на
которой
происходит
адсорбция
веществ
из
соприкасающихся с ней газов или жидкостей. Адсорбционные
свойства адсорбентов зависят от
• химического состава и физического состояния поверхности;
• характера пористости;
• удельной поверхности.
Все промышленные адсорбенты в зависимости от их
химического состава можно подразделить на 3 класса:
• углеродные;
• минеральные;
• полимерные.
В каждом классе имеются собственные подклассы.
35.
Классификация адсорбентов36.
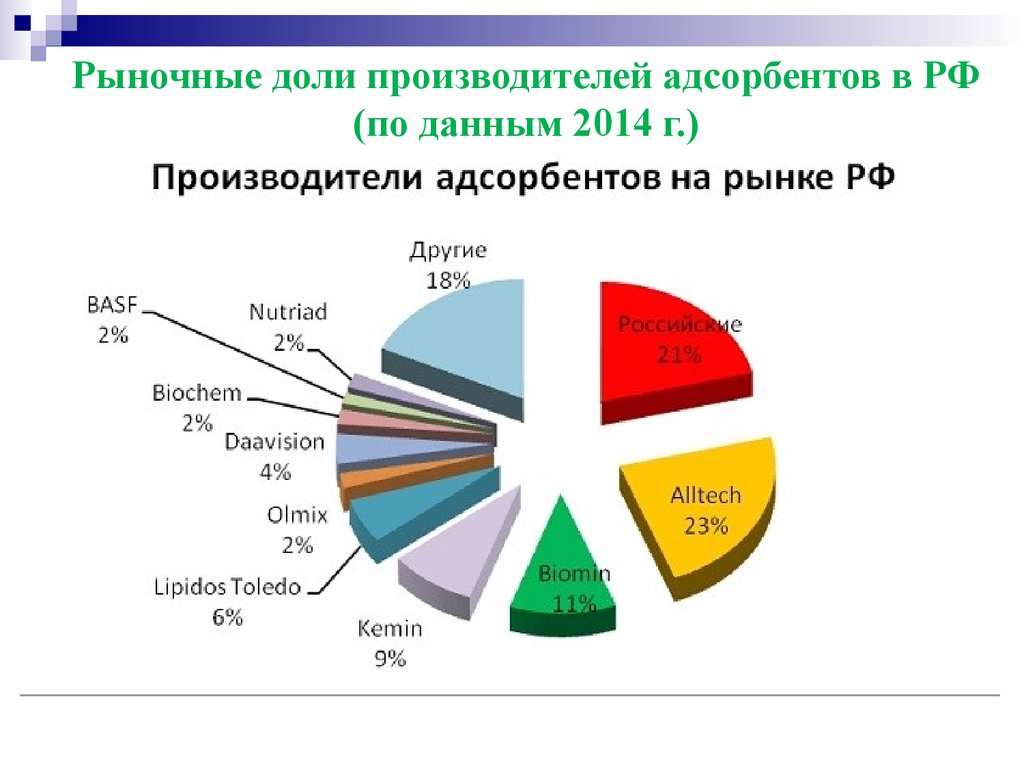
Рыночные доли производителей адсорбентов в РФ(по данным 2014 г.)
37.
Рыночные доли производителей адсорбентов в РФ(по данным 2014 г.)
Сегодня на российском рынке представлены
продукты таких зарубежных производителей, как
Alltech (США, Бельгия, Сербия, Великобритания);
Biomin, Likra Tierernahrung (Австрия); Andres
Pintaluba, Lipidos Toledo, SCA Iberica (Испания);
Miavit, Biochem (Германия); Daavision, Framelco,
Orffa, Selko, Perstorp, Hameco Agro (Нидерланды);
Kemin, Impextraco, Nutri-ad, Novus, Innovad (Бельгия);
Olmix, Ceva Sante Animale, Jefo (Франция); BASF,
Cenzone,
Agranco
(США);
Lallemand
(Великобритания); Бразилии; Индии; Польши;
Словакии
и
Израиля.
38.
Углеродные адсорбентыУглеродными
адсорбентами
называются
углеродсодержащие материалы, получаемые на основе
природного или полимерного сырья, обладающие
разветвленной пористой структурой и поглотительной
способностью по широкому спектру веществ из газовых и
жидких сред.
Среди них наибольшее значение имеют активные
(активированные) угли.
39.
Активные углиАктивированные угли – это группа углеродных сорбентов,
(зерненые, порошкообразные, гранулированные) выпускаемых
промышленностью и имеющих нормативные показатели
качества.
1. зерненный (дробленый) 2. порошкообразный 3. гранулированный
40.
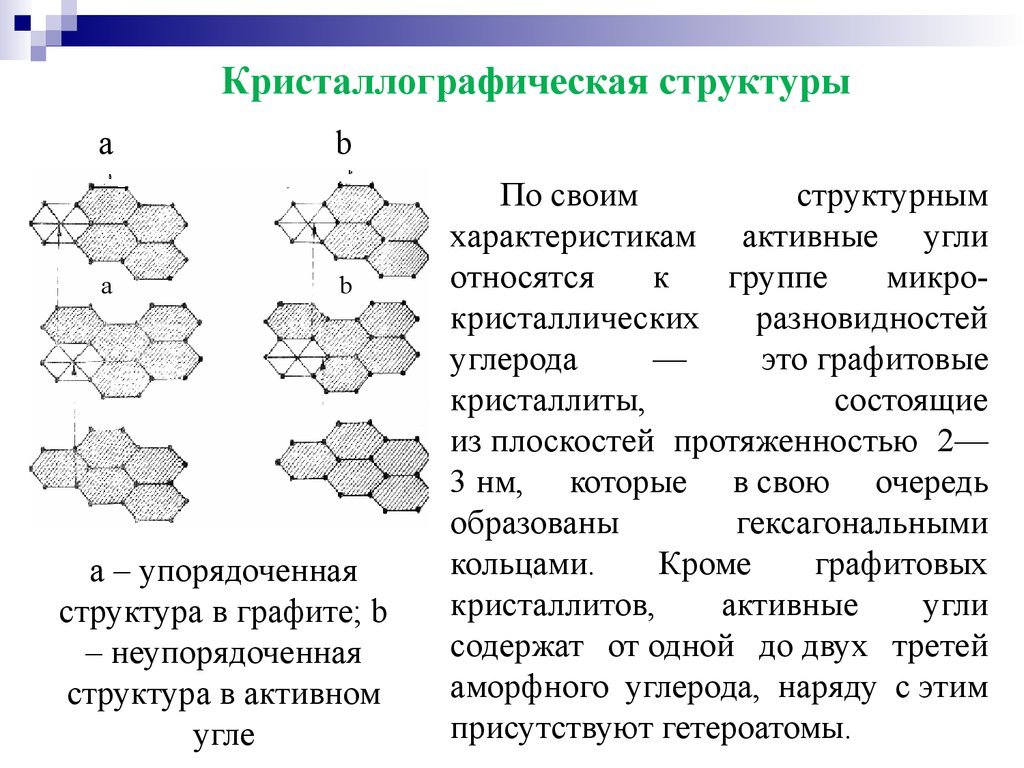
Кристаллографическая структурыa b
a b
а – упорядоченная
структура в графите; b
– неупорядоченная
структура в активном
угле
По своим
структурным
характеристикам активные угли
относятся к группе микрокристаллических разновидностей
углерода
—
это графитовые
кристаллиты,
состоящие
из плоскостей протяженностью 2—
3 нм, которые в свою очередь
образованы
гексагональными
кольцами.
Кроме
графитовых
кристаллитов,
активные
угли
содержат от одной до двух третей
аморфного углерода, наряду с этим
присутствуют гетероатомы.
41.
Пористая структураМежду отдельными частицами углеродного материала
имеются поры шириной 10-10-10-8 м. Эти адсорбенты, обычно,
характеризуются развитой полидисперсной структурой, хотя
возможен и их синтез с узким распределением пор по
радиусам определенных размеров. Как правило, активные угли
содержат все три известные разновидности пор - макропоры с
радиусами от 100 до 200 нм, переходные (мезо-) с радиусами
от 1,5 до 100 нм и микропоры с радиусами менее 1,5 нм.
42.
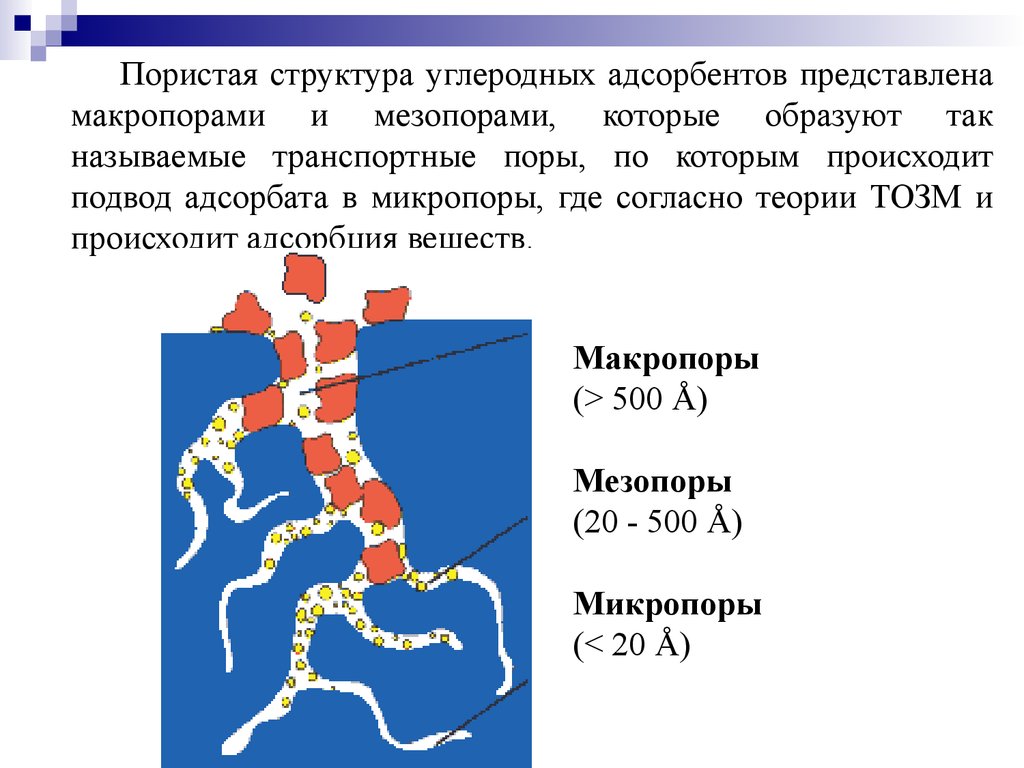
Пористая структура углеродных адсорбентов представленамакропорами и мезопорами, которые образуют так
называемые транспортные поры, по которым происходит
подвод адсорбата в микропоры, где согласно теории ТОЗМ и
происходит адсорбция веществ.
Макропоры
(> 500 Å)
Мезопоры
(20 - 500 Å)
Микропоры
(< 20 Å)
43.
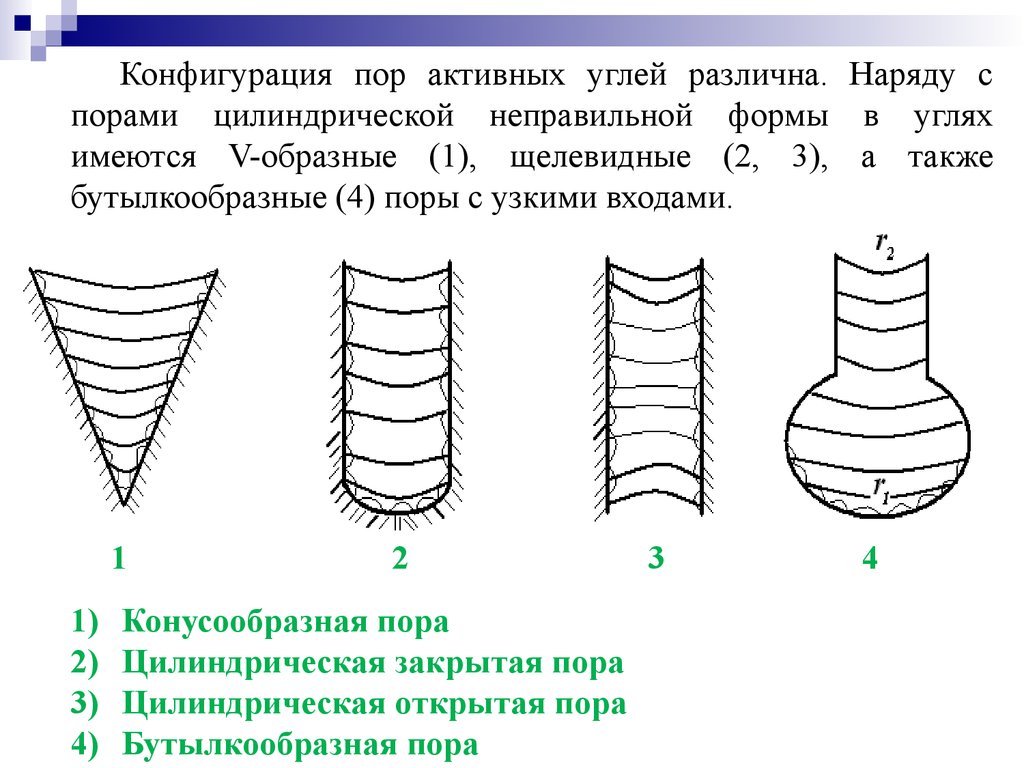
Конфигурация пор активных углей различна. Наряду спорами цилиндрической неправильной формы в углях
имеются V-образные (1), щелевидные (2, 3), а также
бутылкообразные (4) поры с узкими входами.
1
1)
2)
3)
4)
2
Конусообразная пора
Цилиндрическая закрытая пора
Цилиндрическая открытая пора
Бутылкообразная пора
3
4
44.
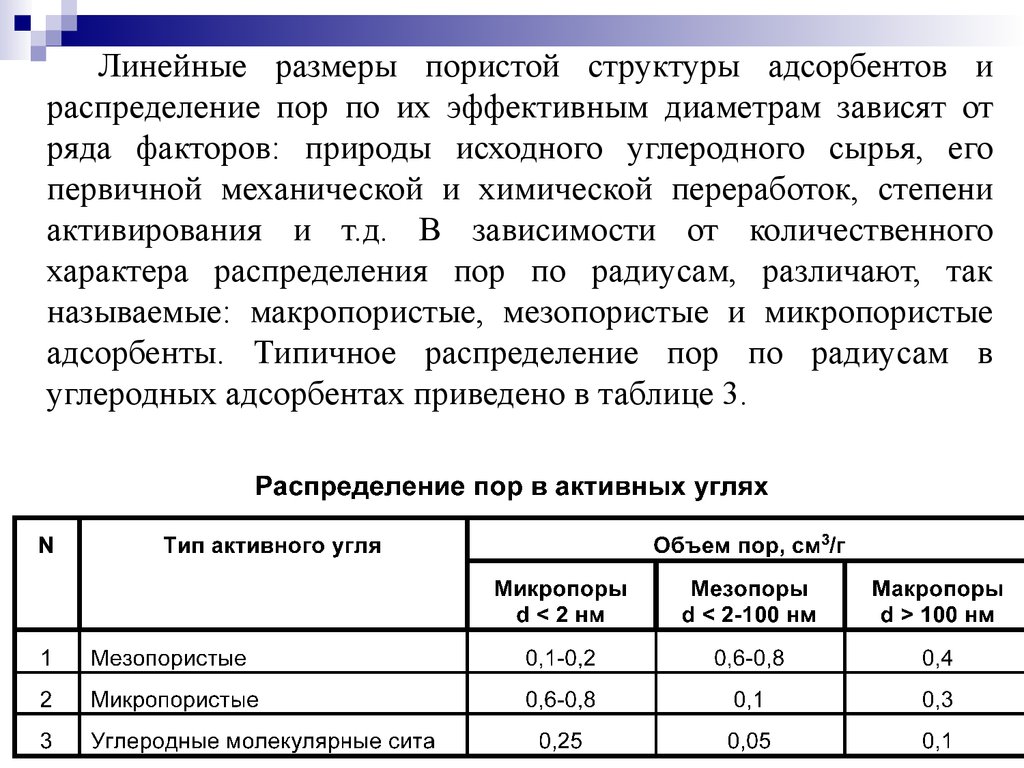
Линейные размеры пористой структуры адсорбентов ираспределение пор по их эффективным диаметрам зависят от
ряда факторов: природы исходного углеродного сырья, его
первичной механической и химической переработок, степени
активирования и т.д. В зависимости от количественного
характера распределения пор по радиусам, различают, так
называемые: макропористые, мезопористые и микропористые
адсорбенты. Типичное распределение пор по радиусам в
углеродных адсорбентах приведено в таблице 3.
45.
Активные угли имеют весьма развитую удельнуюповерхность, которая достигает 500-3000 м2/г. Столь развитая
поверхность образована транспортными порами (макро- и
мезопорами), т.к. в соответствие с теорией объемного
заполнения микропор М.М. Дубинина, понятие о поверхности
микропор не имеет физического смысла.
46.
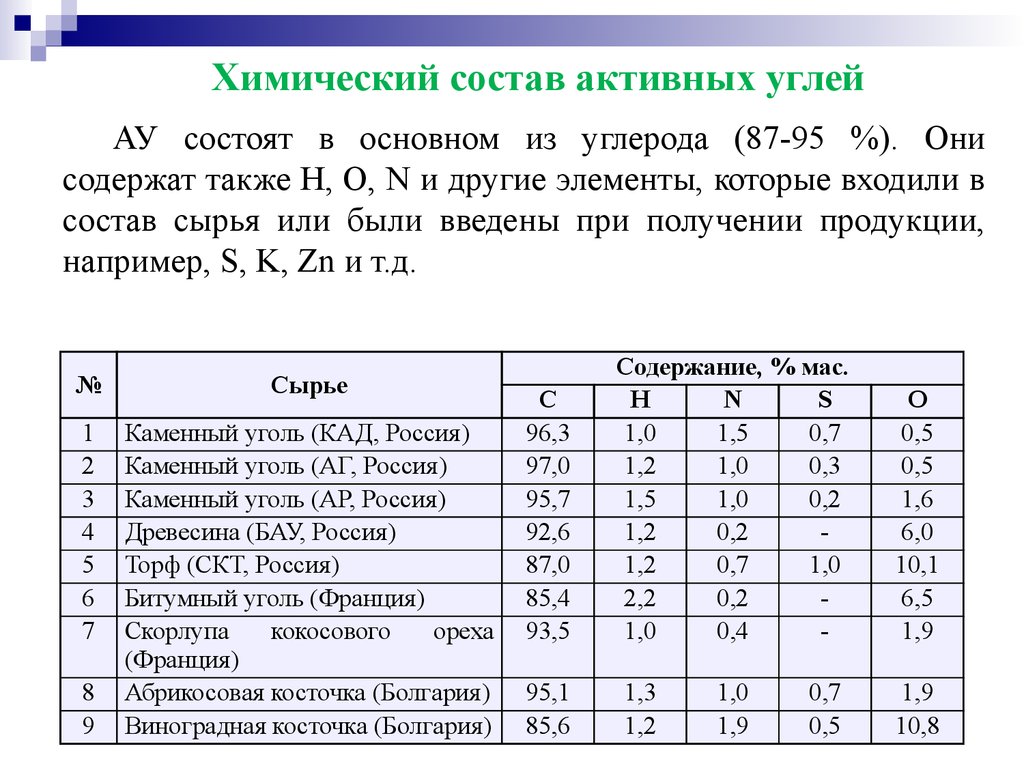
Химический состав активных углейАУ состоят в основном из углерода (87-95 %). Они
содержат также Н, О, N и другие элементы, которые входили в
состав сырья или были введены при получении продукции,
например, S, K, Zn и т.д.
№
1
2
3
4
5
6
7
8
9
Сырье
С
Каменный уголь (КАД, Россия)
96,3
Каменный уголь (АГ, Россия)
97,0
Каменный уголь (АР, Россия)
95,7
Древесина (БАУ, Россия)
92,6
Торф (СКТ, Россия)
87,0
Битумный уголь (Франция)
85,4
Скорлупа кокосового ореха 93,5
(Франция)
Абрикосовая косточка (Болгария) 95,1
Виноградная косточка (Болгария) 85,6
Содержание, % мас.
Н
N
S
1,0
1,5
0,7
1,2
1,0
0,3
1,5
1,0
0,2
1,2
0,2
1,2
0,7
1,0
2,2
0,2
1,0
0,4
1,3
1,2
1,0
1,9
0,7
0,5
O
0,5
0,5
1,6
6,0
10,1
6,5
1,9
1,9
10,8
47.
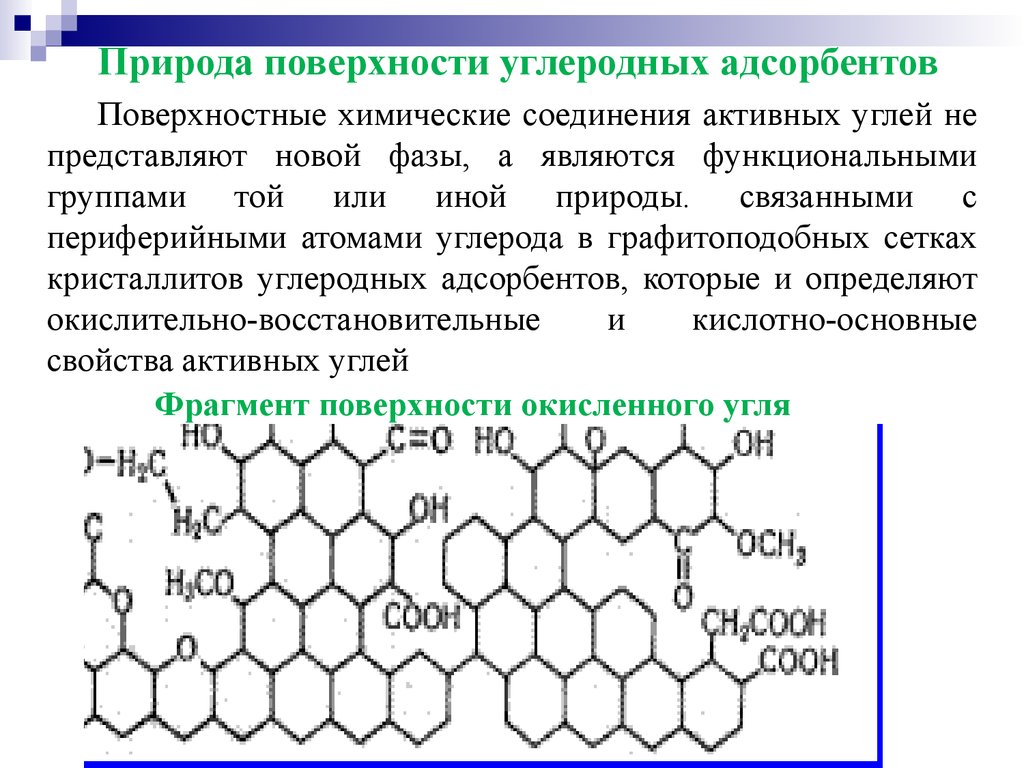
Природа поверхности углеродных адсорбентовПоверхностные химические соединения активных углей не
представляют новой фазы, а являются функциональными
группами той или иной природы. связанными с
периферийными атомами углерода в графитоподобных сетках
кристаллитов углеродных адсорбентов, которые и определяют
окислительно-восстановительные
и
кислотно-основные
свойства активных углей
Фрагмент поверхности окисленного угля
48.
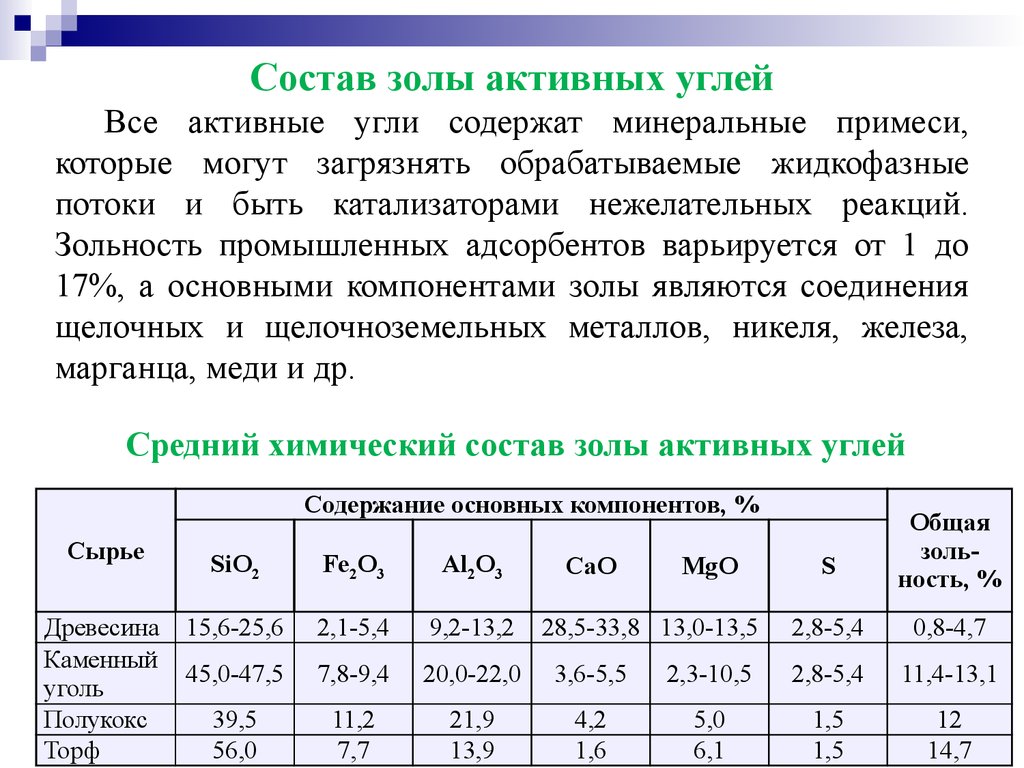
Состав золы активных углейВсе активные угли содержат минеральные примеси,
которые могут загрязнять обрабатываемые жидкофазные
потоки и быть катализаторами нежелательных реакций.
Зольность промышленных адсорбентов варьируется от 1 до
17%, а основными компонентами золы являются соединения
щелочных и щелочноземельных металлов, никеля, железа,
марганца, меди и др.
Средний химический состав золы активных углей
Содержание основных компонентов, %
Сырье
SiO2
Древесина 15,6-25,6
Каменный
45,0-47,5
уголь
Полукокс
39,5
Торф
56,0
Fe2O3
Al2O3
2,1-5,4
9,2-13,2
7,8-9,4
20,0-22,0
3,6-5,5
11,2
7,7
21,9
13,9
4,2
1,6
CaO
MgO
28,5-33,8 13,0-13,5
S
Общая
зольность, %
2,8-5,4
0,8-4,7
2,3-10,5
2,8-5,4
11,4-13,1
5,0
6,1
1,5
1,5
12
14,7
49.
КлассификацияБольшое разнообразие адсорбционных процессов и,
соответственно, требований к активным углям привело к
существованию многочисленных их классификаций.
Классификация по форме частиц
гранулированные;
форма
гранул
может
быть
цилиндрической и сферической. Эти активные угли
используются на установках со стационарным слоем для
очистки и разделения газовых и жидкофазных потоков;
дробленые; зернистая неправильная форма, используются
во всех вариантах адсорбционных процессов (со
стационарным, движущимся, псевдоожиженным слоем
адсорбента);
порошковые; пылевидные частицы размером < 100 мкм,
используются для очистки веществ в жидкой фазе.
50.
Классификация в зависимости от назначения АУВ этой классификации каждый тип угля отличается характерной
структурой пор. В соответствии с этой классификацией
различают следующие виды АУ:
газовые (СКТ); предназначены для улавливания примесей,
присутствующих в газовых потоках в небольших
концентрациях. Эти угли должны обладать большим объемом
микропор (не менее 0,3-0,5 см3/г) и умеренно развитой
транспортной пористостью (≥ 0,1 см3/г), обеспечивающей
достаточную интенсивность диффузии внутри зерна
адсорбента;
рекуперационные (АРТ). Их назначение – улавливание
паров органических растворителей с последующей их
десорбцией и возвратом растворителей в технологический
процесс. Так как стадия десорбции должна проводиться без
осложнений, суммарный объем макро- и мезопор
рекуперационных углей должен быть примерно равным
51.
осветляющие(БАУ, ОУ, КАД); предназначены для
поглощения веществ из жидких сред, поэтому их структура
должна обладать развитой мезопористостью. Кроме того,
осветляющие угли должны содержать не более 10 масс. %
минеральных
зольных
компонентов,
особенно
водорастворимых;
для очистки почв (Агросорб); предназначены для
детоксикации почв, загрязненных пестицидами; для
устранения из почвы тяжелых металлов, радионуклидов с
одновременным кондиционированием почв. Эти угли должны
обладать объемом микропор ~ 0,2-0,3 см3/г) и развитой
транспортной ористостью;
медицинские (ФАС-Э, СКТ-6А); предназначены для
поглощения вредных веществ из желудочно-кишечного тракта,
крови, плазмы и лимфы. Эти угли должны обладать большими
объемами микропор (не менее 0,4-0,5 см3/г) и транспортных
пор (не менее 0,4 см3/г). Помимо высокой пористости эти угли
52.
дляприготовления катализаторов, осушителей и
химических поглотителей (ОЛБ, ОЛ, КГ); используются в
качестве основы, характеризуются развитыми объемами
макро- и мезопор.
Классификация по форме частиц
• каменноугольные;
•торфяные;
•древесные;
•косточковые;
•полимерные;
•из отходного сырья.
Классификация по способу активации
•парогазовой активации;
•химической активации;
•смешанная.
53.
Классификация по способу формования•экструзионные;
•брикетированные;
•жидкостного формования.
Классификация по прочностным свойствам
•низкопрочные;
•высокопрочные.
Классификация по показателю насыпной плотности
•с низкой плотностью (< 300 г/л);
•с нормальной плотностью (300 – 500 г/л));
•с высокой плотностью (> 500 г/л).
Реактивированные АУ – это отработанные угли с
восстановленными адсорбционными свойствами для повторного
использования (АР-Р, АГ-Р).
Определяющими техническими характеристиками АУ
являются адсорбционная способность, прочность при
истирании, насыпная плотность, фракционный состав и
содержание золы.
54.
Технология получения углеродных адсорбентовТиповая схема получения углеродных адсорбентов включает
следующие стадии:
1) подготовка
сырья (сепарация, дробление, сушка,
классификация и т.д.);
2) карбонизация углеродсодержащего сырья - термообработка
обычно без доступа окислителя при 500 - 900 оС;
3) активации карбонизата.
Активация углеродных матриц бывает:
4) физической (парогазовой) в присутствии окислителя (пары
воды, СО2, воздух либо их смесь) при 700-1000 оС.
5) химической в результате введения в исходный материал
неорганических катализаторов (ZnCl2, H3PO4, карбонаты
калия и др.) с карбонизацией в инертной среде или в
присутствии газообразного окислителяв диапазоне
температур 200-850 оС.
55.
СырьеКритерии при выборе сырья для производства углеродных
адсорбентов:
• содержание углерода и минеральных примесей;
• прочность;
• количество летучих соединений;
• величина запасов;
• объемы и легкость добычи сырья;
• транспорта и хранения;
• затраты на организацию технологического процесса
переработки;
• экологическая безопасность технологии и т.п.
56.
Структура потребления сырья для производствауглеродных адсорбентов
Сырье
№
Потребление
тонн/год
%
1
Древесина
130.000
36,1
2
Уголь каменный
100.000
27,8
3
Уголь бурый
50.000
13,9
4
Торф
35.000
9,7
5
Скорлупа кокосовых орехов
35.000
9,7
6
Прочее
10.000
2,8
7
Всего
360.000
100
57.
Области применения углеродных адсорбентов№
Направление
1 Очистка питьевой воды
Доля от общего объема
пр-ва, %
34
2 Очистка газовых выбросов
26
3 Пищевая промышленность
22
4 Химия и фармацевтика
18
Итого
100
58.
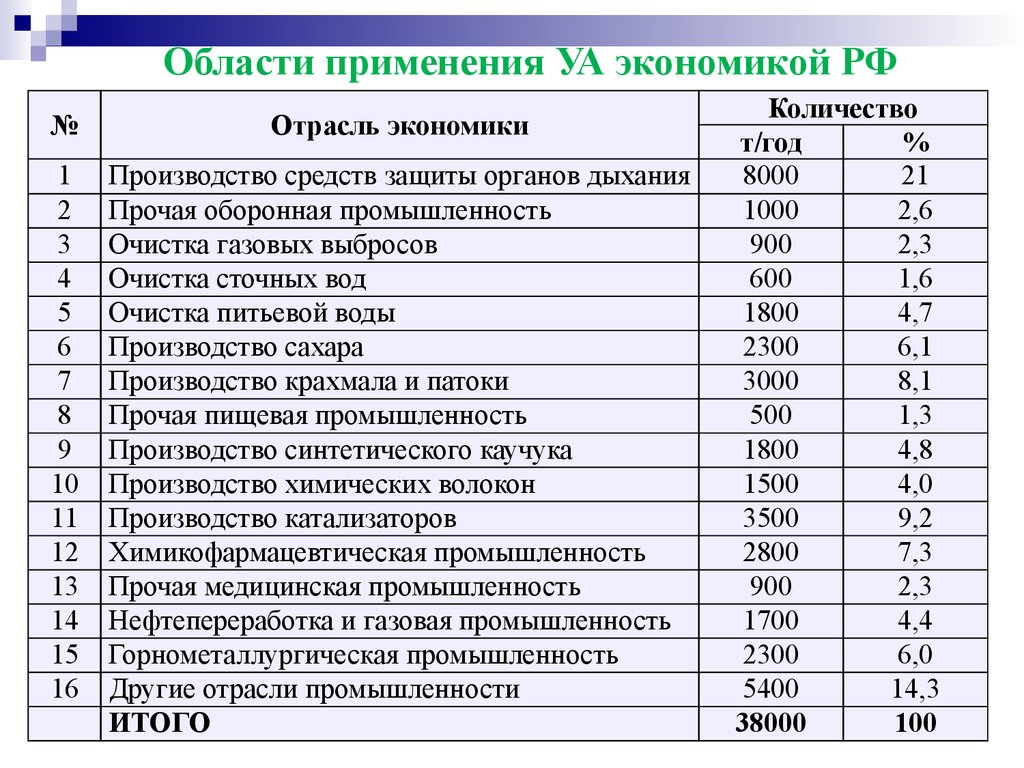
Области применения УА экономикой РФ№
Отрасль экономики
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Производство средств защиты органов дыхания
Прочая оборонная промышленность
Очистка газовых выбросов
Очистка сточных вод
Очистка питьевой воды
Производство сахара
Производство крахмала и патоки
Прочая пищевая промышленность
Производство синтетического каучука
Производство химических волокон
Производство катализаторов
Химикофармацевтическая промышленность
Прочая медицинская промышленность
Нефтепереработка и газовая промышленность
Горнометаллургическая промышленность
Другие отрасли промышленности
ИТОГО
Количество
т/год
%
8000
21
1000
2,6
900
2,3
600
1,6
1800
4,7
2300
6,1
3000
8,1
500
1,3
1800
4,8
1500
4,0
3500
9,2
2800
7,3
900
2,3
1700
4,4
2300
6,0
5400
14,3
38000
100
59.
Минеральные адсорбенты1. Цеолиты
Цеолиты – кристаллические водные алюмосиликаты
каркасной структуры, из которых путем умеренного нагревания
вода может быть обратимо удалена без разрушения
кремнеалюмокислородного каркаса; при этом в каркасе
образуется система регулярных каналов и полостей, доступных
для адсорбции молекул малых размеров. Химическая формула:
Me2 / nO Al2O3 xSiO2 yH 2O
где Ме – катион щелочного или щелочноземельного металла с
валентностью n (обычно это Na+, K+, Ca2+, Ba2+, Si2+, Mg2+), y –
число молекул воды, а отношение у/х может изменяться от 1 до 5
для различных видов цеолитов. Значение х ≥ 2.
Соотношение Na/Al в цеолитах равно 1.
Соотношение SiO2/Al2O3 носит название кремнеземового
модуля адсорбента.
60.
Минеральные адсорбенты1. Цеолиты
61.
Цеолиты бывают:• природные (горные породы);
• синтетические.
То есть цеолиты встречаются в природе и известны очень давно.
Промышленный синтез цеолитов был осуществлен в конце 40-х
годов XX в.
Синтетические цеолиты более пригодны для промышленных
целей из-за высокой однородности структуры и чистоты, чем
природные цеолиты. Однако они на много дороже горных пород.
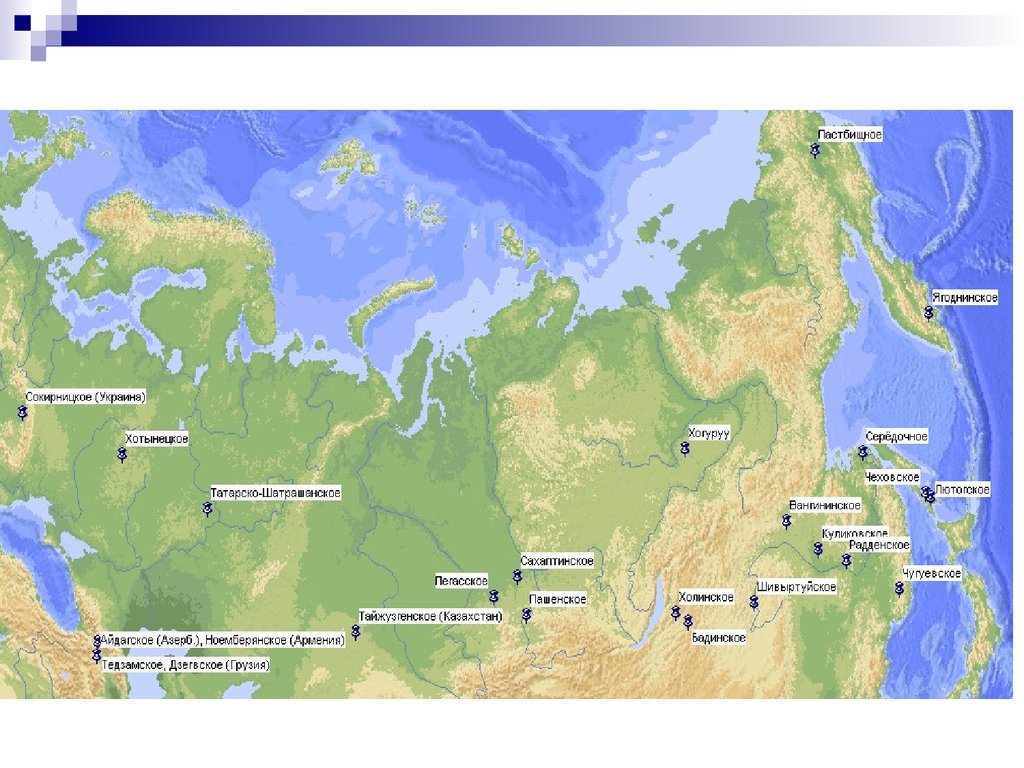
Природные цеолиты
Основные разведанные запасы природных цеолитов
сосредоточены в Европе, России, Японии и США.
Объем разведанных запасов природных цеолитов в странах СНГ
составляет порядка 1,6 млрд. т.
К наиболее крупным и целесообразным с точки зрения
разработки месторождениям стран СНГ можно отнести:
62.
Сокирницкое (Украина),Тедзамское и Дзегвское (Грузия),
Айдагское (Азербайджан),
Ноемберянское (Армения),
Тайжузгенское и Чанканайское (Казахстан).
На территории России выявлено примерно 120 месторождений
и проявлений цеолитсодержащих пород. Из них в государственном
балансе учтено 14 месторождений. Балансовые запасы цеолитовых
пород в России составляют 661,9 млн. т, или примерно 40 %
запасов стран СНГ. Среди них:
Хотынецкое (Орловская область),
Татарско-Шатрашанское (Татарстан),
Пегасское (Кемеровская область),
Сахаптинское и Пашенское (Красноярский край),
63.
Холинское, Шивыртуйское и Бадинское (Читинская область),Хонгуруу (Республика Саха),
Куликовское и Вангинское (Амурская область),
Радденское, Середочное (Хабаровский край),
Чугуевское (Приморский край),
Лютогское и Чеховское (Сахалинская область),
Пастбищное (Чукотский АО).
Ягоднинское (Камчатская область) (рис. 1)
Основную массу сырья данных месторождений составляют
клиноптилолитовые породы.
64.
65.
Распределение балансовых запасов цеолитов натерритории России
Забайкальский край 72,2
Республика Татарстан 13,3
Приморский край 3,1
Хабаровский край 3,1
Амурская область 2,3
Республика Саха (Якутия) 1,7
Сахалинская область 1,3
Камчатская область 1,1
Чукотский АО 1,0
Кемеровская область 0,9
Всего 100
66.
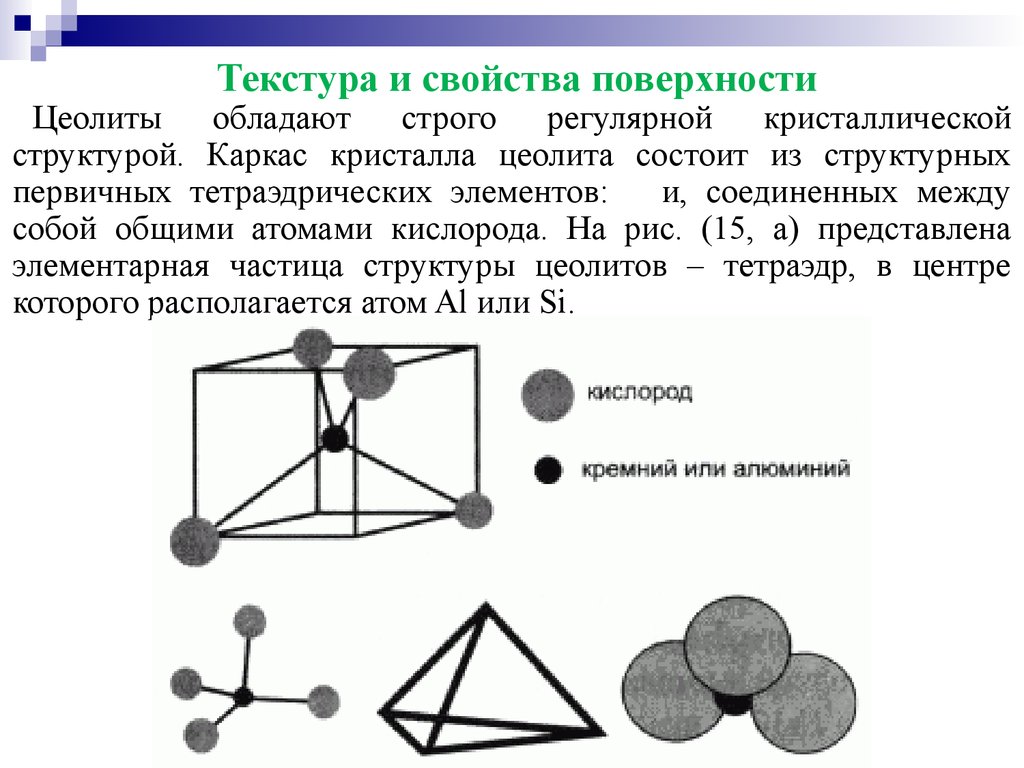
Текстура и свойства поверхностиЦеолиты обладают строго регулярной кристаллической
структурой. Каркас кристалла цеолита состоит из структурных
первичных тетраэдрических элементов: и, соединенных между
собой общими атомами кислорода. На рис. (15, а) представлена
элементарная частица структуры цеолитов – тетраэдр, в центре
которого располагается атом Al или Si.
67.
Когда каждый атом кислорода принадлежит двум соседнимкремний-кислородным или алюмокислородным тетраэдрам,
образуется трехмерная бесконечная каркасная структура.
Вторичные структурные единицы представляют собой
характерные конфигурации из тетраэдров (рис. 15, б).
Координационные числа у Al и Si равны 4, в вершинах
обязательно 4 связи. Al и Si – взаимозаменяющие элементы, но Al
имеет валентность 3, а Si – 4, поэтому тетраэдр [AlO 4]− имеет
отрицательный заряд. Для компенсации в структуру должен быть
введен однозарядный катион на одну связь алюминия. Поэтому в
цеолитах содержание алюминия равно содержанию натрия.
Цеолиты имеют жесткую упорядоченную трехмерную
кристаллическую решетку. Полости сообщаются между собой в
трех измерениях. Катионы и молекулы воды не входят в
кристаллическую решетку цеолитов, а располагаются в полостях
и каналах цеолитов. Распределение электронов в структуре
цеолита таково, что имеются определенные предпочтительные
68.
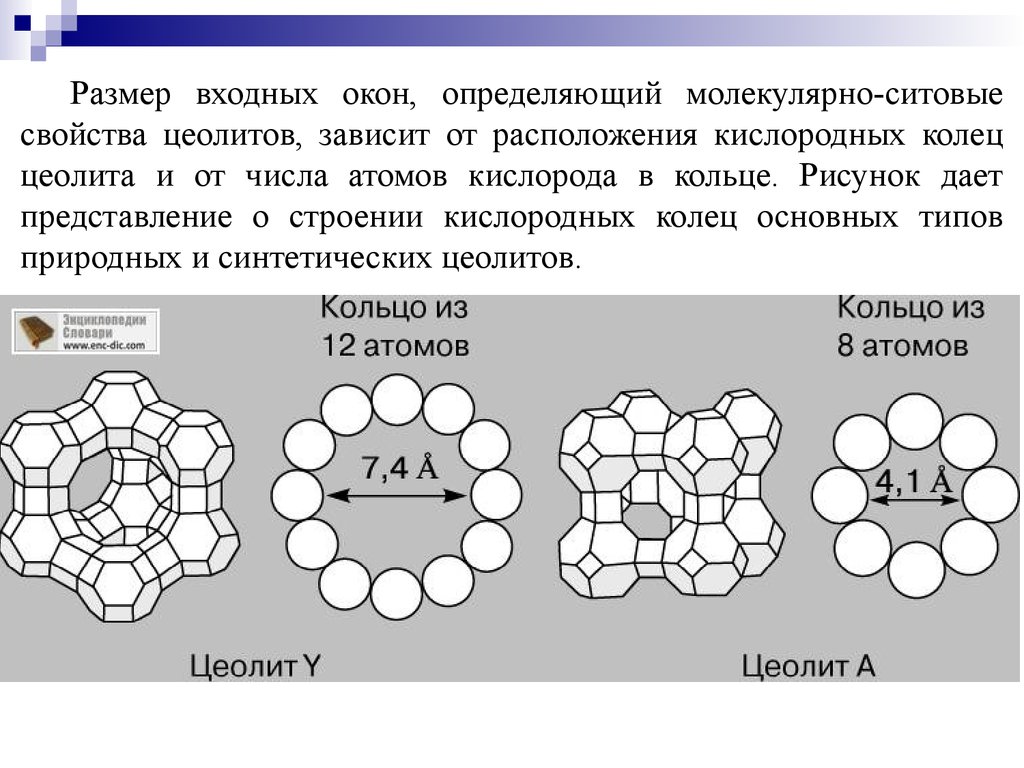
Размер входных окон, определяющий молекулярно-ситовыесвойства цеолитов, зависит от расположения кислородных колец
цеолита и от числа атомов кислорода в кольце. Рисунок дает
представление о строении кислородных колец основных типов
природных и синтетических цеолитов.
69.
Поверхность цеолитов гетероионна, т.е. на поверхностикристалла цеолита имеются отрицательно (ионы AlO4–) и
положительно заряженные ионы (катионы). Энергетика
поверхности зависит от содержания алюминия и характеризуется
соотношением SiO2/Al2O3. Чем меньше алюминия в цеолитах, тем
меньше катионов, тем поверхность цеолита более энергетически
однородна.
Соотношение SiO2/Al2O3 называется кремневым модулем и
определяет кислотостойкость цеолита. Чем выше содержание
кремния, тем выше его кислотостойкость.
Катионы не входят в кристаллическую решетку цеолитов и
имеют возможность перемещаться со своих основных позиций,
мигрировать.
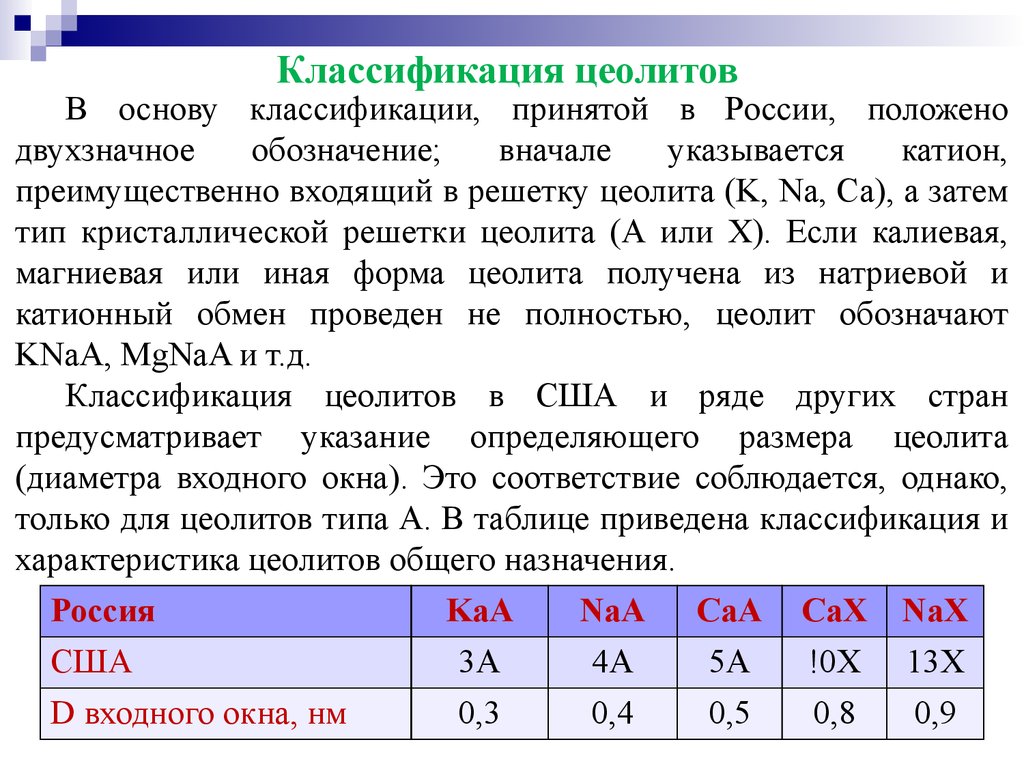
70. Классификация цеолитов
В основу классификации, принятой в России, положенодвухзначное обозначение; вначале указывается катион,
преимущественно входящий в решетку цеолита (K, Nа, Са), а затем
тип кристаллической решетки цеолита (А или Х). Если калиевая,
магниевая или иная форма цеолита получена из натриевой и
катионный обмен проведен не полностью, цеолит обозначают
KNaA, MgNaA и т.д.
Классификация цеолитов в США и ряде других стран
предусматривает указание определяющего размера цеолита
(диаметра входного окна). Это соответствие соблюдается, однако,
только для цеолитов типа А. В таблице приведена классификация и
характеристика цеолитов общего назначения.
Россия
KaA
NaA CaA CaX NaX
США
D входного окна, нм
3А
0,3
4А
0,4
5А
0,5
!0Х
0,8
13Х
0,9

















































































 chemistry
chemistry








