Similar presentations:
Реакционная способность химических соединений. Лекция 9
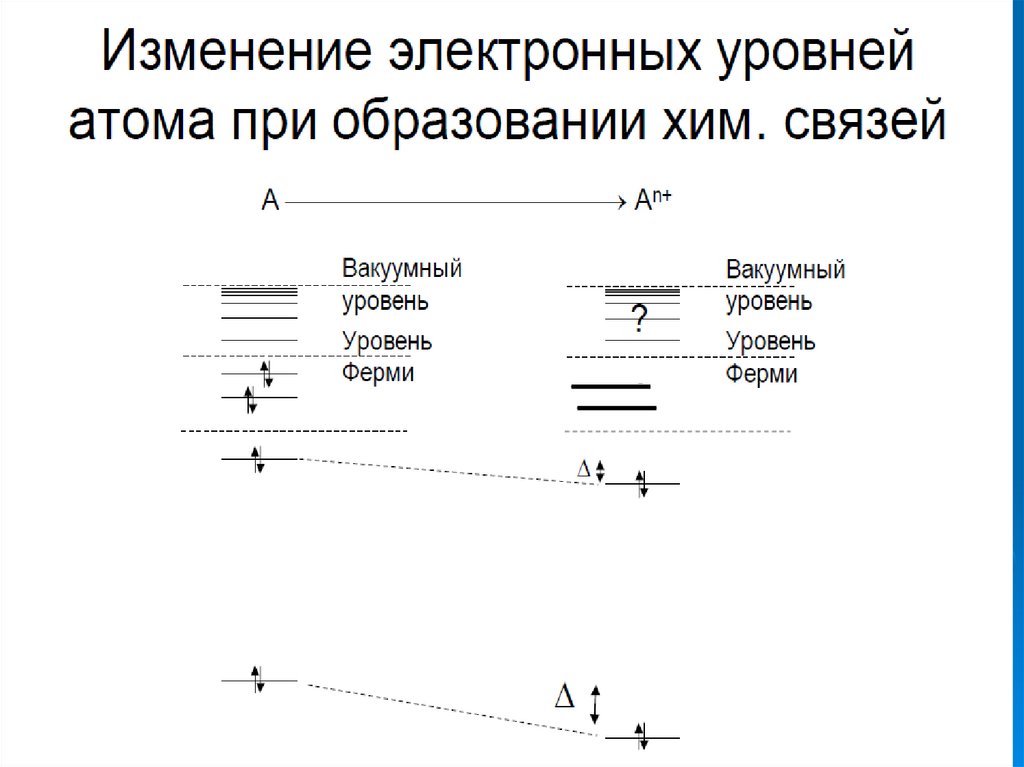
1.
Лекция 9Реакционная способность
химических соединений
Sir Christopher (Kelk)
Ingold 1893-1970
Kenichi Fukui
Roald Hoffmann
2.
B3.
(атом кислорода)4.
5.
6.
7.
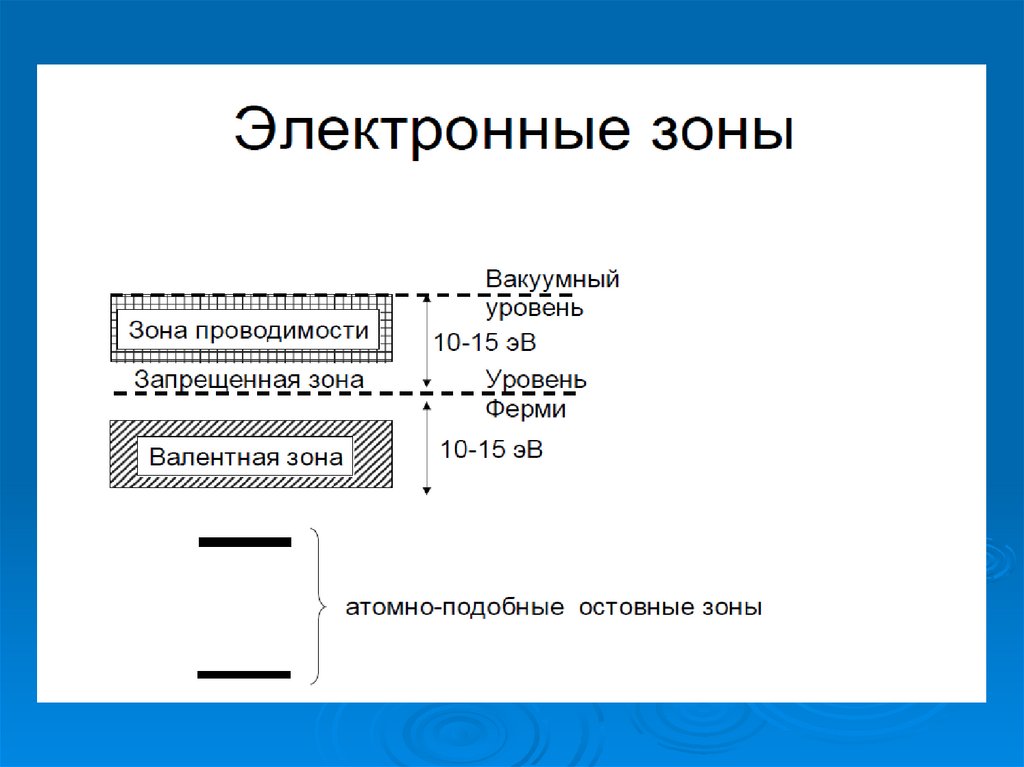
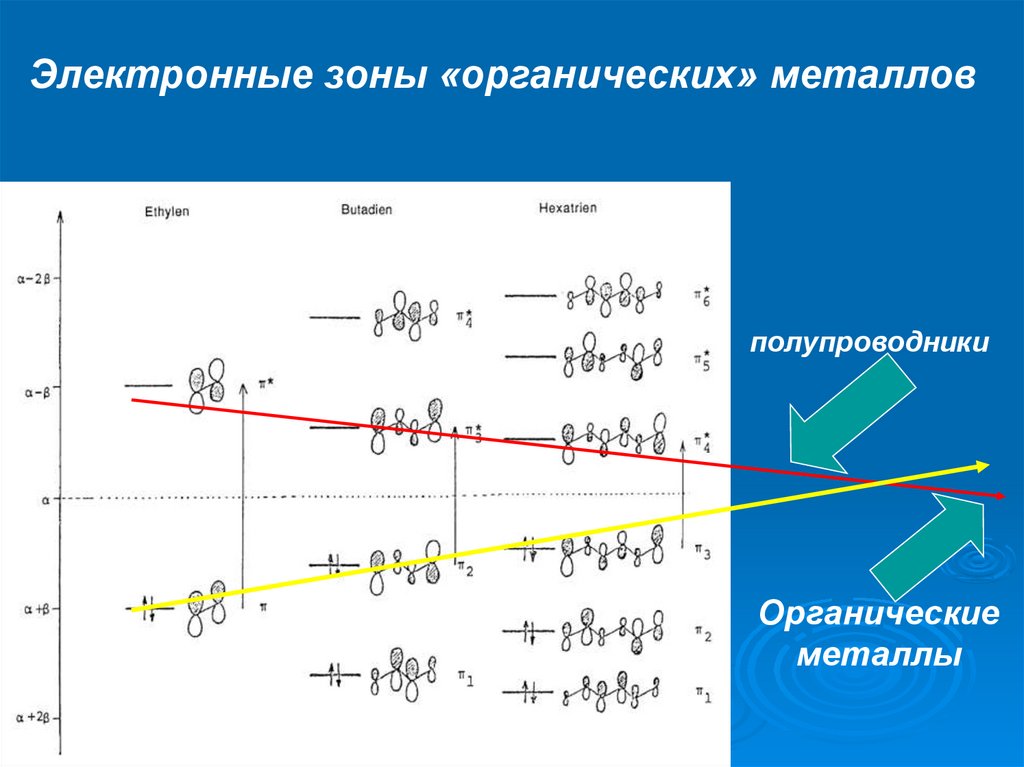
Электронные зоны «органических» металловполупроводники
Органические
металлы
8.
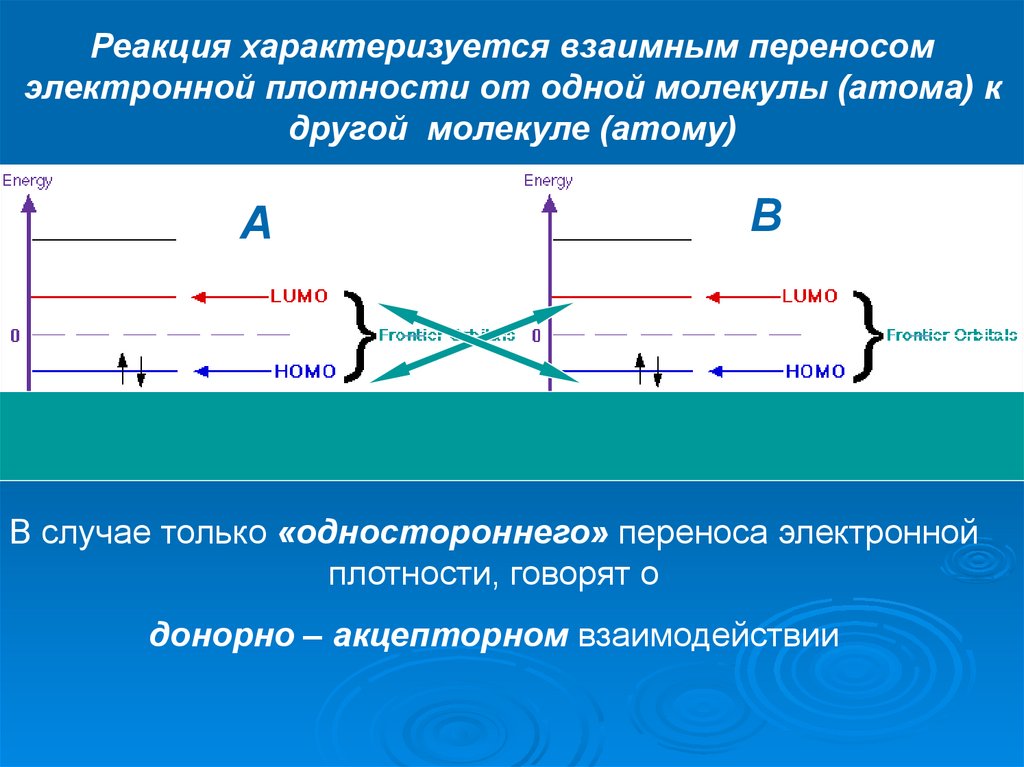
Реакция характеризуется взаимным переносомэлектронной плотности от одной молекулы (атома) к
другой молекуле (атому)
A
B
В случае только «одностороннего» переноса электронной
плотности, говорят о
донорно – акцепторном взаимодействии
9.
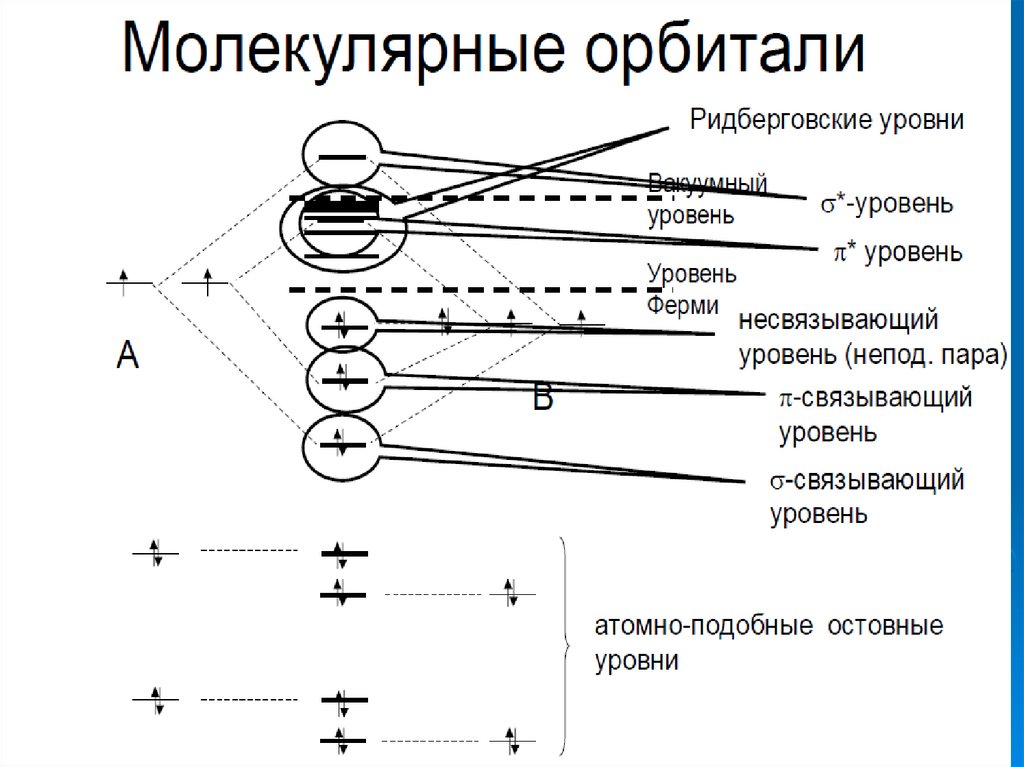
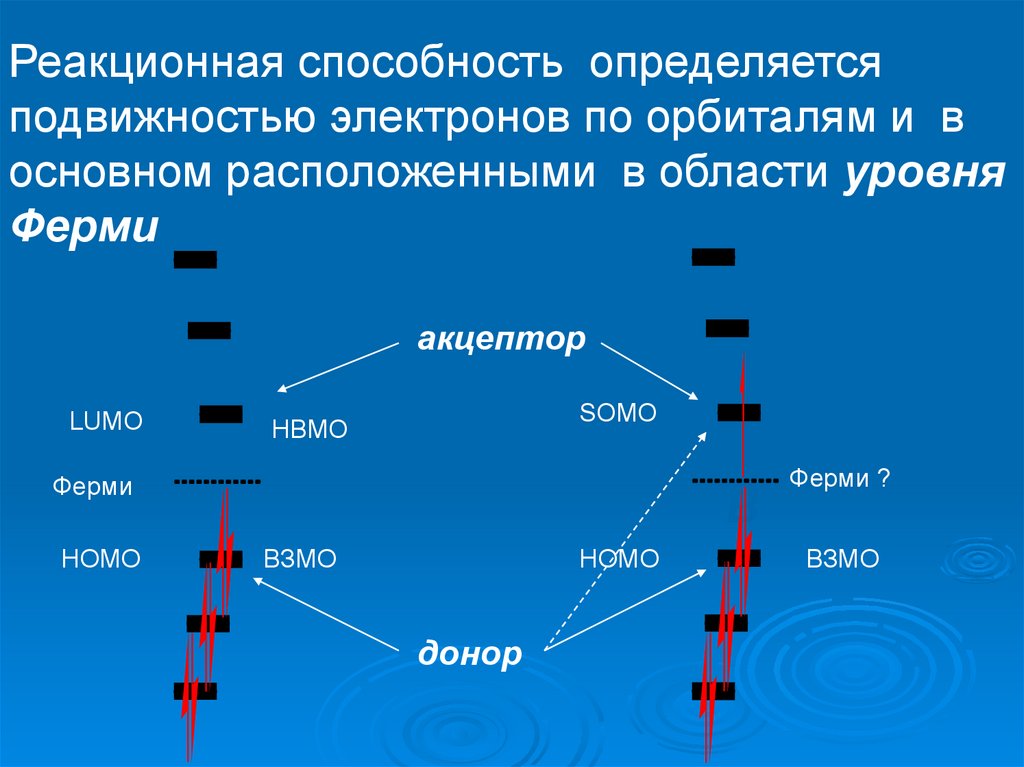
Реакционная способность определяетсяподвижностью электронов по орбиталям и в
основном расположенными в области уровня
Ферми
акцептор
LUMO
SOMO
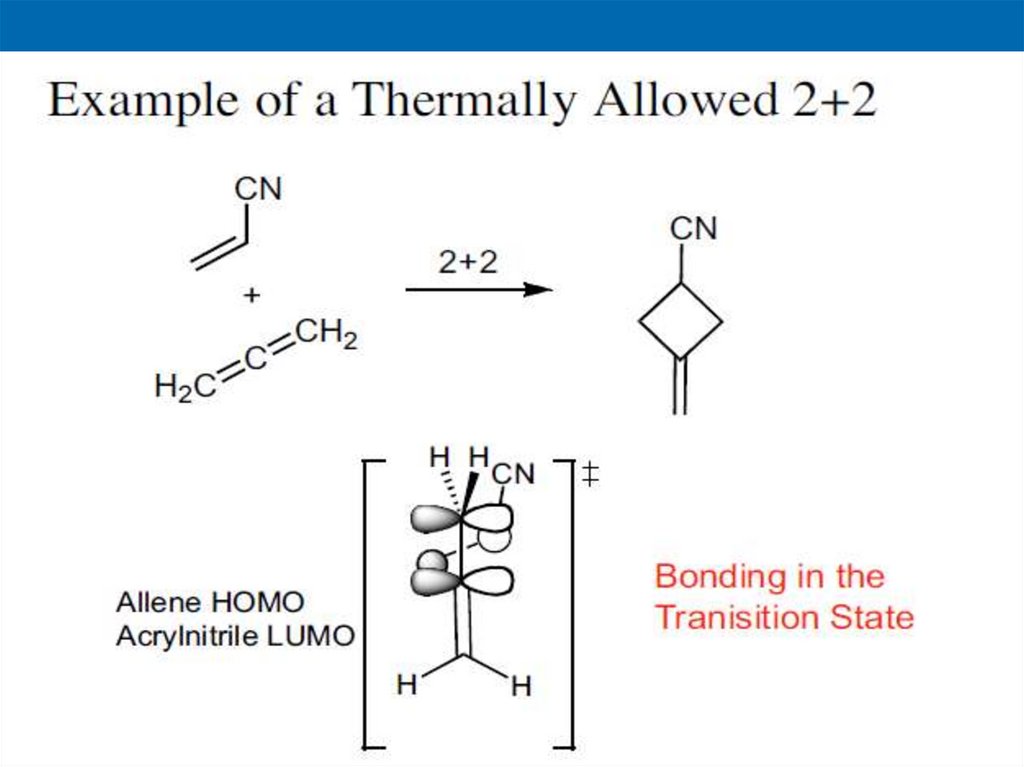
НВМО
Ферми
HOMO
B
ВЗМО
HOMO
донор
Ферми ?
ВЗMO
10.
Свойства валентных электронных уровней (10 –15 эВ ниже уровня Ферми) и вакантных
электронных уровней (10 – 15 эВ выше уровня
Ферми) определяют большинство практически
важных свойств атомов, молекул и веществ –
- реакционная способность,
- электрофизические свойства,
- магнитные свойства,
- окраска и т.д.
11.
Очевидно,что реакционная способность молекул
зависит от расположения (т.е. энергии)
МО
надо только освободить молекулу,
«отпустить» привязь
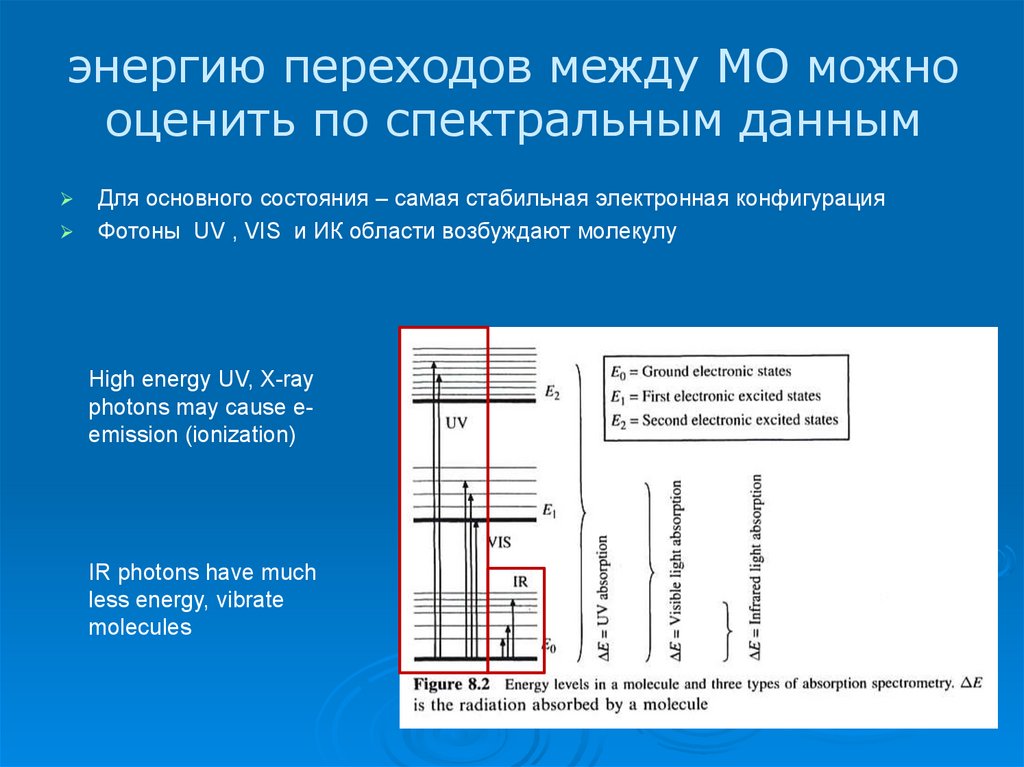
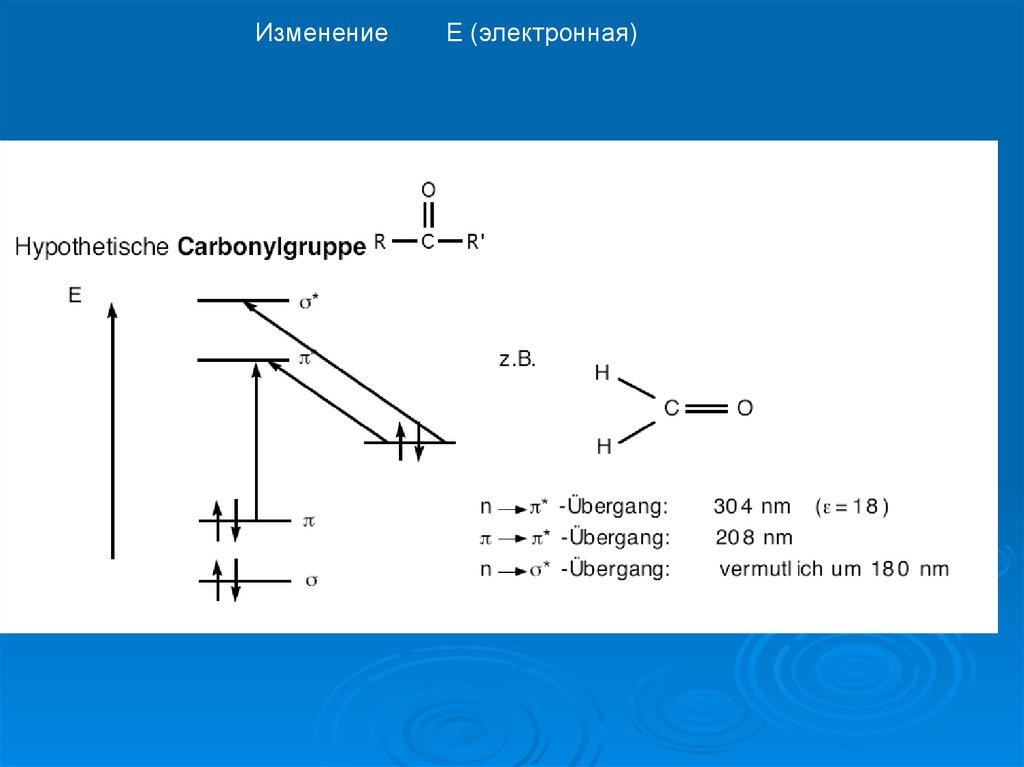
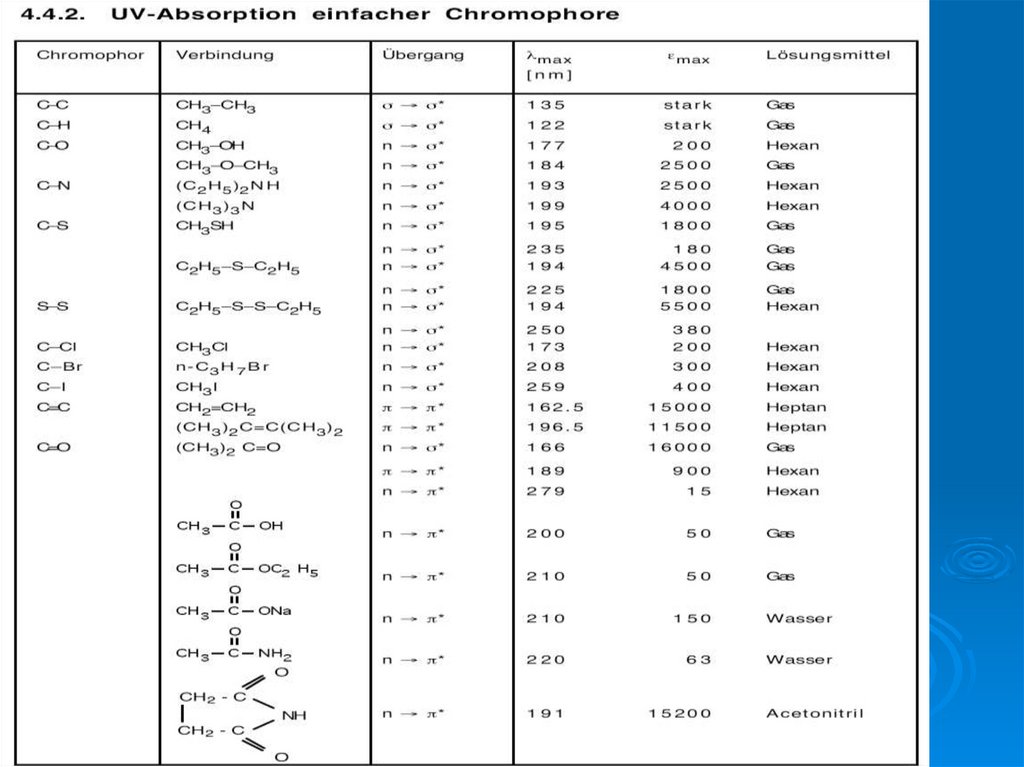
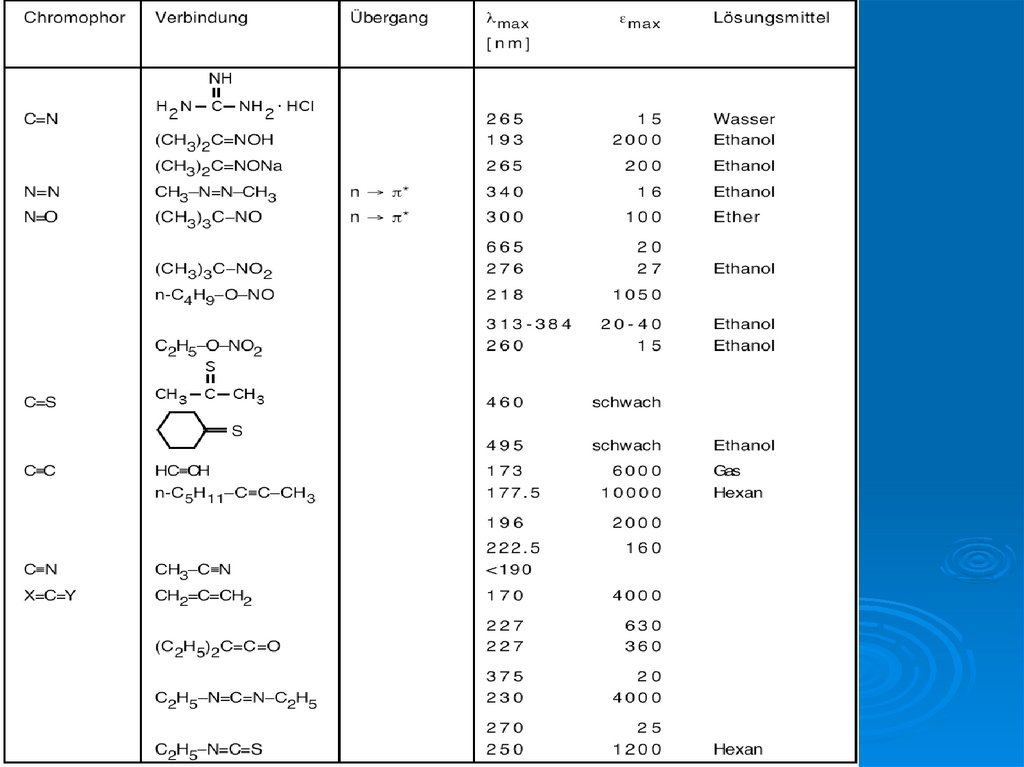
12. энергию переходов между МО можно оценить по спектральным данным
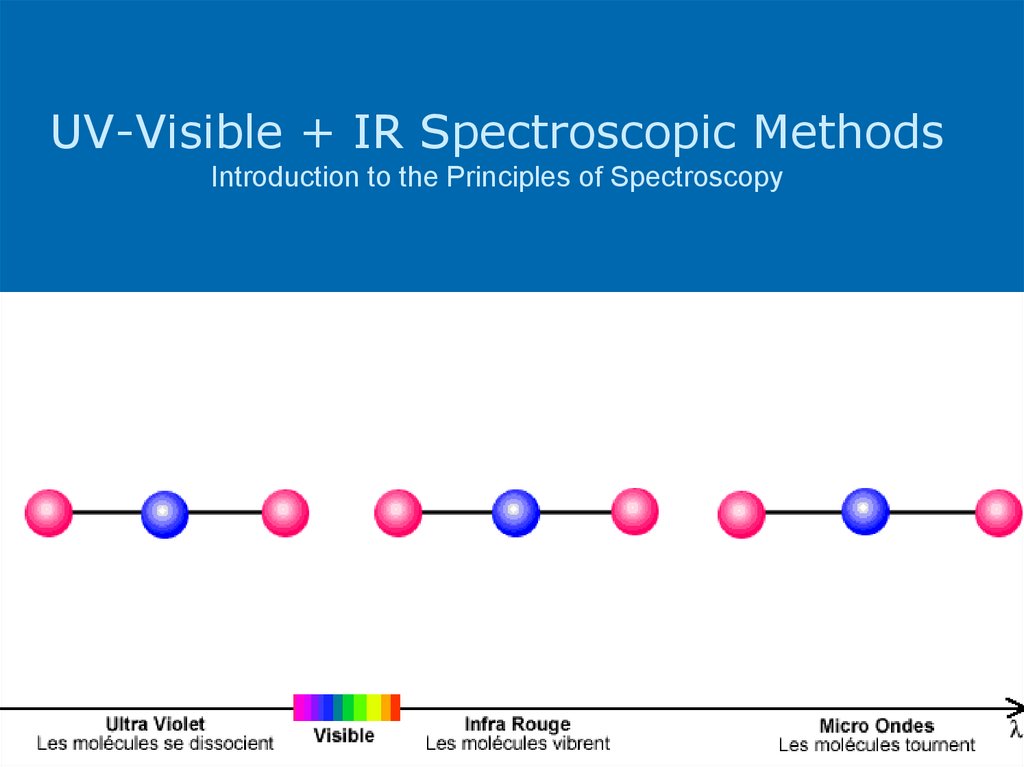
Для основного состояния – самая стабильная электронная конфигурацияФотоны UV , VIS и ИК области возбуждают молекулу
High energy UV, X-ray
photons may cause eemission (ionization)
IR photons have much
less energy, vibrate
molecules
13. UV-Visible + IR Spectroscopic Methods Introduction to the Principles of Spectroscopy
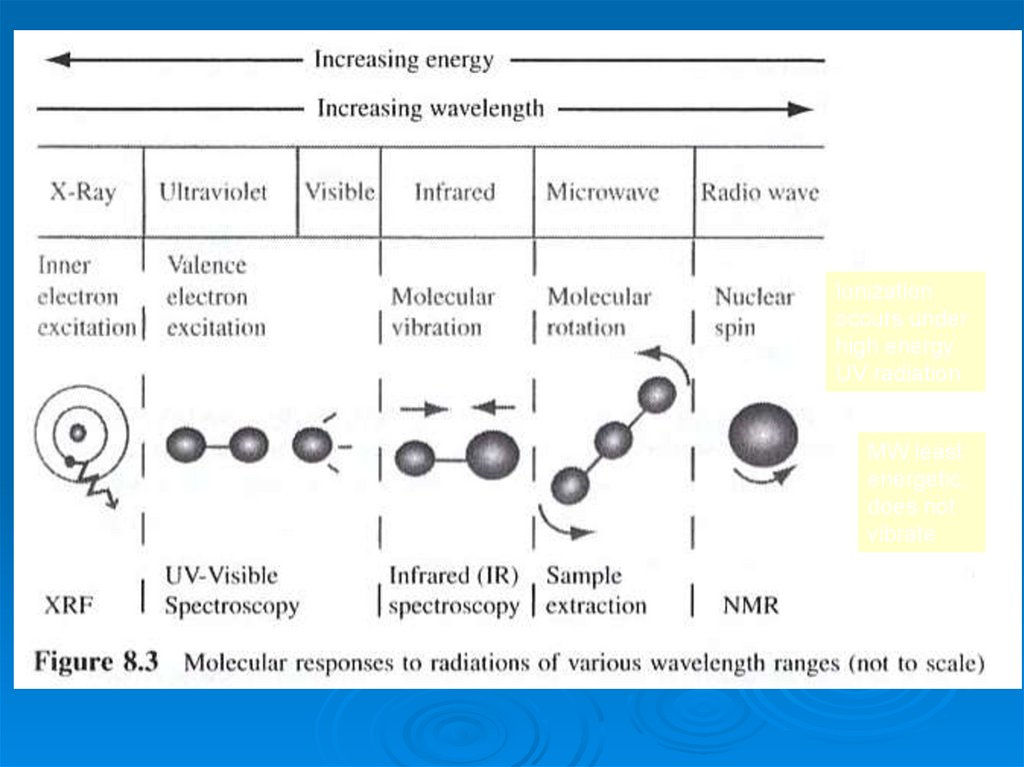
14. UV-Visible + IR Spectroscopic Methods Introduction to the Principles of Spectroscopy
Ionizationoccurs under
high energy
UV radiation
MW least
energetic,
does not
vibrate
15.
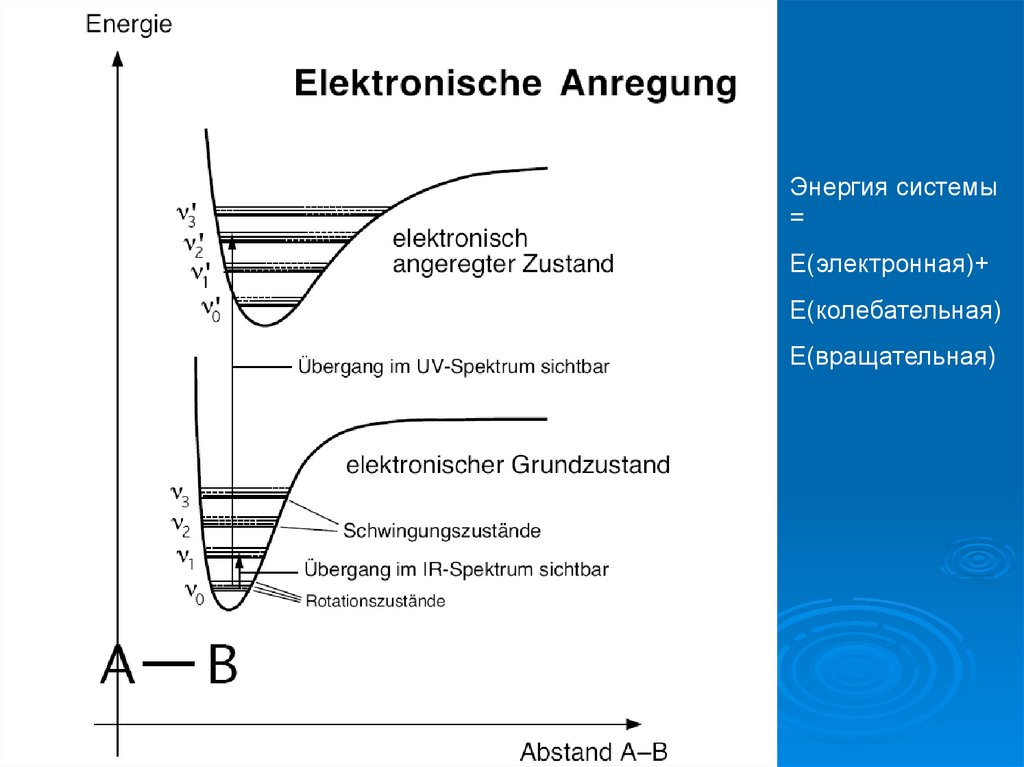
Энергия системы=
Е(электронная)+
Е(колебательная)
Е(вращательная)
16.
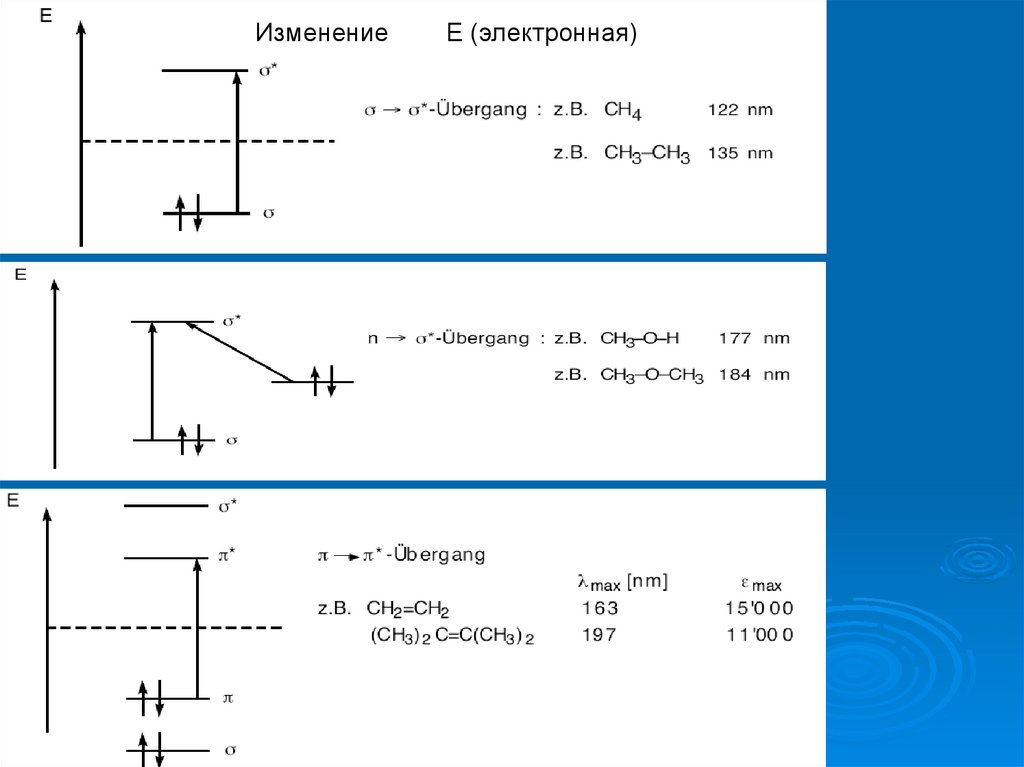
ИзменениеЕ (электронная)
17.
ИзменениеЕ (электронная)
18.
19.
20.
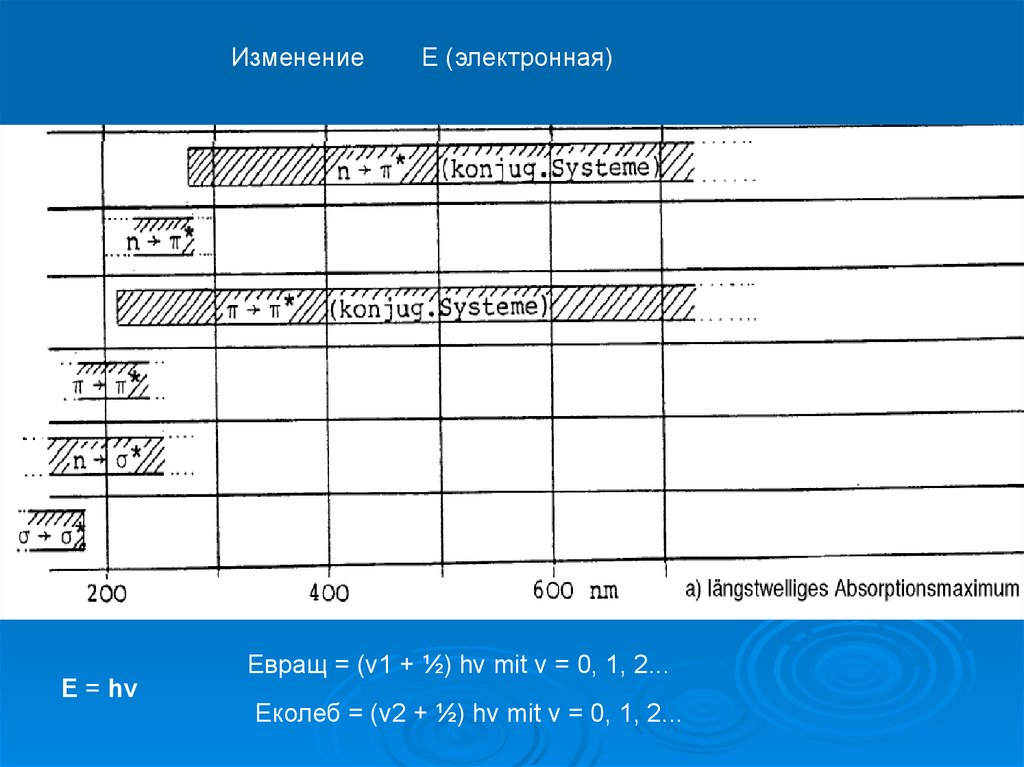
ИзменениеE = hν
Е (электронная)
Eвращ = (v1 + ½) hν mit v = 0, 1, 2...
Eколеб = (v2 + ½) hν mit v = 0, 1, 2...
21.
22.
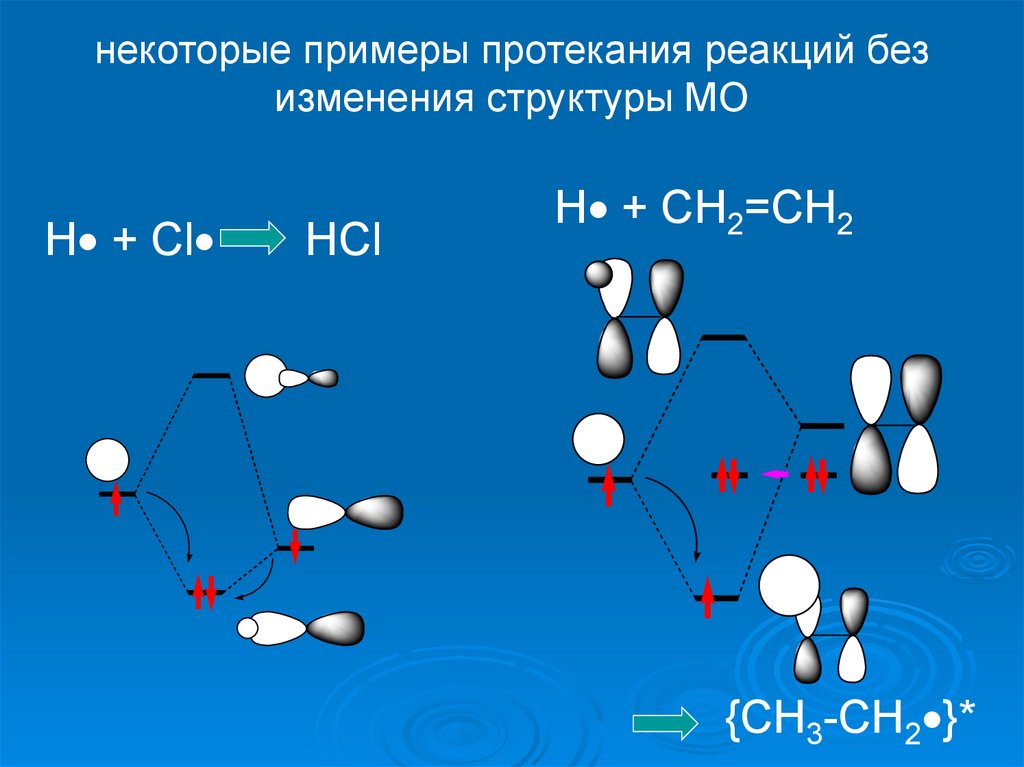
некоторые примеры протекания реакций безизменения структуры МО
H + Cl =
HCl
H + CH2=CH2
{CH3-CH2 }*
23.
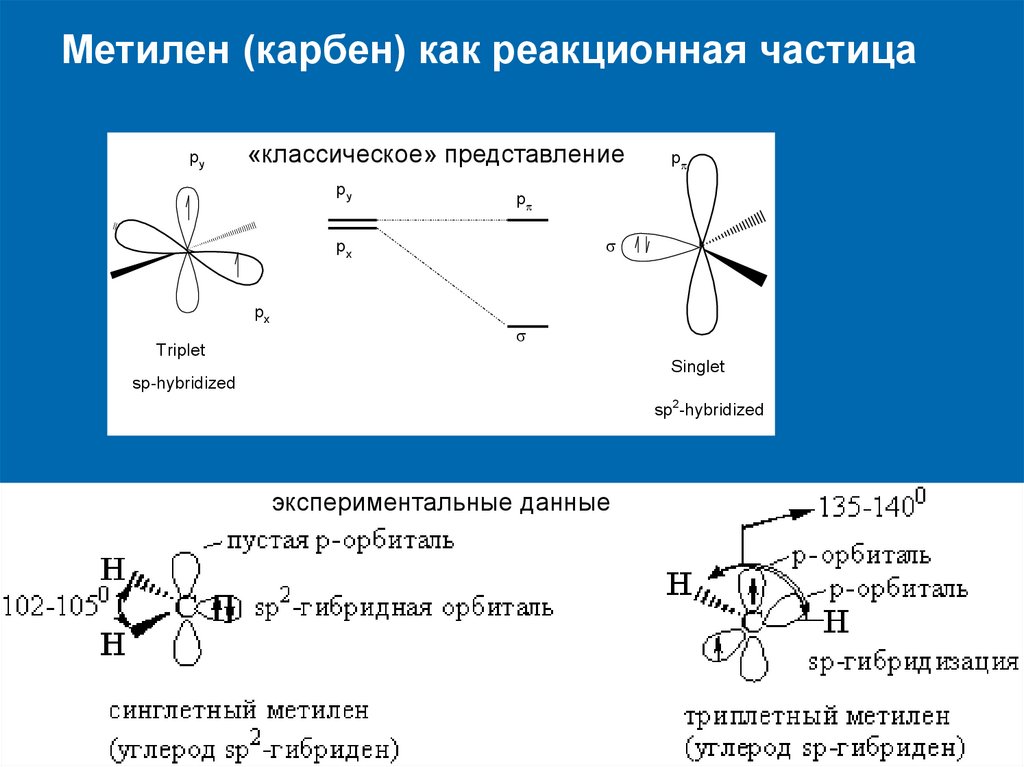
Метилен (карбен) как реакционная частицаpy
«классическое» представление
py
p
px
px
Triplet
p
Singlet
sp-hybridized
sp2-hybridized
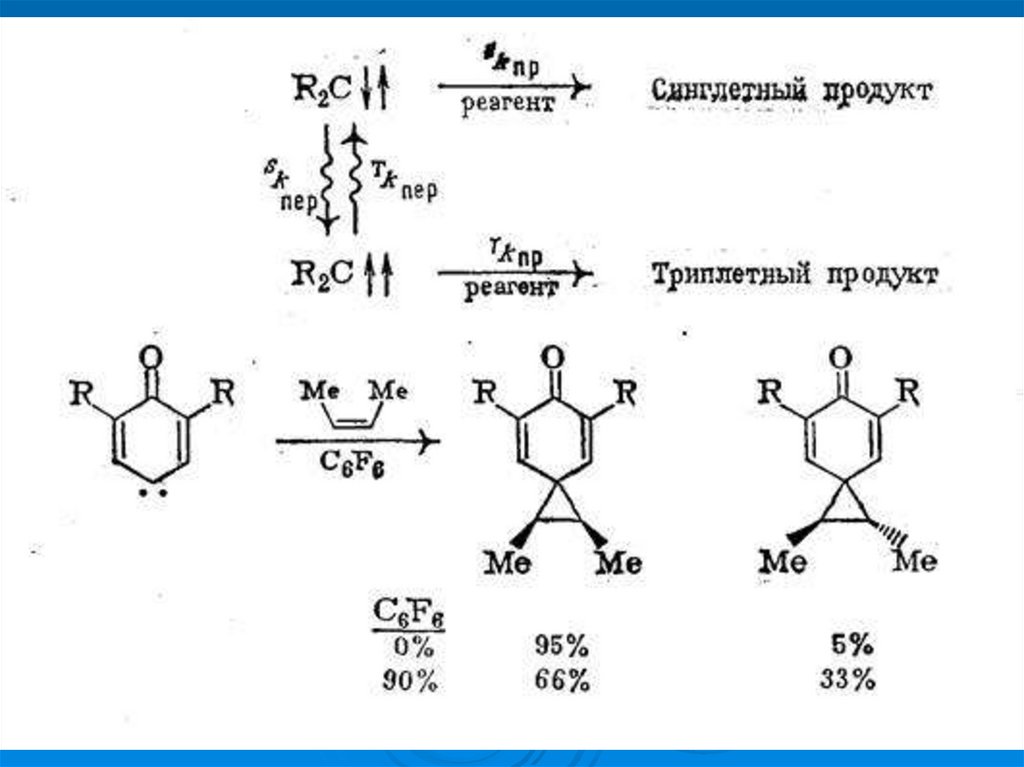
экспериментальные данные
24.
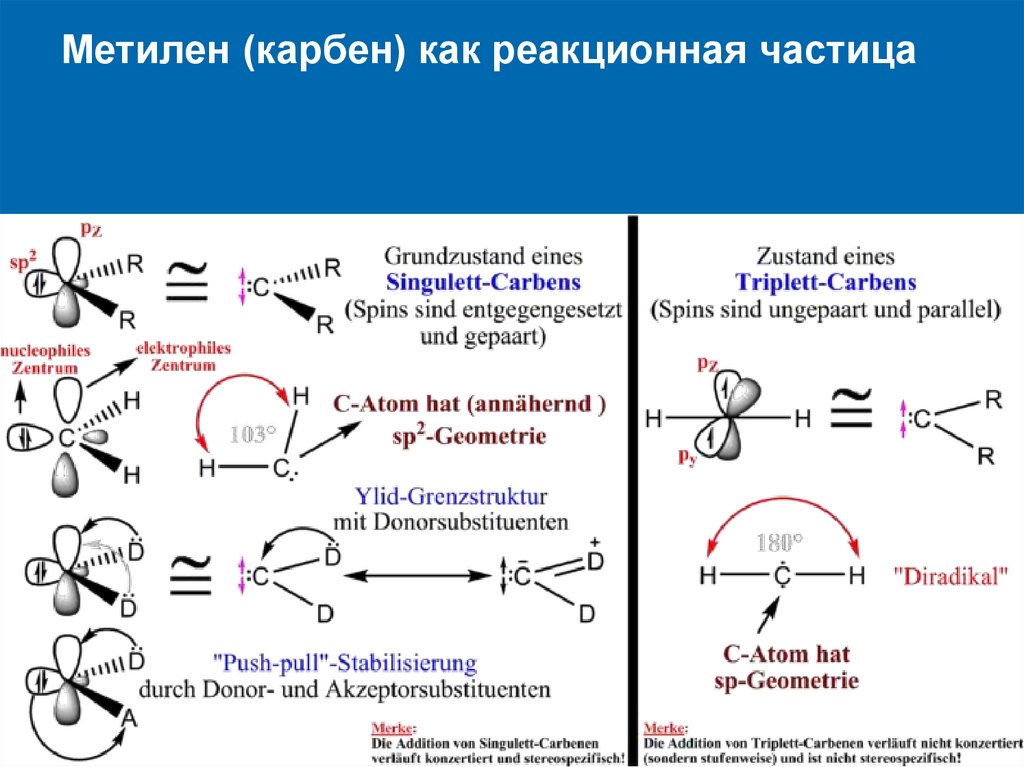
Метилен (карбен) как реакционная частица25.
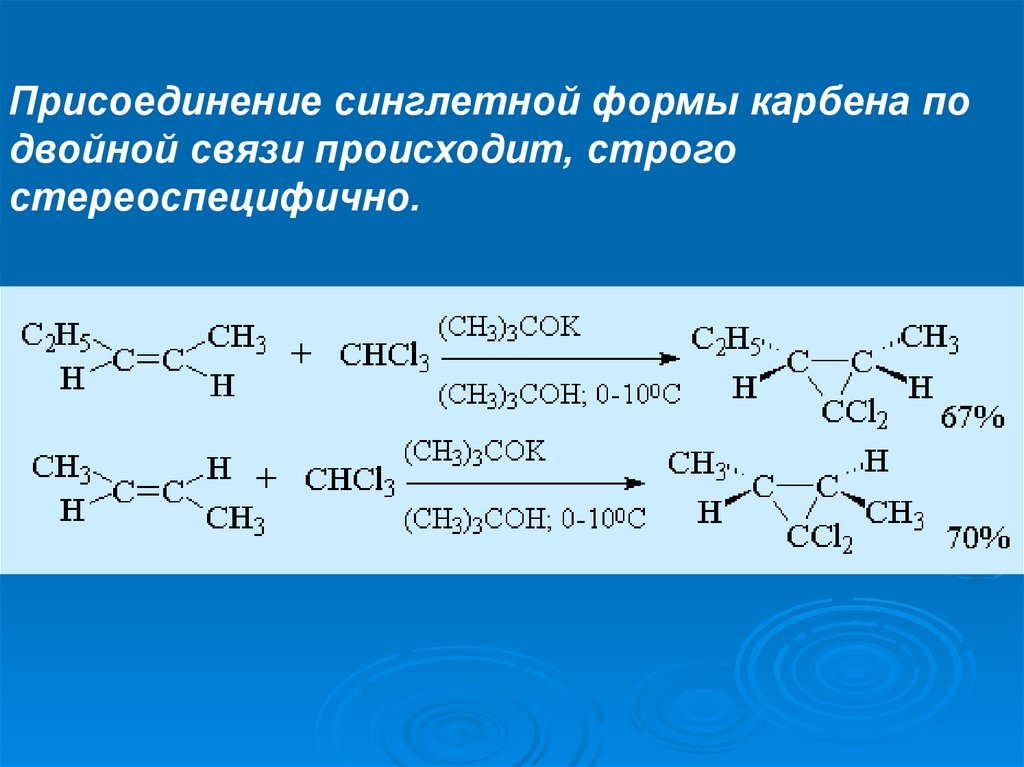
Присоединение синглетной формы карбена подвойной связи происходит, строго
стереоспецифично.
26.
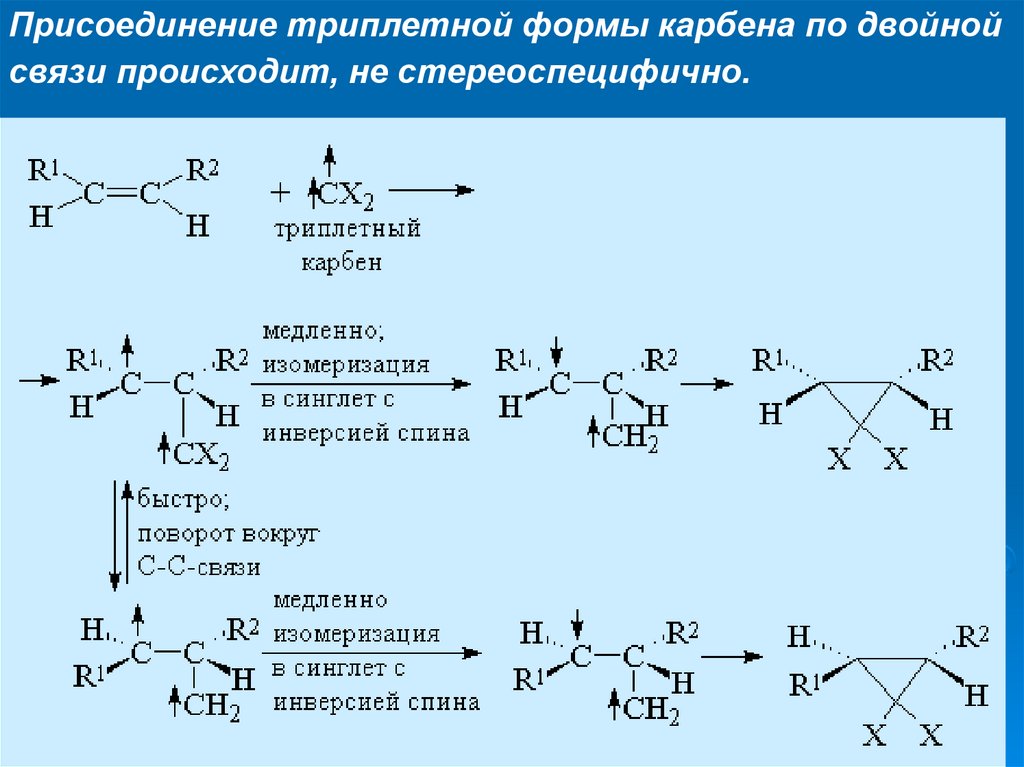
Присоединение триплетной формы карбена по двойнойсвязи происходит, не стереоспецифично.
27.
28.
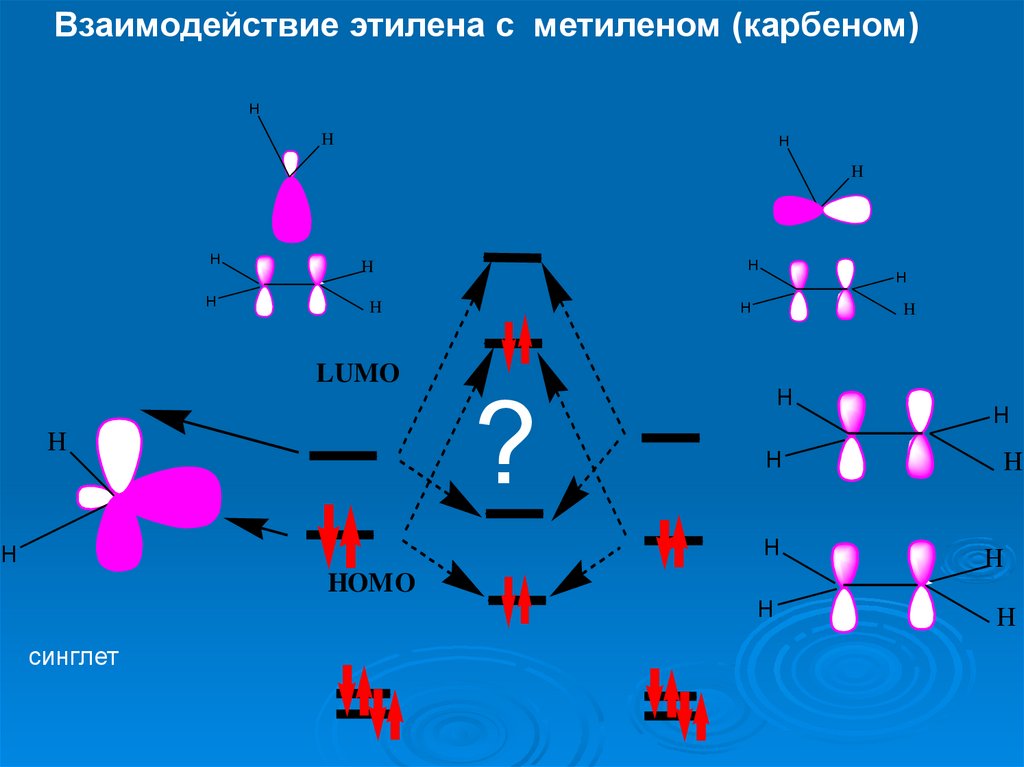
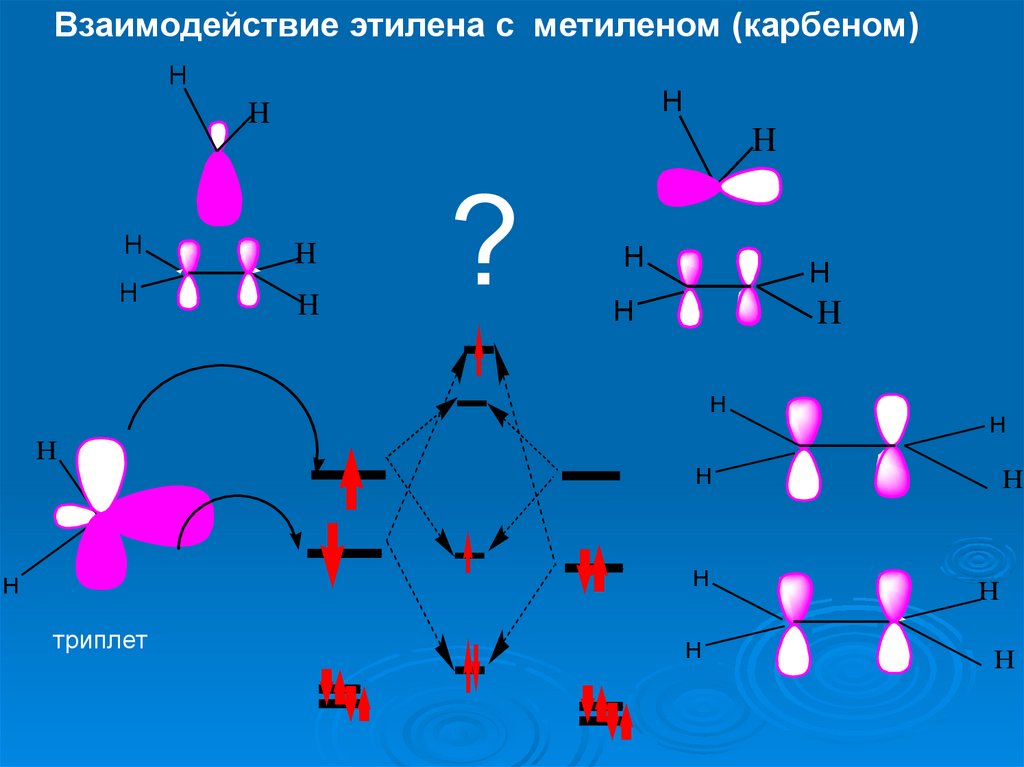
Взаимодействие этилена с метиленом (карбеном)H
H
H
H
H
H
H
H
H
H
H
H
LUMO
?
H
H
H
H
H
H
H
H
HOMO
H
синглет
H
29.
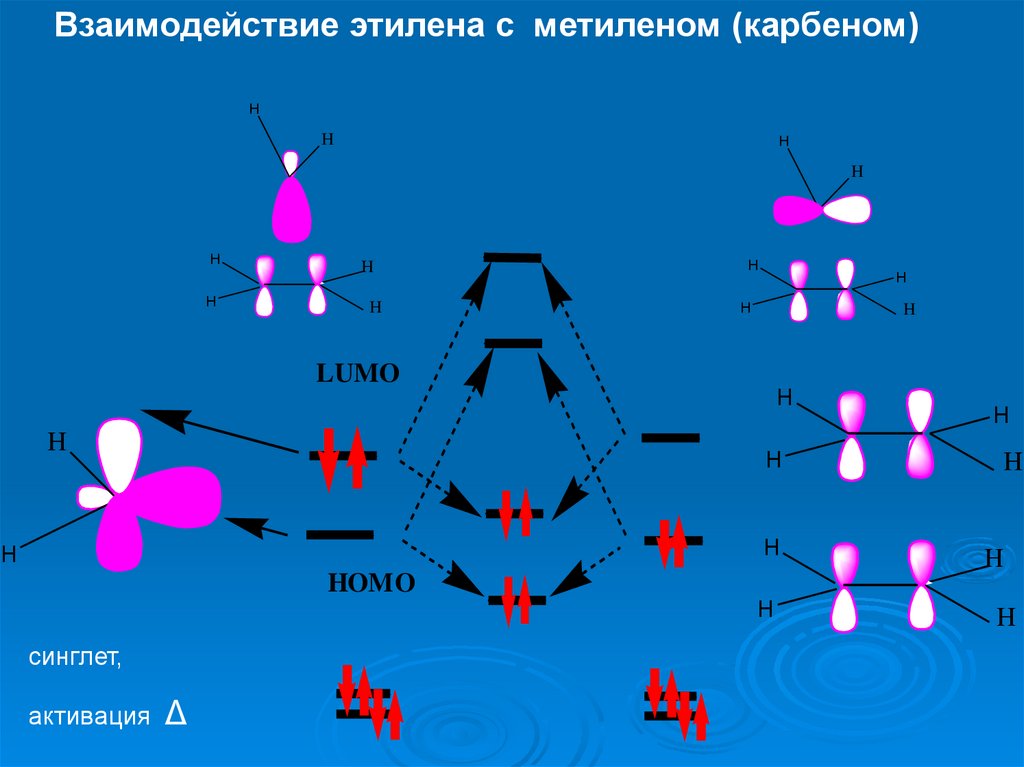
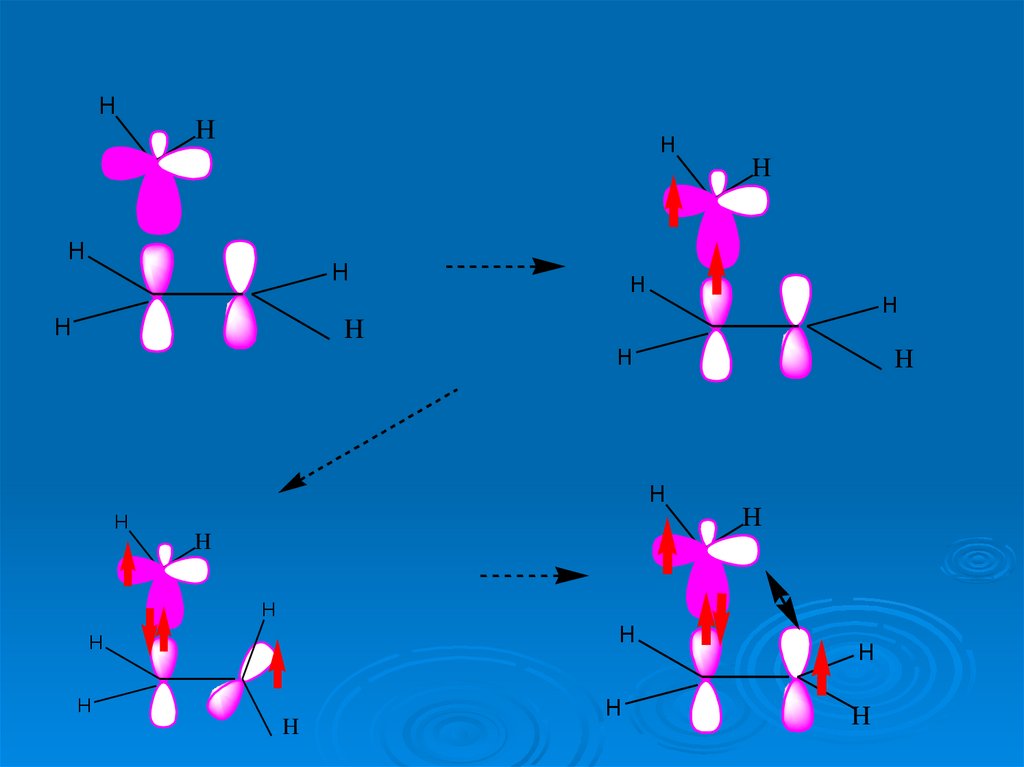
Взаимодействие этилена с метиленом (карбеном)H
H
H
H
H
H
H
H
H
H
H
H
LUMO
H
H
H
H
H
H
H
H
HOMO
H
синглет,
активация
Δ
H
30.
Взаимодействие этилена с метиленом (карбеном)H
H
H
H
H
H
H
H
?
H
H
H
H
H
H
H
H
H
H
триплет
H
H
H
H
31.
HH
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
32.
33.
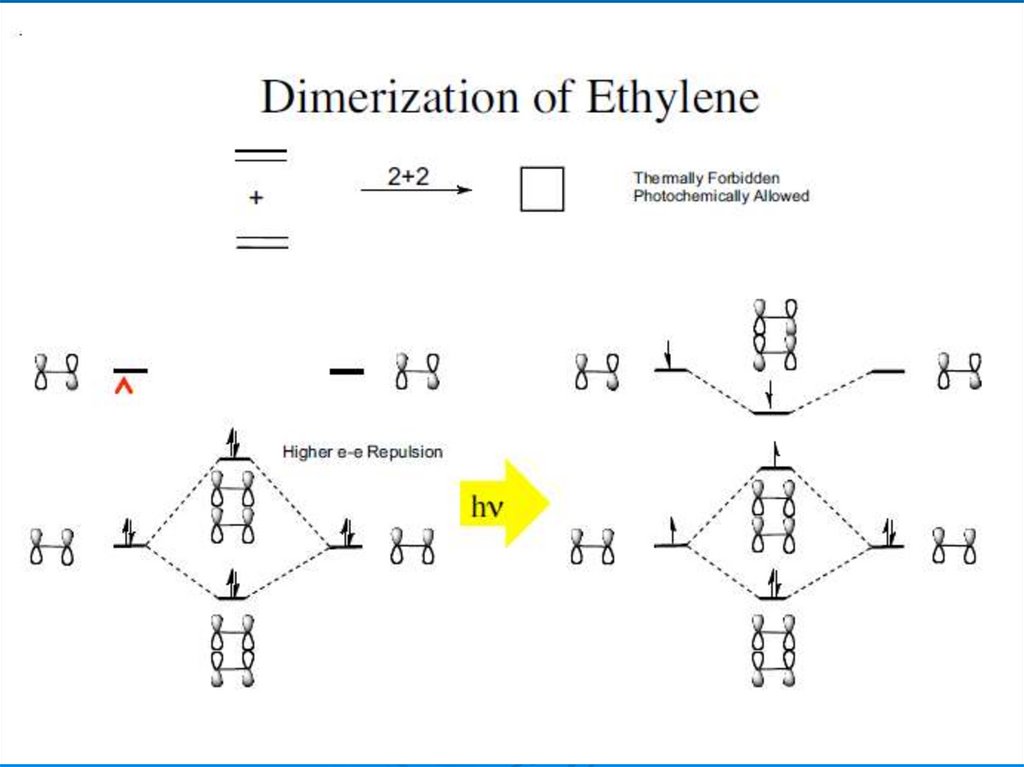
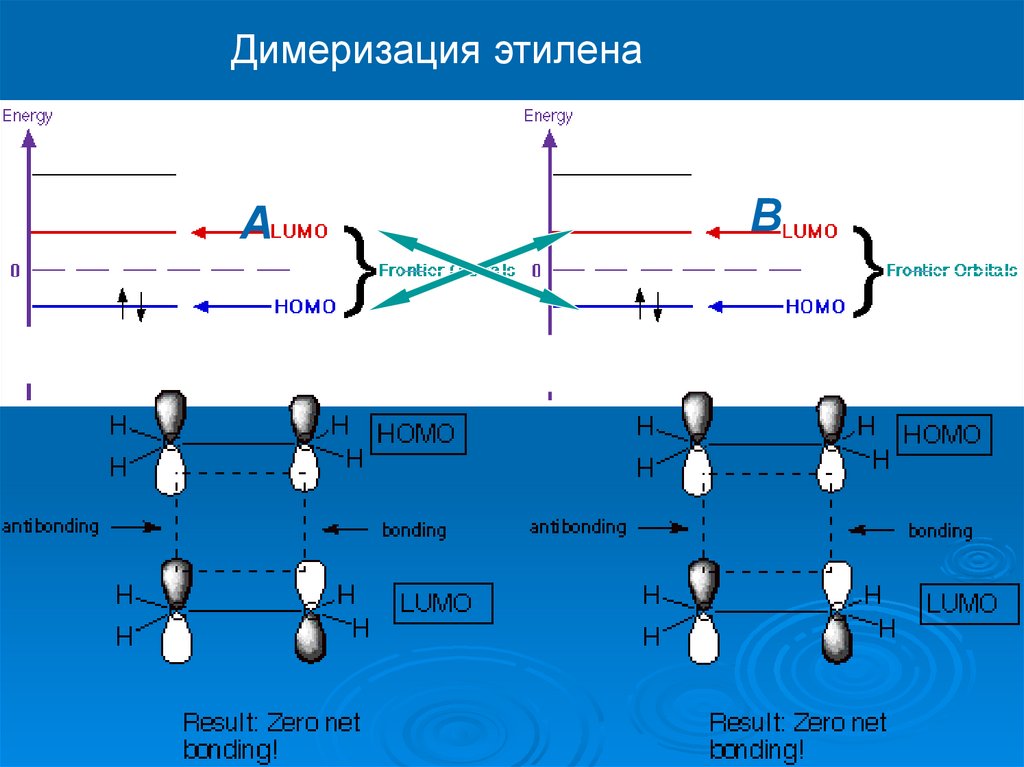
Димеризация этиленаA
B
34.
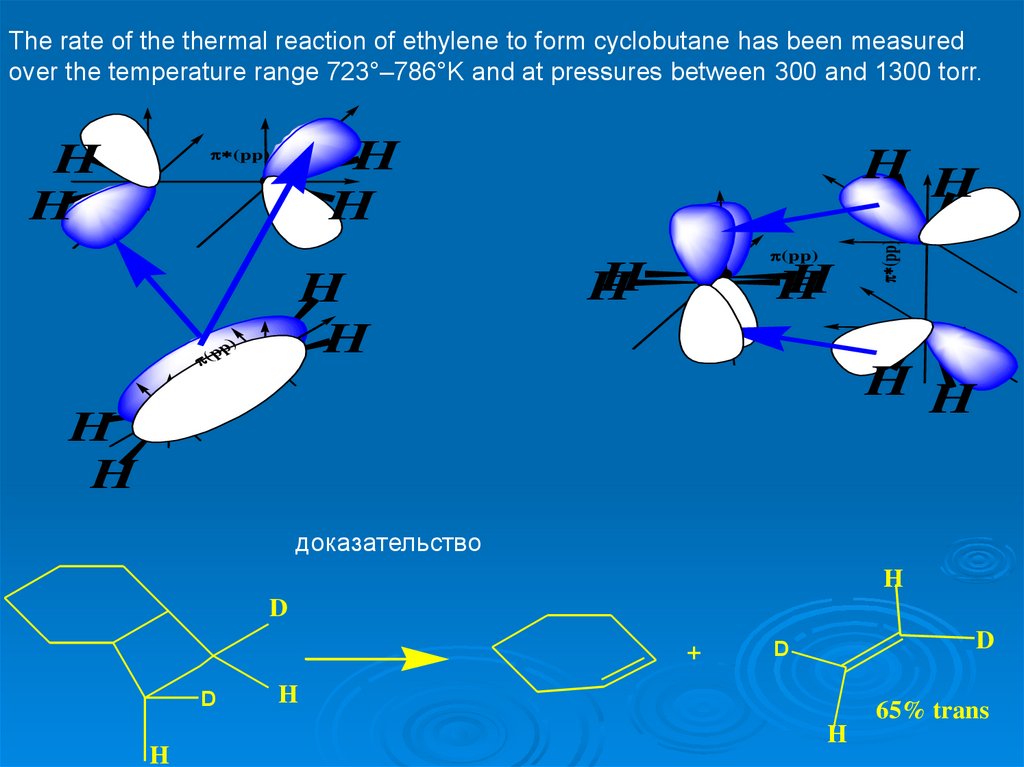
The rate of the thermal reaction of ethylene to form cyclobutane has been measuredover the temperature range 723°–786°K and at pressures between 300 and 1300 torr.
H
H
(pp)
(p
H
H
p)
H H
(pp)
H
H
H
H
(pp)
H
H
H H
H
H
доказательство
H
D
+
D
H
D
D
H
65% trans
H
35.
36.
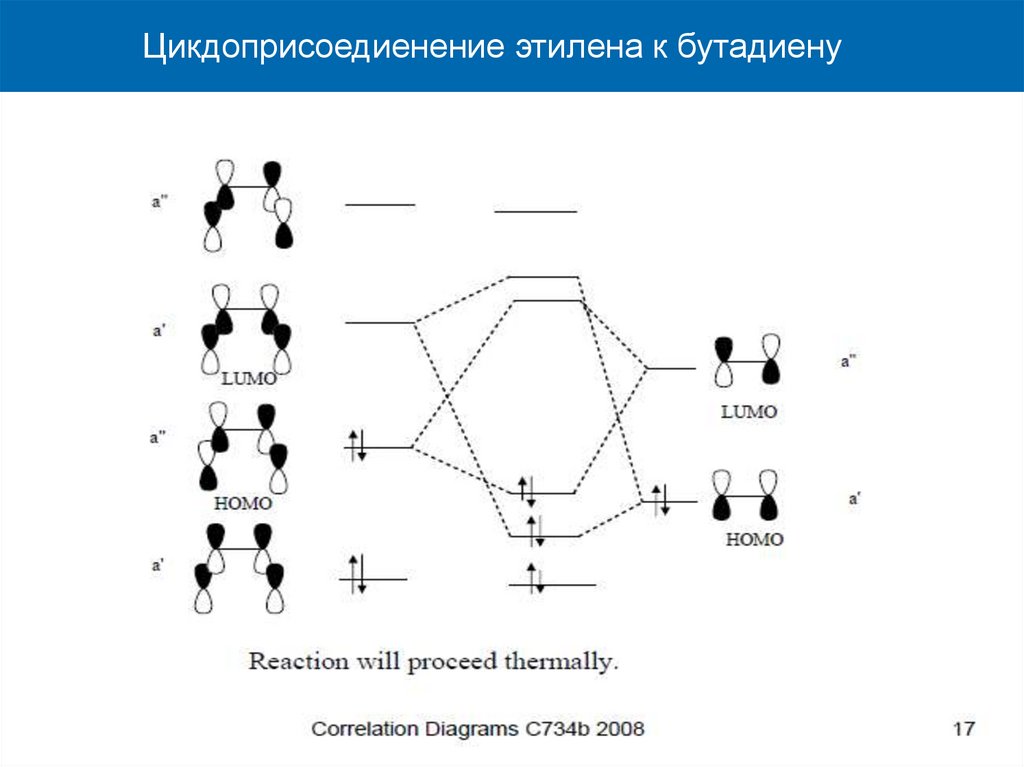
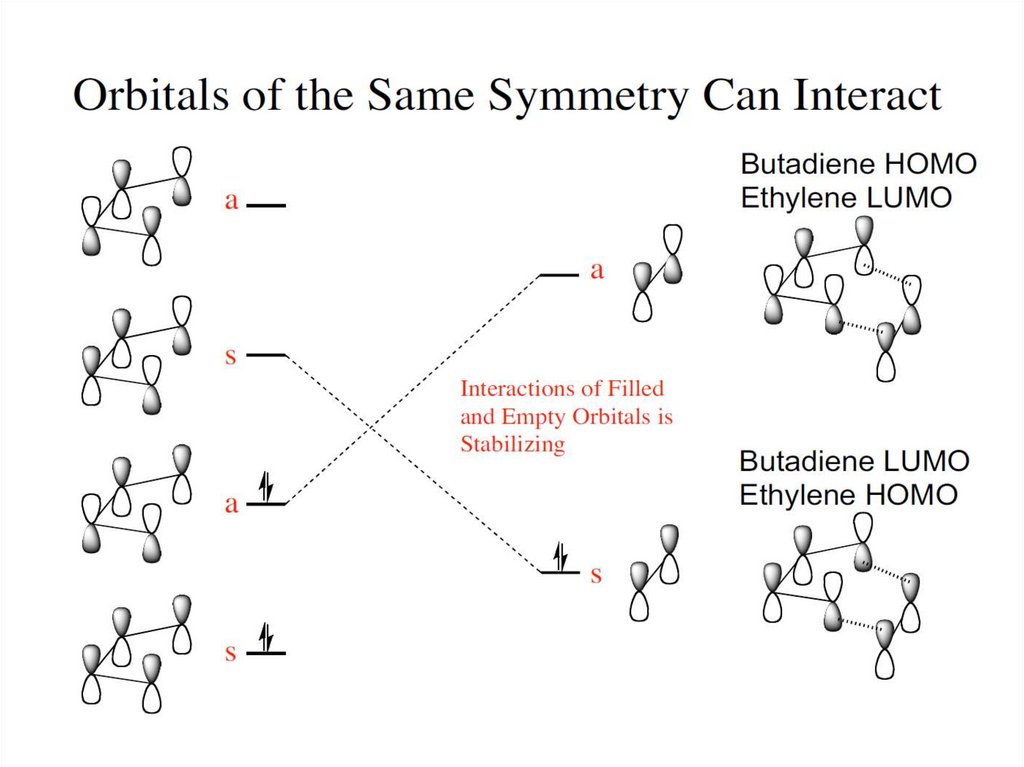
Цикдоприсоедиенение этилена к бутадиену37.
38.
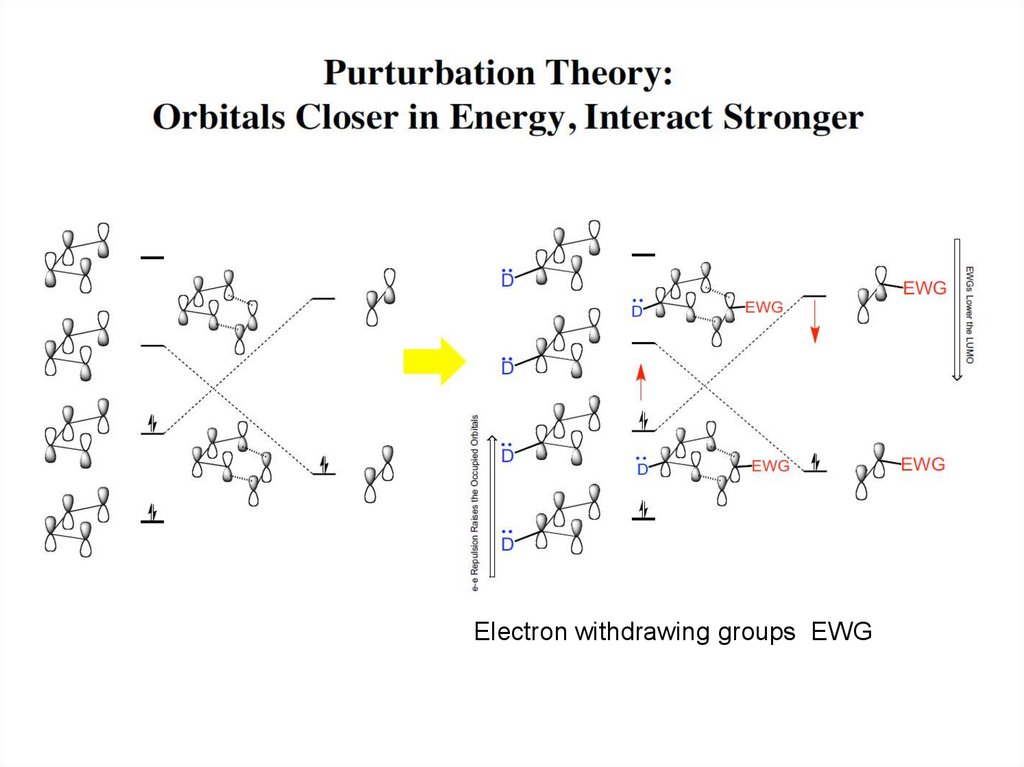
Electron withdrawing groups EWG39.
Однако,реакционная способность молекул
зависит не только от расположения МО,
но и от их строения
необходимо
дополнительное
возбуждение для
перестройки МО
40.
некоторые примеры протеканияреакций с изменением
структуры МО
41.
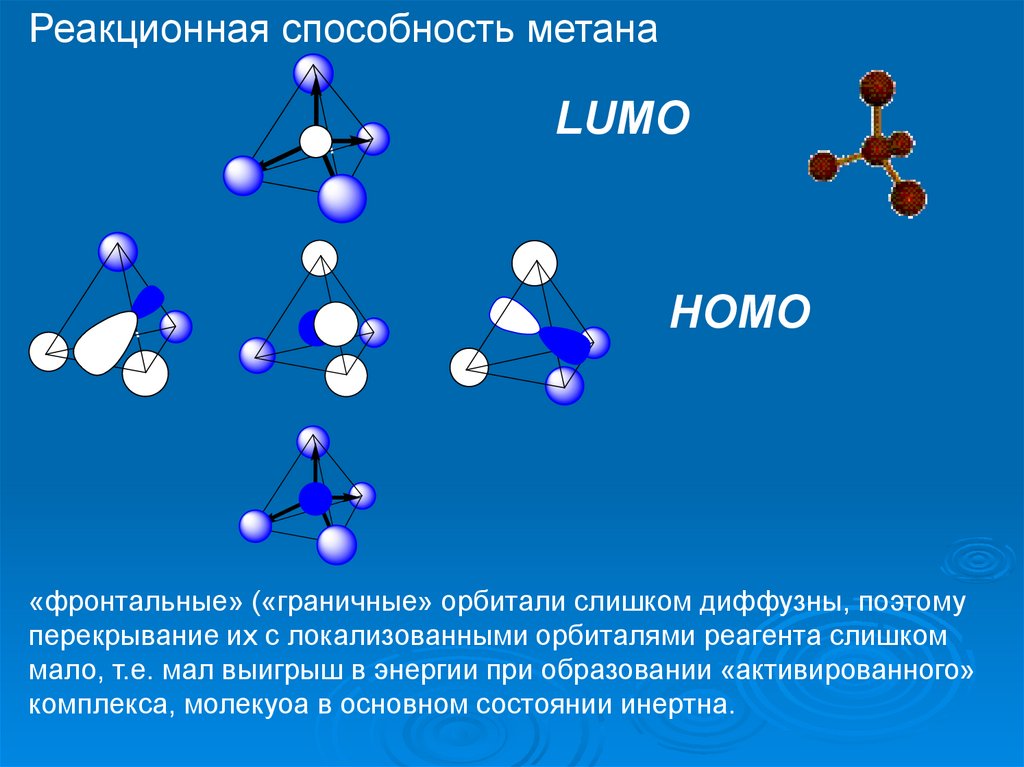
Реакционная способность метанаLUMO
HOMO
«фронтальные» («граничные» орбитали слишком диффузны, поэтому
перекрывание их с локализованными орбиталями реагента слишком
мало, т.е. мал выигрыш в энергии при образовании «активированного»
комплекса, молекуоа в основном состоянии инертна.
42.
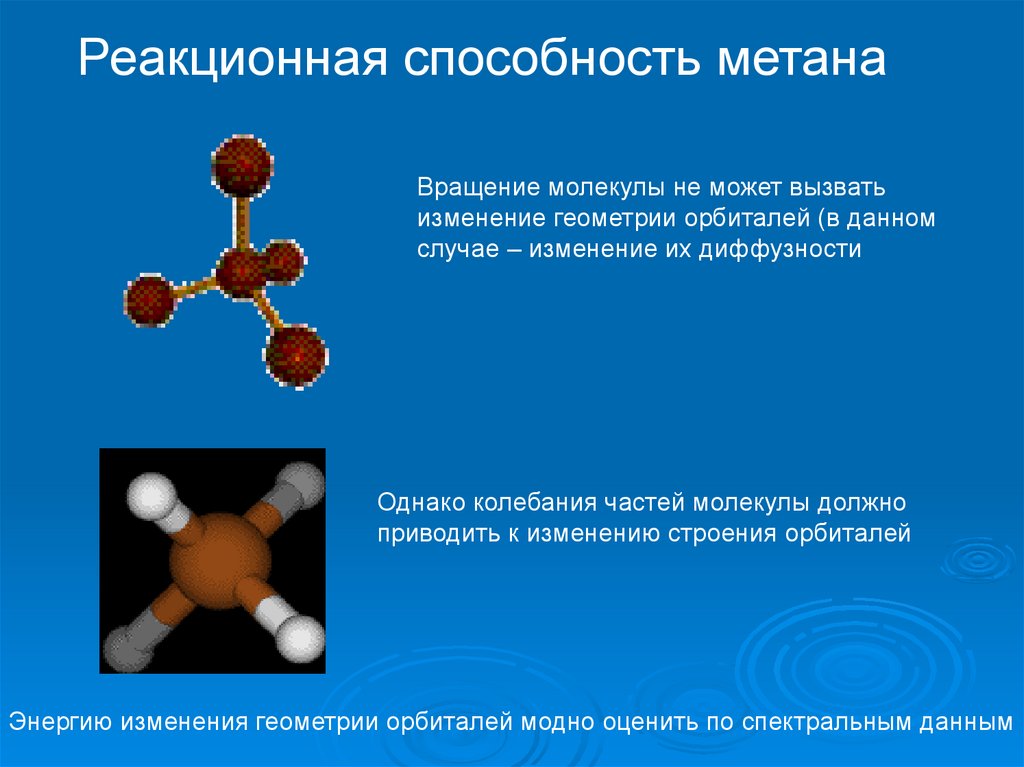
Реакционная способность метанаВращение молекулы не может вызвать
изменение геометрии орбиталей (в данном
случае – изменение их диффузности
Однако колебания частей молекулы должно
приводить к изменению строения орбиталей
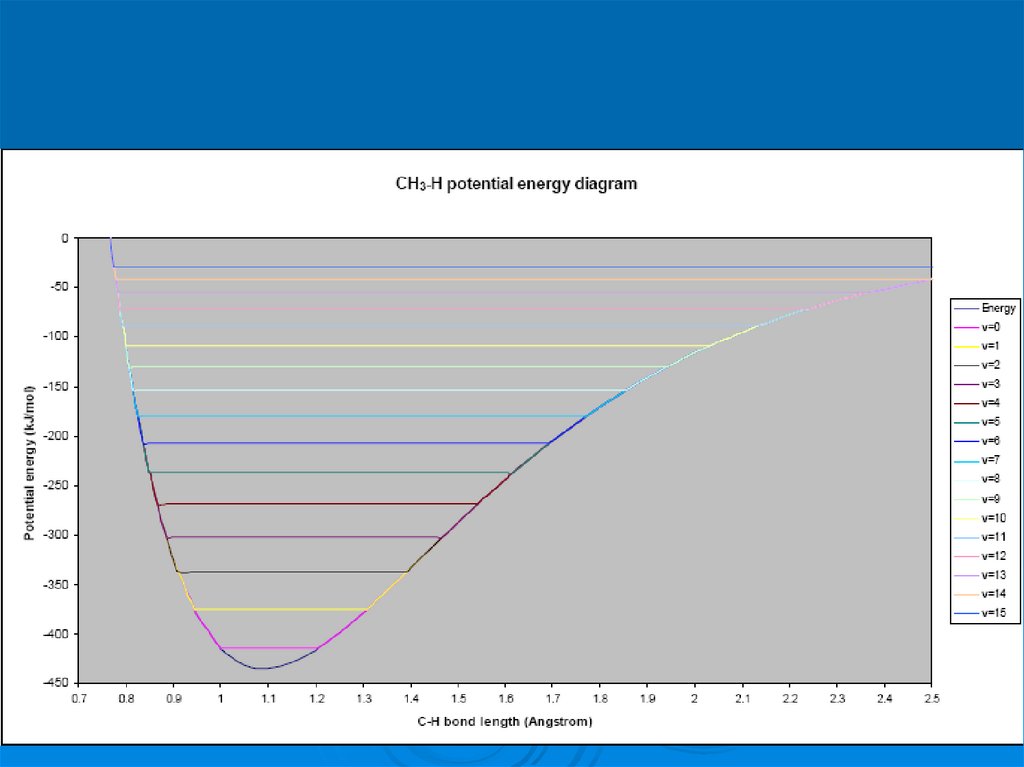
Энергию изменения геометрии орбиталей модно оценить по спектральным данным
43.
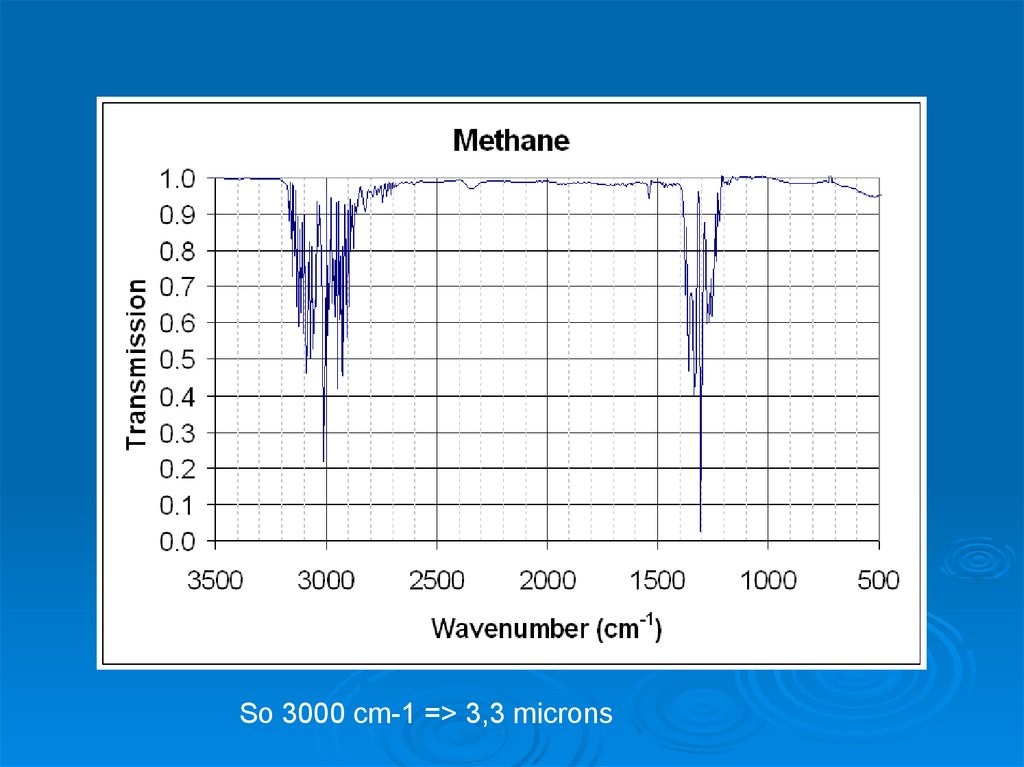
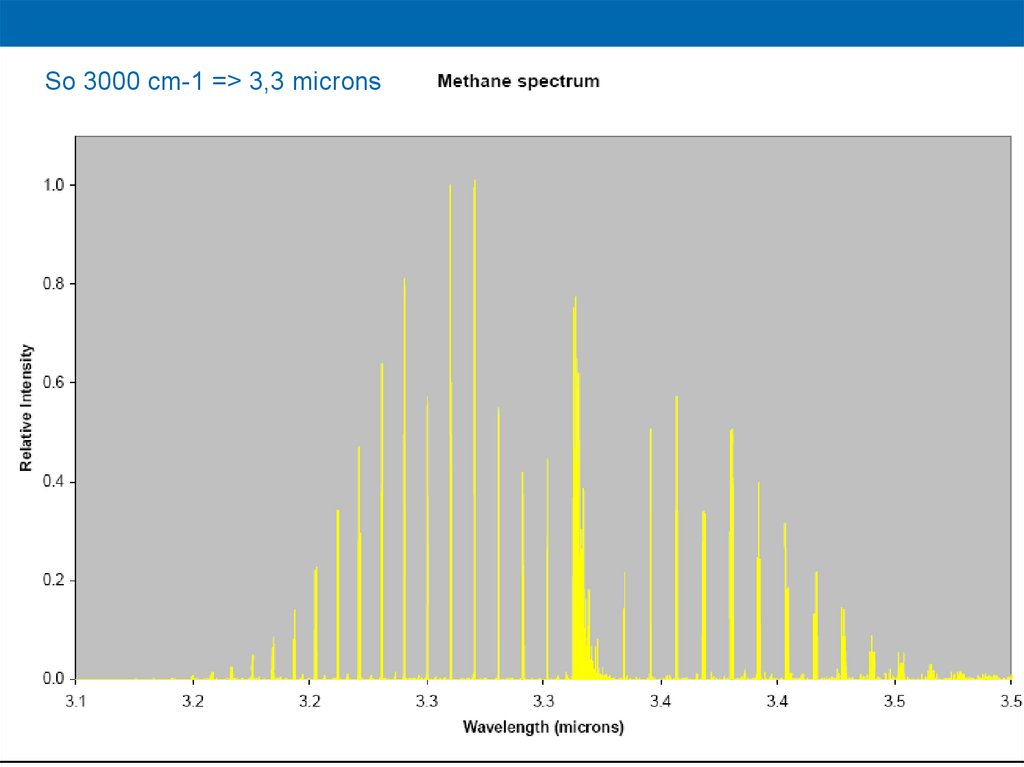
So 3000 cm-1 => 3,3 microns44.
45.
So 3000 cm-1 => 3,3 microns46.
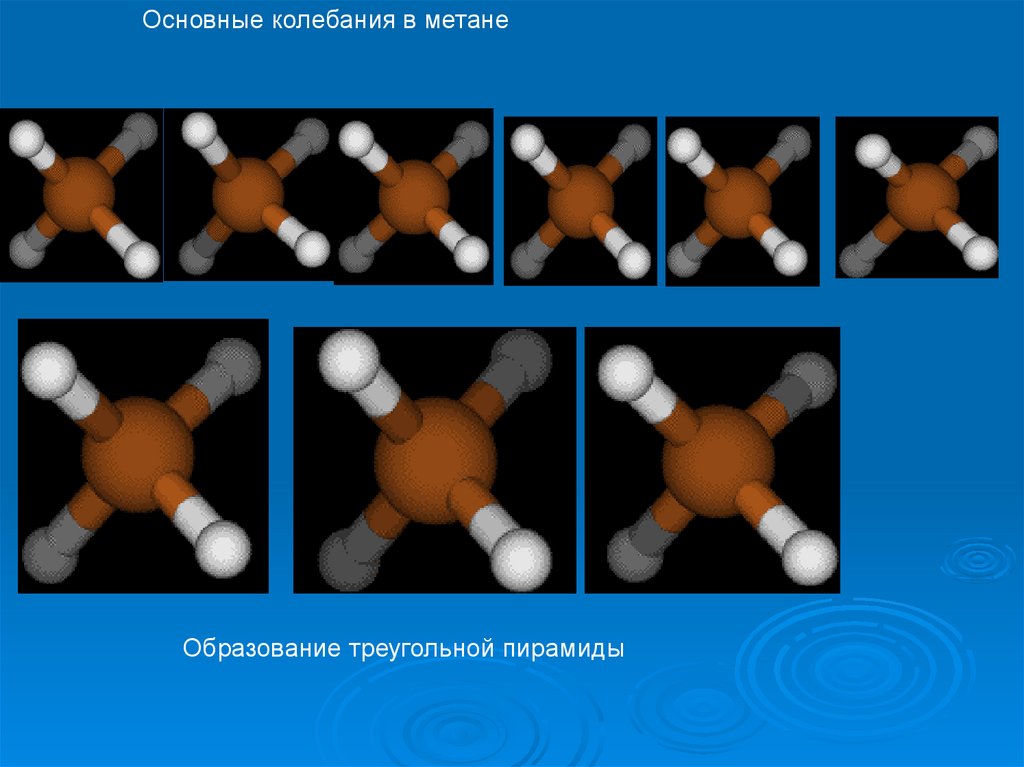
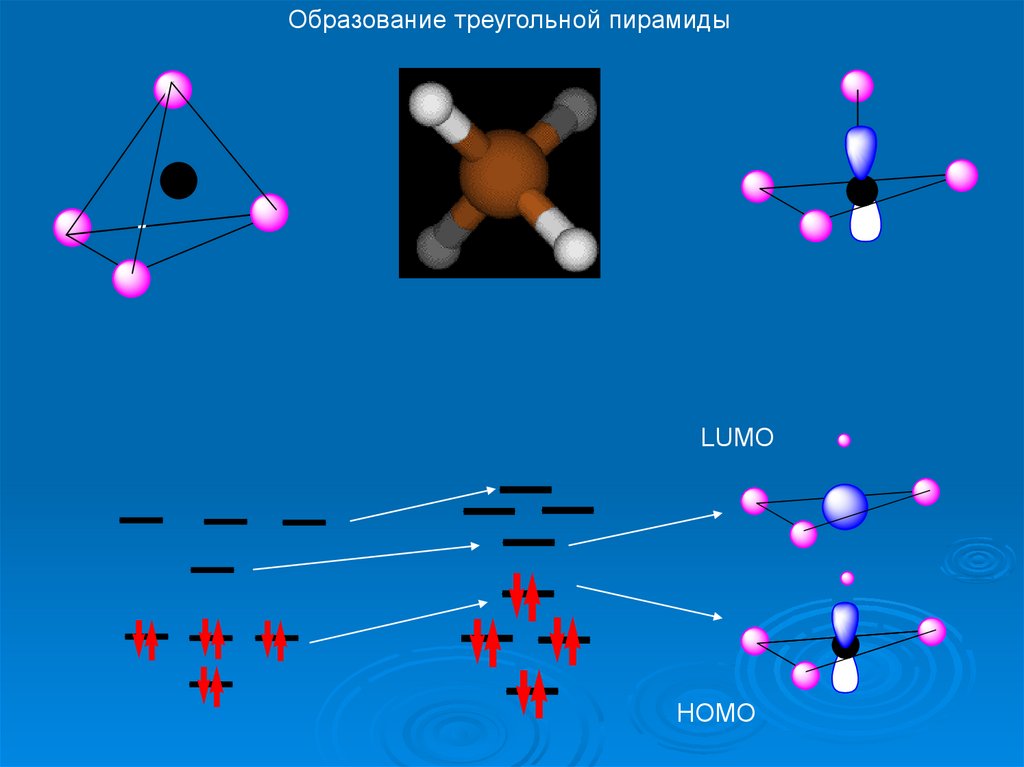
Основные колебания в метанеОбразование треугольной пирамиды
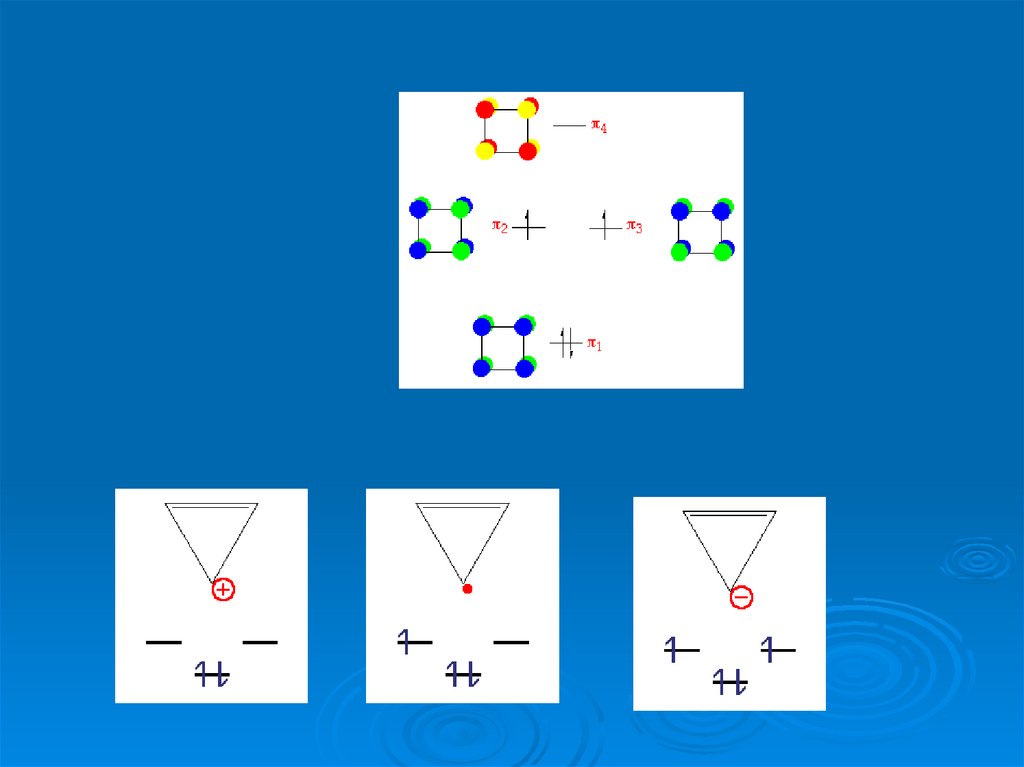
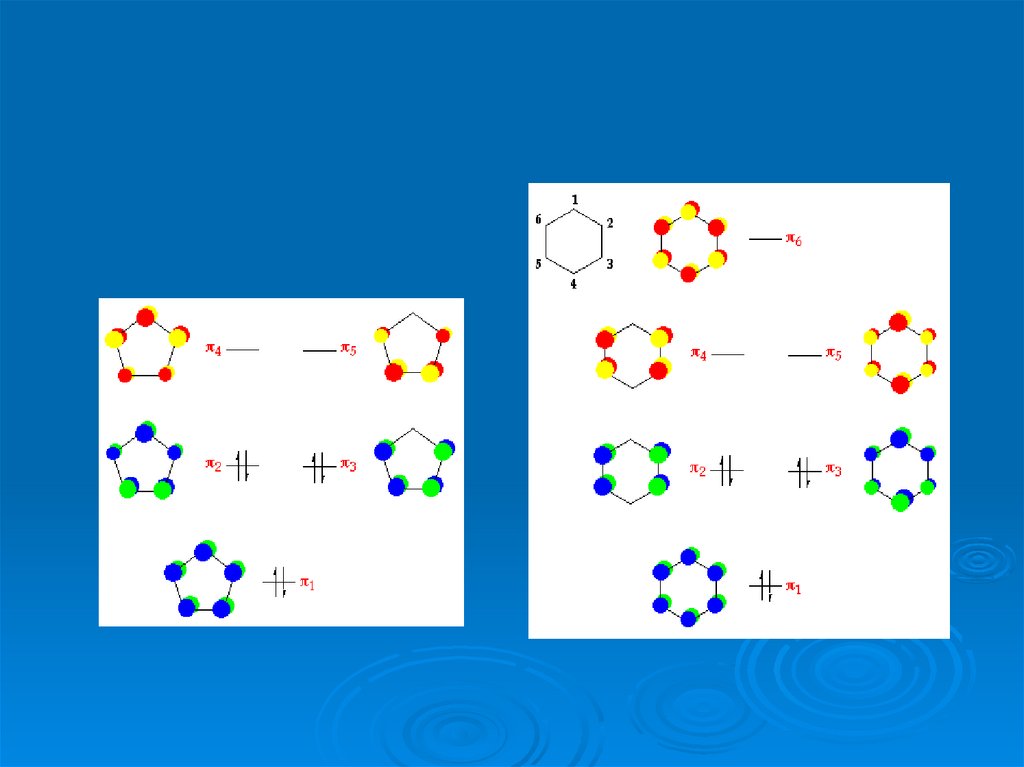
47.
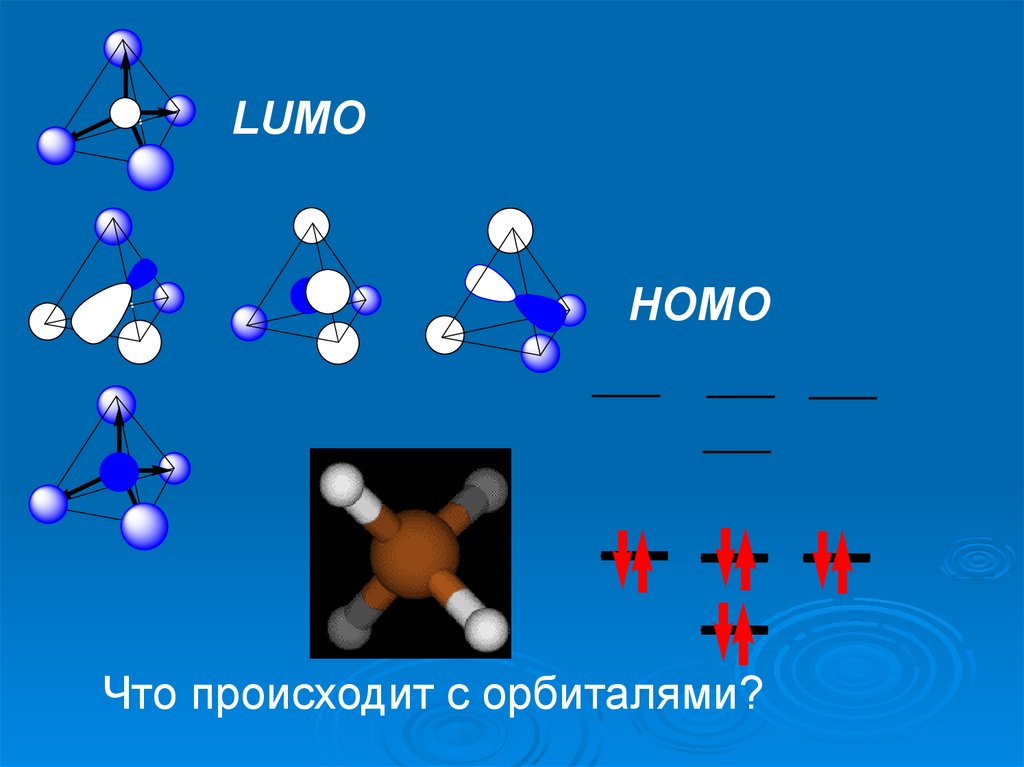
LUMOHOMO
Что происходит с орбиталями?
48.
Образование треугольной пирамидыLUMO
HOMO
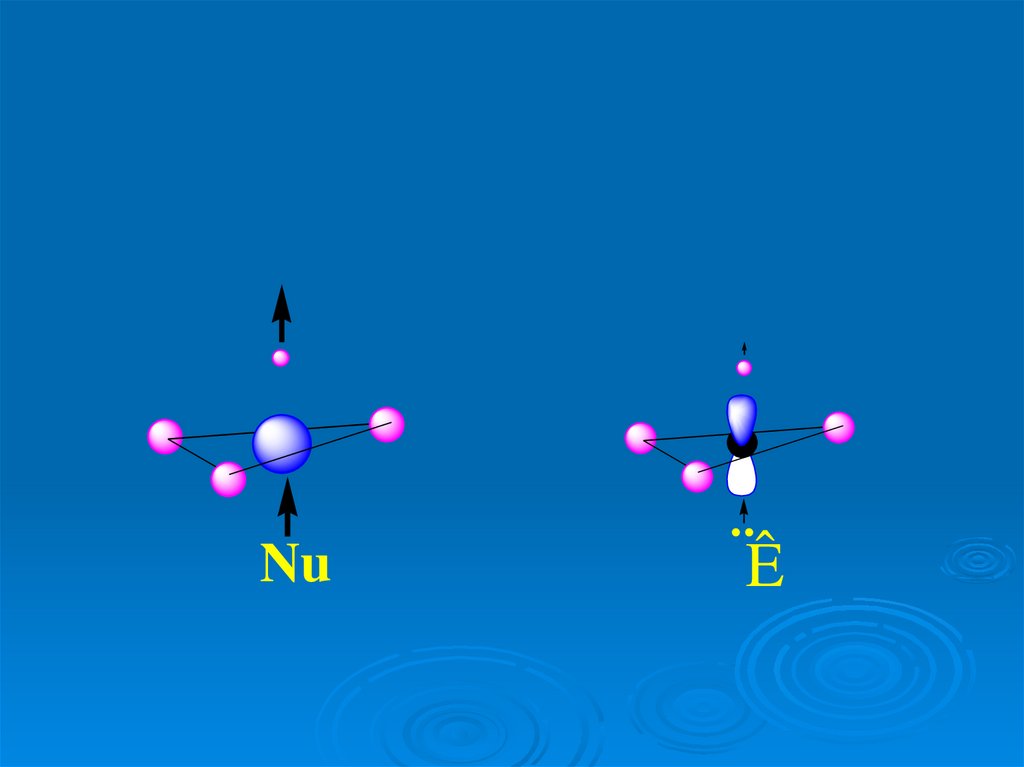
49.
Nu¨Ê

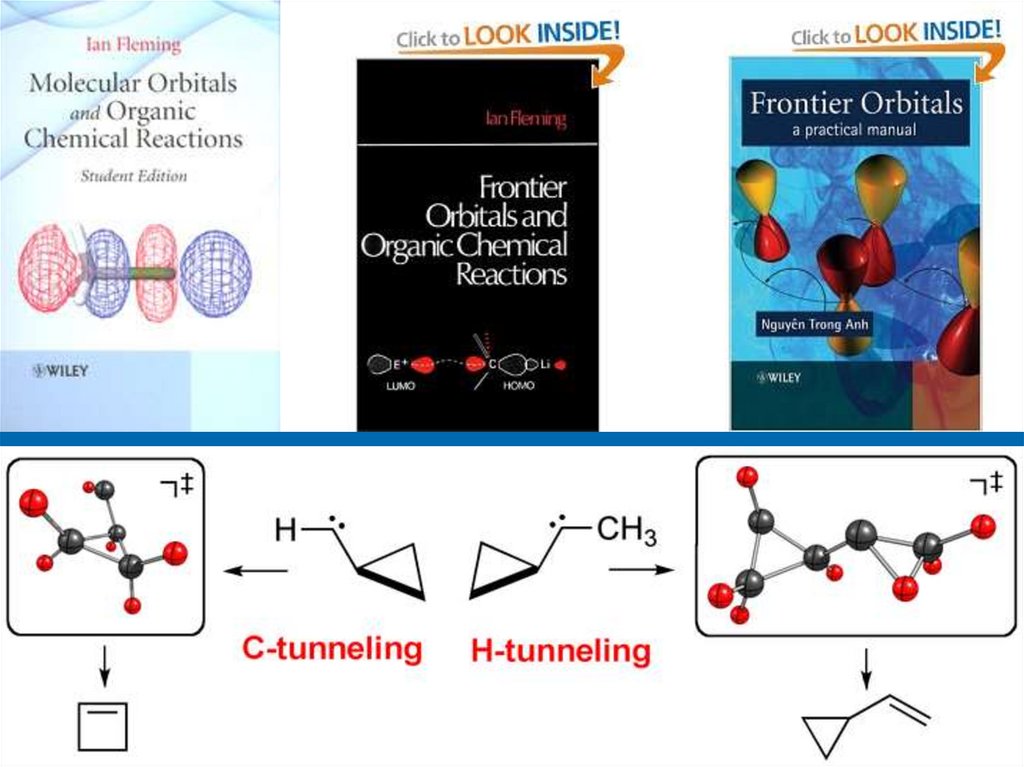







 chemistry
chemistry








