Similar presentations:
Такая знакомая сода
1.
Выполнил: ученик 8 «а» класса МБОУ СОШ № 39.
Руководитель: учитель химии МБОУ СОШ № 39
Тимченко Татьяна Александровна.
2.
Цель исследования:Дать обоснование широкому применению
карбоната и гидрокарбоната натрия с точки
зрения их разнообразных химических свойств.
3.
Задачи исследования:1.Собрать информацию об известных в истории химии
методах промышленного получения соды и дать их
описание;
2.Провести анкетирование среди учащихся 8 классов для
выявления знаний применении соды в лечебных целях.
3.Исследовать общие и особые свойства карбоната и
гидрокарбоната натрия.
4.Получить мыло из стеариновой кислоты и карбоната и
гидрокарбоната натрия в быту;
5.Составить мини-справочник рецептов применения
соды.
4.
Объект исследованияКарбонат натрия и гидрокарбонат натрия (сода)
5.
Предмет исследованияШирокое применение соды в лечебных целях и в
качестве чистящих средств.
6.
ГипотезаЗнание о свойствах соды расширяет
область ее применения.
7.
Что такое «сода»Название “сода” происходит от растения Salsola Soda,
из золы которого ее добывали.
8.
Производство содыВ 1791г. французский химик Н.Леблан получил
патент на способ
превращения глауберовой соли в соду.
По этому способу при температуре около 1000℃
запекается смесь
сульфата натрия (глауберовой соли),
мела или известняка (CaCo3) и древесного угля.
9.
Производство содыВ 1861 г. бельгийский ученый-химик Э.Сольве запатентовал метод производства соды,
который используют и по сей день.В насыщенный раствор хлорида натрия
пропускают эквимолярные количества газообразных аммиака и оксида угерода(IV),т.е.
вводят гидрокарбонат аммония NH4CHO3: NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl.
Выпавший осадок малорастворимого гидрокарбоната натрия отфильтровывают и
кальцинируют нагреванием до 140-160℃,при этом он переходит в карбонат натрия:
2NaHCO3→Na2CO3+CO2↑+H2O.
10.
Производство содыПолучение соды способом Хоу. Он отличается от
способа Леблана тем, что здесь не используется
карбонат кальция .
11.
Состав и свойствагидрокарбоната натрия.
Пищевая сода (NaHCO3, гидрокарбонат натрия) – это порошок белого цвета без
ярко выраженного запаха, он не токсичен ,легко растворяется в воде и пожаро- и
взрывобезопасен. При постоянной работе в атмосфере, загрязненной пылью
двууглекислого натрия, может возникнуть раздражение дыхательных путей.
12.
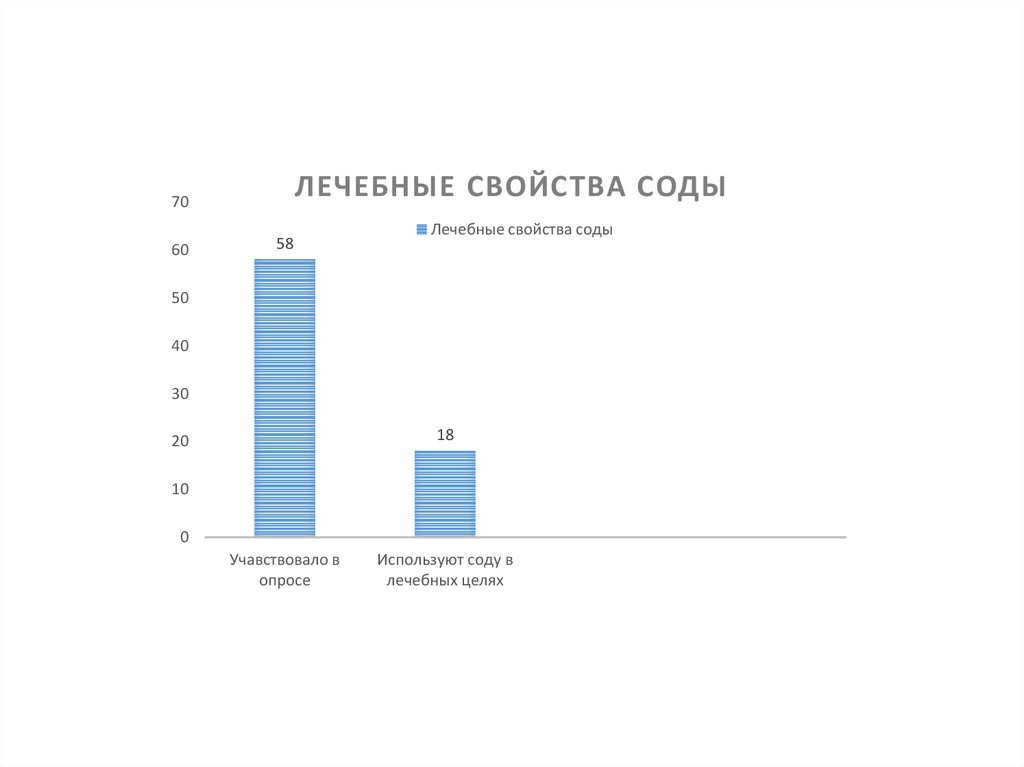
ЛЕЧЕБНЫЕ СВОЙСТВА СОДЫ70
60
58
Лечебные свойства соды
50
40
30
18
20
10
0
Учавствовало в
опросе
Используют соду в
лечебных целях
13.
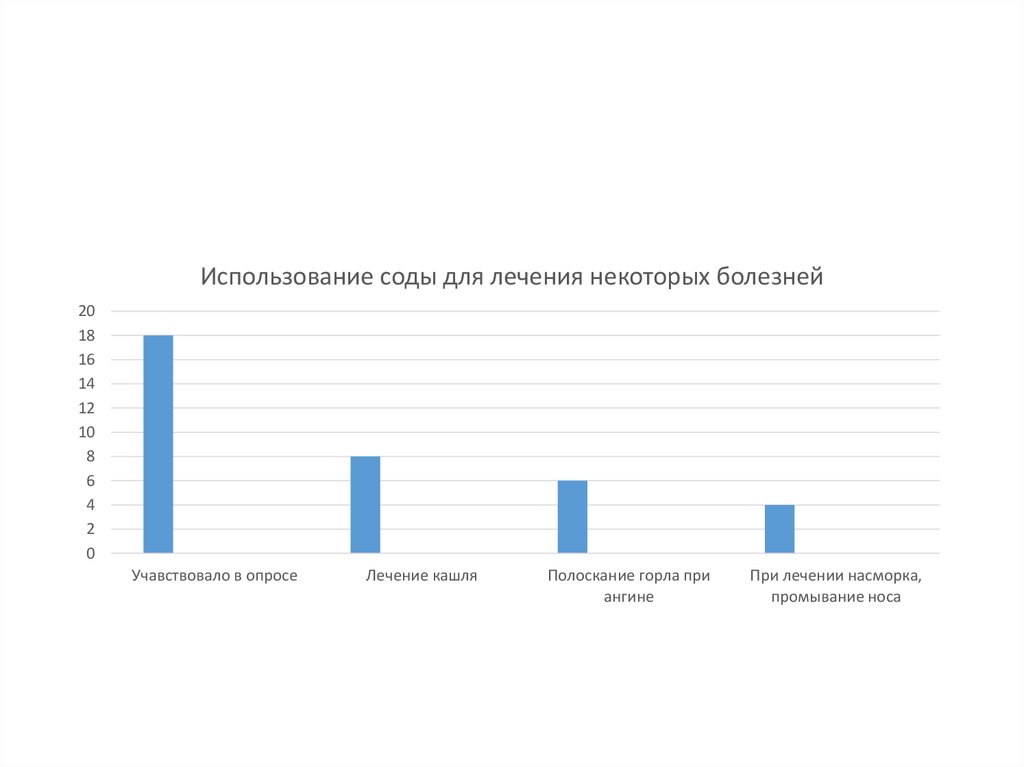
Использование соды для лечения некоторых болезней20
18
16
14
12
10
8
6
4
2
0
Учавствовало в опросе
Лечение кашля
Полоскание горла при
ангине
При лечении насморка,
промывание носа
14.
Химические эксперименты.Определение среды (pH) растворов карбоната и гидрокарбоната натрия.
pH(NaHCO3)≈8 - слабощелочная среда;
pH(Na2CO3)≈12 – сильнощелочная среда.
15.
Получение углекислого газа при взаимодействиикарбоната и гидрокарбоната натрия с кислотами.
16.
Исследование реакций карбоната игидрокарбоната натрия с раствором хлорида
кальция
17.
Исследование реакций раствора карбоната натрия с растворамисульфата меди(II), хлорида алюминия и хлорида железа(III)
18.
Варение мыла19.
Выводы1. Нами была собрана информация об известных в истории химии методах промышленного
получения соды.
2.Мы исследовали общие и особые свойства соды. Растворы карбоната и гидрокарбоната натрия
имеют щелочную среду, и это их свойство широко применяется в лечебных целях, а также в
производстве чистящих средств.
3.В лабораторных условиях мы смогли получить мыло из стеариновой кислоты и карбоната
натрия.
4.После исследования свойств соды мы довели сведения до ребят, участвующих в анкетировании,
что лечение содой - это самый простой и эффективный метод, заменяющий дорогостоящие
лекарства.
5. Отобранный нами материал позволил создать реальный продукт - мини-сборник рецептов
применения карбоната и гидрокарбоната натрия


















 chemistry
chemistry








