Similar presentations:
Газообразное состояние вещества. 11 класс
1.
Газообразные вещества11 класс
2.
Основные свойстваГАЗООБРАЗНОГО СОСТОЯНИЯ ВЕЩЕСТВА
Газы не имеют формы и объема,
занимают весь объем
Легко сжимаются
Смешиваются друг с другом
Почему?
Свойства газов объясняются тем,
что расстояния между молекулами много больше самих
молекул, поэтому молекулы слабо притягиваются друг к
другу
3. Закон Авогадро:
Вравных
объемах
различных
газов
при
одинаковых
условиях
(T,P)
содержится одинаковое число
молекул.
4.
Следствия:Один моль любого газа при нормальных условиях
содержит 6,02х1023 молекул. (Постоянная Авогадро)
При нормальных условиях (н.у.) 1 моль любого газа
занимает объем 22,4л.
л
22
,
4
(Молярный объём)
Vm
н.у. ─ это
273К и 101300Па
или
0ºС и 760 мм рт.ст.
моль
5. Относительная плотность (D) II газа по I газу
M (II газа)Dпо I газу ( IIгаза) M(I газа)
D
по возд.
M
( IIгаза)
M
г
29
M воздуха
газа
возд.
моль
6.
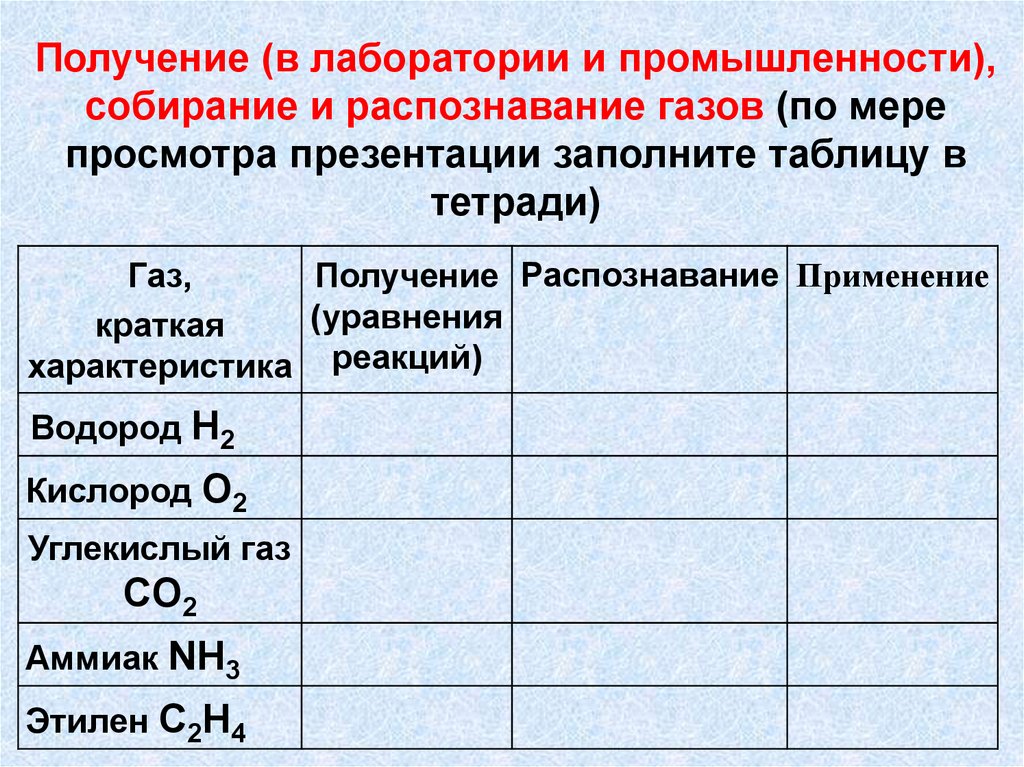
Получение (в лаборатории и промышленности),собирание и распознавание газов (по мере
просмотра презентации заполните таблицу в
тетради)
Газ,
Получение Распознавание Применение
(уравнения
краткая
характеристика реакций)
Водород H2
Кислород О2
Углекислый газ
CO2
Аммиак NH3
Этилен С2Н4
7.
Водород – H2 – это самый легкий газ. В лаборатории егополучают чаще всего в аппарате Киппа взаимодействием
цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2↑
Чтобы распознать водород, к отверстию
перевернутого вверх дном сосуда подносят зажженную
лучину.
Раздается глухой хлопок, если водород чистый
или
«лающий» звук, если водород содержит примеси.
8.
Кислород – О2 – газ, содержание которого в атмосфересоставляет 21%. Кроме кислорода в верхних слоях
атмосферы содержится аллотропное видоизменение –
озон О3.
В лаборатории кислород получают:
1) разложением перманганата калия
2KMnO4 = K2MnO4 + MnO2 + О2↑
2)разложением пероксида водорода в
присутствии катализатора MnO2
2H2O2 = 2Н2О + О2↑
Распознают кислород по вспыхиванию
тлеющей лучинки, внесенной в сосуд с
этим газом.
9.
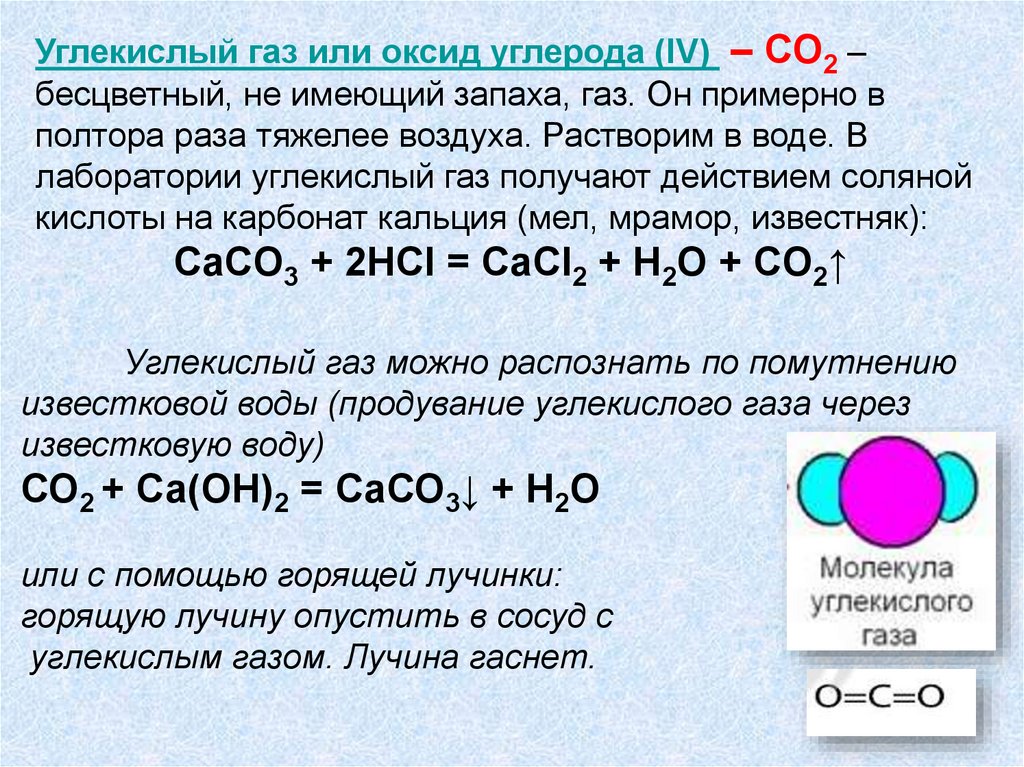
Углекислый газ или оксид углерода (IV) – СО2 –бесцветный, не имеющий запаха, газ. Он примерно в
полтора раза тяжелее воздуха. Растворим в воде. В
лаборатории углекислый газ получают действием соляной
кислоты на карбонат кальция (мел, мрамор, известняк):
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Углекислый газ можно распознать по помутнению
известковой воды (продувание углекислого газа через
известковую воду)
СО2 + Са(ОН)2 = СаСО3↓ + Н2О
или с помощью горящей лучинки:
горящую лучину опустить в сосуд с
углекислым газом. Лучина гаснет.
10.
Аммиак – NH3 – газ с резким запахом,бесцветный, хорошо растворим в воде.
В лаборатории аммиак получают
взаимодействием щелочей с
солями аммония:
NH4Cl + NaOH = NaCl + H2O + NH3↑
Аммиак можно распознать:
по запаху, соблюдая правило техники
безопасности;
поднести влажную лакмусовую бумажку
к пробирке с аммиаком. Лакмусовая бумажка
посинеет;
стеклянную палочку смочить в соляной кислоте и
опустить в пробирку с аммиаком. Наблюдается
появление дыма. (Опыт «Дым без огня).
11.
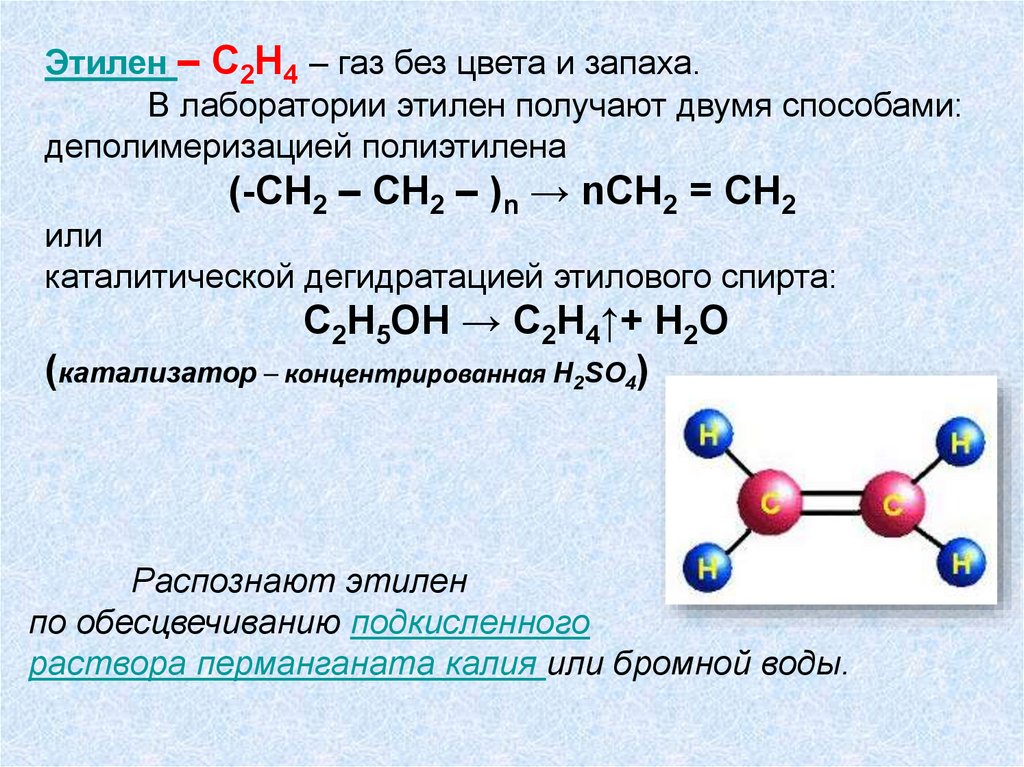
Этилен – С2Н4 – газ без цвета и запаха.В лаборатории этилен получают двумя способами:
деполимеризацией полиэтилена
(-СН2 – СН2 – )n → nСН2 = СН2
или
каталитической дегидратацией этилового спирта:
С2Н5ОН → С2Н4↑+ Н2О
(катализатор ─ концентрированная H2SO4)
Распознают этилен
по обесцвечиванию подкисленного
раствора перманганата калия или бромной воды.
12.
Оцени свою работу после урока«Всё хорошо»
Многое
вспомнил (а),
хорошо усвоил (а)
тему урока
«И так, и сяк»
Остались
непонятные
вопросы
«Совсем никак»
Я ничего
не понял (а)
13.
Домашнее заданиеПодготовиться к практической работе № 1 на стр. 214
Сделать конспект по презентации до таблицы
Заполнить таблицу (см. слайд 6)
§ 8 Упр. 3-6











 chemistry
chemistry