Similar presentations:
Степень окисления – Условный заряд атомов химического элемента в соединении
1. Степень окисления – Условный заряд атомов химического элемента в соединении.
2.
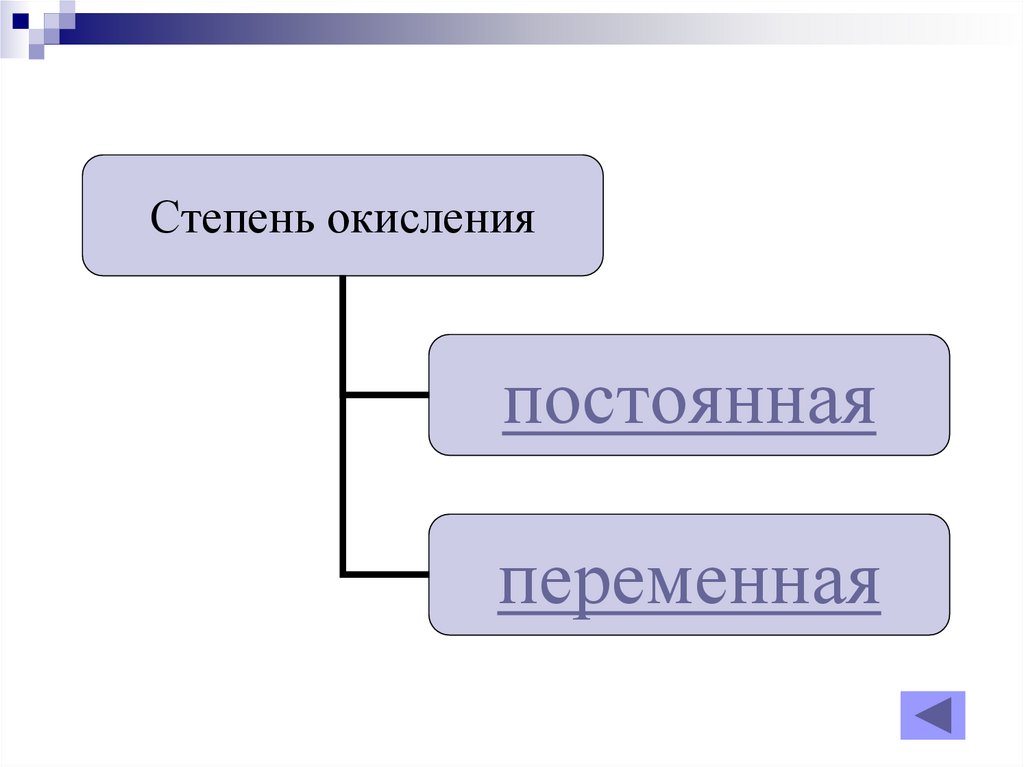
Степень окисленияпостоянная
переменная
3. постоянная
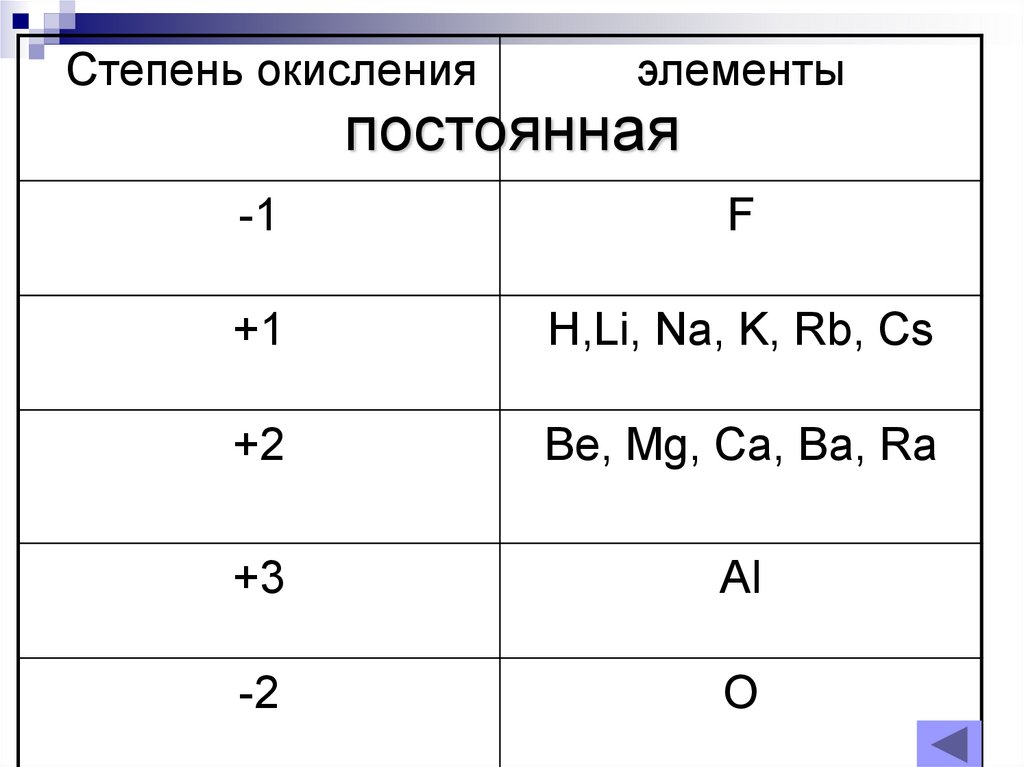
Степень окисленияэлементы
-1
F
+1
Н,Li, Na, K, Rb, Cs
+2
Be, Mg, Ca, Ba, Ra
+3
Al
-2
O
постоянная
4. Степень окисления серы K2SO3 в равна
+3+2
+6
+4
+1
-2
K2SO3
+2
-6
5.
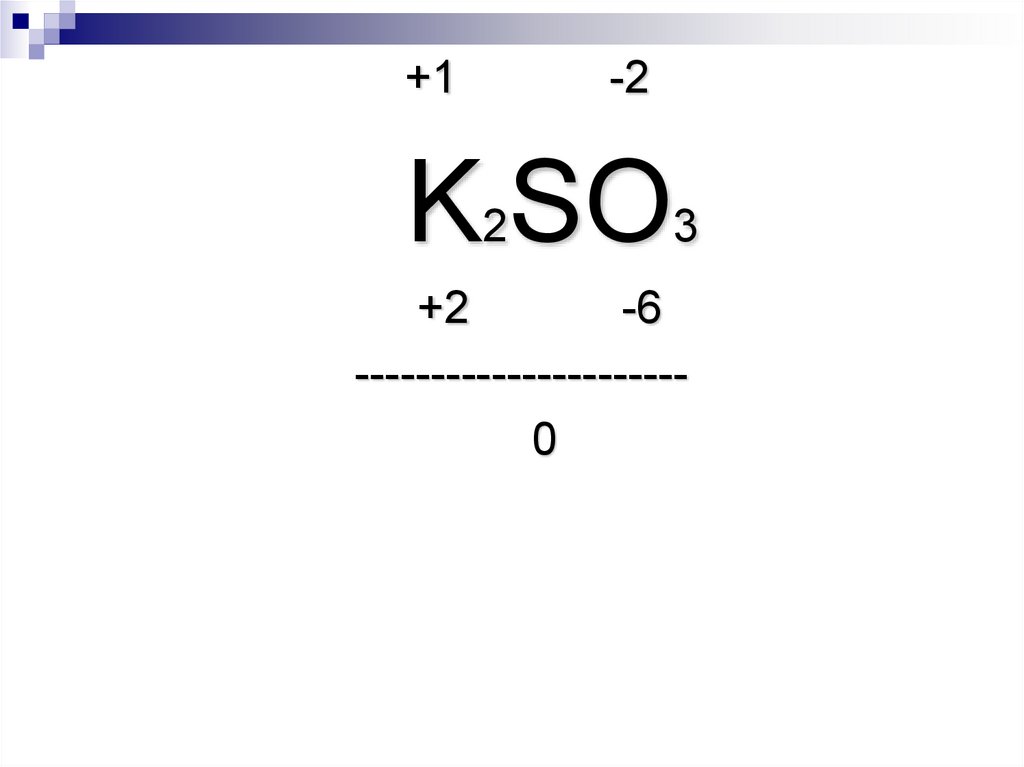
+1-2
K2SO3
+2
-6
---------------------0
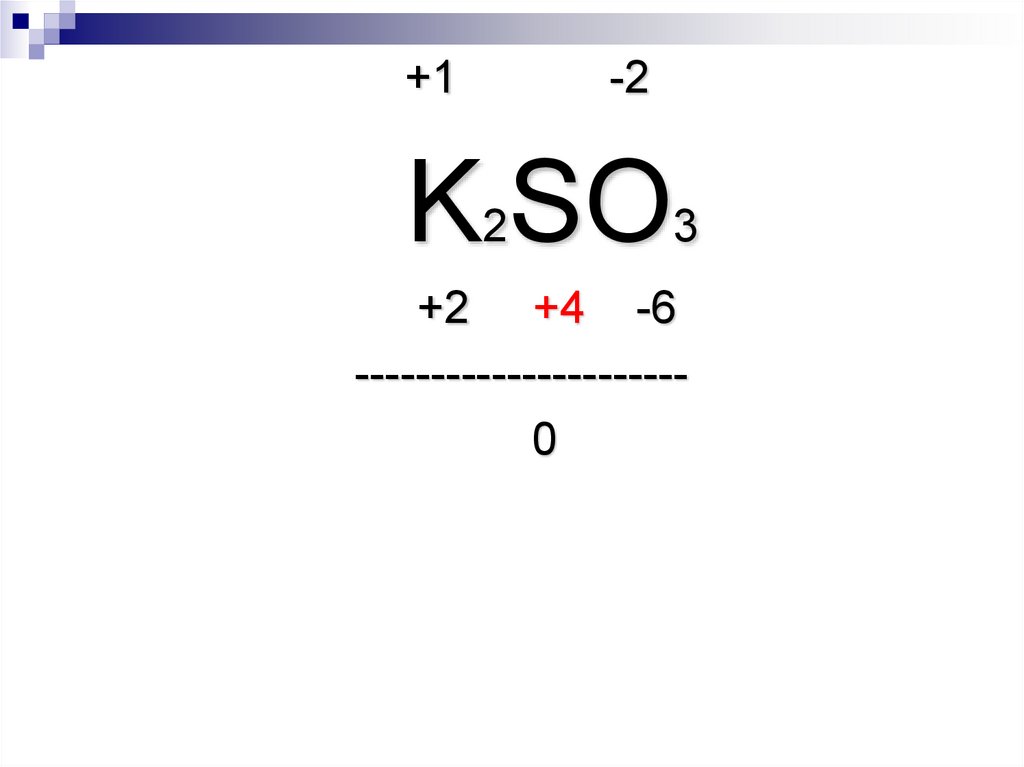
6.
+1-2
K2SO3
+2 +4 -6
---------------------0
7. Степень окисления серы K2SO3 в равна
+3+2
+6
+4
K2SO3
8.
+1-2
Na3PO4
9.
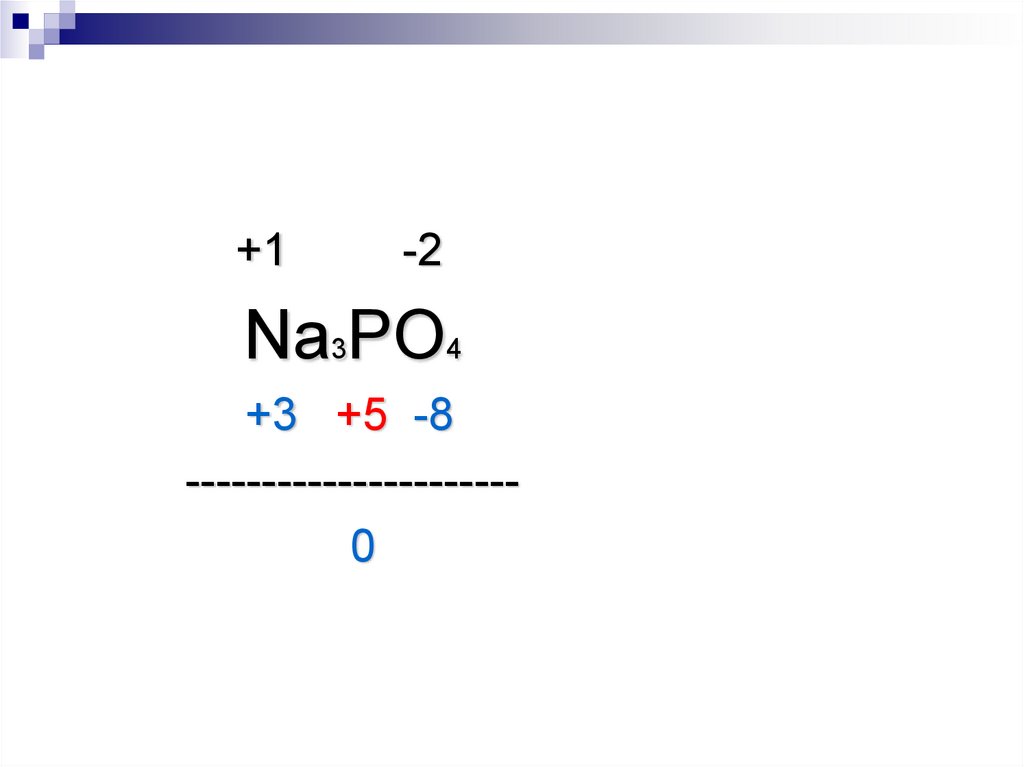
+1-2
Na3PO4
+3 +5 -8
---------------------0
10.
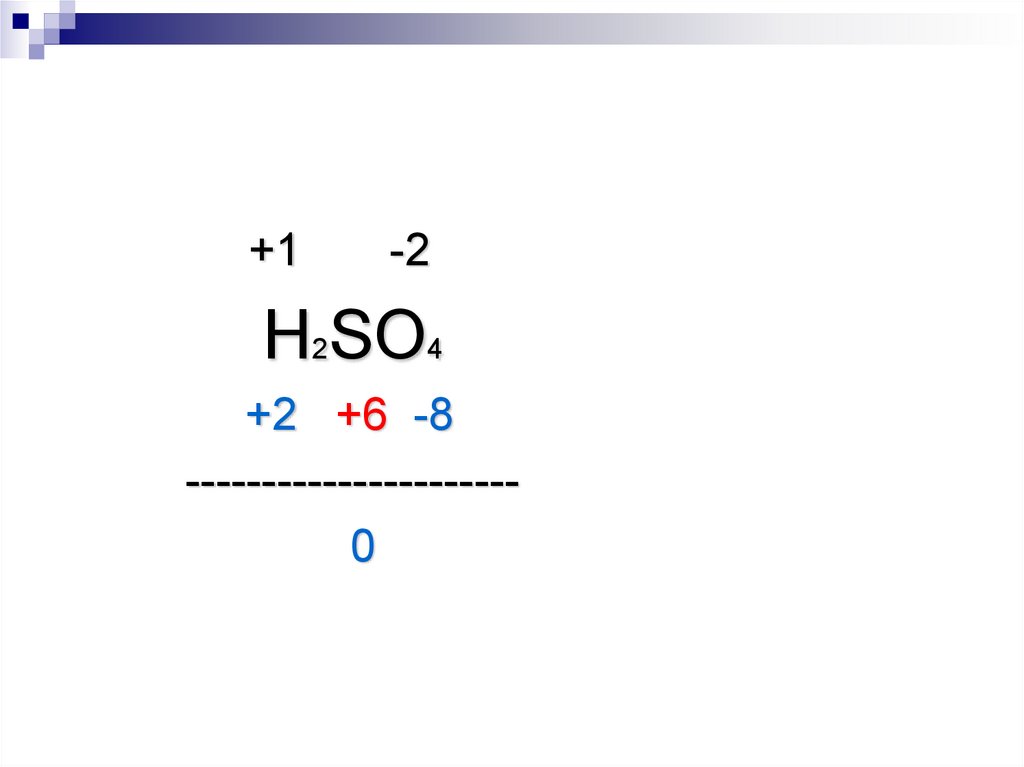
+1-2
H2SO4
+2 +6 -8
---------------------0
11.
Mg3(PO4)212.
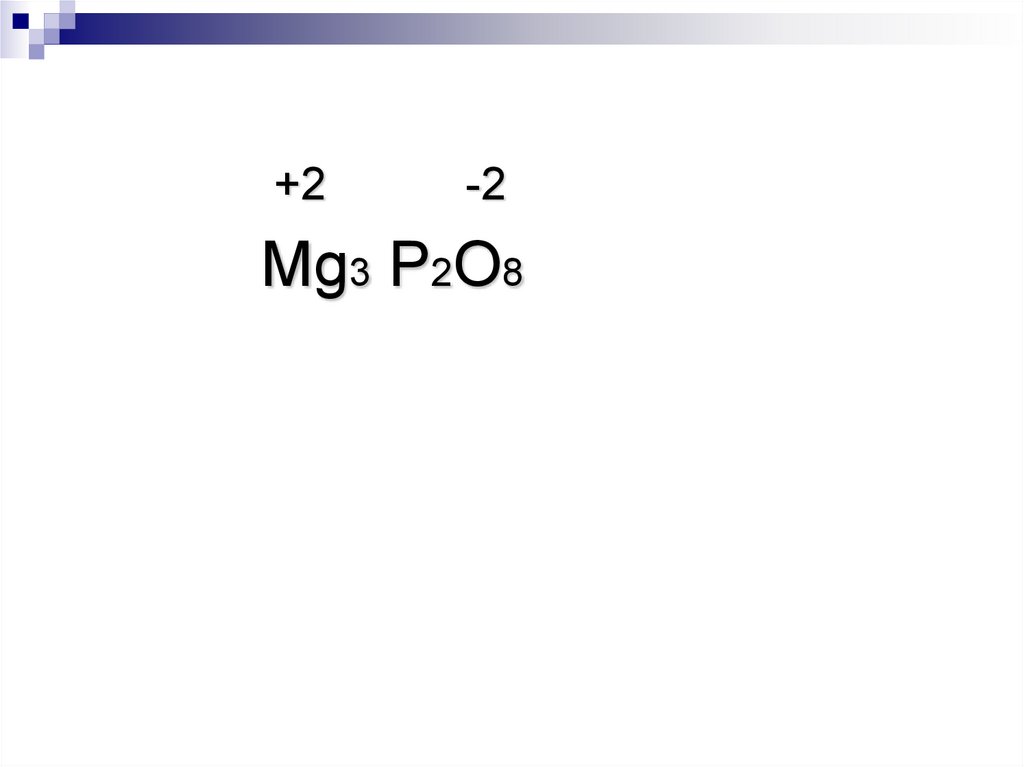
Mg3 P2O813.
+2-2
Mg3 P2O8
14.
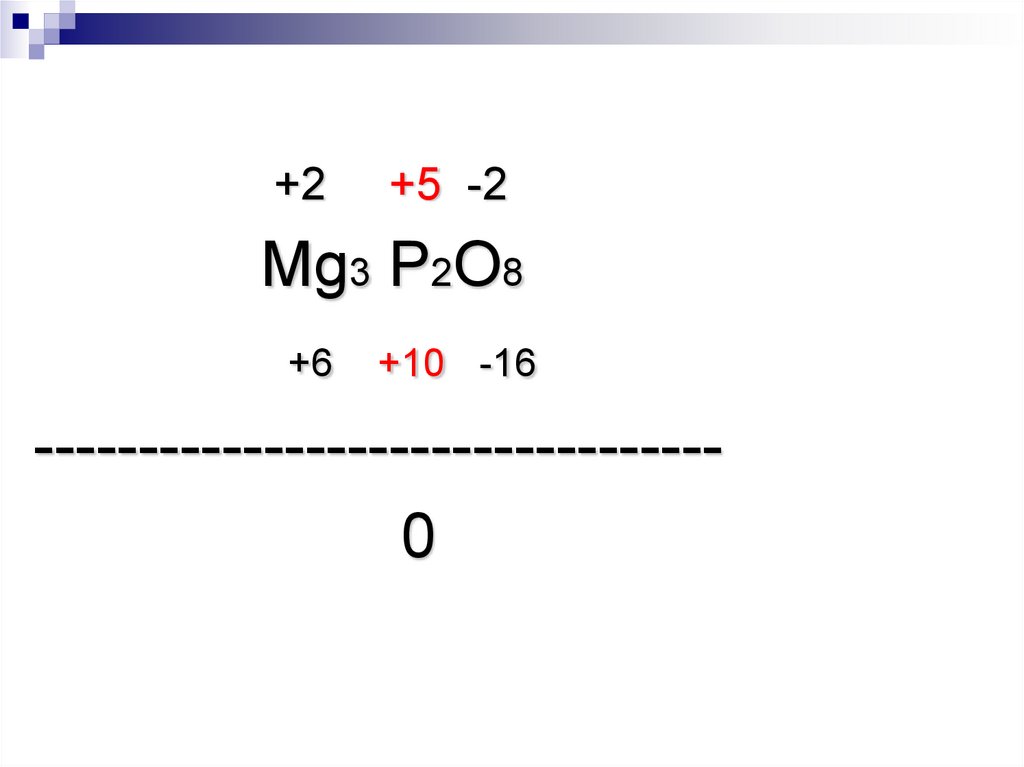
+2+5 -2
Mg3 P2O8
+6
+10 -16
--------------------------------0
15.
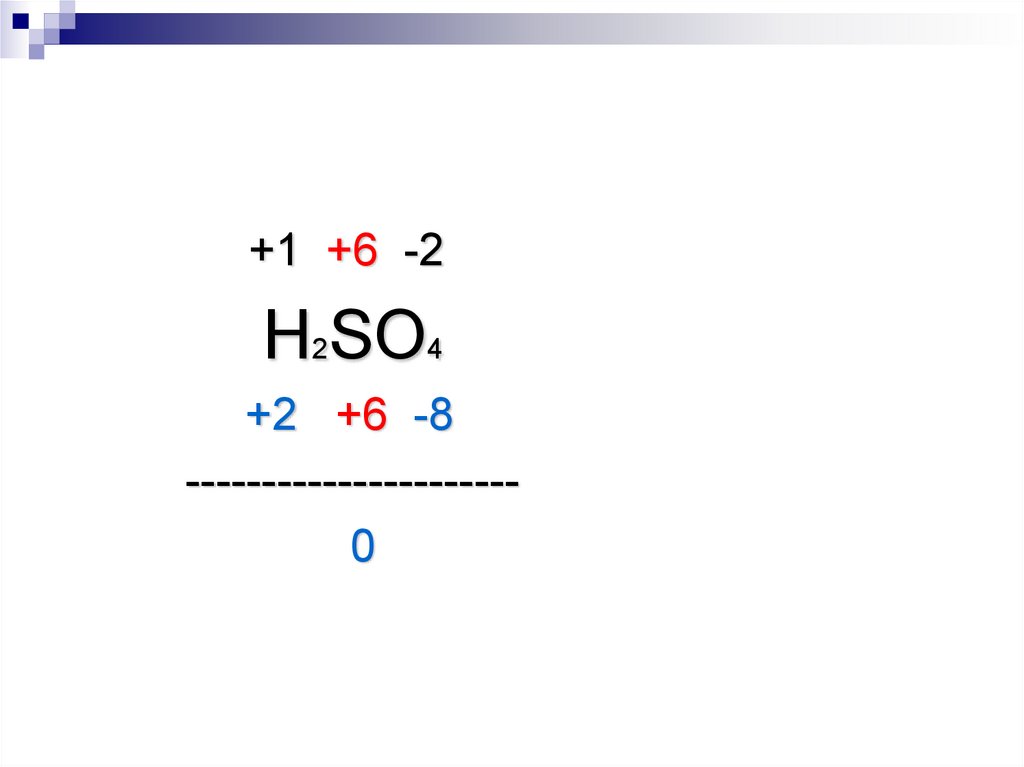
+1-2
H2SO4
16.
+1 +6 -2H2SO4
+2 +6 -8
---------------------0
17.
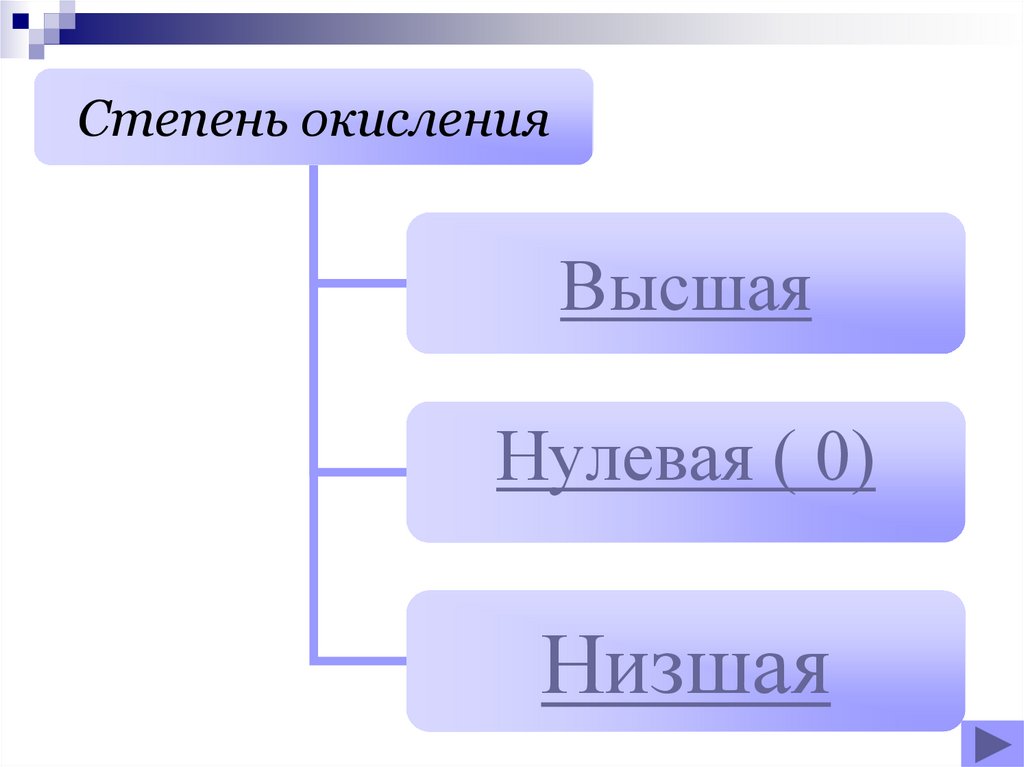
Степень окисленияВысшая
Нулевая ( 0)
Низшая
18. Степень окисления 0 в простых веществах
19. Высшая степень окисления с 1 по 7 группу равна номеру группы 1 группа +1 2 группа +2 5 группа +5
20. Низшая степень окисления с 4 по 7 группу равна -8 + номер группы 4 группа -4 7 группа -1 5 группа -3 6 группа -2
21. Магний имеет минимальное значение степени окисления
22. Магний имеет минимальное значение степени окисления
23. Сера имеет минимальное значение степени окисления
Окислительно –восстановительные
реакции
… – реакции, протекающие с изменением
степени окисления элементов.
24. Сера имеет минимальное значение степени окисления
Два антипода парою ходят,Первый – теряет; второй - находит,
Ролью меняясь при этом порой…
Кто ж из них первый и кто же второй?
восстановитель
окислитель
25. Минимальное и максимальное значение степени окисления хлора
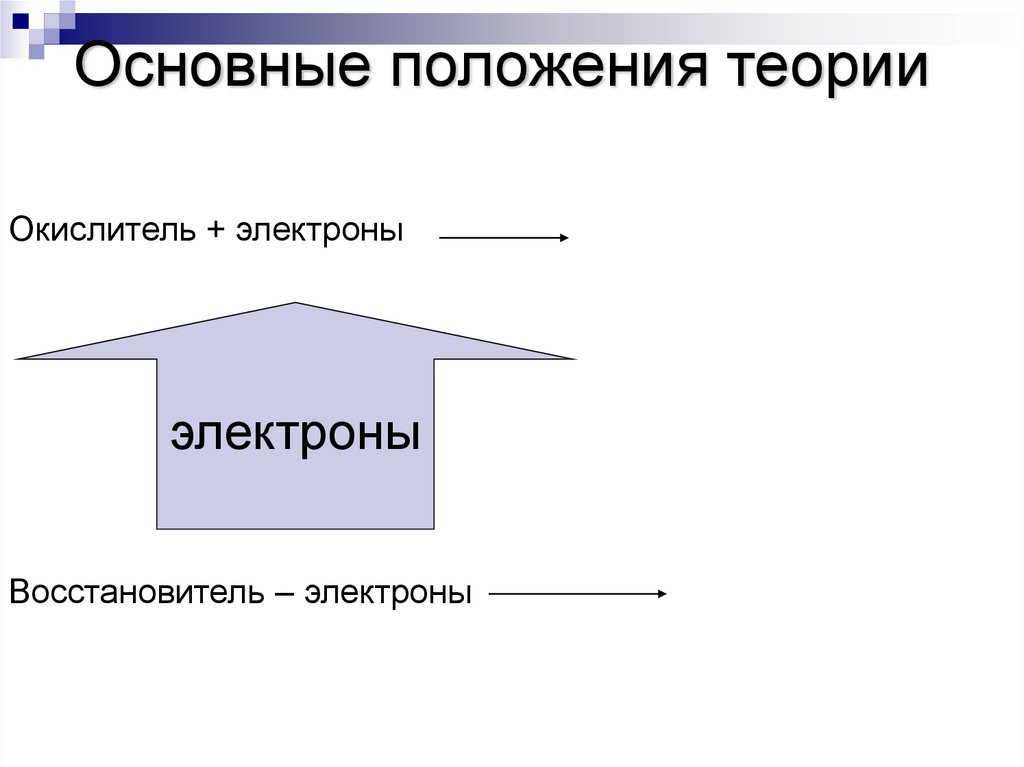
Основные положения теорииОкислитель + электроны
электроны
Восстановитель – электроны
26. Минимальное и максимальное значение степени окисления хлора
Алгоритм составления ОВР1.
2.
3.
Определить степени окисления элементов
в соединениях, участвующих в реакции.
Выявить элемент, степень окисления
которого понизилась, повысилась,
окислитель и восстановитель.
Выявить число отданных и принятых
электронов.
27.
ВосстановительЭ
- nē
Э n+
Атомы металлов (I и II гр., Al, Fe, Zn…).
Отрицательно заряженные ионы неметаллов
(S2–, Cl –, Br–… до свободных элементов).
28.
ОкислительЭ
+ nē
Э n-
Атомы элементов VI–VII групп (О2, Сl2…).
Ионы металлов в высоких степенях окисления
(Cu2- -------Cu+)
Ионы молекул содержат атомы неметаллов в
высоких степенях окисления (КМnО4 – Mn7+).
Ионы и молекулы, содержащие атомы
неметаллов в высоких степенях окисления.
29. Окислительно – восстановительные реакции
Сера (-2,0,+2,+4,+6)Железо ( +2, +3)
30. Два антипода парою ходят, Первый – теряет; второй - находит, Ролью меняясь при этом порой… Кто ж из них первый и кто же второй?
Высшая степень окисленияХарактерна для Ме и нМе
Определяем по номеру группы
31.
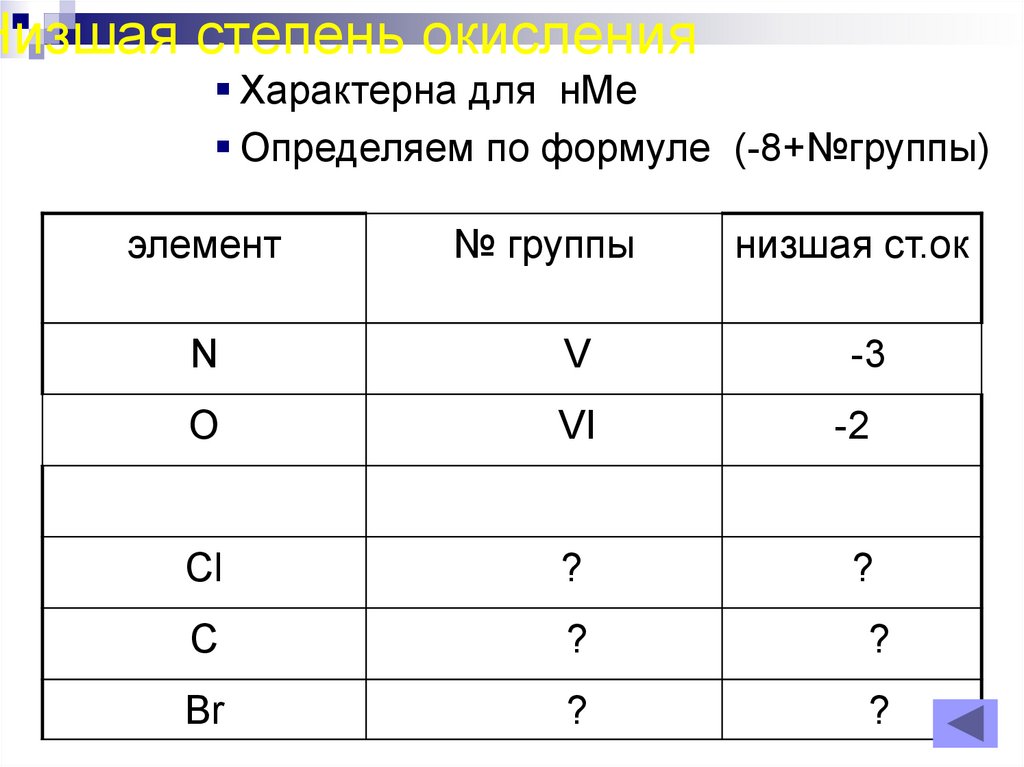
Низшая степень окисленияХарактерна для нМе
Определяем по формуле (-8+№группы)
элемент
№ группы
низшая ст.ок
N
V
-3
O
VI
-2
Cl
?
?
С
?
?
Br
?
?
32. Алгоритм составления ОВР
Нулевая ( 0)Все простые вещества
Йод
Бром
Литий




















 chemistry
chemistry








