Similar presentations:
Основы фармацевтического товароведения
1.
Основы фармацевтическоготовароведения
2020-2021 УЧ.ГОД
2.
Товар - это продукт материальной деятельности,созданный для продажи и удовлетворяющий
какие-либо потребности.
Товар = потребительские свойства +
потребительская стоимость
К. Маркс считал, что «потребительские
стоимости товаров составляют предмет
особой дисциплины - ТОВАРОВЕДЕНИЯ».
На Международной теоретической конференции
преподавателями высшей школы по вопросам
общего товароведения (сентябрь 1962 г.) в
Лейпциге: «Товароведение представляет
собой естественнонаучную дисциплину,
предметом которой является потребительская
стоимость товаров».
3.
Две категории товароведения:• потребительские свойства - показатели
качества. На основе которых
разрабатываются классификации.
• потребительская стоимостькатегория субъективно-синтетическая:
она отражает субъективную оценку
покупателем товара во всей совокупности
его свойств, и эта оценка выражается в его
готовности заплатить за товар ту или иную
цену.
4.
• Первое академическое определениетовароведения дал в конце 18 века Иоганн
Бекман: наука о свойствах, получении и
испытании товаров, а также об их
экономическом значении.
5.
• Товароведение - это научная дисциплина,которая изучает потребительские свойства
товаров, их классификацию и кодирование,
стандартизацию, факторы,
обуславливающие качество товаров,
контроль и его оценку, закономерности
формирования ассортимента товаров и его
структуру, условия сохранения качества
товаров при их транспортировке, в
потреблении и эксплуатации.
(Большая советская энциклопедия, 1977 г.)
6.
• Цель товароведения - установитьсоответствие показателей потребительских
свойств и выпускаемого ассортимента
продукции требованиям потребителей в
интересах наиболее полного
удовлетворения их потребностей и
осуществления обратной связи между
потребителями и производством в части
повышения качества и обновления
ассортимента товаров.
7.
Принципы товароведения:безопасность
эффективность
совместимость
взаимозаменяемость
систематизация.
8.
• Медицинское товароведение изучаетпотребительские свойства медицинских
товаров, то есть те свойства, которыми
должен обладать тот или иной товар,
применяемый в медицине в соответствии в
его назначением в лечебнодиагностическом процессе (медицинские
инструменты, медицинские приборы,
медицинские аппараты, медицинское
оборудование).
9.
• Фармацевтическое товароведение это дисциплина, занимающаяся изучениемпотребительских стоимостей и
потребительских свойств
фармацевтических и
парафармацевтических товаров, факторов,
обеспечивающих их качество, методов
товароведения, а также товароведческих
операций, связанных с продвижением
указанных товаров от поставщика к
потребителю.
10.
Медицинское и фармацевтическоетовароведение изучает:
• потребительские свойства фармацевтических и
медицинских товаров;
• ассортимент;
• классификацию;
• кодирования;
• стандартизация
• товароведческие операции - перемещения товаров в
аптечной сети;
• факторы влияния на качество товаров;
• организацию хранения товаров;
• правила упаковки;
• условия транспортирования;
• методы товароведческого анализа;
• правила маркировки
11.
ФЗ РФ №61-ФЗ от 12.04.010 "Обобращении лекарственных
средств" аптечные организации
имеют право приобретать и
реализовать:
12.
1.2.
3.
4.
5.
6.
лекарственные препараты
изделия медицинского назначения,
дезинфицирующие средства,
предметы и средства личной гигиены,
посуду для медицинских целей,
предметы и средства, предназначенные для ухода
за больными, новорожденными и детьми, не
достигшими возраста трех лет,
7. очковую оптику и средства ухода за ней,
8. минеральные воды,
9. продукты лечебного, детского и диетического
питания,
10. биологически активные добавки,
11. парфюмерные и косметические средства,
12. медицинские и санитарно-просветительные
печатные издания, предназначенные для
пропаганды здорового образа жизни.
13.
• Лекарственный препарат – этолекарственное средство в виде
лекарственной формы, применяемое для
профилактики, диагностики, лечения
заболевания, реабилитации, для
сохранения, предотвращения или
прерывания беременности
14.
Согласно ФЗ №323-ФЗ от 23.11.2011 "Об охране здоровьяграждан" ст.38
• Медицинские изделия - это любые инструменты,
аппараты, приборы, оборудование, материалы и прочие
изделия, применяемые в медицинских целях отдельно
или в сочетании между собой, а также вместе с другими
принадлежностями, необходимыми для применения
указанных изделий по назначению, включая специальное
программное обеспечение, и предназначенные
производителем для профилактики, диагностики, лечения
и медицинской реабилитации заболеваний, мониторинга
состояния организма человека, проведения медицинских
исследований, восстановления, замещения, изменения
анатомической структуры или физиологических функций
организма, предотвращения или прерывания
беременности, функциональное назначение которых не
реализуется путем фармакологического,
иммунологического, генетического или метаболического
воздействия на организм человека.
15.
ст. 39• Лечебное питание - питание, обеспечивающее
удовлетворение физиологических потребностей
организма человека в пищевых веществах и
энергии с учетом механизмов развития
заболевания, особенностей течения основного и
сопутствующего заболеваний и выполняющее
профилактические и лечебные задачи. Лечебное
питание является неотъемлемым компонентом
лечебного процесса и профилактических
мероприятий, включает в себя пищевые рационы,
которые имеют установленный химический состав,
энергетическую ценность, состоят из определенных
продуктов, в том числе специализированных
продуктов лечебного питания, подвергаемых
соответствующей технологической обработке.
16.
Специализированными продуктами лечебногопитания являются пищевые продукты с
установленным химическим составом,
энергетической ценностью и физическими
свойствами, доказанным лечебным эффектом,
которые оказывают специфическое влияние на
восстановление нарушенных или утраченных в
результате заболевания функций организма,
профилактику этих нарушений, а также на
повышение адаптивных возможностей
организма.
17.
БАД - это композиции натуральных илиидентичных натуральным биологически
активных веществ, предназначенных для
непосредственного приема с пищей или
введения в состав пищевых продуктов с
целью обогащения рациона отдельными
пищевыми БАД из растительного,
животного или минерального сырья, а
также химическими или биологически
активными веществами и их комплексами.
18.
• Медицинская техника - машины, механизмы,механические устройства, автоматы и
полуавтоматы, используемые в медицине.
• Медицинский инструмент - орудие,
преимущественно ручное, для производства какихлибо медицинских работ.
• Приспособление - устройство (обычно простейшее),
при помощи которого совершается какое-либо
действие, процесс и т. п.
• Медицинский инструментарий - совокупность
медицинских инструментов и приспособлений,
предназначенный обеспечить выполнение
основных видов работ в определенной области
медицины.
19.
• Медицинские приборы - техническиесредства измерения, анализа, обработки и
предоставления информации,
предназначенные для диагностики,
профилактики и лечения.
• Медицинские аппараты - технические
устройства, обеспечивающие воздействие на
объект каким-либо видом энергии с целью
изменения объекта или определения его
характеристик.
• Медицинское оборудование - совокупность
устройств, приспособлений, приборов,
механизмов и т. п., необходимых для
производства каких-либо работ в медицине.
20.
• Диетическое питание – это лечебное ипрофилактическое питание, сочетающее в
себе комплекс сбалансированных витаминов,
минералов, белков, жиров и углеводов.
• Продукты детского питания предназначенные для питания детей в
возрасте до 14 лет и отвечающие
физиологическим потребностям детского
организма пищевые продукты
• Минеральная вода — вода, содержащая в
своем составе
растворённые соли, микроэлементы, а также
некоторые биологически активные
компоненты.
21.
Специализированная пищевая продукция –это детское питание, в т.ч. вода
питьевая; диетическое питание, в т.ч.
лечебное и диетическое питание;
минеральная вода; продукция для питания
спортсменов; продукция для питания
беременных и кормящих; биологически
активные добавки.
22.
• Парафармацевтическая продукция — этотовары дополнительного аптечного
ассортимента, сопутствующие
лекарственным средствам и медицинским
изделиям, предназначенные для
профилактики, лечения заболеваний,
облегчения состояния человека, ухода за
частями тела.
23.
Парафармацевтические товары• парфюмерно-косметические товары
• продукты детского и диетического,
лечебно-профилактического питания, в т.ч.
и БАДы
• предметы ухода за детьми
• санитарно-гигиенические изделия
• минеральные воды
• очковая оптика
• санитарно-просветительские и печатные
издания.
24.
Классификация товаров аптечногоассортимента. Кодирование
Классификация — это последовательное
распределение множества объектов на
отдельные классы, группы и другие
подразделения по наиболее общим для
каждого уровня признакам.
25.
Классификация товаров необходима длявыполнения следующих целей:
- для автоматизированной обработки
информации о лекарственных средствах и
других товарах аптечного ассортимента;
- для изучения потребительских свойств и
качества товара;
- для учета, а также планирования
товарооборота аптечных организаций;
- для совершенствования системы
стандартизации товаров
фармацевтического рынка;
26.
- для составления реестров цен и каталогов, атакже прайс-листов;
- для проведения маркетинговых исследований
на фармацевтическом рынке;
- при сертификации (декларировании)
продукции;
- для проведения статистического анализа
производства, реализации и использования
продукции на различных уровнях, в том числе
на макроэкономическом, региональном и
отраслевом.
27.
Требования к классификации фармацевтическихтоваров:
- гарантировать полноту охвата всех видов товаров,
имеющихся на фармацевтическом рынке;
- обеспечивать гибкость построения и при
необходимости давать возможность ввода новых
наименований товаров, не нарушая при этом
системы классификации, а также учитывать
потенциальные изменения в номенклатуре и
ассортименте товаров;
- способствовать всестороннему исследованию
потребительских свойств фармацевтических
товаров;
- содействовать улучшению торговой деятельности на
всем пути движения товаров;
- содействовать принципам кодирования товаров и
образования краткого шифра товара.
28.
2 метода классификации:- Иерархический - последовательное деление
заданного множества объектов или товаров
на подчиненные классификационные
подмножества или группировки;
- Фасетный - параллельное разделение
множества объектов по одному признаку
на отдельные, независимые друг от друга
подразделения или группировки, иначе
называемые фасетами.
29.
Классификация медицинских,фармацевтических товаров
1. Классические, гомеопатические. В
качестве типологического признака —
система медицины.
Лекарственные препараты - лекарственные
средства в виде лекарственных форм,
применяемые для профилактики,
диагностики, лечения заболевания,
реабилитации, для сохранения,
предотвращения или прерывания
беременности
30.
Гомеопатический лекарственный препарат лекарственный препарат, произведенныйили изготовленный из фармацевтической
субстанции или фармацевтических
субстанций в соответствии с требованиями
общих фармакопейных статей к
гомеопатическим лекарственным
препаратам или в соответствии с
требованиями фармакопеи страны
производителя такого лекарственного
препарата;
31.
2. Лечебные, профилактические идиагностические лекарственные
средства. В качестве типологического
признака — предназначение.
3. Готовые, экстемпоральные лекарственные
средства, и внутриаптечная заготовка.
Типологический признак — характер
производства.
32.
4. Оригинальный, референтный,взаимозаменяемый, воспроизведенный
лекарственные средства. Типологический
признак — первичность регистрации.
33.
5. Патентованные, непатентованныелекарственные средства. Типологический
признак — правовая защита
6. Новые, известные лекарственные
средства. Типологический признак —
новизна.
7. Рецептурные, безрецептурные
лекарственные средства. Типологический
признак - вид отпуска.
34.
8. Подлинные, фальсифицированное лекарственныесредства. Типологический признак - подлинность.
9. Доброкачественные, недоброкачественные или
забракованные. Типологический признак - качество.
• фальсифицированное лекарственное средство лекарственное средство, сопровождаемое ложной
информацией о его составе и (или) производителе;
• недоброкачественное лекарственное средство лекарственное средство, не соответствующее
требованиям фармакопейной статьи либо в случае ее
отсутствия требованиям нормативной документации
или нормативного документа;
• контрафактное лекарственное средство лекарственное средство, находящееся в обороте с
нарушением гражданского законодательства;
35.
Анатомо-терапевтическо-химическаяклассификация (АТХ) это международная
система классификации лекарственных
средств. Латинское название - Anatomical
Therapeutic Chemical Classification System (ATC).
АТХ классификация разработана в середине 70-х
годов прошлого столетия, но только в 1990
году ее обнародовала Европейская
ассоциация исследований фармацевтического
рынка (European Pharmaceutical Market
Research Assiciation, EPhMRA) - для
определения размера и анализа потребности
рынка лекарственных препаратов и
поддержания его конкурентоспособности.
36.
1-й уровень - 14 основных анатомическихгрупп
2-й уровень, основная терапевтическая
группа
3-й уровень, терапевтическая группа
4-й уровень, химико-терапевтическая
подгруппа
5-й уровень, химические субстанции
37.
АТХ (АТС) - классификация• A Пищеварительный тракт и обмен
веществ
• B Кровь и система кроветворения
• C Сердечно-сосудистая система
• D Дерматологические препараты
• G Mочеполовая система и половые
гормоны
• H Гормональные препараты для
системного назначения (исключая
половые гормоны)
38.
• J Противомикробные препаратысистемного действия
• L Противоопухолевые и
иммуномодулирующие препараты
• M Костно-мышечная система
• N Нервная система
• P Противопаразитарные препараты,
инсектициды и репелленты
• R Дыхательная система
• S Органы чувств
• V Прочие препараты
39.
Кодировка препарата ФуросемидАТС (ВОЗ): Весь код: С03СА01
С - Сердечно-сосудистая система
03 - Мочегонные средства
С - Высокоактивные диуретики (петлевые)
А - Простые препараты сульфаниламидов
(сульфонамиды)
• 01 - Фуросемид
40.
Классификациямедицинских изделий
Минздрава России
от 06.06.2012 N 4н
"Об утверждении номенклатурной
классификации медицинских изделий"
41.
• Номенклатурная классификациямедицинских изделий (далее классификация) по видам содержит
числовое обозначение (номер) вида
медицинского изделия, а также
девятизначные цифровые коды (ААА ББ ВВ
ГГ), используемые для определения видов
медицинских изделий.
42.
Алгоритм кодирования,применяемый для
классификации медицинских
изделий по видам
43.
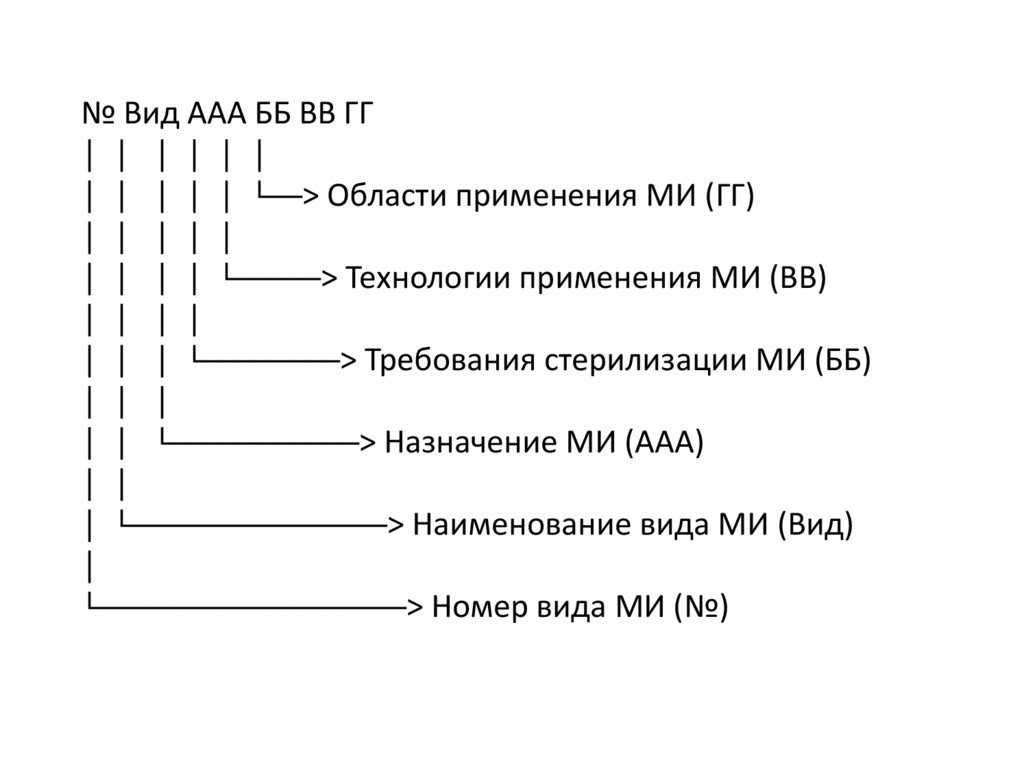
№ Вид ААА ББ ВВ ГГ│ │ │ │ │ │
│ │ │ │ │ └──> Области применения МИ (ГГ)
│ │ │ │ │
│ │ │ │ └─────> Технологии применения МИ (ВВ)
│ │ │ │
│ │ │ └────────> Требования стерилизации МИ (ББ)
│ │ │
│ │ └───────────> Назначение МИ (ААА)
│ │
│ └───────────────> Наименование вида МИ (Вид)
│
└──────────────────> Номер вида МИ (№)
44.
Таблица 1. Назначение МИпо классификационному признаку (ААА)
Таблица 2. Требования стерилизации МИ
по классификационному признаку (ББ)
Таблица 3. Технологии применения МИ
по классификационному признаку (ВВ)
Таблица 4. Области медицинского
применения МИ по классификационному
признаку (ГГ)
45.
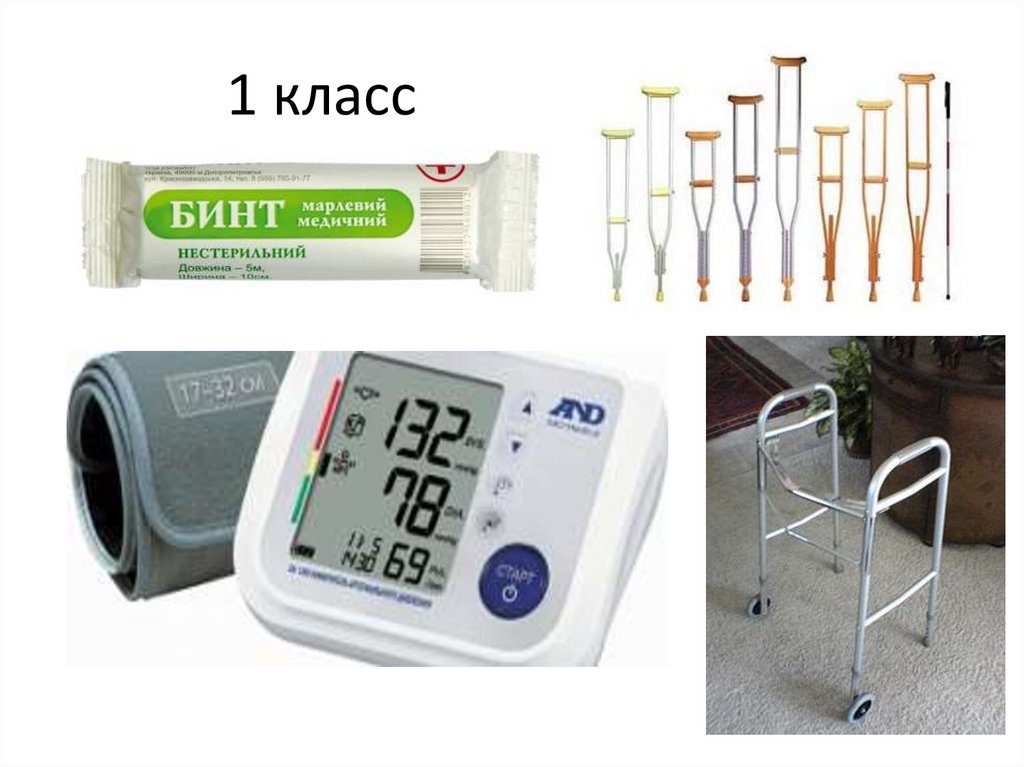
КЛАССИФИКАЦИЯ МИ• класс 1 - медицинские изделия с низкой
степенью риска;
• класс 2а - медицинские изделия со средней
степенью риска;
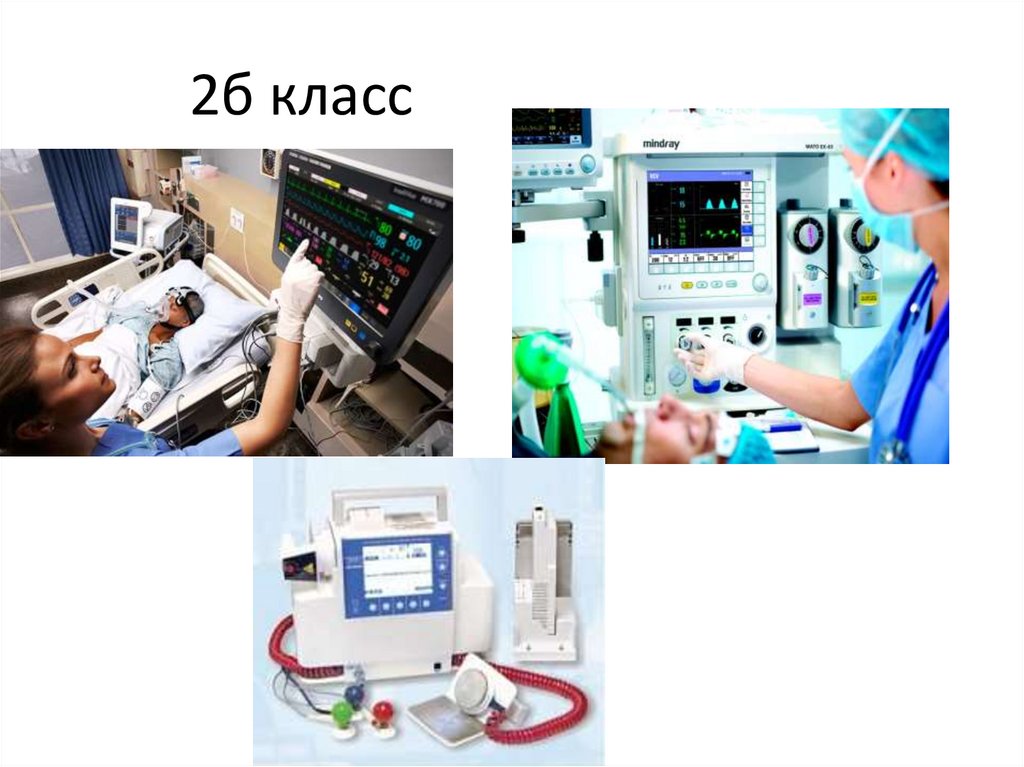
• класс 2б - медицинские изделия с
повышенной степенью риска;
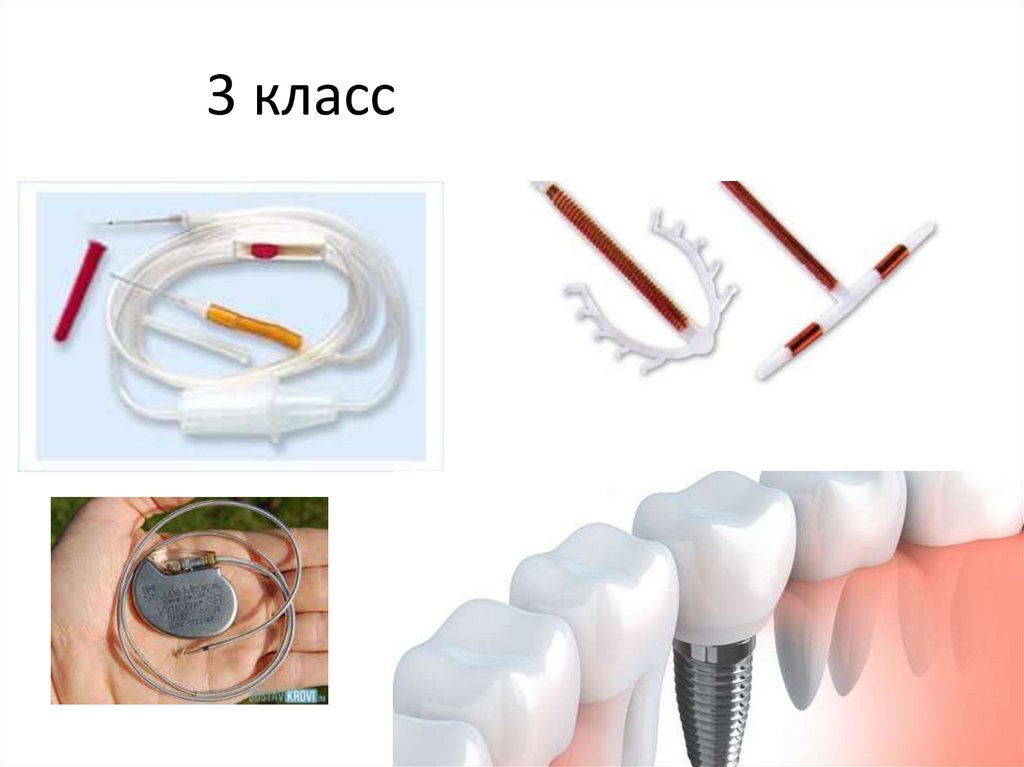
• класс 3 - медицинские изделия с высокой
степенью риска.
46.
47.
1 класс48.
2а класс49.
2б класс50.
3 класс51.
Классификация упаковкиУпаковка — средство или комплекс средств,
совместно обеспечивающих защиту и
сохранность лекарственных средств от
повреждений и потерь, а также
окружающей среды от загрязнений в
процессе обращения (транспортирования,
хранения и реализации) лекарственных
средств
52.
Упаковка состоит:Тара
Укупорочные средства
Средства дозирования
Средства доставки
Вспомогательные укупорочные средства и
т.д.
53.
Классификация упаковкилекарственных препаратов
1. Первичная или индивидуальная
упаковка (потребительская тара).
Первичная упаковка имеет
непосредственный контакт с товаром, т.е.
лекарственным препаратом. Это флаконы,
тубы, ампулы, пакеты, контурная упаковка,
капсулы и др. Стоимость первичной
упаковки целиком входит в стоимость
товара и оплачивается потребителем.
54.
2. Вторичная упаковка.Вторичная упаковка служит для размещения
единичной первичной упаковки или она
объединяет несколько первичных упаковок.
Это картонные коробки, пачки и др.
Вторичная упаковка несет наиболее полную
информацию о лекарственном препарате,
обеспечивая его потребительские свойства.
55.
3. Групповая упаковка.Групповая упаковка служит для размещения
вторичные упаковок. Она формируется из
термоусадочных пленок или
картонных коробок с прокладками,
которые выполняют функцию амортизатора
при транспортировании. Групповая
упаковка обеспечивает надежный учет
и контроль товара, т.к. несет
соответствующую информацию.
56.
4. Транспортная упаковка.Транспортная упаковка доставляет товар до
места назначения. В качестве транспортной
упаковки используются ящики
фанерные, мешки тканевые и бумажные,
бочки, контейнеры. Свободные места
в транспортной таре заполняются алигнином,
бумагой или полимерной стружкой.
57.
По степени защиты от вскрытия• Контроль первого вскрытия – упаковка,
предусматривающая невозможность
использования ее содержимого без
очевидного нарушения специального
элемента упаковки, необратимо
изменяющегося при первом вскрытии, что
позволяет отслеживать признаки первого
вскрытия.
58.
По степени защиты от вскрытия• Упаковка с защитой от вскрытия детьми –
упаковка, труднодоступная для вскрытия
маленькими детьми, но доступная к
использованию взрослыми.
59.
По защите от факторов внешнеговоздействия
• Хорошо укупоренная упаковка – упаковка,
обеспечивающая защиту содержимого от
попадания извне посторонних твердых,
жидких газообразных веществ, и/или
потери содержимого при обычных условиях
хранения, транспортирования и
реализации (влажность 60+5%,температура
15-20*С)
60.
По защите от факторов внешнеговоздействия
• Плотно укупоренная упаковка – упаковка,
обеспечивающая защиту содержимого от
попадания извне посторонних твердых,
жидких и газообразных веществ, и/или
потери содержимого, выветривания,
расплывания или испарения при обычных
условиях хранения, транспортирования и
реализации.
61.
По защите от факторов внешнеговоздействия
• Герметично укупоренная упаковка –
упаковка, обеспечивающая защиту
содержимого от попадания извне
посторонних веществ, и/или потери
содержимого, обеспечивающая
непроницаемость для твердых, жидких и
газообразных веществ при обычных
условиях хранения, транспортирования и
реализации.
62.
• плотно укупоренная упаковка = герметичноукупоренная упаковка
• герметично укупоренная упаковка ≠ плотно
укупоренная упаковка
63.
По защите от факторов внешнеговоздействия
• Герметично запаянная упаковка – упаковка,
обеспечивающая герметичность с помощью
расплавленного материала упаковки.
• Воздухонепроницаемая упаковка – плотно
укупоренная упаковка, обеспечивающая
непроницаемость для воздуха, газов, паров
и других газообразных веществ при
обычных условиях хранения,
транспортирования, реализации.
64.
По защите от факторов внешнеговоздействия
• Влагонепроницаемая упаковка – плотно
укупоренная упаковка, обеспечивающая
непроницаемость для воды, влаги и других
жидких веществ при обычных условиях
хранения, транспортирования, реализации.
• Герметично укупоренная упаковка =
воздухо- и влагонепроницаемая упаковка
65.
По защите от факторов внешнеговоздействия
• Светозащитная упаковка – упаковка,
обеспечивающая защиту содержимого от
действия световой энергии за счет особенных
свойств используемого упаковочного
материла или за счет специального покрытия
упаковки.
• Изотермическая упаковка – упаковка, внутри
которой сохраняется заданная температура в
течение установленного времени.
66.
По защите от факторов внешнеговоздействия
• Вакуумная упаковка – упаковка, внутреннее
давление в которой ниже атмосферного
67.
По количеству использований иколичеству доз
• Одноразовая упаковка – упаковка, содержащая
лекарственное средство в количестве,
предназначенном для полного использования
непосредственно после вскрытия упаковки.
• Многоразовая упаковка - упаковка, содержащая
лекарственное средство в количестве, которое
предполагается использовать многократно по
частям, последовательно отбирая содержащееся в
ней лекарственное средство без изменения
безопасности, качества, чистоты оставшейся части
лекарственного средства до его полного
использования.
68.
По количеству использований иколичеству доз
• Однодозная упаковка – упаковка,
содержащая лекарственный препарат в
твердой, мягкой или жидкой лекарственной
форме в количестве, соответствующем
одной дозе.
• Многодозная упаковка - упаковка,
содержащая лекарственный препарат в
количестве, соответствующем более одной
дозы лекарственного препарата. Она может
быть дозированная и недозированная.
69.
По типу и виду• Ампула, баллон, банка и т.д.
• Контурная безъячейковая упаковка (стрип)
– гибкая упаковка из комбинированных
материалов с лекарственным средством.
Запечатанным между двумя слоями
упаковки, из которых лекарственное
средство извлекается путем надрыва
70.
По типу и виду• Контурная ячейковая упаковка (блистер) –
гибкая упаковка из комбинированных
материалов с лекарственным средством.
Запечатанным между двумя слоями
упаковки, один из которых представляет
собой перфорированные ячейки,
повторяющие форму упаковываемого
лекарственного препарата, который
извлекается путем выдавливания или
вскрытия.
71.
По механическим свойствам• Жесткая – упаковка, форма и размеры которой
не изменяются при наполнении или удалении
содержимого
• Мягкая - упаковка, форма и размеры которой
изменяются при наполнении или удалении
содержимого
• Хрупкая – упаковка, чувствительная к
воздействию динамических нагрузок
• Гибкая – упаковка, изготовленная из легко
сгибаемых упаковочных материалов на основе
бумаги, фольги, полимеров, картона
72.
Требования, предъявляемые купаковке
1. Чистота.
Материал не должен содержать канцерогенных
и токсических веществ и иметь
постороннего запаха. Все материалы
проходят токсикологические, санитарнохимические испытания. Допускается слабый
запах для материалов из резины и
полиэтилена низкой плотности. Материалы
должны иметь разрешение к применению
Минздрава РФ.
73.
2. Упаковка должнаиметь гладкую поверхность.
3. Упаковочный материал должен быть:
- газо-, влаго - и светонепроницаемым;
- индифферентным к лекарственным
препаратам;
- достаточно прочным, чтоб выдерживать
нагрузки при перемещении
и транспортировании;
- устойчивым к стерилизации и дезинфекции.
74.
4. Упаковка фармацевтических имедицинских товаров должна надежно
защищать лекарственный препарат от
воздействия факторов внешней среды
при транспортировании и хранении кислорода и углекислого газа, повышенной
и пониженной температуры, УФ- лучей,
повышенной влажности, агрессивных сред.
75.
5. Упаковка фармацевтических имедицинских товаров должна обеспечивать
невозможность подделки содержимого, то
есть невозможность вскрытия до
употребления лекарственного препарата.
Такая упаковка
называется антиинтрузионной.
76.
Это могут быть:- защитное кольцо на металлической или пластмассовой
крышке;
- отрывной язычок на жестяных банках;
- алюминиевая фольга по периметру жестяной банки;
- отрывная полоска;
- клапанная пробка;
- запайка горловины тубы;
- этикетка-бандероль;
- новые технологии тиснения, когда в пробку помещаются
индикаторы технологии тиснения, когда в пробку
помещаются индикаторы целостности,
которые невозможно подделать.
77.
6. Упаковка фармацевтических имедицинских товаров должна быть
непроницаемой, чтобы
избежать миграции препарата в
окружающую среду, особенно токсичных
лекарственных препаратов.
7. Упаковка фармацевтических и
медицинских товаров должна защищать
товар от ударов и напряжения.
78.
8. Упаковка фармацевтических и медицинскихтоваров должна
обеспечивать потребительские свойства
товаров:
- соответствовать назначению;
- быть носителем научной, эстетической и
рекламной информации;
- обеспечивать удобство ношения и
возможность повторного использования;
- упаковка должна легко уничтожаться или
перерабатываться
79.
9. Упаковка должна обеспечиватьмногократное использование
без нарушения герметичности остающегося
препарата
10. Упаковка должна вписываться в
технологический процесс, т.е. обеспечивать
возможность применения автоматов.
11. Упаковка должна быть экономически
целесообразной (не должна стоить дороже
товара). Должна гарантировать от ошибок и
неправильностей при отпуске и
использовании товара.
80.
12. Упаковка, по возможности, должны иметьзащитные устройства
от вскрытия малолетними детьми.
13. Одно из основных требований к
современной упаковке разработка фирменного стиля упаковки.
81.
основные требования к первичнойупаковке,
1. Конструктивные требования к первичной
упаковке.
2. Требования к материалам.
3. Общие требования к упаковке.
4. Специфические требования, зависящие от
типа препарата, конструкции упаковки и
технологии изготовления.
82.
1. Конструктивные требования кпервичной упаковке
• защиту ЛП от воздействия неблагоприятных
воздействий внешней среды;
• предохранять от механических воздействий;
• обеспечить герметичность и стабильность;
• защиту от микробного загрязнения;
• дозированное или поштучное извлечение ЛП;
• эстетичный внешний вид и удобство использования;
• элементы конструкции должны быть
стандартизированы, не должно быть отклонений от
геометрических размеров;
• элементы первичной упаковки должны быть
сконструированы с возможностью их автоматической
обработки и герметичного соединения на
автоматическом оборудовании.
83.
2. Материалы первичной упаковкине должны содержать
• тяжелых металлов, мышьяка, других
вредных примесей, в количествах,
превышающих нормативы;
• красителей, не разрешенных к
применению;
• канцерогенных и токсичных компонентов;
• постороннего запаха;
• микробной обсемененности выше
установленных норм;
84.
Не допускается:• повреждения защитных покрытий;
• наличия механических загрязнений;
• материалы не должны быть хрупкими и
должны выдерживать термическую и
механическую обработку, обработку
дезинфицирующими растворами;
• материалы должны быть нейтральными и
не вступать во взаимодействие с
компонентами ЛП.
85.
3. Общие требования к упаковке:• четкость напечатанных на упаковке текстов;
• краткая аннотация или инструкция по
применению;
• цветное оформление;
• отсутствие вспомогательных средств для
вскрытия упаковки;
• по возможности наличие контроля первого
вскрытия;
• безопасность в обращении, отсутствие острых
углов и краев.
86.
4. Специфические требования купаковке
Определяются типом лекарственного препарата и
технологическим процессом его изготовления.
Например, при хранении ряда препаратов не
допускается воздействие на них прямого
солнечного света, поэтому упаковка должна быть
непрозрачной или, например, для стеклянных
флаконов выполнена из оранжевого стекла. Для
инъекционных растворов, глазных капель,
наоборот, упаковка должна быть максимально
прозрачна для возможности контроля
микрозагрязнений.
87.
Виды первичной упаковки длялекарственных средств
Жесткая упаковка:
металл используется для первичной тары: банок,
пробирок (для упаковки таблеток, драже,
порошков, гранул, капсул), аэрозольных баллонов,
туб (для мазей, паст, линиментов);
стекло используется для производства банок,
пробирок, флаконов, бутылок (в них запаковывают
таблетки, драже, порошки, гранулы, капсулы, мази,
пасты, линименты, глазные капли), ампул;
полимер используют для изготовления пробирок,
стаканчиков, банок (они используются для упаковки
таблеток, драже).
88.
Полужесткая упаковка:картон используют для производства коробок, пачек
(для пластырей, растительных лекарственных
средств);
полимеры используют для производства шприцтюбиков (для лекарственных форм,
предназначенных для инъекций); тюбиккапельницы применяют для упаковки глазных
капель; контуров, используемых для упаковки
суппозиториев;
комбинированный материал применяют для
контурной упаковки суппозиториев, таблеток,
драже, капсул, порошков, гранул, растительных
лекарственных средств.
89.
Мягкая упаковка:из полимера применяется как упаковка в
виде пакетов для порошков, гранул,
пластырей;
бумажная упаковка в виде пакета, завертки
используется для упаковки драже, таблеток,
растительных лекарственных средств.
90.
МАРКИРОВКАМаркировка (маркирование) - нанесение на продукцию,
тару, упаковку условных рисунков, цифровых, буквенночисловых или символических знаков, обозначающих
наименование предприятия-изготовителя, его
местонахождение и подчиненность, марку, и т.д.
Маркировка (нем. mark — знак, markiren - обозначать,
отличать знаком) — это обязательная информация,
нанесенная на изделие или упаковку в виде комплексов
знаков или символов, характеризующих это изделие.
Маркировка подразделяется на потребительскую и
транспортную.
91.
92.
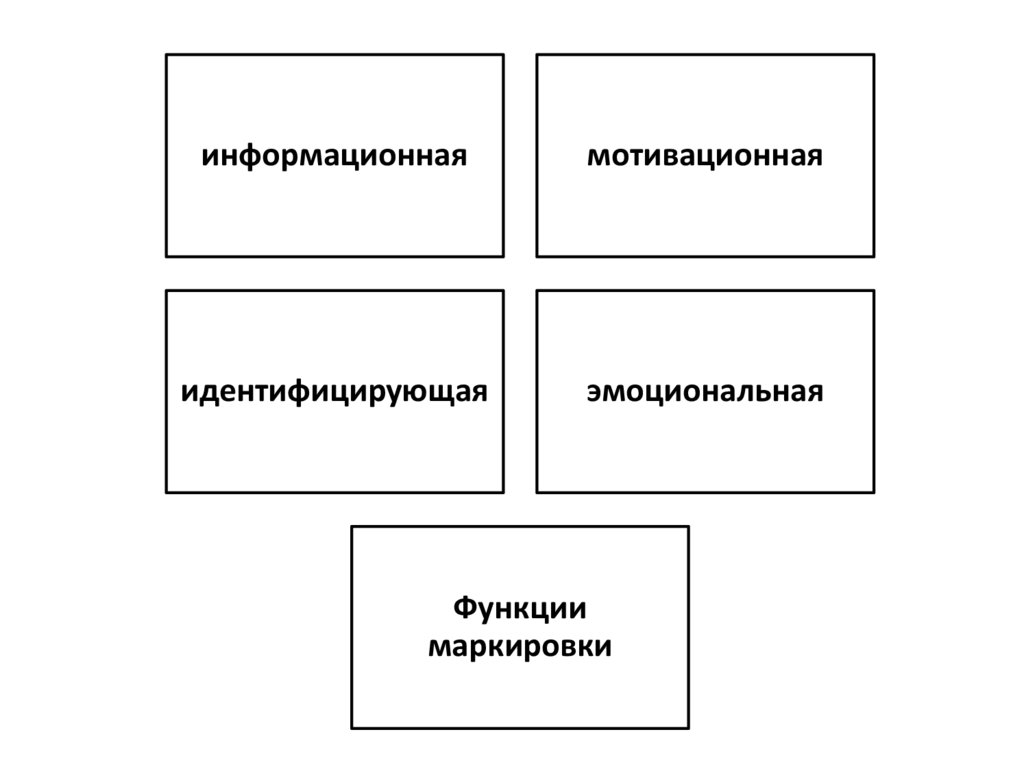
информационнаямотивационная
идентифицирующая
эмоциональная
Функции
маркировки
93.
Маркировка — это одно из средств товарнойинформации, которое представляет собой
текст, условные обозначения или рисунок,
нанесенные на упаковку и (или) товар и
предназначенные для идентификации товара
или отдельных его свойств, доведения до
потребителя информации об изготовителях,
качественных и количественных
характеристиках товара.
Маркировка может включать три элемента:
текст, рисунок и информационные знаки.
94.
Способы нанесения маркировкиТипографический
Штемпельный
Ручной
Компьютерный
95.
96.
первичная упаковка(за исключением ЛРП) 61-ФЗ от 2010 г.
на русском языке указывают:
наименование лекарственного препарата
(международное непатентованное, или
группировочное, или химическое, или
торговое наименование)
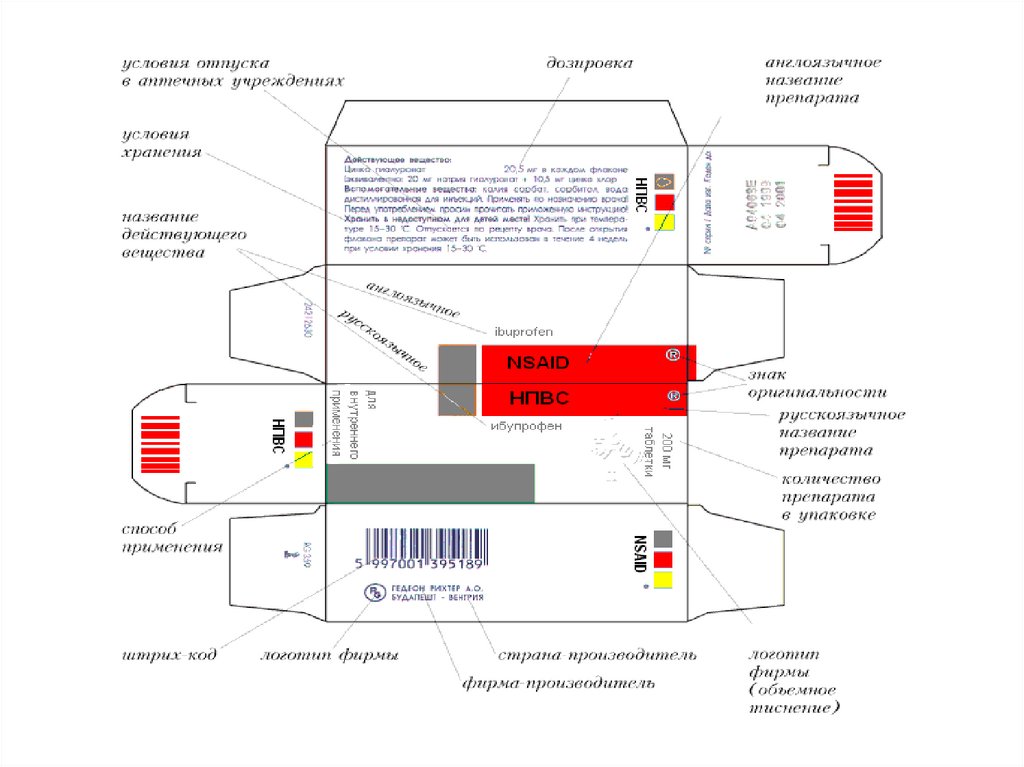
номер серии
дата выпуска (для иммунобиологических
лекарственных препаратов)
срок годности
дозировка или концентрация, объем,
активность в единицах действия или
количество доз;
97.
вторичная (потребительская)упаковка
указаны наименование лекарственного препарата
торговое наименования и международное
непатентованное, или группировочное, или
химическое
наименование производителя
номер серии
дата выпуска (для иммунобиологических
лекарственных препаратов)
номер регистрационного удостоверения
срок годности
способ применения
98.
вторичная (потребительская)упаковка
дозировка или концентрация
объем
активность в единицах действия либо
количество доз в упаковке
лекарственная форма
условия отпуска
условия хранения
предупредительные надписи.
99.
Дополнительные надписи• Лекарственные средства в качестве сывороток
должны поступать в обращение с указанием
животного, из крови, плазмы крови, органов и
тканей которого они получены.
• На вторичную (потребительскую) упаковку
лекарственных средств, полученных из крови,
плазмы крови, органов и тканей человека,
должна наноситься надпись: "Антитела к ВИЧ1, ВИЧ-2, к вирусу гепатита C и поверхностному
антигену вируса гепатита B отсутствуют".
100.
На первичную упаковку и вторичную(потребительскую) упаковку
радиофармацевтических лекарственных
средств должен наноситься знак
радиационной опасности.
На вторичную (потребительскую) упаковку
гомеопатических лекарственных
препаратов должна наноситься надпись:
"Гомеопатический".
101.
На вторичную (потребительскую) упаковкулекарственных растительных препаратов
должна наноситься надпись: "Продукция
прошла радиационный контроль".
На первичную упаковку (если для этого
существует техническая возможность) и
вторичную (потребительскую) упаковку
лекарственных препаратов, предназначенных
для клинических исследований, должна
наноситься надпись: "Для клинических
исследований".
102.
На вторичную (потребительскую) упаковкулекарственного препарата наносится
штриховой код.
На первичную упаковку и вторичную
(потребительскую) упаковку лекарственных
средств для ветеринарного применения
должна наноситься надпись: "Для
ветеринарного применения".
103.
На транспортную тару, которая непредназначена для потребителей и в
которую помещено лекарственное
средство, должна наноситься информация:
наименование,
серия лекарственного средства,
дата выпуска,
количестве вторичных (потребительских)
упаковок лекарственного средства,
срок годности лекарственного средства,
условия его хранения
104.
О производителе лекарственного средства:наименование,
место нахождения производителя
лекарственного средства (адрес, в том
числе страна и (или) место производства
лекарственного средства.
Условия хранения и перевозки, необходимые
предупредительные надписи и
манипуляторные знаки.
105.
Требования к упаковке имаркировке БАД
Постановление Главного государственного
санитарного врача РФ от 17.04.2003 №50 «О
введении в действие санитарноэпидемиологических правил и нормативов
СанПиН 2.3.2.1290-03″ (вместе с «СанПиН
2.3.2.1290-03. 2.3.2. Продовольственное сырье
и пищевые продукты. Гигиенические
требования к организации производства и
оборота биологически активных добавок к
пище (БАД). Санитарно-эпидемиологические
правила и нормативы» )
106.
Требования к упаковке БАД1. Упаковка БАД должна обеспечивать сохранность
и качество на всех этапах оборота.
2. При упаковке БАД должны использоваться
материалы, разрешенные для использования в
установленном порядке для контакта с пищевыми
продуктами или лекарственными средствами.
3. Требования к информации, нанесенной на
этикетку БАД, устанавливаются в соответствии с
действующими законодательными и
нормативными документами, регламентирующими
вынесение на этикетку информации для
потребителя.
107.
Требования к маркировке БАД-наименования БАД, и в частности:
- товарный знак изготовителя (при наличии);
- обозначения нормативной или технической
документации, обязательным требованиям которых
должны соответствовать БАД (для БАД отечественного
производства и стран СНГ);
- состав БАД с указанием ингредиентного состава в
порядке, соответствующем их убыванию в весовом или
процентном выражении;
- сведения об основных потребительских свойствах
БАД;
- сведения о весе или объеме БАД в единице
потребительской упаковки и весе или объеме единицы
продукта;
108.
- сведения о противопоказаниях дляприменения при отдельных видах
заболеваний;
- указание, что БАД не является лекарством;
- дата изготовления, гарантийный срок
годности или дата конечного срока
реализации продукции;
- условия хранения;
- информация о государственной регистрации
БАД с указанием номера и даты;
- место нахождения, наименование
изготовителя (продавца) и место нахождения и
телефон организации, уполномоченной
изготовителем (продавцом) на принятие
претензий от потребителей.
109.
• Информация, предусмотренная настоящейстатьей, доводится до сведения
потребителей в любой доступной для
прочтения потребителем форме.
• Использование термина «экологически
чистый продукт» в названии и при
нанесении информации на этикетку БАД, а
также использование иных терминов, не
имеющих законодательного и научного
обоснования, не допускается.
110.
Информация о медицинскихизделиях
(постановление Правительства РФ от 19.01.1998 №55 «Об
утверждении Правил продажи отдельных видов
непродовольственных товаров надлежащего качества»)
Информация о медицинских изделиях должна содержать :
сведения о номере и дате регистрационного
удостоверения на медицинское изделие, выданного
Федеральной службой по надзору в сфере
здравоохранения
с учетом особенностей конкретного вида товара сведения
о его назначении
способе и условиях применения
действии и оказываемом эффекте
ограничениях (противопоказаниях) для применения.
111.
ПиктограммыСертификация / декларирование по
Техническому Регламенту Таможенного
Союза
112.
Товар изготовлен изпереработанного сырья или товар
пригодный для переработки
Возможность утилизации (петля Мебиуса)
113.
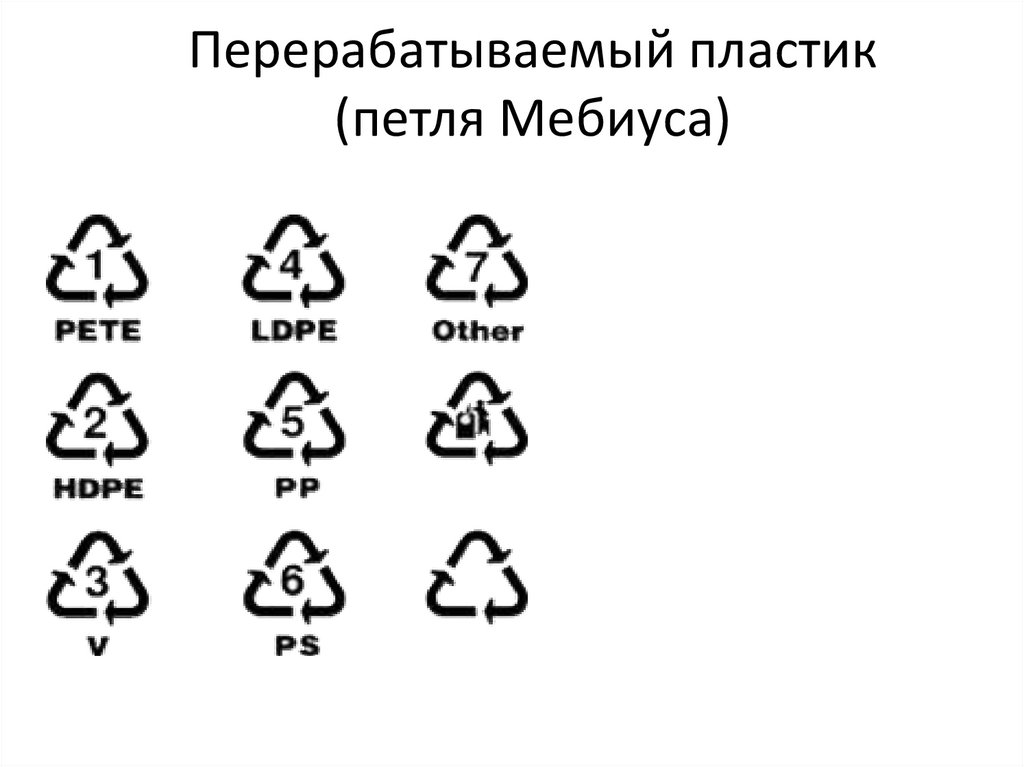
Перерабатываемый пластик(петля Мебиуса)
114.
1. PETE — Полиэтилентерфталат2. HDPE — Полиэтилен высокой плотности
3. PVC ПВХ — Поливинилхлорид
4. LDPE — Полиэтилен низкой плотности
5. PP — Полипропилен
6. PS — Полистирол
7. Другие виды пластика
%% - сколько уже в этой упаковке содержится
переработанного сырья
115.
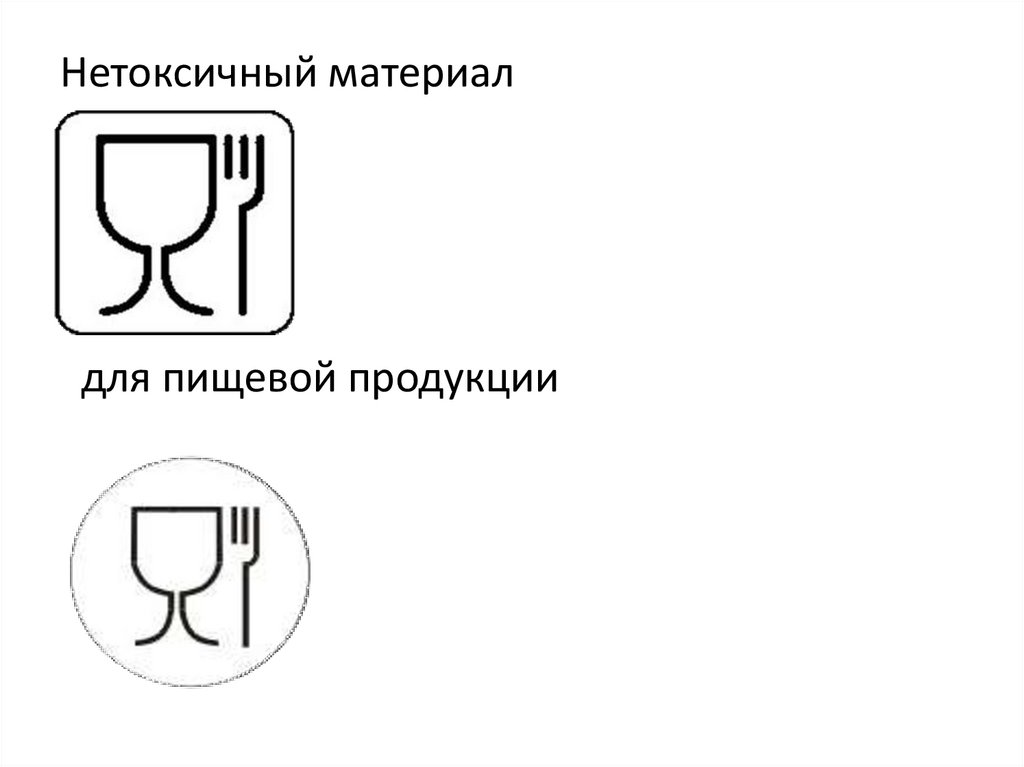
Нетоксичный материалдля пищевой продукции
116.
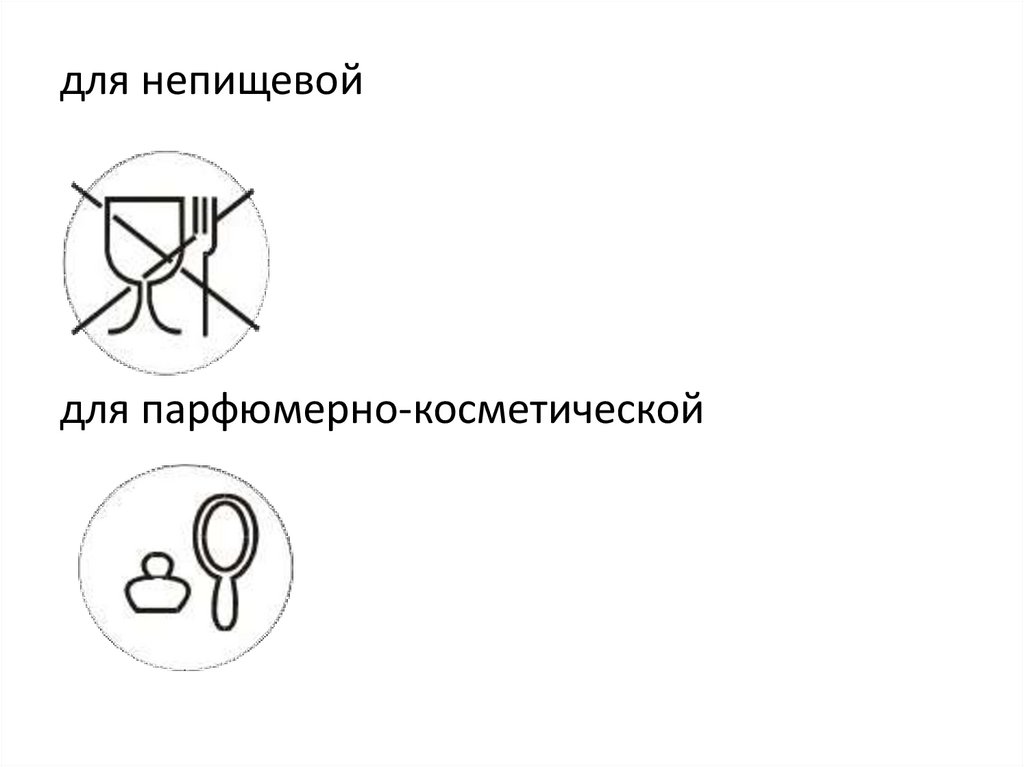
для непищевойдля парфюмерно-косметической
117.
Не подходит для детей до 3-х летПереработанная бумага
118.
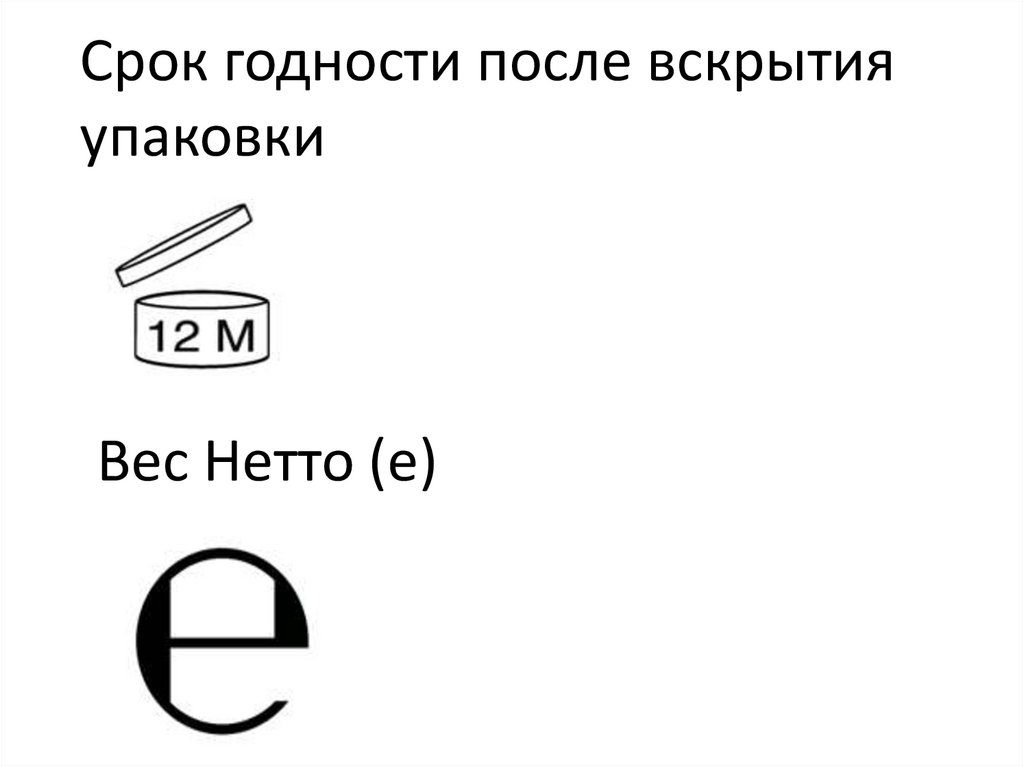
Срок годности после вскрытияупаковки
Вес Нетто (e)
119.
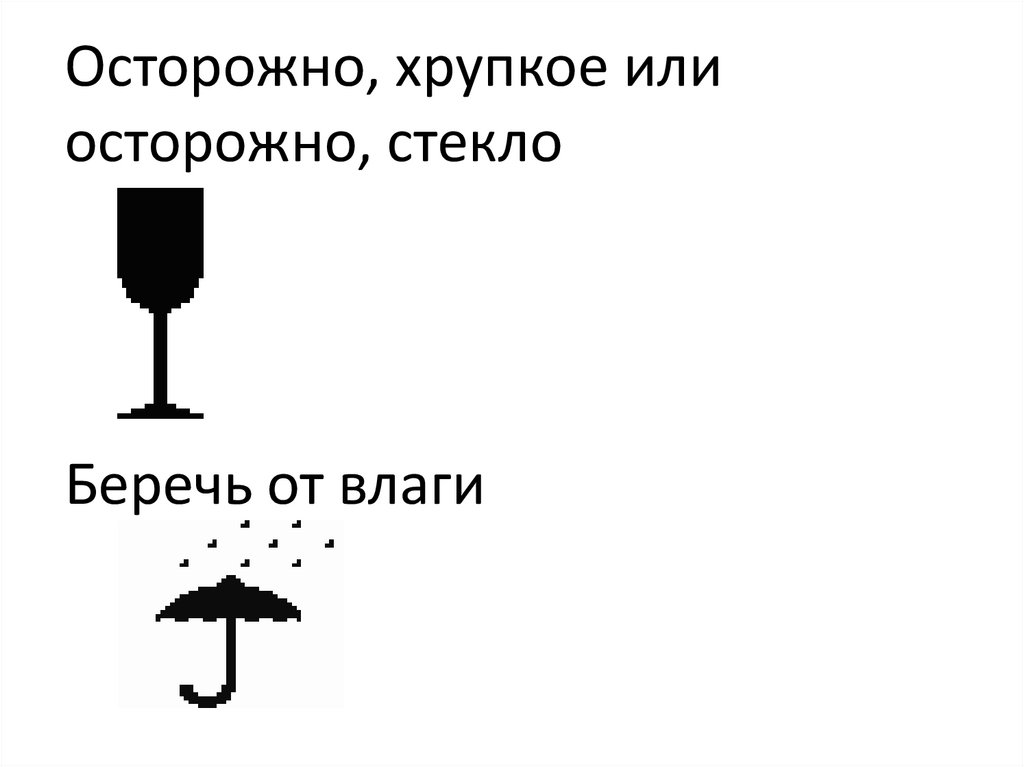
Осторожно, хрупкое илиосторожно, стекло
Беречь от влаги
120.
Ограничение температуры, рядом указываетсязначение. Например, 50°C
Упаковку следует
выбросить в урну
121.
Гос.регистрация лекарственных препаратов(ФЗ от 22.04.2010 №61-ФЗ)
Государственной регистрации подлежат:
1) все лекарственные препараты, впервые
подлежащие вводу в обращение в Российской
Федерации;
2) лекарственные препараты, зарегистрированные
ранее, но произведенные в других лекарственных
формах в соответствии с перечнем наименований
лекарственных форм, в новой дозировке при
доказательстве ее клинической значимости и
эффективности;
3) новые комбинации зарегистрированных ранее
лекарственных препаратов.
122.
Государственной регистрации не подлежат:1) лекарственные препараты, изготовленные аптечными
организациями, ветеринарными аптечными
организациями, индивидуальными
предпринимателями, которые имеют лицензию на
фармацевтическую деятельность, по рецептам на
лекарственные препараты и требованиям медицинских
организаций, ветеринарных организаций;
2) лекарственные препараты, приобретенные
физическими лицами за пределами Российской
Федерации и предназначенные для личного
использования;
3) лекарственные препараты, ввозимые в Российскую
Федерацию для оказания медицинской помощи по
жизненным показаниям конкретного пациента на
основании разрешения, выданного уполномоченным
федеральным органом исполнительной власти;
123.
4) лекарственные средства, ввозимые в РоссийскуюФедерацию на основании выданного уполномоченным
федеральным органом исполнительной власти
разрешения и предназначенные для проведения
клинических исследований лекарственных препаратов и
(или) проведения экспертизы лекарственных средств
для осуществления государственной регистрации
лекарственных препаратов;
5) фармацевтические субстанции;
6) радиофармацевтические лекарственные препараты,
изготовленные непосредственно в медицинских
организациях в порядке, установленном
уполномоченным федеральным органом
исполнительной власти;
7) лекарственные препараты, производимые для экспорта.
124.
Не допускается государственная регистрация:1) лекарственных препаратов, отличающихся
друг от друга качественным составом
действующих веществ, под одинаковым
торговым наименованием;
2) одного лекарственного препарата,
выпускаемого производителем под
различными торговыми наименованиями и
представленного на государственную
регистрацию в виде двух и более
лекарственных препаратов.
125.
• Регистрационное удостоверение лекарственногопрепарата с указанием лекарственных форм и
дозировок выдается бессрочно, за исключением
регистрационного удостоверения лекарственного
препарата, выдаваемого со сроком действия пять
лет, на впервые регистрируемые в Российской
Федерации лекарственные препараты.
• По истечении указанного в части 1 настоящей статьи
срока выдается бессрочное регистрационное
удостоверение лекарственного препарата при
условии подтверждения его государственной
регистрации.
126.
Отмена гос.регистрацииРешение об отмене государственной регистрации
лекарственного препарата и исключении
лекарственного препарата из государственного реестра
лекарственных средств принимается уполномоченным
федеральным органом исполнительной власти в случае:
1) представления соответствующим уполномоченным
федеральным органом исполнительной власти
заключения о риске или об угрозе здоровью, жизни
человека или животного при применении
лекарственного препарата, превышающих его
эффективность, по результатам осуществляемого им
мониторинга безопасности лекарственного препарата;
2) подачи держателем или владельцем регистрационного
удостоверения лекарственного препарата или
уполномоченным им другим юридическим лицом
заявления об отмене государственной регистрации
лекарственного препарата;
127.
3) неподтверждения государственной регистрациилекарственного препарата по истечении срока
действия регистрационного удостоверения,
выданного на пять лет;
4) непредставления заявителем информации, которая
может повлечь за собой необходимость внесения
изменений в документы, содержащиеся в
регистрационном досье на зарегистрированный
лекарственный препарат, в течение тридцати
рабочих дней со дня наступления этих изменений;
5) осуществления государственной регистрации
лекарственного препарата под торговым
наименованием зарегистрированного ранее под
этим торговым наименованием лекарственного
препарата, отличающегося качественным составом
действующих веществ;
128.
6) осуществления государственнойрегистрации заявителем одного и того же
лекарственного препарата под различными
торговыми наименованиями;
7) вынесения судом решения о нарушении
прав правообладателя объектов
интеллектуальной собственности при
обращении лекарственных средств;
8) отсутствия лекарственного препарата в
обращении в Российской Федерации в
течение трех и более лет;
129.
9) невыполнения держателем или владельцемрегистрационного удостоверения лекарственного
препарата либо уполномоченным ими другим
юридическим лицом мероприятий по обеспечению
безопасности лекарственных препаратов,
установленных уполномоченным федеральным
органом исполнительной власти
10) отказа держателя или владельца
регистрационного удостоверения лекарственного
препарата либо уполномоченного ими другого
юридического лица от внесения изменений в
инструкцию по применению лекарственного
препарата, касающихся новых подтвержденных
данных о том, что риск причинения вреда здоровью
человека или животного вследствие приема
лекарственного препарата превышает
эффективность его применения.
130.
Государственный реестр лекарственныхсредств
1) в отношении лекарственных препаратов:
а) наименование лекарственного препарата
(международное непатентованное, или
группировочное, или химическое и торговое
наименования);
б) лекарственная форма с указанием дозировки
лекарственного препарата и его количества в
потребительской упаковке;
в) наименование держателя или владельца
регистрационного удостоверения
лекарственного препарата;
131.
г) наименование и адрес производителялекарственного препарата;
д) фармакотерапевтическая группа, код
лекарственного препарата по анатомотерапевтическо-химической
классификации, рекомендованной
Всемирной организацией
здравоохранения;
е) показания и противопоказания к
применению лекарственного препарата;
ж) побочные действия лекарственного
препарата;
132.
з) срок годности лекарственного препарата;и) условия хранения лекарственного препарата;
к) условия отпуска лекарственного препарата;
л) номер фармакопейной статьи или в случае ее
отсутствия номер нормативной документации
либо нормативного документа;
м) дата государственной регистрации
лекарственного препарата и его
регистрационный номер, дата замены
регистрационного удостоверения
лекарственного препарата на бессрочное
регистрационное удостоверение
лекарственного препарата, дата подачи
заявления о подтверждении государственной
регистрации лекарственного препарата, дата
отмены государственной регистрации
лекарственного препарата;
133.
н) качественный состав и количественныйсостав действующих веществ и
качественный состав вспомогательных
веществ лекарственного препарата;
о) информация обо всех разрешенных видах
вторичной (потребительской) упаковки;
п) дата принятия решения о возможности
рассматривать лекарственный препарат
при государственной регистрации в
качестве орфанного лекарственного
препарата;
134.
р) наличие лекарственного препарата в перечнежизненно необходимых и важнейших
лекарственных препаратов;
с) наличие в лекарственном препарате
наркотических средств, психотропных веществ
и их прекурсоров, подлежащих контролю в
Российской Федерации, в соответствии с
законодательством Российской Федерации,
международными договорами Российской
Федерации, в том числе Единой конвенцией о
наркотических средствах 1961 года и
Конвенцией о психотропных веществах 1971
года;
135.
т) информация о том, является ли данныйлекарственный препарат референтным
лекарственным препаратом;
у) сведения о подаче заявления о внесении
изменений в документы, содержащиеся в
регистрационном досье на лекарственный
препарат;
ф) сведения о взаимозаменяемости
лекарственного препарата;
х) срок введения лекарственного препарата в
гражданский оборот;
136.
ПОСТАНОВЛЕНИЕ ПРАВИТЕЛЬСТВА РФот 19 июня 2012 г. N 615
«ОБ УТВЕРЖДЕНИИ ПРАВИЛ
ВЕДЕНИЯ ГОСУДАРСТВЕННОГО РЕЕСТРА
МЕДИЦИНСКИХ ИЗДЕЛИЙ
И ОРГАНИЗАЦИЙ (ИНДИВИДУАЛЬНЫХ
ПРЕДПРИНИМАТЕЛЕЙ), ОСУЩЕСТВЛЯЮЩИХ
ПРОИЗВОДСТВО И ИЗГОТОВЛЕНИЕ
МЕДИЦИНСКИХ ИЗДЕЛИЙ»
137.
Реестр содержит следующие сведения:а) наименование медицинского изделия;
б) дата государственной регистрации
медицинского изделия и его регистрационный
номер, срок действия регистрационного
удостоверения;
в) назначение медицинского изделия,
установленное производителем;
г) вид медицинского изделия в соответствии с
номенклатурной классификацией
медицинских изделий, утверждаемой
Министерством здравоохранения Российской
Федерации;
138.
д) класс потенциального риска применениямедицинского изделия в соответствии с
номенклатурной классификацией
медицинских изделий, утверждаемой
Министерством здравоохранения
Российской Федерации;
е) код Общероссийского классификатора
продукции для медицинского изделияотменен;
ж) наименование и место нахождения
организации - заявителя медицинского
изделия;
139.
з) наименование и место нахожденияорганизации - производителя
(изготовителя) медицинского изделия или
фамилия, имя, отчество (если имеется),
место жительства индивидуального
предпринимателя - производителя
(изготовителя) медицинского изделия;
и) адрес места производства или
изготовления медицинского изделия;
к) сведения о взаимозаменяемых
медицинских изделиях.
140.
Минеральные воды141.
классификацияВ зависимости от общей минерализации
пресные (минерализация до 1 г на дм³
включительно);
слабоминерализованные (минерализация более 1
до 2 г на дм³ включительно);
маломинерализованные (минерализация более 2
до 5 г на дм³ включительно);
среднеминерализованные (более 5 до 10 г на дм³
включительно);
высокоминерализованные (более 10 до 15 г на дм³
включительно).
142.
от назначения• столовые — минеральные воды с
минерализацией менее 1 г на дм³ и с
содержанием биологически активных
компонентов менее установленной
концентрации; столовые воды пригодны
для ежедневного применения здоровыми
людьми без ограничений;
143.
• лечебные — минеральные воды сминерализацией более 10 г на дм³ или с
меньшей минерализацией, но при
превышении концентрации некоторых
биологически активных компонентов
установленных норм; лечебные
минеральные воды назначаются для
лечебно-профилактического приёма при
ряде заболеваний и не рекомендованы для
обычного столового питья.
144.
• лечебно-столовые — минеральные воды сминерализацией более 1 г и до 10 г на дм³
включительно при концентрации
биологически активных компонентов менее
установленных норм или минеральные воды с
минерализацией менее 1 г на дм³, но при
превышении некоторыми биологически
активными компонентами установленных
норм; лечебно-столовые воды допускаются
для столового потребления здоровыми
людьми без ограничений непродолжительный
период или нерегулярно; лечебно-столовые
воды могут применяться для профилактики и
лечения определённых заболеваний
145.
по химическому составу• Гидрокарбонатные (щелочные) —
предназначены для тех, кто занимается
спортом (оказывают благоприятное влияние
при усиленной мышечной работе,
восстанавливая резервную щелочность крови,
а также при диабете, инфекционных
заболеваниях). Применяются при лечении
мочекаменной болезни и подагры.
Противопоказания — гастрит (так как
выделяющийся при распаде гидрокарбонатов
углекислый газ стимулирует секрецию
желудочного сока);
146.
• сульфатные — рекомендуются тем, у когонаблюдаются проблемы с печенью и
желчным пузырем (в качестве
желчегонного, а также как слабительное),
ожирение и сахарный диабет.
Категорически нельзя употреблять такую
воду детям и подросткам, так как сульфаты
препятствуют росту костей, связывая
кальций пищи в просвете ЖКТ в
нерастворимые соли;
147.
• хлоридные — способствуют регулировкеработы кишечника, желчевыводящих путей
и печени. Противопоказания к применению
(категорически) — повышенное давление;
• магниевые — помогают
при стрессовых ситуациях.
Противопоказания — склонность к
расстройству желудка;
• железистые и другие.
148.
В зависимости от газового состава и наличияспецифических компонентов
углекислые,
сульфидные (сероводородные),
азотные,
кремнистые (H2SiO3), бромистые, йодистые,
железистые, мышьяковистые,
радиоактивные (Rn) и другие.
149.
Реакция воды (степень кислотности илищелочности, выражаемая величиной pH)
• кислые воды имеют pH = 3,5—6,8
• нейтральные — 6,8—7,2
• щелочные — 7,2—8,5 и выше.
150.
МИНИСТЕРСТВОЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ
ФЕДЕРАЦИИ
ПРИКАЗ
от 21 сентября 2016 г. N 724н
ОБ УТВЕРЖДЕНИИ ТРЕБОВАНИЙ
К ИНСТРУКЦИИ ПО
МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
151.
Инструкция по медицинскому применениюлекарственного препарата должна содержать
а) наименование лекарственного препарата
(международное непатентованное, или
группировочное, или химическое и торговое
наименования);
б) лекарственная форма с указанием наименований и
количественного состава действующих веществ и
качественного состава вспомогательных веществ
(при необходимости количественного состава
вспомогательных веществ);
в) описание внешнего вида лекарственного препарата
для медицинского применения;
152.
г) физико-химические свойства (длярадиофармацевтических лекарственных
препаратов);
д) фармакотерапевтическая группа, код
лекарственного препарата для медицинского
применения по анатомо-терапевтическохимической классификации,
рекомендованной Всемирной организацией
здравоохранения, или указание
"гомеопатический лекарственный препарат";
153.
е) фармакодинамика и фармакокинетика (заисключением фармакокинетики
гомеопатических лекарственных препаратов и
растительных лекарственных препаратов);
ж) показания для применения;
з) противопоказания для применения;
и) меры предосторожности при применении;
к) указание возможности и особенностей
применения лекарственного препарата для
медицинского применения беременными
женщинами, женщинами в период грудного
вскармливания, детьми, взрослыми,
имеющими хронические заболевания;
154.
л) режим дозирования, способы введения иприменения, при необходимости время приема
лекарственного препарата для медицинского
применения, продолжительность лечения, в том
числе у детей до и после одного года;
м) возможные нежелательные реакции при
применении лекарственного препарата для
медицинского применения;
н) симптомы передозировки, меры по оказанию
помощи при передозировке;
о) взаимодействие с другими лекарственными
препаратами и (или) пищевыми продуктами;
п) формы выпуска лекарственного препарата;
155.
р) указание (при необходимости) особенностейдействия лекарственного препарата для
медицинского применения при первом приеме или
при его отмене;
с) описание (при необходимости) действий врача
(фельдшера) и (или) пациента при пропуске приема
одной или нескольких доз лекарственного
препарата для медицинского применения;
т) возможное влияние лекарственного препарата для
медицинского применения на способность
управлять транспортными средствами,
механизмами;
у) срок годности и указание на запрет применения
лекарственного препарата для медицинского
применения по истечении срока годности;
ф) условия хранения;
156.
х) указание на необходимость хранениялекарственного препарата для медицинского
применения в местах, недоступных для детей;
ц) указание (при необходимости) специальных мер
предосторожности при уничтожении
неиспользованных лекарственных препаратов для
медицинского применения;
ч) условия отпуска;
ш) наименования и адреса производственных
площадок производителя лекарственного
препарата;
щ) наименование, адрес организации,
уполномоченной держателем или владельцем
регистрационного удостоверения лекарственного
препарата для медицинского применения на
принятие претензий от потребителя.
157.
• Инструкция входит в составрегистрационного досье на лекарственный
препарат для медицинского применения,
согласовывается с МЗ РФ при
государственной регистрации
лекарственного препарата и выдается
одновременно с регистрационным
удостоверением лекарственного препарата
с указанием на ней номера данного
регистрационного удостоверения
лекарственного препарата и даты
государственной регистрации.
158.
• Инструкция согласовывается с Министерствомздравоохранения Российской Федерации для
одного лекарственного препарата для
медицинского применения в одной
лекарственной форме.
• Инструкция не должна содержать подробные
результаты клинических исследований
лекарственного препарата, статистические
показатели, описание дизайна,
демографические характеристики, а также
указаний на его преимущества перед другими
лекарственными препаратами.



















































































































































 management
management








