Similar presentations:
Диссоциация кислот
1.
Диссоциация кислоти щелочей
Химия 9 кл
Махметова Р.К
2.
Цели урока• составлять уравнения электролитической
диссоциации кислот
• составлять уравнения электролитической
диссоциации щелочей
3.
• одна молекулаазотной кислоты:
HNO3
+
H + NO3
-
катион водорода и
нитрат-анион
• две молекулы азотной
кислоты:
2 HNO3
+
2H + 2NO3
-
катион водорода и
нитрат-анион
4.
Диссоциация серной кислотыДиссоциация многоосновных кислот происходит ступенчато, например диссоциация серной
кислоты протекает в две ступени так как число атомов водорода в ней два
Первая ступень: H2SO4
-
+
–
H + HSO4
+
2H + SO4
Вторая ступень: HSO4
Суммарно этот процесс можно записать уравнением:
H2SO4
+
2H + SO4
2-
серная кислота катион водорода и сульфат-анион
5.
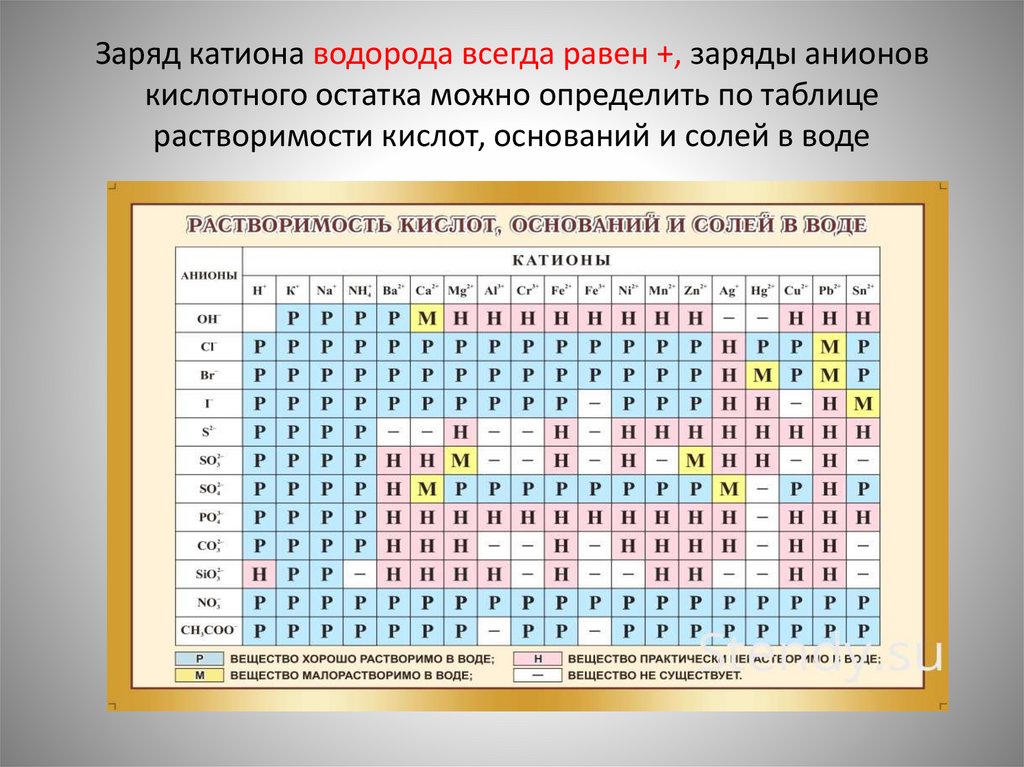
Заряд катиона водорода всегда равен +, заряды анионовкислотного остатка можно определить по таблице
растворимости кислот, оснований и солей в воде
6.
Запомни!!!Не диссоцируют (не распадаются на ионы) в водном растворе:
1)сернистая кислота разлагается на сернистый газ и воду - H2SO3 SO2 + H2O
2)угольная кислота разлагается на углекислый газ и воду - H2СO3 СO2 + H2O
3)сероводородная кислота выделяется в виде газа - H2S
7.
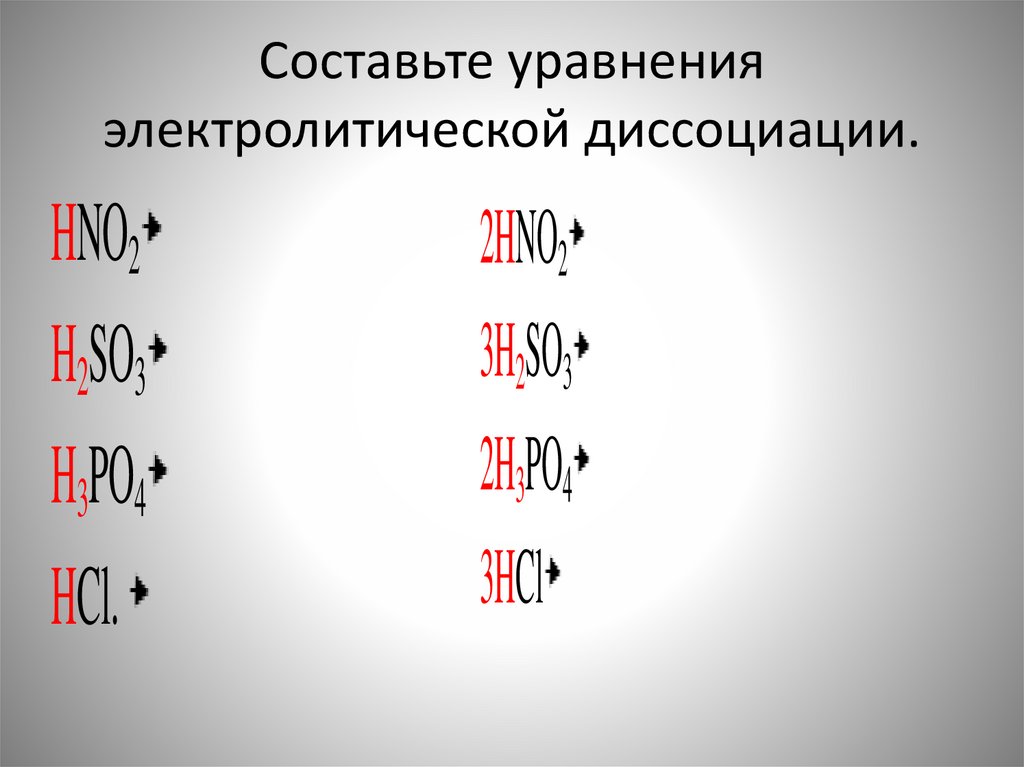
Составьте уравненияэлектролитической диссоциации.
HNO2
H2SO3
H3PO4
HCl.
2HNO2
3H2SO3
2H3PO4
3HCl
8.
Основания это сложные вещества при диссоциации которыхв водных растворах образуются катионы металлов и
гидроксид – анионы (OH-)
Na + + OH-
NaOH
катион натрия и гидроксид –ион
Ba(OH)2
Ba 2+ + 2OH –
катион бария и гидроксид - ион
3NaOH
3Na + + 3 OH-
катион натрия и гидроксид –ион
2Ba(OH)2
2Ba 2++ 4OH –
катион бария и гидроксид - ион
9.
Запомни!!!• не диссоцируют (не распадаются на ионы)
нерастворимые основания.
• Например: Zn(OH)2, Al(OH)3
• См. Таблицу растворимости
10.
Напишите уравнение диссоциации следующихвеществ:
• 3КOH, 4LiOH, Al(OH)3
• КOH, Са(OH)2
• Д/з параграф 3 стр 14-15 ( до солей), упр
№6 стр 16








 chemistry
chemistry








