Similar presentations:
Растворение. Растворы
1. Растворение. Растворы
2. Задачи:
• Познакомить с растворением, как сфизико-химическим процессом.
• Дать классификацию растворов по
признаку растворимости.
• Сформировать понятия:
–Раствор,
–Растворитель
–Растворенное вещество
3. Большинство веществ в природе находится в виде растворов:
Газообразныевоздух
Жидкие
Твёрдые
спиртовые настойки сплавы ме
4.
• …у тебя нет ни вкуса, ни запаха,тебя невозможно описать, тобою
наслаждаются, не ведая, что ты
такое. Нельзя сказать, что
необходима для жизни: ты сама
жизнь.
Антуан де Сент – Экзюпери.
Планета людей.
5. Самый распространённый растворитель – вода.
Растворение – это процессразрушения растворяемого вещества
до структурных единиц (атомов,
молекул, ионов) и их равномерное
распределение по всему объёму
растворителя.
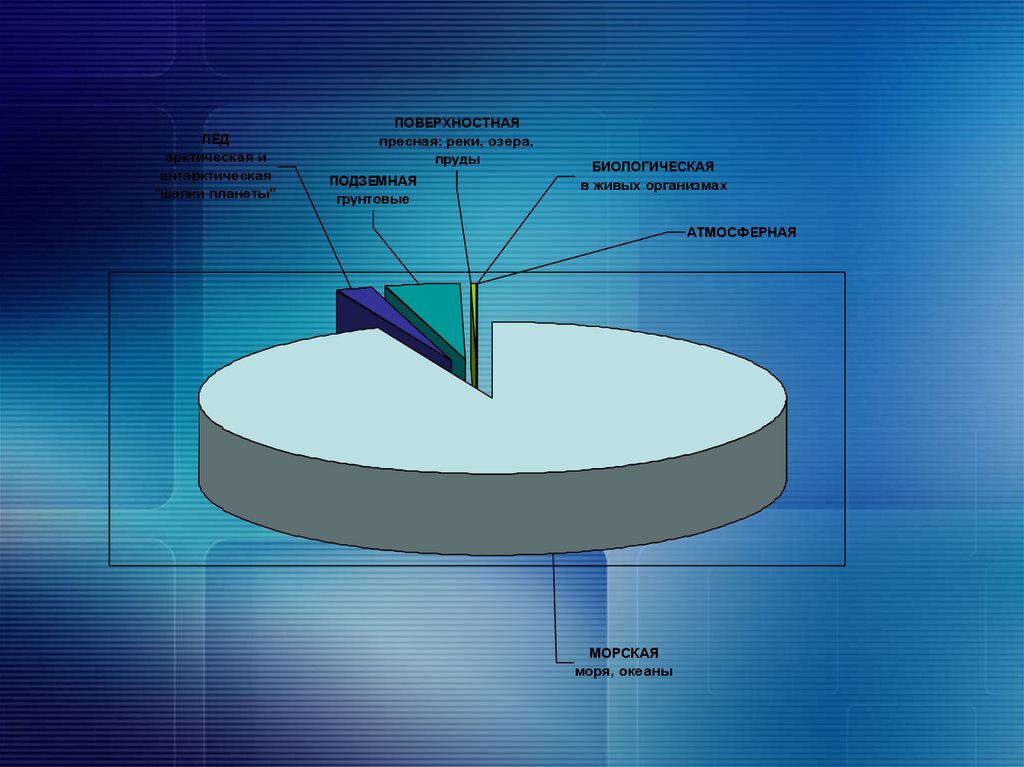
6. ¾ поверхности Земли покрыто водой
СушаВода
7.
ЛЁДарктическая и
антарктическая
"шапки планеты"
ПОВЕРХНОСТНАЯ
пресная: реки, озера,
пруды
ПОДЗЕМНАЯ
грунтовые
БИОЛОГИЧЕСКАЯ
в живых организмах
АТМОСФЕРНАЯ
МОРСКАЯ
моря, океаны
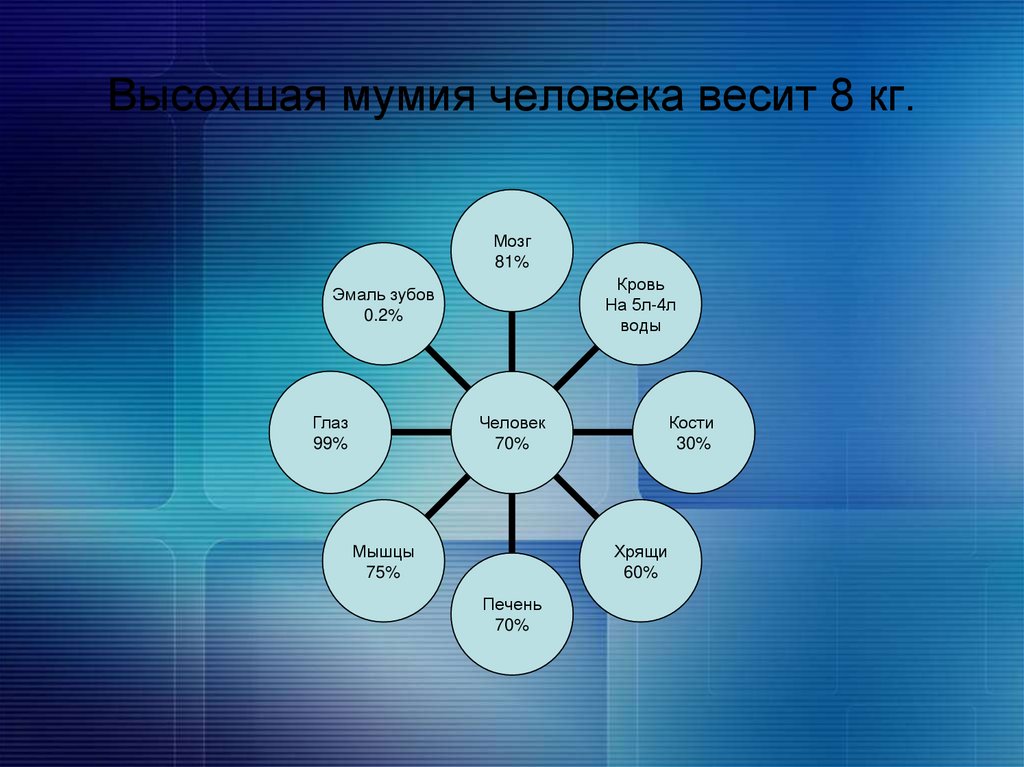
8. Высохшая мумия человека весит 8 кг.
Мозг81%
Кровь
На 5л-4л
воды
Эмаль зубов
0.2%
Глаз
99%
Кости
30%
Человек
70%
Мышцы
75%
Хрящи
60%
Печень
70%
9. Раствор –
Это однородная система, состоящая израстворителя, растворённого вещества
и продуктов их взаимодействия.
10. Процесс растворения
• Физический :диффузия,
перемешивание
• Химический:
выделение или
поглощение тепла,
изменение цвета
11. Химическое взаимодействие с растворителем:
сольватацияЕсли растворитель вода –
гидратация
12. Растворимость -
Растворимость способность разрушаться под действиемрастворителя.
-Растворимые (более 1,0 г
на 100 г воды)
-Малорастворимые(0,1 г 1,0 г на 100 г воды);
-Нерастворимые (менее 0,1
г на 100 г воды).
13. Растворимость зависит от:
природы вещества
природы растворителя
температуры
давления (для газов)
14. Коэффициент растворимости -
Коэффициент растворимости это число, показывающее, сколькограммов вещества может раствориться
в 100 г воды при данной температуре.
В зависимости от того, достигнут
коэффициент растворимости или нет,
растворы делят на:
насыщенные
ненасыщенные
перенасыщенные
15.
Типы растворовпо содержанию
растворенного
вещества
Ненасыщенные –
в-во при данной
температуре
еще растворяется
Насыщенные –
больше
не растворяется
Перенасыщенные –
содержат в растворе
больше вещества,
чем насыщенный
раствор
16. Применение растворов в промышленности
17. Применение растворов в сельском хозяйстве
18. Применение растворов в быту и медицине
19. Количественный состав растворов выражается с помощью концентраций:
Массовая доляω = mр.в/mр – ра * 100%
(омега)
Объёмная доля
φ = Vр.в /Vр-ра * 100%
(фи)
20. Решение задач
Какова массовая доля соли в растворе,приготовленном из 180 г воды и 20 г
соли?
21.
• Дано:m( р.в) = 20 г
m(р-ля) = 180 г
ω(р.в) - ?
• Решение:
1. Рассчитаем m(р-ра)
m(р-ра) =m(р-ля) +m(р.в.)
m(р-ра) =180г +20г = 200г
2. Запишем формулу для
расчета ω(р.в)
m(р.в.)
ω(р.в) =
*100%
m(р-ра)
20г
ω(р.в) =
*100% =10%
200г
• Ответ: ω(р.в) = 10%
22. Задача №2
Какую массу серной кислоты и водынеобходимо взять для приготовления
350 г 20%-ного раствора кислоты?
Ответ : m( р.в) = 70 г
m(р-ля) = 280 г
23. Задача №3
• В дождевой воде содержится 0,01%растворенных солей. Вычислите массу
солей в 1 тонне такой воды.
• Ответ: m( р.в) = 100 г





















 chemistry
chemistry








